что такое дбс в медицине
ДВС-синдром
ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания) — нарушение свёртываемости крови вследствие повышенного тромбообразования. Возникает в виде осложнения во время хирургических операций, из-за травмы, шока, сепсиса. Может протекать бессимптомно либо в виде острой коагулопатии.
Причины
ДВС-синдром — это не отдельное заболевание, он возникает после определенных действий. Самые распространённые причины ДВС:
Из этого следует, что угроза возникновения синдрома существует при большинстве тяжёлых болезней и терминальных состояний (реанимационные действия).
Симптомы
ДВС-синдром разделяют на несколько форм:
При ДВС-синдроме основное поражение приходится на органы с развитой сетью капилляров (легкие, кожа, мозг и др.). На коже признаки заболевания наиболее заметны. Проявления следующие:
Диагностика
Большую роль при постановке диагноза играет клиническая картина. При серьёзных поражениях внутренних органов диагноз очевиден. Но в подострых и хронических формах симптоматика не столь яркая.
Помимо клинической картины, для установки диагноза важны данные клинических исследований:
Лечение
Чтобы подавить ДВС-синдром, в первую очередь необходимо избавиться от причины, его вызвавшей. Для лечения ДВС-синдрома применяют:
Профилактика
Профилактические меры связаны с определение группы риска (людей с низким содержанием антитромбина III, эритроцитозом). К группе риска также относятся люди с хроническими заболеваниями (сахарный диабет, пиелонефрит и пр.), пожилые и др.
Успешный результат при лечении ДВС-синдрома полностью зависит от опыта медицинского персонала и врачей, а также от скорости их реакции. Помните, что только квалифицированные специалисты в состоянии оказать необходимую помощь при ДВС-синдроме. Обращайтесь за лечением в «СМ-Клиника» в Санкт-Петербурге.
Что такое дбс в медицине
Причины ДВС-синдрома.
Синдром диссеминированного внутрисосудистого свертывания характеризуется распространенным образованием маленьких тромбов (фибриновых, эритроцитарных, гиалиновых) в микроциркуляторном русле всего организма в сочетании с несвертываемостью крови, приводящей к множественным массивным кровоизлияниям.
Как правило, причина диссеминированного внутрисосудистого свертывания крови неизвестна, но чаще всего ДВС-синдром развивается на фоне заболеваний, протекающих с повреждением тканей, эндотелия сосудов и клеток крови, которые сопровождаются гемодинамическими нарушениями и гиперкоагуляцией.
Причины острой (геморрагической) диссеминированной внутрисосудистой свертываемости представлены в таблице 1.
Таблица 1. Причины острой (геморрагической) диссеминированной внутрисосудистой свертываемости.
Бактериальный (грамотрицательный сепсис, грамположительные инфекции, риккетсиоз).
· Вирусный (ВИЧ, цитомегаловирус [ЦМВ], вирус ветряной оспы и вирус гепатита).
· Гематологический (острый миелоцитарный лейкоз).
· Метастатическая (муцино-секретирующая аденокарцинома).
· Эмболия околоплодных вод.
· Острое перипартальное кровоизлияние.
· Преэклампсия/эклампсия/гемолиз, повышение уровня печеночных ферментов и тромбоцитопения (HELLP-синдром).
· Септический аборт и внутриутробная инфекция.
Ожоги. ДТП. Интоксикация.
Гемолитические реакции. Переливание. Протезы.
Причины хронической диссеминированной внутрисосудистой свертываемости представлены в таблице 2.
Таблица 2. Причины хронической внутрисосудистой свертываемости.
Солидные опухоли. Лейкемия.
Синдром мертвого плода.
Ревматоидный артрит. Болезнь Рейно.
Неспецифический язвенный колит (НЯК).
Аневризма аорты. Острое отторжение трансплантата.
Патофизиология ДВС-синдрома.
В патогенезе ДВС-синдрома необходимо отметить несколько наиболее важных механизмов, развивающихся параллельно и приводящих к дезорганизации системы.
1.Генерация тромбина путем активации тканевого фактора (III);
2.Дисфункции физиологических антикоагулянтных механизмов, таких как антитромбиновая система и система С-реактивного пептида, которые участвуют в обычных условиях в контроле образования тромбина;
3.Депрессия системы фибринолиза, которая обусловлена высоким уровнем циркулирующего в крови ингибитора активатора плазминогена 1-го, который подавляет процесс фибринолиза. [3]
Рассмотрим каждый механизм более детально:
Генерация тромбина и тканевой фактор. Генерация тромбина определяется через 3-5 ч после возникновения бактериемии или эндотоксемии. Эндотоксин, фактор некроза опухоли (TNF) а, интерлейкин (IL) 1, IL 6 и другие провоспалительные медиаторы индуцируют экспрессию тканевого фактора (ТФ) эндотелиальными клетками и моноцитами. Тканевой фактор активирует внешний путь коагуляции. При этом основная роль в запуске генерации тромбина отводится комплексу тканевой фактор/фактор VIIa, который активирует факторы X и IX. [5]
Избыточное высвобождение тканевого фактора является первичным механизмом развития ДВС-синдрома при травме, особенно при повреждении головного мозга, который содержит значительное количество ТФ и другие тканевые тромбопластины [4].
Повреждение систем, ингибирующих коагуляцию.
Снижение функциональной активности естественных регуляторов коагуляции способствует дальнейшему образованию тромбина с формированием фибрина. Плазменный уровень наиболее важного ингибитора тромбина — антитромбина III — значительно снижен у пациентов с ДВС-синдромом, что объясняется тремя механизмами: его пониженным синтезом, повышенным потреблением в связи с неадекватной генерацией тромбина, повышенной деградацией антитромбина III эластазой активированных нейтрофилов. Низкий уровень антитромбина III ассоциируется с высокой летальностью пациентов. [1]
Исследования установили, что снижение плазменного уровня антитромбина III предшествует клинической манифестации сепсиса и развитию полиорганной недостаточности. [4]
Кроме того, при ДВС-синдроме отмечается снижение активности таких важнейших ингибиторов коагуляции, как системы ЦРБ (C-реактивного белка) и ингибитора тканевого фактора. Все выше указанные изменения сопровождаются увеличением прокоагулянтного потенциала крови. [2]
Депрессия системы фибринолиза. Исследования на экспериментальных моделях показывают, что бактериемия и эндотоксемия вызывают повышение фибринолитической активности благодаря высвобождению активаторов плазминогена эндотелиальными клетками. Но профибринолитический ответ тотчас сопровождается супрессией фибринолитической активности, связанной с повышением плазменного уровня ингибитора активатора плазминогена 1-го типа. [5]
Итогом комплексной дисрегуляции системы гемостаза как результата системной активации гемокоагуляции является внутрисосудистое выпадение фибрина, что в конечном результате приводит к тромбозам в просвете мелких и средних сосудов и сопровождается снижением перфузии, развитием тканевой ишемии с последующей полиорганной недостаточностью.
Стадии ДВС-синдрома.
В патогенезе ДВС-синдрома выделяют 5 стадий:
Продолжительность стадии составляет до 10 минут. Клиническое проявление – шок.
Клинически эта стадия не выражена.
Клинически стадия не проявляется.
Клинически проявляется выраженными кровотечениями и кровоизлияниями.
Особенности патогенеза.
Особенности патогенеза и тяжесть синдрома зависит от нарушения микроциркуляции в органах и степени их дисфункции.
Полиорганная недостаточность развивается вследствие тромбогеморрагических повреждений органов, имеющих хорошо развитую микроциркуляторную сеть, в первую очередь легких, почек, головного и спинного мозга, желудочно-кишечного тракта, кожи, надпочечников, печени.
Легкие. ДВС-синдром является одной из причин развития острого респираторного дистресс-синдрома – ARDS (acute respiratory distress syndrome) в следствие сосудистого микротромбирования и высвобождения из тромбоцитов вазоактивных веществ. Первые симптомы – диспноэ и падение артериальной оксигенации.
При своевременном устранении патологического пускового механизма прогноз весьма благоприятен, так как эндотелий сосудов легких обладает высокой фибринолитической активностью, данная функция эндотелия позволяет лизировать образовавшиеся микротромбы в легочных капиллярах в течение нескольких часов.
Почки. Отложение фибрина в гломерулярных сосудах почек может привести к почечной недостаточности. В корковом слое почек появляются билатеральные некрозы, что проявляется микрогематурией и макрогематурией. Почечная недостаточность может сначала проявляться полиурией, а затем сменяться на олигурию.
Головной и спинной мозг. Степень выраженности энцефалопатии определяется тяжестью состояния. Возможно менингеальное кровотечение, которое проявляется явлениями менингизма, также имеет место очаговая неврологическая симптоматика вследствие кровоизлияний в головной и спинной мозг.
Желудок и кишечник. Поражение желудка и кишечника может иметь три различных типа проявлений:
1) образование кровоточащих эрозий и язв (шоковые или гипоксические язвы, которые нередко возникают при остром инфаркте миокарда и других видах шока);
2) диффузная кровоточивость слизистой оболочки – пропитывание ее кровью и пропотевание крови в полость кишечника;
3) нарушение барьерной функции слизистой оболочки и появление волны бактериемии с трансформацией асептических форм ДВС в септико-токсические формы.
Кожа и слизистые оболочки. Микротромбирование сосудов кожи приводит к локальным геморрагическим некрозам, которые могут быть расположены на лице, конечностях.
Для ДВС характерны носовые, десневые кровотечения, кровотечения из мест инъекций. Тип кровоточивости петехиальный либо гематомный. Такая кровоточивость обусловлена формированием неплотных, легко лизирующихся сгустков.
Летальность при острых формах ДВС-синдрома достигает 50%.
ДВС-синдром
Диссеминированное внутрисосудистое свертывание (ДВС) ㅡ клинико-патологический синдром, осложняющий течение различных заболеваний. ДВС характеризуется системной активацией патологических путей, приводящей к нарушению регуляции коагуляции; проявляется образованием фибриновых сгустков с последующей органной дисфункцией и сопутствующим потреблением тромбоцитов и факторов свертывания, клинически проявляющимся кровотечениями.
Смертность от ДВС за последние годы значительно снизилась. По данным министерства здравоохранения Японии, смертность от ДВС упала с 65 % в 1998 году до 46 % в 2010 и 2012 годах, такая же тенденция наблюдается и в США (с 76 до 51 % между 2006 и 2010 годами). Данное снижение смертности обусловлено более глубоким пониманием патогенеза заболевания, улучшением ранней диагностики и применением новых протоколов лечения ДВС.
Этиология
ДВС часто развивается на фоне сепсиса либо инфекции (30–51 %), травмы (черепно-мозговая травма, ожоги, жировая эмболия) или больших оперативных вмешательств (45 %). Другими причинами ДВС могут быть деструкция органов (тяжелый панкреатит), злокачественный процесс, тяжелые акушерские патологии (эмболия амниотической жидкостью, отслойка плаценты, тяжелая преэклампсия, послеродовое кровотечение), фульминантная печеночная недостаточность, цирроз печени, тяжелые токсические или иммунологические реакции (отравление ядами змей, переливание несовместимой крови, отторжение трансплантата), сосудистые заболевания (гемангиомы, аневризмы аорты, синдром Казабаха-Мерритта).
Патофизиология ДВС
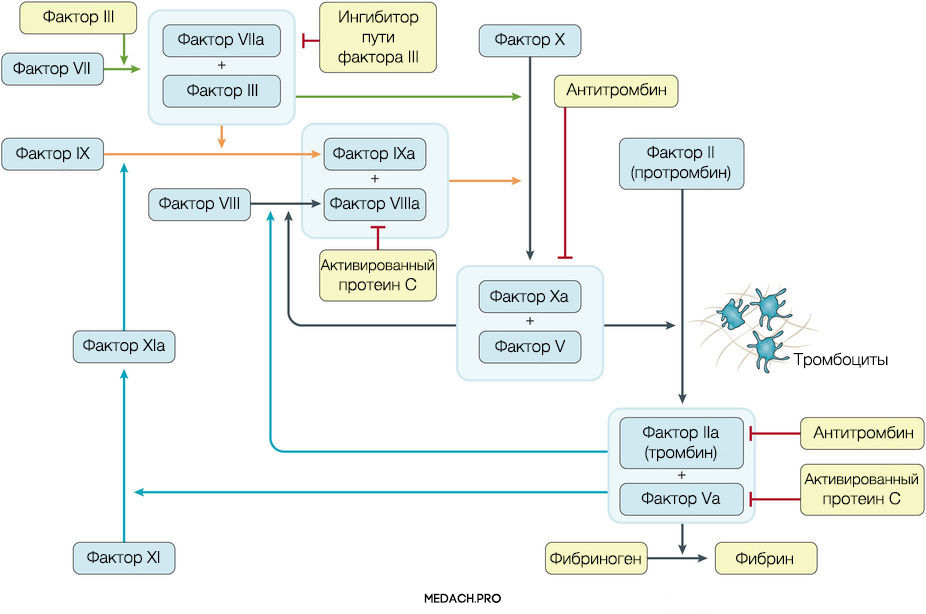
К развитию ДВС приводит нарушение регуляции противосвертывающей и свертывающей систем крови. Формирование фибринового сгустка является продуктом целого каскада реакций, в которых задействованы как факторы свертывания, так и клеточные элементы. Выделяют внутренний и внешний пути активации коагуляции. Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь) (рис. 1).
Рисунок 1 | Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь)
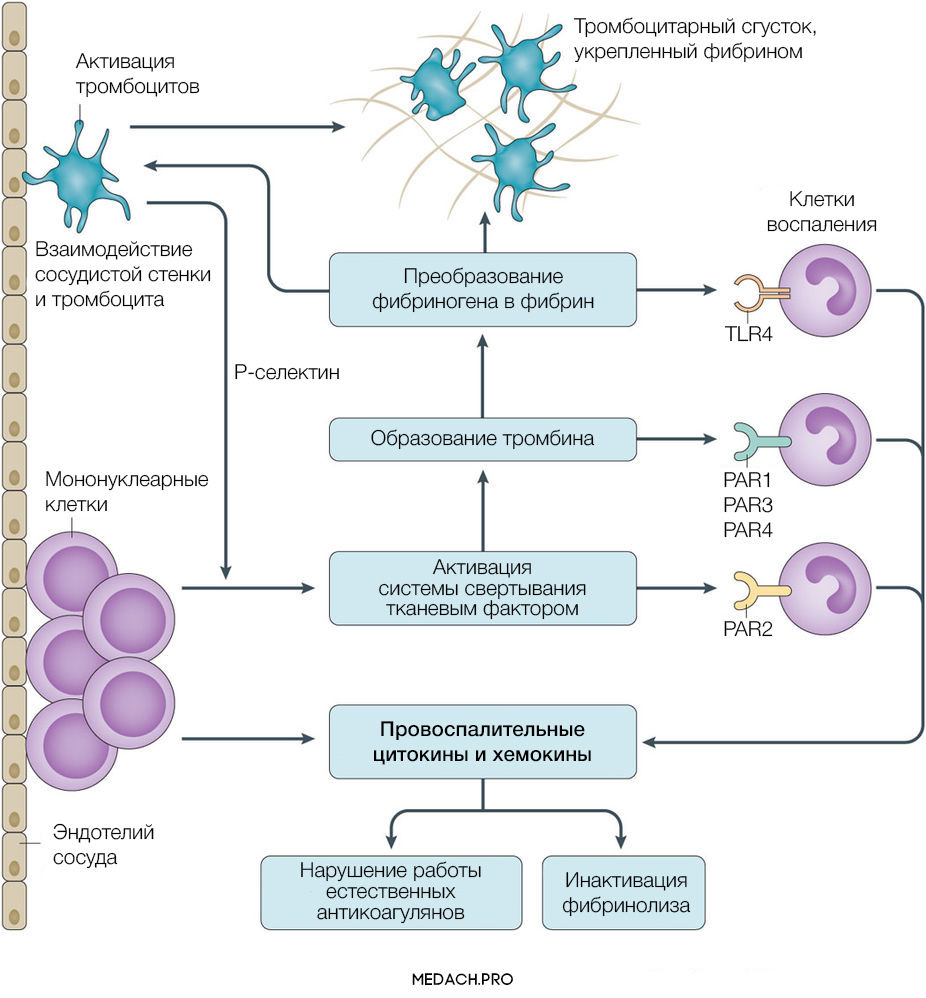
Тканевой фактор (ТФ) представляет собой мембрано-ассоциированный гликопротеин, находящийся в субэндотелиальном слое сосудов, в физиологических условиях не контактирующий с кровью. Выброс тканевого фактора могут спровоцировать различные процессы, такие как прямое повреждение сосудов, воспалительные и иммунологические реакции. При сепсисе ТФ непосредственно продуцируется моноцитами, а также выделяется в результате взаимодействия тромбоцитов со стенкой сосудов, что приводит к значительному усилению коагуляции. Выброс провоспалительных цитокинов и хемокинов провоцируется взаимодействием ТФ, тромбина и других факторов коагуляции с воспалительными клетками через специфические протеаза-активируемые рецепторы (PARs) 1–4 типа, а также дополнительно тромбином через Toll-like рецепторы 4 типа (TLR4). Развитие ДВС на фоне онкологических процессов имеет свои особенности, так как некоторые опухоли могут производить прокоагулянтные факторы (тканевой фактор и цистеиновая протеаза фактора X) (рис. 2).
Рисунок 2 | Активация прокоагулянтных факторов в патогенезе ДВС-синдрома
Важное место в процессе свертывания занимает тромбин: он не только участвует в преобразовании фибриногена в фибрин, но также активирует другие факторы и ко-факторы свертывания (факторы VII, IX и XI). Тромбин инициирует скрепление частиц фибриногена в мономеры, а затем и в полимеры. Последующая стабилизация тромба происходит с помощью тромбин-активируемых факторов XIII (фактора XIIIа).
Реакции коагуляции контролируются противосвертывающей системой крови, включающей в себя: антитромбин (блокирует фактор Xa и тромбин), протеин С (протеолитически разрушает Va и VIIIa факторы), ингибитор пути тканевого фактора (ингибирует комплекс тканевой фактор-VIIa фактор).
При сепсис-индуцированном ДВС нарушаются все три компонента противосвертывающей системы. Во-первых, снижается уровень антитромбина в результате нарушения его синтеза в печени, увеличения его клиренса из-за образования протеаза-антитромбинового комплекса, экстраваскулярных потерь из-за повышения проницаемости клеточной стенки и разрушения эстеразой нейтрофилов. В дополнение к этому, в стенке сосудов нарушается синтез протеогликанов, способствующих связи антитромбина с гепарин-сульфатом. Во-вторых, при сепсисе снижается активность протеина С и его кофактора — протеина S, который обладает как антикоагулянтным, так и в некоторой степени противовоспалительным эффектами. В-третьих, нарушается работа системы ингибитора пути активации тканевого фактора (ИПТФ). В норме ИПТФ присутствует на поверхности эндотелия сосудов или циркулирует в крови в связанном с липопротеинами виде. Его роль в развитии ДВС пока плохо изучена.
Повреждение тромбоцитов играет центральную роль в нарушении коагуляции при ДВС. Тромбоциты могут активироваться как напрямую, через провоспалительные медиаторы (фактор активации тромбоцитов), так и опосредованно через тканевой фактор и тромбин. Впоследствии на мембране активированных тромбоцитов происходит фиксация фибрина. Тромбин стимулирует экспрессию на мембране тромбоцитов Т-селектина, который регулирует адгезию тромбоцитов к лейкоцитам и эндотелию сосудистой стенки, а также ускоряет секрецию ТФ мононуклеарами. В дополнение ко всему повреждение эндотелия и взаимодействие тромбоцит-сосудистая стенка вызывает выброс в кровь ультра-больших мономеров фактора фон Виллебранда (vWF). Фактор фон Виллебранда является важным медиатором адгезии тромбоцитов и коагуляции крови, его деградация осуществляется с помощью металлопротеиназы ADAMTS-13. Доказано, что недостаток металлопротеиназы и, вследствие этого, снижение деградации vWF способствует развитию ДВС-синдрома и более тяжелому его течению.
Фенотип ДВС синдрома
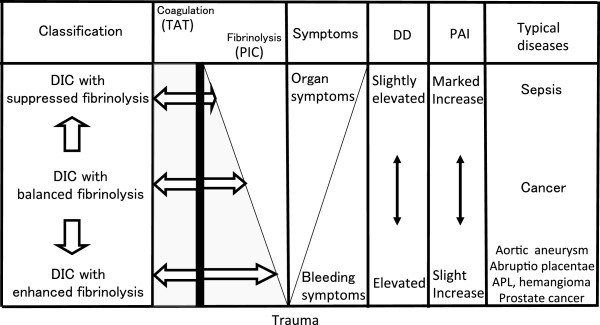
Повышенное образование тромбина при ДВС-синдроме приводит к манифестации различных фенотипов, которые не обязательно характеризуются повышенным тромбообразованием. Например, ранняя гиперфибринолитическая (геморрагическая) фаза, вызывающая всплеск продукции тромбина в ранней фазе тяжелой травмы. Через 24–48 часов она сменяется прокоагулянтной (тромботической) фазой, характерной чертой которой является гиперпродукция плазмин-ингибирующего комплекса, приводящая к супрессии активности протеина С. Фенотип ДВС частично зависит от этиологического фактора, но в большей степени обусловлен преобладающим нарушением в регуляции гемостаза организма [2, 3]. Часто наблюдается активация системы свертывания (повышение тромбин-антитромбинового комплекса), однако степень фибринолитической активности (ингибитора активатора плазминогена) варьирует в зависимости от причины (рис. 3).
Рисунок 3 | Фенотипы ДВС-синдрома. TAT — комплекс тромбин-антитромбин; PIC — комплекс плазмин-альфа-2-антиплазмин; DD — Д-димер; PAI — ингибитор активатора плазминогена
В столбце «Symptoms» обозначен переход от кровотечений к органному поражению (развитие микро- и макротромбозов). На данном рисунке не обозначены продукты деградации фибрина (ПДФ), тем не менее при гиперфибринолитическом фенотипе ДВС имеется тенденция к преобладанию ПДФ над количеством Д-димеров. При терапии препаратами транс-ретиноевой кислоты при остром промиелоцитарном лейкозе ингибируется экспрессия опухолевыми клетками аннексина II, в результате чего меняется и фенотип ДВС (теряет характеристики гиперфибринолитического, приобретая характеристики прокоагулянтного фенотипа).
Диагностика
Критерии для выявления ДВС-синдрома по шкале ISTH (International Society of Thrombosis and Haemostasis Scoring System):
Рисунок 4 | ISTH (International Society of Thrombosis and Haemostasis Scoring System)
Критерии Japanese Association for Acute Medicine (JAAM):
Рисунок 5 | Japanese Association for Acute Medicine (JAAM)
Данные шкалы отличаются различной чувствительностью в отношении прогнозирования смертности: считается, что шкала JAAM имеет бо́льшую чувствительность к неявному ДВС-синдрому, в результате чего смертность при ДВС-синдроме, выявленном по данной шкале, почти в два раза ниже (около 22%).
Критерии ДВС Japanese Ministry of Health, Labor and Welfare (JMHLW):
Рисунок 6 | Japanese Ministry of Health, Labor and Welfare (JMHLW)
Данные критерии не адаптированы для пациентов с заболеваниями печени или нефротическим синдромом.
На основании представленных выше шкал выставляется диагноз ДВС. Наиболее подходящая шкала выбирается в зависимости от возможности проведения определенных лабораторных тестов и клинической ситуации. При возможности пациенту рекомендуется проводить контроль лабораторных показателей коагуляции каждые 8 часов.
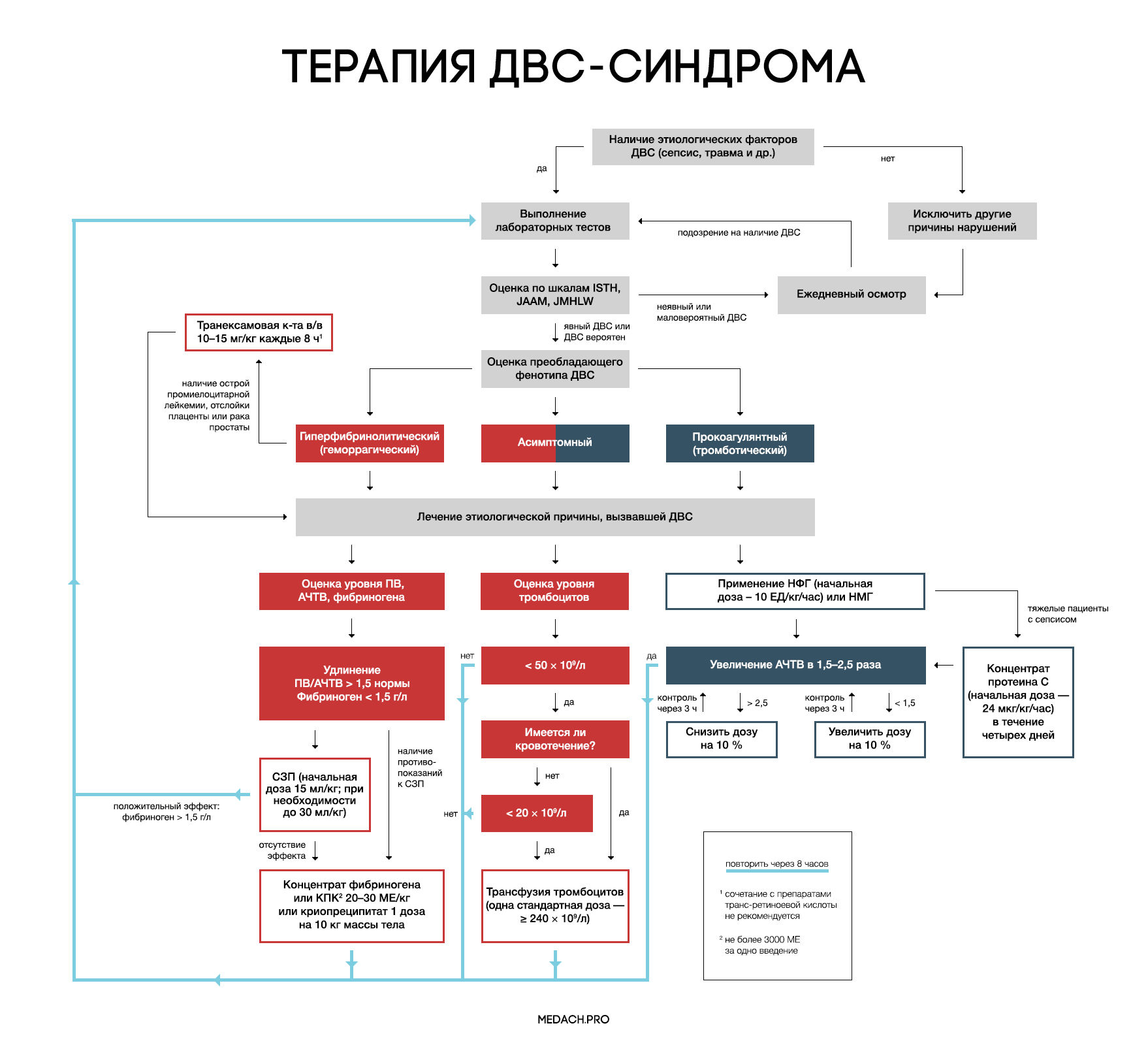
Лечение
Рисунок 7 | Алгоритм тактики ведения пациентов с ДВС-синдромом (авторская работа Medach)
Терапия этиологического фактора
Главным в терапии ДВС-синдрома является лечение состояния, вызвавшего его развитие. Выделяют два варианта течения ДВС-синдрома:
— Контролируемый ДВС-синдром: характеризуется временным нарушением регуляции коагуляционных механизмов и быстрым восстановлением после ликвидации провоцирующего состояния (трансфузионная реакция, отслойка плаценты). В ряде случаев может разрешаться самостоятельно.
— Неконтролируемый ДВС-синдром (вызван сепсисом или травмой): в этом случае помимо ликвидации основной этиологической причины требуется незамедлительное начало терапии.
Важно отметить, что раннее начало применения препаратов, влияющих на систему свертывания крови (до развития ДВС-синдрома), может в значительной степени нарушить регуляцию гемостаза и, вследствие этого, ухудшить состояние пациента.
Заместительная терапия
Рекомендации по заместительной терапии ДВС сделаны на основании объединения данных гайдлайнов различных сообществ (British Committee for Standards in Haematology (BCSH), Japanese Society of Thrombosis and Hemostasis (JSTH), Italian Society for Thrombosis and Hemostasis (SISET)), занимающихся интенсивной терапией ДВС. При сочетании активного кровотечения или риска его развития и определенных уровней лабораторных показателей рекомендуется применение тромбоцитарной массы, свежезамороженной плазмы (СЗП), криопреципитата или концентрата фибриногена, концентрата протромбинового комплекса (КПК). Все нижеперечисленные рекомендации касаются категории пациентов с активным кровотечением.
Рекомендуется трансфузия тромбоцитов при наличии признаков активного кровотечениями и уровне тромбоцитов Антикоагулянтная терапия
Применение антикоагулянтов противопоказано при развитии ДВС-синдрома в результате травмы, или при травматическом шоке в сочетании с активным кровотечением. Для использования при ДВС-синдроме с преобладанием тромбозов рекомендуется нефракционированный гепарин (НФГ) или низкомолекулярные гепарины (НМГ). НФГ применяется в начальной дозе 10 ЕД/кг/час под контролем АЧТВ с поддержанием его увеличения в 1,5–2,5 раза от нормы. Необходимо помнить о профилактике тромбоэмболии НФГ или НМГ у тяжелых пациентов без признаков кровотечений. Уровень антитромбина III может частично использоваться для оценки дальнейшей эффективности применения гепарина, но зачастую имеются сложности (высокая стоимость, отсутствие реагентов) при измерении активности антитромбина III. На данный момент крупные исследования о применении НМГ у пациентов с ДВС-синдромом отсутствуют, и возможность профилактики НМГ строится на данных их использования у пациентов хирургического профиля.
Синтетические ингибиторы протеаз (габексата мезилат, нафамостата мезилат) разрешены к использованию в Японии, однако крупные РКИ, показывающие их эффективность при ДВС-синдроме, отсутствуют.
Концентраты антикоагулянтных факторов
Исследования в данном направлении ведутся на протяжении уже многих лет; так, с 1980 года проводятся испытания концентрата антитромбина, однако его эффективность при ДВС-синдроме до сих пор не доказана. На основании предположения, что при ДВС происходит угнетение выработки протеина С, зародилась идея применения активированного протеина С. После проведения больших исследований данный препарат показал эффективность в группах с тяжелой сопутствующей патологией (сепсис). Крупных исследований, сравнивающих эффективность рекомбинантного активированного человеческого протеина С и полученного из плазмы концентрата протеина С, не проводилось. Концентрат протеина С применяется в виде продолжительной инфузии со скоростью 24 мкг/кг/час в течении четырех дней. При необходимости проведения инвазивных процедур введение протеина С прерывается до их выполнения (период полувыведения около 20 минут), а затем возобновляется через несколько часов. При применении протеина С необходимо учитывать повышение рисков кровотечения (2–3,5 %) и внутричерепного кровоизлияния (0,1–0,3 %), а также то, что в исследованиях препарата не участвовали пациенты с тромбоцитопенией ( Антифибринолитики
При ДВС-синдроме фибринолиз заблокирован повышением уровня ингибитора активатора плазминогена (PAI-1). Следовательно, при кровотечениях, вызванных ДВС-синдромом, применение антифибринолитиков не рекомендуется, за исключением случаев развития гиперфибринолитического фенотипа ДВС, возникшего на фоне острой промиелоцитарной лейкемии, отслойки плаценты или карциномы простаты.
Отличительными лабораторными особенностями гиперфибринолитического фенотипа является наличие повышенного уровня тромбин-антитромбинового комплекса (≥ 20 мкг/л) и плазмин-ингибирующего комплекса (≥ 10 мкг/л), а также снижение активности альфа-2-ингибитора плазмина более чем на 50 %.
При таком фенотипе показано использование транексамовой кислоты в дозе по 1 грамму (10–15 мг/кг) через каждые 8 часов. У пациентов с лейкемией часто проводится лечение препаратами транс-ретиноевой кислоты, но, по данным исследований, ее сочетание с транексамовой кислотой повышает риск развития тромбозов. Данную комбинацию необходимо применять в крайнем случае, при наличии признаков жизнеугрожающего кровотечения.
Источники
Levi M. et al. Guidelines for the diagnosis and management of disseminated intravascular coagulation //British journal of haematology. – 2009. – Т. 145. – №. 1. – С. 24-33.
Gando S., Levi M., Toh C. H. Disseminated intravascular coagulation //Nature Reviews Disease Primers. – 2016. – Т. 2. – С. 16037.
Gando S., Wada H., Thachil J. Differentiating disseminated intravascular coagulation (DIC) with the fibrinolytic phenotype from coagulopathy of trauma and acute coagulopathy of trauma‐shock (COT/ACOTS) //Journal of Thrombosis and Haemostasis. – 2013. – Т. 11. – №. 5. – С. 826-835.
ISTH, International Society on Thrombosis and Haemostasis. Adapted with permission from from Taylor Jr. FB, Toh CH, Hoots WK, et al. Towards Definition, Clinical and Laboratory Criteria, and a Scoring System for Disseminated Intravascular Coagulation. Thromb Haemost 2001; 86: 1327–30.
Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, Mayumi T, Murata A, Ikeda T, Ishikura H, Ueyama M, Ogura H, Kushimoto S, Saitoh D, Endo S, Shimazaki S, Japanese Association for Acute Medicine Disseminated Intravascular
Coagulation (JAAM DIC) Study Group: A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med 2006, 34: 625-631.
Kobayashi N. et al. Criteria for diagnosis of DIC based on the analysis of clinical and laboratory findings in 345 DIC patients collected by the Research Committee on DIC in Japan //Disseminated intravascular coagulation. – Karger Publishers, 1983. – Т. 49. – С. 265-275.
Wada H. et al. Guidance for diagnosis and treatment of disseminated intravascular coagulation from harmonization of the recommendations from three guidelines //Journal of thrombosis and haemostasis. – 2013. – Т. 11. – №. 4. – С. 761-767.
Afshari, A., Wetterslev, J., Brok, J. & Moller, A. M. Antithrombin III for critically ill patients. Cochrane Database Syst. Rev. 3, CD005370 (2008).
Abraham, E. et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 290, 238–247 (2003).
Asakura H. Classifying types of disseminated intravascular coagulation: clinical and animal models //Journal of intensive care. – 2014. – Т. 2. – №. 1. – С. 20.