что такое болотный газ
Болотный газ
Болотный газ — бесцветный газ со слабым, но неприятным запахом, который выделяется со дна стоячих водоёмов в результате гниения ила и других остатков растительного и животного происхождения.
Впервые химическое исследование болотного газа провёл в 1776 году А. Вольта и установил, что он отличается от водорода.
См. также
Полезное
Смотреть что такое «Болотный газ» в других словарях:
БОЛОТНЫЙ ГАЗ — выделяется со дна стоячих водоемов. Главный компонент метан; содержит незначительные количества углекислого газа и азота … Большой Энциклопедический словарь
болотный газ — выделяется со дна стоячих водоёмов. Главный компонент метан; содержит незначительные количества углекислого газа и азота. * * * БОЛОТНЫЙ ГАЗ БОЛОТНЫЙ ГАЗ, выделяется со дна стоячих водоемов. Главный компонент метан; содержит незначительные… … Энциклопедический словарь
болотный газ — pelkių dujos statusas T sritis chemija apibrėžtis Metano, anglies dioksido ir azoto mišinys, išsiskiriantis yrant augalų liekanoms. atitikmenys: angl. marsh gas rus. болотный газ … Chemijos terminų aiškinamasis žodynas
болотный газ — metanas statusas T sritis ekologija ir aplinkotyra apibrėžtis Organinis junginys (CH₄) – sotusis angliavandenilis. Bespalvės, bekvapės dujos, lengvesnės už orą. Vandenyje tirpsta blogai; dega blyškia liepsna, sudarydamas anglies dioksidą ir… … Ekologijos terminų aiškinamasis žodynas
Болотный газ или метан
(также водородистый метил, формен) — предельный углеводород состава СН4, первый член ряда СnН2n+n, одно из простейших соединений углерода, вокруг которого группируются все остальные и от которого могут быть произведены через замещение атомов водорода различными остатками. В природе болотный газ встречается в свободном состоянии в смеси с азотом, углекислотой, а иногда также и другими углеводородами; он представляет продукт разложения органических веществ, главным образом растений, в присутствии воды без доступа воздуха, а такие условия для его образования, по крайней мере в небольших количествах, встречаются на каждом шагу. Значительные массы болотного газа содержатся в каменноугольных копях, где разложение органических остатков продолжается еще и поныне; здесь он скопляется в пустотах среди пород и с силой вырывается из случайно сделанного отверстия. Большие количества болотного газа, смешанного с азотом, углекислотой и парами нефти, выделяются из трещин в земле по соседству с нефтяными месторождениями, напр. по берегам р. Аллегани, в Северо-Американских Соед. Штатах, у нас, в России, по прибрежью Каспийского моря, в особенности в окрестностях Баку, где находится знаменитый древний храм огнепоклонников (см. Бакинские огни). В Пенсильвании выделяющийся газ утилизируют на металлургических заводах. Образование болотного газа идет непрерывно и в настоящее время в стоячих водах; присутствие его можно доказать в любом пруде или болоте: достаточно потрогать болотный ил палкой, как тотчас же на поверхность воды всплывают пузырьки газа, который можно собрать в опрокинутую горлом вниз склянку с воронкой, наполненную водой. Газ этот оказывается смесью метана с азотом и угольной кислотой; он образуется здесь вследствие брожения растительной клетчатки (под влиянием бактерий). Грязные вулканы Керченского и Апшеронского полуостровов и других местностей выделяют также много иногда совершенно чистого болотного газа; кроме того, он найден в некоторых источниках, соляных залежах (Величка), в тосканских фумаролах и т. д. Присутствие болотного газа доказано также в кишечном канале человека и в продуктах выдыхания некоторых домашних животных.
Болотный газ образуется в значительных количествах при некоторых химических реакциях: на первом месте здесь следует поставить сухую перегонку органических веществ: дерева, торфа, каменного угля, нефти и т. п.; он является, таким образом, существенной составной частью светильного газа, где его содержание тем значительнее, чем выше была температура фабрикации. Продукты замещения водородов болотного газа галоидами дают при восстановлении (амальгамой натрия, водородом при высокой температуре) обратно болотный газ. Бертело, много работавший с этим веществом, синтезировал его, пропуская смесь сероводорода и паров сернистого углерода над слоем меди:
Броди наблюдал образование его при действии электрических искр на смесь окиси углерода и водорода. Для получения болотного газа сильно нагревают тесную смесь уксусно-натровой соли с 4 ч. натристой извести; подмесь этилена удаляют, пропуская газ через пемзу, смоченную серной кислотой, но он содержит еще водород:
Химически чистый болотный газ образуется при разложении цинкметила Zn(СН3)2 водой, при чем выделяется окись цинка. Гладстон и Трайб получают его, разлагая йодистый метил при посредстве медно-цинковой пары.
Чистый болотный газ бесцветен, не имеет запаха и вкуса; уд. вес его 0,559; критическая температура, по Ольшевскому, — 81,8° Ц. (при давлении в 54,9 атмосф.); температура кипения — 164°; темпер. затвердевания — 185°,8; легко воспламеняется и горит бледным, едва светящим пламенем; наиболее сильно взрывает при зажигании в смеси с 2 об. кислорода или 7—8 объемами воздуха; при 16 объемах воздуха взрыва уже не происходит; в воде мало растворим, значительно легче в алкоголе; не ядовит. По химическим свойствам болотный газ представляет весьма прочное вещество, не дающее продуктов присоединения, реагирующее только с галоидами (кроме йода); при пропускании его через раскаленную трубку лишь незначительная часть переходит в нафталин; при действии искр сильного индукционного аппарата часть болотного газа разлагается на углерод и водород, причем образуется также ацетилен. Хлор не действует в темноте; при рассеянном свете образуются продукты субституции, а на прямом солнечном свету смесь обоих газов дает сильный взрыв; болотный газ не изменяется при обработке смесью дымящейся серной и азотной кислот.
Продукты субституции болотного газа галоидами.
Бром на болотный газ действует весьма трудно; йод совсем не действует. Бромистый и йодистый метил получаются при действии брома или йода и желтого фосфора на метильный алкоголь. Из них йодистый метил (CH3J) имеет большое применение к лабораторной и фабричной практике для получения различного рода веществ и красок, содержащих метильные группы. Он представляет бесцветную, сильно преломляющую свет тяжелую жидкость уд. веса 2,1992 (при 0°), обладающую эфирным, несколько резким запахом, кипящую при 44°, трудно загорающуюся; почти нерастворимую в воде и легко — в спирте и эфире. Йодистый метил легко вступает в обменное разложение со многими веществами: алкоголятами, солями кислот, амидокислотами и т. п.; восстановители легко переводят его в Б. газ; при нагревании с водой в запаянных трубках дает йодистый водород и метильный алкоголь (Нидерист).
Фтористый метил, СН3F, получен впервые Дюма и Пелиго нагреванием метилсерно-калиевой соли с фтористым калием. Муассан и Мельсан в последнее время приготовили его, действуя фтористым серебром на йодистый метил. Вещество представляет бесцветный газ с приятным эфирным запахом, горящий голубоватым пламенем; уд. вес его найден 1,22 (вместо 1,19 теоретич.); при 32 атм. сгущается в жидкость (при обыкновенной температуре); 100 к. см воды растворяют (при 18°) 193 к. см газа; значительно более растворим в метильном алкоголе; весьма прочен, трудно омыляется водным едким кали.
2) Из продуктов вторичного замещения галоидами водорода болотного газа известны: хлористый метилен, бромистый метилен, йодистый метилен и фтористый метилен. Первые два образуются, по А. М. Бутлерову, при действии хлора или брома на йодистый метилен, полученный впервые Бутлеровым же при нагревании йодоформа (CJ3) с алкоголятом натрия. Йодистый метилен представляет желтоватую, сильно преломляющую свет жидкость, кипящую с некоторым разложением при 180°; при 0° она застывает в листоватые кристаллы, плавящиеся при +2°, уд. вес 3,342 (при +5°). При нагревании йодистого метилена с водой и медью до 100° образуются этилен и его гомологи (Бутлеров); с уксусно-серебряной солью получается эфир метиленгликоля СН2(СО3СН3)2, а со щавелево-серебряной — оксиметилен (см. Муравьиная кислота и Альдегид). Благодаря значительному удельному весу йодистый метилен употребляется для определения плотности растворяемых в воде солей (Ретжерс).
3) Продукты третичного замещения галоидами водородов бол. газа: хлороформ (CHCl3), см. это сл.; бромоформ (CHBr3), см. это сл.; йодоформ (CHJ3), см. это сл.; фтороформ (CHF3), см. это сл.
4) Продукты полного замещения галоидами: четыреххлористый углерод, перхлорметан, CCl4 открыт Реньо в 1839 г. при действии хлора на хлороформ; его получают, пропуская сухой хлор в кипящую смесь сернистого углерода CS2 с пятихлористой сурьмой. Вещество представляет жидкость с пряным запахом, кипящую при 76,7°, уд. веса 1,6084 (при 9,5°); критическая температура его 285,3° (Павлевский); нерастворим в воде, но легко — в алкоголе и эфире; действует анестезирующим образом. Восстановители переводят четыреххлористый углерод в хлороформ и хлористый метилен; при пропускании паров его через раскаленную трубку получаются: перхлорэтилен C2Cl4 и перхлорэтан C2Cl6; с фосфорным ангидридом при 200° образуются хлорокись углерода COCl2, хлорокись фосфора и угольная кислота (Густавсон); вещество хлорирует при нагревании неорганические кислоты и металлические окиси.
Четырехбромистый углерод CBr4 содержится в броме, добываемом из золы морских растений; получен Боласом и Гровесом при продолжительном нагревании сернистого углерода с бромом и йодом; образуется, между прочим, при действии бромистого алюминия (AlBr3) на четыреххлористый углерод или брома на четырехйодистый углерод CJ4 (Густавсон); вещество представляет таблички, плавящиеся при 92,5°; кипит, почти не разлагаясь, при 189,5°; четырехбромистый углерод сходен по реакциям с хлористым соединением; разлагается при 350° с выделением брома и образованием тетрабромэтилена С2Br4 и бромбензола C6Br6.
Четырехиодистый углерод CJ4 получен Густавсоном при действии йодистого алюминия на четыреххлористый углерод; кристаллизуется в темно-красных правильных октаэдрах; разлагается при нагревании на воздухе; при кипячении с водой дает йодоформ.
Четырехфтористый углерод CF4 получен Муассаном при пропускании фтора над мелко раздробленным углем; уголь при этом раскаляется и горит в атмосфере фтора. В этом случае, а также при действии фтора на Б. газ наряду с четырехфтористым углеродом образуются и другие фтористые соединения углерода. Шабрие рекомендует готовить вещество нагреванием фтористого серебра с четыреххлористым углеродом в запаянных трубках из богемского стекла. Четырехфтористый углерод представляет газ, сгущающийся при 15° в жидкость; мало растворим в воде, разъедает стекло. Серная кислота и растворы щелочей на него не действуют.
Нитропроизводные болотного газа.
1) Нитрометан, нитрокарбол CH3NO2 получен в 1872 г. Кольбе при действии азотистокислого калия на калиевую соль монохлоруксусной кислоты; одновременно с ним В. Мейер получил это соединение двойным разложением азотисто-серебряной соли с йодистым метилом. Нитрометан представляет тонущее в воде, трудно растворимое в ней масло с характерным эфирным запахом; кипит при 101°, горит бледным пламенем. По химическим свойствам нитрометан представляет как бы одноосновную кислоту (благодаря присутствию группы электроотрицательного характера); напр. с алкогольным едким натром он дает соль CH2(NO2)Na. Водород в момент выделения восстановляет его в метиламин; с кислотами, напр., соляной, при нагревании образуется муравьиная кислота и гидроксиламин. Хлор и бром почти не действуют на нитрометан; но в присутствии едких щелочей получаются галоидозамещенные нитросоединения (см. Нитросоединения). Представителем их может служить хлорпикрин.
2) Хлорпикрин, или трихлорнитрометан, CCl3(NO2), открыт Стенгоузом при перегонке раствора пикриновой кислоты (см. это сл.) с хлорной известью; состав вещества определен Жераром и Кагуром. Хлорпикрин образуется, по-видимому, весьма часто при действии хлора на соединения, содержащие в своем составе несколько нитрогрупп, или при обработке азотной кислотой веществ, богатых хлором. Кекуле получил его при действии концентрированной азотной кислоты на хлорал и при перегонке спирта с поваренной солью, азотной и серной кислотами. Готовят его обыкновенно, действуя пикриновой кислотой (4,5 ч.) на хлорную известь (45 ч.), замешанную с водой в тесто, при нагревании; по окончании реакции хлорпикрин отгоняют с водяным паром. Хлорпикрин представляет бесцветную, сильно преломляющую свет жидкость с пронзительным, вызывающим слезы запахом. Перегоняется без разложения при 112°; уд. вес при 0° 1,692; нерастворим в воде, но легко растворяется в бензоле, сероуглероде, алкоголе; в свою очередь является растворителем для йода, смол и других богатых углеродом соединений. Восстановители переводят его в метиламин; образует с алкоголятом натрия ортоугольные эфиры; с алкогольным аммиаком дает гуанидин (см. это сл.).
3) Тринитрометан, нитроформ CH(NO2)3, получен Л. Н. Шишковым при кипячении с водой тринитроацетонитрила C(NO2)3-CN, при чем отщепляется угольная кислота и образуется аммонийная соль нитроформа:
которую разлагают действием серной кислоты. Реакцию следует вести осторожно, так как нитроформ легко взрывает при нагревании. Вещество представляет бесцветные кубы или ромбоэдры, плавящиеся при 15°, легко воспламеняющиеся, растворимые в воде с желтым цветом. Водород нитроформа легко замещается металлами; бром на солнечном свету дает бромнитроформ; смесь крепкой азотной и серной кислот переводит вещество в:
4) тетранитрометан, нитроуглерод C(NO2)4, открытый при только что упомянутой реакции Шишковым; соединение представляет кристаллы, плавящиеся при +13°; кипит, не разлагаясь, при 126°; не взрывает и не воспламеняется; в воде не растворимо.
Цианистый метил — см. Ацетонитрил.
В походных условиях обычно готовят пищу на костре. Но не всегда у берега реки или озера, пруда или другого водоёма можно найти валежник или хворост. Нередко даже есть лес, но нет валежника, сухостоя, а рубить молодые деревца нельзя. Тем, кто бывает у воды, представляется возможность использовать для приготовления пищи болотный (подводный) газ, который можно добыть на месте. Подводный газ имеет много достоинств: он сгорает без шума, дыма и копоти значительно полнее, чем другие виды топлива, теплотворная способность его такая же, как и у природного газа (главная составная часть того и другого метан).
Бурное выделение подводного газа при ворошении дна со значительными илистыми отложениями позволяет собрать его в короткое время. Снаряжение для сбора и использования подводного газа несложно и включает в себя газовый баллон и складную газовую плитку.
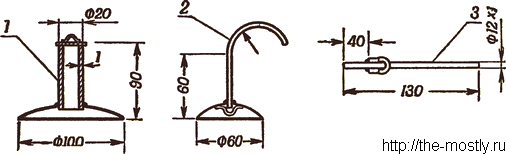
Изготовление газового баллона лучше всего начать с заготовки металлических частей: отрезков трубок для центрального глухого патрубка с фланцем 1, загнутой трубки 2 с фланцем и наконечником 3. Трубчатые заготовки могут быть как стальные, так и медные, длина их указана на рисунке.
Концы скобок выгибаются так, чтобы при пайке они плотно прилегали к припаеваемым поверхностям. Кружки для фланцев и кружок-заглушка для центрального глухого патрубка вырезаются из полумиллиметровой жести. Фланцам придают выпуклую форму и сверлят в центре отверстия по диаметру трубок. Места пайки предварительно лудятся. Карабин имеется в продаже в охотничьих магазинах.
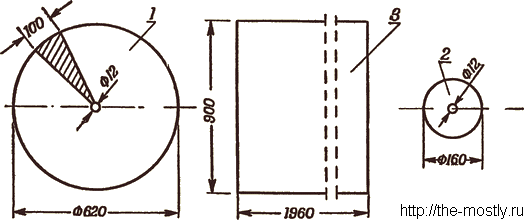
После того как цилиндр склеен по выкройке 3, в него вклеивается нижнее вогнутое основание на расстоянии 200 мм от нижнего обреза цилиндра и привязываются концы шнура к проволочным скобам фланца и глухого патрубка. Затем вклеивается верхнее выпуклое основание. Длина шнура равна высоте цилиндра. Для придания баллону дополнительной прочности на швы наклеиваются усилительные ленты, на нижнем обрезе цилиндра делается бортик (ткань или клеёнка подшиваются и в подшивку вставляется двух или трёхмиллиметровая проволока).
Совершенно необходимо тщательно проверить надёжность клейки. (Например, погружением в воду наполненного воздухом баллона.)
Резиновый шланг для подвода газа, а также пластмассовый кран можно приобрести в аптеке. Отверстие в кране следует увеличить до максимально возможного диаметра. Вместо пластмассового крана можно применить бельевую защепку, привязав её к шлангу во избежание потери.
Изготовление складной газовой плитки следует начать с подготовки трубки с глухим концом и отверстием в середине для горелки (рис. 5). Для этого один конец стальной или медной трубки необходимо запаять, а в средней части просверлить или пропилить отверстие диаметром 8. 10 мм. На это место напаять (с предварительным лужением) гайку с резьбой М8. Горелка (трубка с коническим раструбом, втулка и хвостовик) используется от горелки «Теклю», имеющейся в продаже в магазинах лабораторного оборудования.
Проволоку в местах предполагаемого изгиба нужно отжечь. Выгибая основание, П-образные стойки и каркас рамки, следует работу начать от середины заготовки, симметрично к краям. Последними загибаются концы. Это важно, так как одновременно проверяется правильность изготовления деталей. Форма изгибов и размеры указаны на рисунке.
Образовавшиеся на концах шарниры в один-два витка обеспечивают надёжность крепления деталей. В ножках стоек должны быть колена для упора. Изготовленная таким образом плитка свободно удерживает сосуд с 5 литрами воды.
Сбор болотного (подводного) газа. Прежде всего заметим, что правила обращения с болотным газом аналогичны правилам обращения с природным газом, широко вошедшим в наш быт. Особенно следует помнить, что попадание в баллон большого количества воздуха может привести к образованию взрывной смеси.
Значительные накопления газа происходят в водоёмах с богатой водной растительностью, в местах с донными отложениями остатков растении и организмов, чаще в стоячих водах. Хорошим местом для сбора являются неглубокие заросшие затоны с зарослями рогозы, осоки, камыша и т. п. Нередко источником подводного газа служит разложившийся на дне торф.
Наполнение баллона подводным газом производится следующим образом. Промеряется глубина водоёма. Нижней части баллона придаётся жёсткость (вставляется в подшивку проволока). Баллон сплющивается (вытесняется воздух), кран закрывается. Наконечник шланга обвязывается небольшим кусочком сетки (размер ячейки 0,1. 0,5 мм), вводится в центральный глухой патрубок и пристёгивается карабином. Затем газовый баллон в сплюснутом состоянии погружается в воду таким образом, чтобы в полости юбки, образованной нижней частью цилиндрической оболочки, не осталось воздуха. Баллон удерживают в вертикальном положении на воде и ворошат илистое дно. Чтобы ускорить наполнение баллона, можно к краям юбки привязать груз. Кран открывают после того, как газ накопился в полости юбки. Это Позволит избежать попадания воды в шланг. Если все же вода в шланг попала, её всегда можно вытеснить, приподнимая баллон в воде, не отрывая его от поверхности. Когда баллон наполнится газом, кран закрывают, и баллон отделяют от воды. Следует помнить, что чем больше диаметр шланга, тем быстрее наполняется баллон.
После сбора газа приводят в рабочее положение складную плитку и подсоединяют к ней шланг газового баллона: наконечник отстёгивают от скобки фланца вогнутого основания и вставляют в резиновый шланг плитки. Место, где устанавливается плитка, должно быть защищено от ветра (кустарником, крутым берегом, камнями). В крайнем случае защитой от ветра может быть газовый баллон.
Опыт показал, что для кипячения литра воды расходуется газа тем меньше, чем интенсивнее горение, так как подогреваемая посуда меньше успевает охладиться, то есть приток тепла значительно превосходит его отход. Но интенсивное горение газа нельзя обеспечить без избыточного давления в баллоне. Кроме того, избыточное давление обеспечивает устойчивое горение плитки на ветру. Проще всего усилить давление газа в баллоне положив какой-нибудь груз сверху. Например, рюкзак, сапог, весло (рис. 6).
В зависимости от силы пламени, материала и ёмкости посуды расход газа на кипячение 1 литра воды составляет 20. 30 литров газа.
По окончании приготовления пищи газовый баллон рекомендуется плотно свернуть, удалив остаток газа.
Описанное снаряжение занимает мало места, лёгкое, доступно средствам и умению каждого рыболова, туриста-водника.
ЭСБЕ/Болотный газ или метан
 Словник: Битбург — Босха. Источник: т. IV (1891): Битбург — Босха, с. 314—317 ( скан · индекс ) • Даты российских событий указаны по юлианскому календарю. Словник: Битбург — Босха. Источник: т. IV (1891): Битбург — Босха, с. 314—317 ( скан · индекс ) • Даты российских событий указаны по юлианскому календарю. |
Болотный газ или метан (также водородистый метил, формен) — предельный углеводород состава СН4, первый член ряда СnН2n+n, одно из простейших соединений углерода, вокруг которого группируются все остальные и от которого могут быть произведены через замещение атомов водорода различными остатками. В природе болотный газ встречается в свободном состоянии в смеси с азотом, углекислотой, а иногда также и другими углеводородами; он представляет продукт разложения органических веществ, главным образом растений, в присутствии воды без доступа воздуха, а такие условия для его образования, по крайней мере в небольших количествах, встречаются на каждом шагу. Значительные массы болотного газа содержатся в каменноугольных копях, где разложение органических остатков продолжается еще и поныне; здесь он скопляется в пустотах среди пород и с силой вырывается из случайно сделанного отверстия. Большие количества болотного газа, смешанного с азотом, углекислотой и парами нефти, выделяются из трещин в земле по соседству с нефтяными месторождениями, напр. по берегам р. Аллегани, в Северо-Американских Соед. Штатах, у нас, в России, по прибрежью Каспийского моря, в особенности в окрестностях Баку, где находится знаменитый древний храм огнепоклонников (см. Бакинские огни). В Пенсильвании выделяющийся газ утилизируют на металлургических заводах. Образование болотного газа идет непрерывно и в настоящее время в стоячих водах; присутствие его можно доказать в любом пруде или болоте: достаточно потрогать болотный ил палкой, как тотчас же на поверхность воды всплывают пузырьки газа, который можно собрать в опрокинутую горлом вниз склянку с воронкой, наполненную водой. Газ этот оказывается смесью метана с азотом и угольной кислотой; он образуется здесь вследствие брожения растительной клетчатки (под влиянием бактерий). Грязные вулканы Керченского и Апшеронского полуостровов и других местностей выделяют также много иногда совершенно чистого болотного газа; кроме того, он найден в некоторых источниках, соляных залежах (Величка), в тосканских фумаролах и т. д. Присутствие болотного газа доказано также в кишечном канале человека и в продуктах выдыхания некоторых домашних животных.
Болотный газ образуется в значительных количествах при некоторых химических реакциях: на первом месте здесь следует поставить сухую перегонку органических веществ: дерева, торфа, каменного угля, нефти и т. п.; он является, таким образом, существенной составной частью светильного газа, где его содержание тем значительнее, чем выше была температура фабрикации. Продукты замещения водородов болотного газа галоидами дают при восстановлении (амальгамой натрия, водородом при высокой температуре) обратно болотный газ. Бертело, много работавший с этим веществом, синтезировал его, пропуская смесь сероводорода и паров сернистого углерода над слоем меди:
Броди наблюдал образование его при действии электрических искр на смесь окиси углерода и водорода. Для получения болотного газа сильно нагревают тесную смесь уксусно-натровой соли с 4 ч. натристой извести; подмесь этилена удаляют, пропуская газ через пемзу, смоченную серной кислотой, но он содержит еще водород:
Химически чистый болотный газ образуется при разложении цинкметила Zn(СН 3)2 водой, при чем выделяется окись цинка. Гладстон и Трайб получают его, разлагая йодистый метил при посредстве медно-цинковой пары.
Чистый болотный газ бесцветен, не имеет запаха и вкуса; уд. вес его 0,559; критическая температура, по Ольшевскому, — 81,8° Ц. (при давлении в 54,9 атмосф.); температура кипения — 164°; темпер. затвердевания — 185°,8; легко воспламеняется и горит бледным, едва светящим пламенем; наиболее сильно взрывает при зажигании в смеси с 2 об. кислорода или 7—8 объемами воздуха; при 16 объемах воздуха взрыва уже не происходит; в воде мало растворим, значительно легче в алкоголе; не ядовит. По химическим свойствам болотный газ представляет весьма прочное вещество, не дающее продуктов присоединения, реагирующее только с галоидами (кроме йода); при пропускании его через раскаленную трубку лишь незначительная часть переходит в нафталин; при действии искр сильного индукционного аппарата часть болотного газа разлагается на углерод и водород, причем образуется также ацетилен. Хлор не действует в темноте; при рассеянном свете образуются продукты субституции, а на прямом солнечном свету смесь обоих газов дает сильный взрыв; болотный газ не изменяется при обработке смесью дымящейся серной и азотной кислот.
Продукты субституции болотного газа галоидами.
Бром на болотный газ действует весьма трудно; йод совсем не действует.
Бромистый и йодистый метил получаются при действии брома или йода и желтого фосфора на метильный алкоголь. Из них йодистый метил (CH3J) имеет большое применение к лабораторной и фабричной практике для получения различного рода веществ и красок, содержащих метильные группы. Он представляет бесцветную, сильно преломляющую свет тяжелую жидкость уд. веса 2,1992 (при 0°), обладающую эфирным, несколько резким запахом, кипящую при 44°, трудно загорающуюся; почти нерастворимую в воде и легко — в спирте и эфире. Йодистый метил легко вступает в обменное разложение со многими веществами: алкоголятами, солями кислот, амидокислотами и т. п.; восстановители легко переводят его в Б. газ; при нагревании с водой в запаянных трубках дает йодистый водород и метильный алкоголь (Нидерист).
Фтористый метил, СН3F, получен впервые Дюма и Пелиго нагреванием метилсерно-калиевой соли с фтористым калием. Муассан и Мельсан в последнее время приготовили его, действуя фтористым серебром на йодистый метил. Вещество представляет бесцветный газ с приятным эфирным запахом, горящий голубоватым пламенем; уд. вес его найден 1,22 (вместо 1,19 теоретич.); при 32 атм. сгущается в жидкость (при обыкновенной температуре); 100 к. см воды растворяют (при 18°) 193 к. см газа; значительно более растворим в метильном алкоголе; весьма прочен, трудно омыляется водным едким кали.
2) Из продуктов вторичного замещения галоидами водорода болотного газа известны: хлористый метилен, бромистый метилен, йодистый метилен и фтористый метилен. Первые два образуются, по А. М. Бутлерову, при действии хлора или брома на йодистый метилен, полученный впервые Бутлеровым же при нагревании йодоформа (СJ 3) с алкоголятом натрия. Йодистый метилен представляет желтоватую, сильно преломляющую свет жидкость, кипящую с некоторым разложением при 180°; при 0° она застывает в листоватые кристаллы, плавящиеся при +2°, уд. вес 3,342 (при +5°). При нагревании йодистого метилена с водой и медью до 100° образуются этилен и его гомологи (Бутлеров); с уксусно-серебряной солью получается эфир метиленгликоля СН2(СО3СН3)2, а со щавелево-серебряной — оксиметилен (см. Муравьиная кислота и Альдегид). Благодаря значительному удельному весу йодистый метилен употребляется для определения плотности растворяемых в воде солей (Ретжерс).
3) Продукты третичного замещения галоидами водородов бол. газа:
хлороформ (СНСl3), см. это сл.; бромоформ (CHBr3), см. это сл.; йодоформ (CHJ3), см. это сл.; фтороформ (CHF3), см. это сл.
4) Продукты полного замещения галоидами:
четыреххлористый углерод, перхлорметан, CCl4 открыт Реньо в 1839 г. при действии хлора на хлороформ; его получают, пропуская сухой хлор в кипящую смесь сернистого углерода CS 2 с пятихлористой сурьмой. Вещество представляет жидкость с пряным запахом, кипящую при 76,7°, уд. веса 1,6084 (при 9,5°); критическая температура его 285,3° (Павлевский); нерастворим в воде, но легко — в алкоголе и эфире; действует анестезирующим образом. Восстановители переводят четыреххлористый углерод в хлороформ и хлористый метилен; при пропускании паров его через раскаленную трубку получаются: перхлорэтилен C 2Cl4 и перхлорэтан C 2Cl6; с фосфорным ангидридом при 200° образуются хлорокись углерода СОСl 2, хлорокись фосфора и угольная кислота (Густавсон); вещество хлорирует при нагревании неорганические кислоты и металлические окиси.
Четырехбромистый углерод CBr4 содержится в броме, добываемом из золы морских растений; получен Боласом и Гровесом при продолжительном нагревании сернистого углерода с бромом и йодом; образуется, между прочим, при действии бромистого алюминия (AlBr 3) на четыреххлористый углерод или брома на четырехйодистый углерод CJ 4 (Густавсон); вещество представляет таблички, плавящиеся при 92,5°; кипит, почти не разлагаясь, при 189,5°; четырехбромистый углерод сходен по реакциям с хлористым соединением; разлагается при 350° с выделением брома и образованием тетрабромэтилена С 2 Вr 4 и бромбензола C 6Br6.
Четырехиодистый углерод CJ4 получен Густавсоном при действии йодистого алюминия на четыреххлористый углерод; кристаллизуется в темно-красных правильных октаэдрах; разлагается при нагревании на воздухе; при кипячении с водой дает йодоформ.
Четырехфтористый углерод CF4 получен Муассаном при пропускании фтора над мелко раздробленным углем; уголь при этом раскаляется и горит в атмосфере фтора. В этом случае, а также при действии фтора на Б. газ наряду с четырехфтористым углеродом образуются и другие фтористые соединения углерода. Шабрие рекомендует готовить вещество нагреванием фтористого серебра с четыреххлористым углеродом в запаянных трубках из богемского стекла. Четырехфтористый углерод представляет газ, сгущающийся при 15° в жидкость; мало растворим в воде, разъедает стекло. Серная кислота и растворы щелочей на него не действуют.
Нитропроизводные болотного газа.
1) Нитрометан, нитрокарбол CH3NO2 получен в 1872 г. Кольбе при действии азотистокислого калия на калиевую соль монохлоруксусной кислоты; одновременно с ним В. Мейер получил это соединение двойным разложением азотисто-серебряной соли с йодистым метилом. Нитрометан представляет тонущее в воде, трудно растворимое в ней масло с характерным эфирным запахом; кипит при 101°, горит бледным пламенем. По химическим свойствам нитрометан представляет как бы одноосновную кислоту (благодаря присутствию группы электроотрицательного характера); напр. с алкогольным едким натром он дает соль CH 2(NO2)Na. Водород в момент выделения восстановляет его в метиламин; с кислотами, напр., соляной, при нагревании образуется муравьиная кислота и гидроксиламин. Хлор и бром почти не действуют на нитрометан; но в присутствии едких щелочей получаются галоидозамещенные нитросоединения (см. Нитросоединения). Представителем их может служить хлорпикрин.
2) Хлорпикрин, или трихлорнитрометан, ССl 3 (NО 2), открыт Стенгоузом при перегонке раствора пикриновой кислоты (см. это сл.) с хлорной известью; состав вещества определен Жераром и Кагуром. Хлорпикрин образуется, по-видимому, весьма часто при действии хлора на соединения, содержащие в своем составе несколько нитрогрупп, или при обработке азотной кислотой веществ, богатых хлором. Кекуле получил его при действии концентрированной азотной кислоты на хлорал и при перегонке спирта с поваренной солью, азотной и серной кислотами. Готовят его обыкновенно, действуя пикриновой кислотой (4,5 ч.) на хлорную известь (45 ч.), замешанную с водой в тесто, при нагревании; по окончании реакции хлорпикрин отгоняют с водяным паром. Хлорпикрин представляет бесцветную, сильно преломляющую свет жидкость с пронзительным, вызывающим слезы запахом. Перегоняется без разложения при 112°; уд. вес при 0° 1,692; нерастворим в воде, но легко растворяется в бензоле, сероуглероде, алкоголе; в свою очередь является растворителем для йода, смол и других богатых углеродом соединений. Восстановители переводят его в метиламин; образует с алкоголятом натрия ортоугольные эфиры; с алкогольным аммиаком дает гуанидин (см. это сл.).
которую разлагают действием серной кислоты. Реакцию следует вести осторожно, так как нитроформ легко взрывает при нагревании. Вещество представляет бесцветные кубы или ромбоэдры, плавящиеся при 15°, легко воспламеняющиеся, растворимые в воде с желтым цветом. Водород нитроформа легко замещается металлами; бром на солнечном свету дает бромнитроформ; смесь крепкой азотной и серной кислот переводит вещество в:
4) тетранитрометан, нитроуглерод C(NO2)4, открытый при только что упомянутой реакции Шишковым; соединение представляет кристаллы, плавящиеся при +13°; кипит, не разлагаясь, при 126°; не взрывает и не воспламеняется; в воде не растворимо.