что такое блокатор циклооксигеназы тромбоцитов
Что такое блокатор циклооксигеназы тромбоцитов
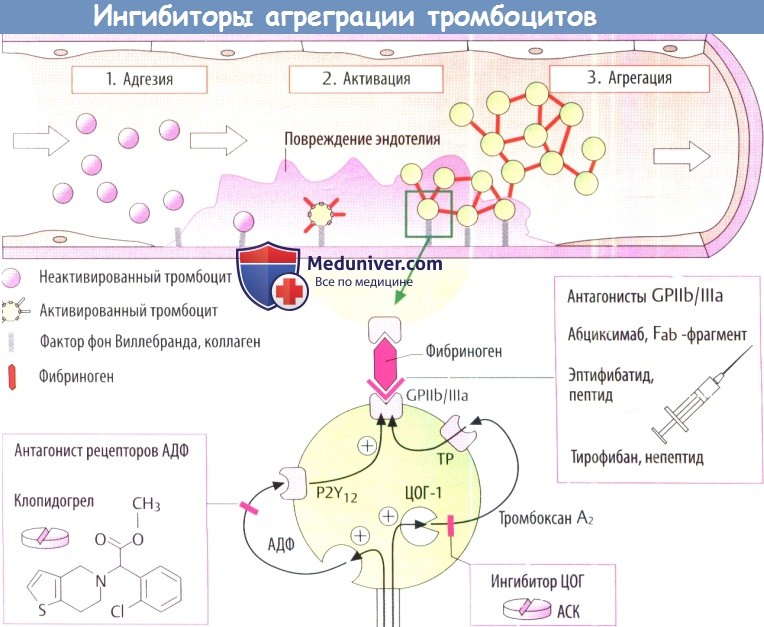
Тромбоциты могут агрегировать при повреждении стенки сосуда или нарушении функции эндотелия (из-за гипертензии, повышенного уровня липопротеидов низкой плотности [ЛПНП] в плазме, нелеченного сахарного диабета, курения). Взаимодействие с фактором фон Виллебранда и коллагеном обеспечивает адгезию тромбоцитов к стенке сосуда и их активацию.
Активация тромбоцитов приводит к изменению их формы и стимулирует выделение веществ, запасенных во внутриклеточных гранулах (аденозиндифосфат [АДФ], серотонин). Кроме того, стимулируется циклооксигеназа (ЦОГ-1), изарахидоновой кислоты образуется тромбоксан А2. Вышедшие АДФ и тромбоксан А2 активируют связанные с G-белками рецепторы (P2Y12 и ТР), что в конечном счете изменяет конформацию гликопротеида GP llb/llla на мембране тромбоцита.
Этот гликопротеид обладает сродством к фибриногену и может вызывать образование поперечных связей между тромбоцитами. Тромб, образующийся над дефектом эндотелия, может затруднять кровоток или вообще закупоривать сосуд (при инфаркте миокарда или инсульте).
Склонность тромбоцитов к агрегированию можно подавлять с помощью различных фармакологических средств.
а) Ацетилсалициловая кислота (АСК) предотвращает синтез тромбоксана, опосредованный ЦОГ-1. Низкие суточные дозы (75-100 мг) могут быть недостаточными. Показания к применению включают профилактику повторного инфаркта после перенесенного инфаркта миокарда и предупреждение инсульта. Несмотря на низкую дозировку этого препарата, не исключаются такие неблагоприятные эффекты, как повреждение слизистой оболочки желудка или индуцирование приступов астмы
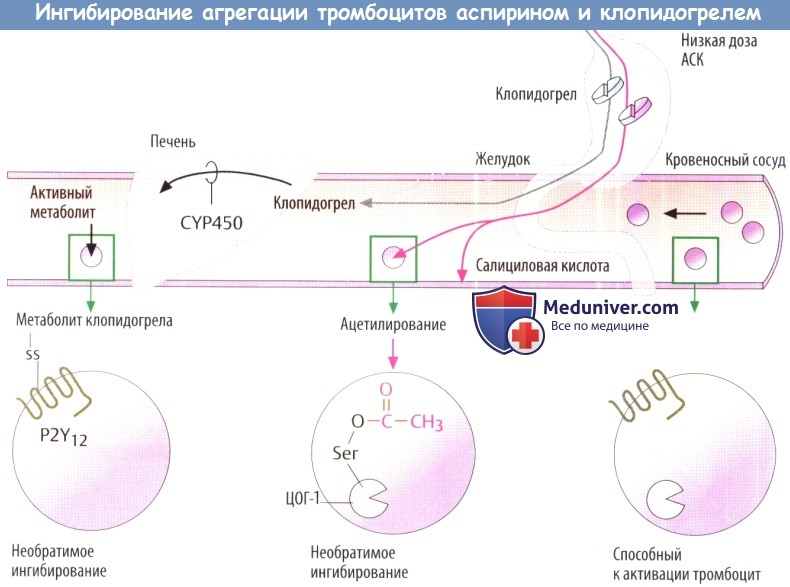
б) Доступной альтернативой аспирину (АСК) служат антагонисты рецепторов АДФ тиклопидин, клопидогрел и прасугрел, которые также можно принимать внутрь. Антагонисты АДФ, аналогично АСК, вызывают необратимое угнетение функции тромбоцитов. Эти вещества представляют собой неактивные предшественники, превращающиеся в печени с помощью цитохромоксидазы Р450 в активные метаболиты, которые ковалентно связываются с подтипом P2Y-рецепторов АДФ на тромбоцитах.
Следовательно АДФ-опосредованная агрегация тромбоцитов ингибируется на протяжении всего жизненного цикла тромбоцита (7-10 дней). Тиклопидин может вызывать серьезные побочные эффекты, в т. ч. нейтропению и тромбоцитопению. «Правопреемник» тиклопидин, клопидогрел, переносится лучше.
в) Антагонисты интегрина гликопротеида IIb/III. Доступные представители этого класса препаратов пригодны лишь для парентерального введения. Их используют при чрескожной коронарной баллонной ангиопластике или нестабильной стенокардии. Они блокируют белок, сшивающий фибриноген, и тем самым уменьшают фибриноген-опосредованное соединение тромбоцитов независимо от фактора, способствующего преципитации.
Абциксимаб представляет собой гибридный Fa-фрагмент антитела, направленного против GP IIb/III. Тирофибан и эптифибатид действуют как конкурентные антагонисты участка, связывающего фибриноген. Поскольку абциксимаб находится в связанном состоянии c GP IIb/IIIa в течение долгого времен агрегация тромбоцитов снова становится возмож ной лишь спустя несколько дней после инъекции. У эптифтибатида и тифибана это действие длится несколько часов.
Антагонисты GP IIb/IIIa несут риск кровотечения во время лечения, т.к. они ингибируют общий конечный путь активации тромбоцитов.
г) Пресистемное действие ацетипсапициповой кислоты. Аспирин угнетает агрегацию тромбоцитов за счет ацетилирования и блокады тромбоцитарной ЦОГ-1. Специфичность этой реакции достигается следующим образом: необратимое ацетилирование ЦОГ происходит в крови в висцеральной области, т.е. до того, как она дойдет до печени.
Учитывая масивное пресистемное деацетилирование аспирина, она почти не влияет на «постпеченочные» циклооксигеназы ЦОГ-1 угнетаетсяименновтромбоцитах, т.к. нормальные клетки, имеющие ядро, способны заново синтезировать фермент.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Антиагреганты в практике лечения сердечно-сосудистых заболеваний
Тромбообразование играет ключевую роль в развитии различных сердечно-сосудистых осложнений. В патогенезе ишемических болезней органов и систем человеческого организма: ишемической болезни сердца (ИБС) [острый коронарный синдром (ОКС), инфаркт миокарда
Тромбообразование играет ключевую роль в развитии различных сердечно-сосудистых осложнений. В патогенезе ишемических болезней органов и систем человеческого организма: ишемической болезни сердца (ИБС) [острый коронарный синдром (ОКС), инфаркт миокарда (ИМ)], ишемического мозгового инсульта, гангрены конечностей и других нарушений кровоснабжения органов и тканей — значительное место занимают воспалительные и атеросклеротические повреждения сосудов с нарушением целостности интимы, замедление кровотока, дисбаланс свертывающей и противосвертывающей системы и нарушение реологических параметров крови.
При повреждении эндотелия сосудов различной этиологии происходит формирование тромба и вследствие этого — критическое сужение просвета сосудов или его полное закрытие (частичная или полная окклюзия). В нарушениях реологических параметров крови агрегационное состояние тромбоцитов и эритроцитов играет ведущую роль [1, 6, 8, 10, 17].
Современное лечение и профилактика сердечно-сосудистых осложнений, в частности ИМ, невозможны без четкого представления механизмов тромбообразования, материальным субстратом которого являются тромбоциты, эритроциты, фибриноген. ИМ — ишемический некроз сердечной мышцы — в 95% случаев развивается в результате формирования тромба в коронарной артерии, что подтверждается данными аутопсии среди умерших в первые 3 ч от начала развития болевого синдрома и результатами коронарографического исследования у больных, поступивших в стационар в первые часы развития миокардиальной катастрофы [10].
В процессе тромбообразования тромбоцит проходит четыре стадии: активация, высвобождение активных биологических веществ (тромбоксаны, аденозиндифосфат АДФ, серотонин, гликопротеиновые (ГП) рецепторы — IIb/IIIa), агрегация и адгезия. Эти процессы (макро- и микротромбообразование) особенно бурно проявляются при дестабилизации коронарного кровотока — ОКС,, включая ИМ. В основе макро- и микротромбообразования лежат механизмы, стимулирующие агрегационную активность тромбоцитов и эритроцитов — наличие ускоренного, турбулентного тока крови в суженном атеросклеротической бляшкой участке сосуда, что способствует повреждению эндотелия (с развитием эндотелиальной дисфункции) и «обнажению» коллагена, одного из главных факторов агрегации и адгезии тромбоцитов. Тромбоциты вступают в контакт с субэндотелиальным слоем, в частности с главным стимулятором адгезии — коллагеном, образуют отростки с образованием тромбоцитарных конгломератов (агрегация) и приклеиваются (адгезия) на этих участках, создавая белый тромб.
Активация тромбоцитов осуществляется катехоламинами, тромбином, АДФ, серотонином, коллагеном, тромбоксаном А2 — продуктом метаболизма арахидоновой кислоты.
В результате активации тромбоцитов происходит высвобождение из последних биологически активных веществ (АДФ, тромбоксан А2, серотонина) и лабилизация мембраны тромбоцита с образованием ГП-рецепторов IIb/IIIa под действием АДФ и тромбоксана А2.
Агрегация тромбоцитов — образование тромбоцитарных конгломератов в плазме крови — происходит при активации и взаимодействии ГП-рецепторов IIb/IIIa через образования фибриновых мостиков между тромбоцитами.
Адгезия — прилипание тромбоцитарных конгломератов к поврежденной интиме сосудов — контролируется фактором Виллебранда.
Таким образом, активация тромбоцитов — ключевой момент в патогенезе сердечно-сосудистых осложнений, во многом определяющий выраженность нарушений кровоснабжения органов и тканей (сердце, головной мозг, периферические сосуды), поэтому антиагрегационная терапия является патогенетически обоснованной.
В настоящее время выделяют четыре группы антитромбоцитарных препаратов, в основе разделения которых лежат принципы доказательной медицины, учитывающие эффективность и наличие побочных действий. Первая группа антитромбоцитарных препаратов, применение которых не рекомендуется для практической кардиологии вследствие отсутствия доказательной основы преимуществ перед Аспирином, неэффективности и потенциальной опасности: сульфинпиразон, дипиридамол, простациклин, блокаторы синтетазы тромбоксана А2, антагонисты рецепторов тромбоксана А2, препараты ингибиторов рецепторов IIb/IIIa тромбоцитов для приема внутрь. Вторая группа, составляющая основу современной антитромбоцитарной терапии, — ингибиторы циклооксигеназы (ЦОГ): ацетилсалициловая кислота (АСК) — Аспирин. Третья группа — тиенопиридины (клопидогрел — Плавикс, тиклопидин — Тиклин). Четвертая группа — блокаторы ГП-рецепторов IIb/IIIa для внутривенного применения (абциксимаб, эптифибатид, тирофибан, фрамон) [1, 3, 8, 9, 11, 12].
АСК используется в медицинской практике более ста лет. Начиная с 1980-х годов, Аспирин активно применяется в клинической практике при лечении ОКС с целью предупреждения развития ИМ. Проведено несколько значительных исследований (VA, RISC, ISIS-2), которые убедительно продемонстрировали способность Аспирина снизить риск развития острого ИМ и смерти от острой коронарной недостаточности на 41–70%. В 2002 г. Antithrombotic Trialists Collaboration опубликовала данные крупнейшего метаанализа результатов 287 рандомизированных клинических исследований, охвативших 135000 пациентов. Полученные данные свидетельствуют о преимуществах Аспирина у пациентов с высоким риском развития осложнений. В метаанализе убедительно показано, что применение высоких доз Аспирина (500–1500 мг) не имеет преимуществ в терапевтической эффективности по сравнению со средними (160–325 мг) и низкими (75–150 мг) дозами и довольно часто сопровождается побочными действиями со стороны желудочно-кишечного тракта (ЖКТ). Подобные результаты легли в основу постулата: оптимальная доза Аспирина для длительной профилактики сердечно-сосудистых осложнений у пациентов с высоким риском находится в пределах 75–150 мг/сут [1, 4, 8, 11, 13, 17].
Американская диабетологическая ассоциация рекомендует применять АСК в дозе от 81 до 325 мг для вторичной профилактики поражений крупных сосудов у больных диабетом старше 30 лет, сочетающегося с компонентами метаболического синдрома: избыточной массой тела (> 120% от идеальной массы тела, индекс массы тела (ИМТ) > 28 для женщин и > 27,3 для мужчин), атерогенной дислипидемией (триглицериды > 250 мг%, холестерин липопротеидов низкой плотности > 130 мг% и холестерин липопротеидов высокой плотности
А. М. Шилов, доктор медицинских наук, профессор
С. А. Князева, кандидат медицинских наук
С. А. Мацевич
ММА им. И. М. Сеченова, Москва
Антитромботическая терапия при ИБС
Атеротромбоз — тромбообразование на поверхности поврежденной атеросклеротической бляшки, является основным патогенетическим механизмом ее роста и причиной развития осложнений атеросклероза. Тромботические осложнения атеросклероза, прежде всего инфаркт ми
Атеротромбоз — тромбообразование на поверхности поврежденной атеросклеротической бляшки, является основным патогенетическим механизмом ее роста и причиной развития осложнений атеросклероза. Тромботические осложнения атеросклероза, прежде всего инфаркт миокарда (ИМ) и инсульт, занимают ведущее место в структуре общей смертности в большинстве развитых стран [1]. В России ситуация выглядит особенно неблагоприятной: на долю сердечно-сосудистых заболеваний приходится большинство случаев смерти — 55,4%, при этом атеротромбоз является причиной смертности в 30% случаев [2].
Антитромботическая терапия признана основой патогенетического лечения как острых, так и хронических форм ИБС. Основными направлениями антитромботической терапии являются: ингибирование функции тромбоцитов, воздействие на систему гемокоагуляции, восстановление проходимости сосуда при его тромботической окклюзии (тромболизис). В этом обзоре будут рассматриваться вопросы антитромботической терапии у больных острым коронарным синдромом (ОКС) без подъема сегмента ST на ЭКГ, а также при вторичной профилактике ИБС.
Острый коронарный синдром без подъемов сегмента ST на ЭКГ (нестабильная стенокардия и инфаркт миокарда без зубца Q)
Ацетилсалициловая кислота (АСК) назначается всем больным с подозрением на острый коронарный синдром (ОКС) при отсутствии противопоказаний [3, 4]. Антитромботический эффект АСК (аспирин кардио, кардиаск, тромбо асс) связан с необратимым ингибированием циклооксигеназы тромбоцитов, следствием которого является уменьшение образования тромбоксана А2 — одного из основных индукторов агрегации, а также мощного вазоконстриктора, высвобождающегося из тромбоцитов при их активации. Эффективность АСК у больных нестабильной стенокардией была установлена для широкого диапазона доз — от 75 до 1300 мг/сут [5–8]. При объединенном анализе результатов 12 исследований, включивших более 5000 пациентов с нестабильной стенокардией, было показано, что прием АСК сопровождается снижением риска развития сосудистых событий на 46% [9]. Кроме того, отмечено, что у больных нестабильной стенокардией АСК не только снижает частоту развития ИМ и смертность, но также уменьшает тяжесть клинических проявлений острой коронарной недостаточности [10]. Учитывая необходимость быстрого достижения антитромботического эффекта препарата у больных ОКС, рекомендовано использование нагрузочной дозы АСК 160–300 мг, с последующим приемом по 75–100 мг/сут [11].
Больные ОКС представляют собой группу высокого риска развития сосудистых осложнений. Известно, что, несмотря на проводимую антитромботическую терапию, 10–15% больных ОКС умирают или переносят крупноочаговый ИМ [4, 12]. Примерно 20% больным, перенесшим ОКС, в течение года требуется повторная госпитализация. Применение коронароангиоскопии у больных, переживших ОКС, позволило выявить признаки внутрикоронарного тромбоза спустя месяц после периода нестабильности [13]. Повышенное содержание маркеров тромбинообразования отмечено у большинства больных ОКС, причем длительность этого повышения сохраняется на протяжении, по меньшей мере, 6 мес [14]. Безусловно, блокируя только один путь активации тромбоцитов, связанный с ингибированием циклооксигеназы и образованием тромбоксана А2, АСК не может решить все проблемы антитромботической терапии. В настоящее время установлено, что назначение антитромботических препаратов различного механизма действия способно усилить традиционную терапию АСК у больных ОКС.
Клопидогрель и тиклопидин — два известных на сегодняшний день представителя группы тиенопиридинов, механизм действия которых связан с ингибированием АДФ-индуцированной агрегации тромбоцитов. Клопидогрель и тиклопидин относятся к пролекарствам. Образование метаболитов, обладающих антитромбоцитарной активностью происходит в печени. Тиклопидин в настоящее время практически не используется у больных ОКС, главным образом в связи с отсроченным антитромботическим эффектом [15]. Клопидогрель, в отличие от тиклопидина, при назначении в нагрузочной дозе 300 мг способен быстро достигать терапевтической концентрации и, следовательно, обеспечивать быстрое ингибирование функции тромбоцитов. Также клопидогрель выгодно отличается от тиклопидина меньшей частотой возникновения побочных эффектов, наиболее значимыми из которых являются: кровотечения, нейтропения, тромбоцитопения [16]. Клопидогрель является препаратом выбора у больных ОКС в случае непереносимости АСК [3, 11].
Идея возможного аддитивного эффекта комбинации двух антиагрегантов различного механизма действия (клопидогреля и АСК) получила свое подтверждение в исследовании СURE, в которое было включено 12 562 больных ОКС без подъемов сегмента ST на ЭКГ, а длительность наблюдения составила от 3 до 12 мес [17]. Клопидогрель применялся однократно в нагрузочной дозе 300 мг, а затем по 75 мг/сут в дополнении к 75–325 мг АСК. При комбинации клопидогреля с АСК, в сравнении с монотерапией АСК, снижение риска развития ИМ, инсульта, сосудистой смерти составило 20%. Преимущества комбинированной терапии отмечались как в первые 30 дней после рандомизации, так и на протяжении 12 мес наблюдения. Снижение риска развития сосудистых осложнений при комбинации клопидогреля с АСК наблюдалось во всех подгруппах и не зависело от сопутствующего назначения гепарина или ингибиторов IIb/IIIa рецепторов.
Отдельный анализ больных, подвергнутых чрескожному вмешательству на коронарных артериях (PCI-CURE), также подтвердил преимущество комбинированной терапии перед АСК [17]. В этой части исследования все больные в течение 4 нед получали клопидогрель, а затем возвращались к терапии в соответствии с рандомизацией. У продолжавших принимать клопидогрель с АСК риск развития ИМ, сосудистой смерти и потребности в проведении срочной коронарной баллонной ангиопластики (КБА) был на 30% ниже за 30 дней наблюдения и на 25% ниже за 12 мес, в сравнении с принимавшими только АСК. Подобные доказательства пользы от длительного совместного применения клопидогреля и АСК у больных ИБС, перенесших чрескожное вмешательство на коронарных артериях, были получены и в исследовании CREDO [19]. В недавно завершившемся исследовании ARMYDA-2, в которое было включено 255 больных ИБС (25% с ОКС без подъема сегмента ST на ЭКГ), было отмечено преимущество использования нагрузочной дозы клопидогреля 600 мг, чем 300 мг перед проведением чрескожного вмешательства на коронарных артериях. Риск смерти, ИМ и потребности в экстренной реваскуляризации за 30 дней наблюдения составил 4% у пациентов, получавших нагрузочную дозу клопидогреля 600 мг перед проведением КБА, в сравнении с 12% среди принимавших 300 мг.
В исследовании СURE серьезные геморрагические осложнения в группе комбинированной терапии встречались чаще: однако статистической разницы по числу угрожающих жизни кровотечений отмечено не было. Прием более высоких доз АСК не приводил к повышению эффективности лечения. Ретроспективный анализ результатов исследования установил зависимость между увеличением числа кровотечений и дозой АСК при его комбинации с клопидогрелем [18]. Риск больших кровотечений был почти в 2 раза выше при приеме АСК > 200 мг/сут, чем при 1000 пациентов) рандомизированных исследований по применению ингибиторов IIb/IIIa рецепторов тромбоцитов, включивших 31 402 больных ОКС без планируемой ранней процедуры вмешательства на коронарных артериях [28]. Установлено, что добавление ингибиторов IIb/IIIa рецепторов тромбоцитов к стандартной антитромботической терапии приводит к дополнительному 9% снижению риска ИМ и смерти за 30 дней наблюдения, при этом разброс значений по исследованиям составлял от 2 до 16%. Подсчитано, что достигнутая 1% абсолютная разница в снижении риска ИМ и смерти на терапии ингибиторами IIb/IIIa рецепторов тромбоцитов, в сравнении с контролем, сопровождается увеличением числа больших кровотечений на 1%. На основании этих данных, Европейским обществом кардиологов был сделан вывод о том, что соотношение пользы и риска применения ингибиторов IIb/IIIa рецепторов тромбоцитов у больных ОКС без планируемой процедуры ранней реваскуляризации остается неясным [11]. И напротив, их назначение в дополнение к другим антитромботическим препаратам при чрескожном вмешательстве на коронарных артериях, позволяет снизить риск тромботических осложнений, связанных с процедурой реваскуляризации. В настоящее время не получено доказательств пользы от применения пероральных ингибиторов IIb/IIIa рецепторов тромбоцитов [29].
При запланированной КБА внутривенное введение ингибиторов IIb/IIIa рецепторов тромбоцитов проводят до, во время и после инвазивного вмешательства. Продолжительность введения отличается у различных ингибиторов IIb/IIIa рецепторов тромбоцитов, что связано с фармакокинетическими особенностями каждого препарата.
Наиболее частыми осложнениями применения ингибиторов IIb/IIIa рецепторов тромбоцитов являются кровотечения и тромбоцитопения. Для снижения риска геморрагических осложнений при проведении КБА на фоне ингибиторов IIb/IIIa рецепторов тромбоцитов рекомендуется снижать дозу вводимого гепарина (до 70 ЕД/кг и менее) и стремиться поддерживать активированное время свертывания крови на уровне 200 с [4, 12]. При совместном назначении с ингибиторами IIb/IIIa рецепторов тромбоцитов предпочтительнее использовать низкомолекулярные гепарины вместо нефракционированного [3]. Тромбоцитопения возникает редко, и прекращение инфузии ингибиторов IIb/IIIa рецепторов обычно приводит к нормализации содержания тромбоцитов. Реже при использовании абциксимаба может потребоваться переливание тромбоцитарной массы.
Учитывая активацию системы свертывания крови при ОКС, приводящую к повышенному тромбинообразованию, представляется патогенетически оправданным применение препаратов, инактивирующих тромбин.
Гепарин является непрямым ингибитором тромбина, так как для осуществления своего антикоагулянтного действия ему необходим кофактор — антитромбин III. Проведенные в начале 1990-х гг. исследования подтвердили эффективность стандартного, нефракционированного гепарина (НФГ) в снижении риска развития ИМ, рефрактерной стенокардии и сосудистой смерти у больных нестабильной стенокардией [30, 31]. Дальнейшие исследования показали, что большего эффекта по снижению риска сосудистых событий у больных ОКС без подъемов сегмента ST на ЭКГ можно достигнуть при сочетании гепарина с АСК, чем при назначении каждого из препаратов в отдельности. По данным метаанализа, проведенного в 1996 г. и включившего шесть исследований, снижение риска ИМ и смерти составило 33% при комбинации гепарина с АСК в сравнении с монотерапией АСК [32]. При этом следует подчеркнуть, что эффективность НФГ при ОКС показана лишь для внутривенного способа введения препарата.
К сожалению, у НФГ имеется ряд существенных недостатков, затрудняющих его применение в клинической практике. Самый главный из них — вариабельность антикоагулянтного и антитромбинового эффектов, что обусловлено высокой степенью связывания НФГ с белками плазмы. Биодоступность препарата при подкожном способе введения еще ниже, чем при внутривенном. При проведении терапии НФГ следует избегать назначения фиксированных доз препарата, а подбирать ее в соответствии с массой тела больного, под контролем активированного частичного тромбопластинового времени (АЧТВ). Болюсно 60–70 ЕД/кг, но не более 5000 ЕД, затем инфузия с начальной скоростью 12–15 ЕД/кг в час, максимум 1000 ЕД [3, 27]. Терапевтический эффект препарата считается достигнутым при удлинении АЧТВ в 1,5–2,5 раза от существующей в лаборатории нормы. Дополнительная трудность заключается также и в том, что тест определения АЧТВ не стандартизован. Имеются различия в чувствительности определения АЧТВ среди реактивов, выпускаемых разными производителями. В настоящее время рекомендуется калибровать диапазон терапевтических значений АЧТВ для каждого используемого реактива. Определение АЧТВ осуществляют каждые 6 ч при подборе дозы НФГ и 1 раз в сут при достигнутом значении АЧТВ в двух последовательных анализах. Кроме того, при проведении инфузии гепарина следует контролировать содержание гемоглобина/гематокрита и тромбоцитов.
Гепарины с низким молекулярным весом (ГНМВ) лишены многих недостатков НФГ, что делает их привлекательной альтернативой при лечении ОКС без подъемов сегмента ST на ЭКГ. ГНМВ в меньшей степени связываются с белками плазмы, обладают лучшей биодоступностью (около 90%, у НФГ — 38%), позволяющей вводить эти препараты подкожно без уменьшения эффекта в сравнении с внутривенным введением. ГНМВ обеспечивают более предсказуемый антикоагулянтный эффект, дозируются по весу больного и не требуют проведения лабораторного контроля. ГНМВ, в отличие от НФГ, обладают преимущественно анти-Ха-фактор-активностью. ГНМВ менее чувствительны к 4-му тромбоцитарному фактору, в меньшей степени влияют на тромбоциты и вызывают меньшее число тромбоцитопений.
При ОКС без подъемов сегмента ST на ЭКГ изучались три ГНМВ: эноксапарин, дальтепарин, надропарин. Дальтепарин и надропарин по эффективности не уступали внутривенному введению НФГ [33, 34]. Применение эноксапарина выявило определенные клинические преимущества перед НФГ: риск смерти, ИМ и потребность в реваскуляризации достоверно снизились приблизительно на 20%, и этот эффект сохранялся на протяжении 8, 14, 43 дней и 1 года наблюдения [35]. Эти данные дали основание утверждать, что назначение именно эноксапарина предпочтительнее НФГ у больных ОКС без подъемов сегмента ST на ЭКГ [27]. Тем не менее в настоящее время сложно говорить о преимуществах того или иного ГНМВ, так как эти препараты не сравнивались напрямую, а между проведенными сравнительными исследованиями с НФГ отмечались существенные различия (по группам больных, дизайну, продолжительности терапии НФГ и т. д.). Недостаточно ясным представляется вопрос о сроках и длительности назначения НФГ и ГНМВ. Учитывая результаты проведенных исследований, наибольшего эффекта от лечения гепаринами следует ожидать при их назначении на ранних сроках заболевания. Есть данные о пользе более длительного назначения ГНМВ у пациентов высокого риска (у больных сахарным диабетом, ИМ в анамнезе, сердечной недостаточностью, лиц > 70 лет, с исходно повышенным уровнем тропонинов крови). В «долгосрочном» исследовании FRISC 2 продолжительность лечения дальтепарином составляла до 3 мес [36]. При терапии дальтепарином в сравнении с плацебо достоверное снижение смерти и ИМ наблюдалось на 30-й день, но эта разница исчезала к 3-му мес. Комбинированный показатель (смерть + ИМ + потребность в реваскуляризации) достоверно снизился к 3-му мес, однако этот положительный эффект был достигнут только у пациентов, получавших консервативное лечение или с исходно повышенным содержанием тропонинов крови.
Таким образом, имеются убедительные данные об эффективности гепаринов, назначаемых в «остром» периоде ОКС без подъемов сегмента ST на ЭКГ, при этом отмечены определенные преимущества ГНМВ перед НФГ [3]. Четких доказательств пользы от долговременной терапии ГНМВ у больных, перенесших ОКС, в настоящее время нет. Тем не менее у ряда пациентов высокого риска (с рецидивирующей стенокардией, повышенным содержанием тропонинов, у которых инвазивное вмешательство на коронарных артериях по каким-либо причинам откладывается) продление срока терапии ГНМВ может привести к дополнительному успеху. При этом следует учитывать стоимость препаратов и то, что они выпускаются только в инъекционной форме.
Тромболитические препараты не применяются при ОКС без подъемов сегмента ST на ЭКГ. Данные крупных исследований и метаанализов не выявили преимуществ проведения тромболиза у больных нестабильной стенокардией и ИМ без зубца Q, напротив, назначение тромболитических препаратов было связано с увеличением риска смерти и ИМ [37].
Вторичная профилактика ИБС
АСК на сегодняшний день является препаратом, чья клиническая эффективность при вторичной профилактике подтверждена многочисленными контролируемыми исследованиями и метаанализами. В 2002 г. были опубликованы результаты очередного крупного метаанализа по оценке эффективности антитромбоцитарных препаратов, охватившего 287 исследований, из которых 195 были контролируемыми и включали более чем 135 000 пациентов высокого риска, а в остальных сравнивалась эффективность лечения различными антиагрегантами у 77 000 больных [9]. Было показано, что назначение антитромбоцитарных препаратов снижает суммарный риск развития сосудистых событий приблизительно на одну четверть, нефатального ИМ — на одну треть, нефатального инсульта — на одну четверть, сосудистой смерти — на одну шестую. При этом снижение абсолютного риска сосудистых осложнений на терапии антиагрегантами в течение 2 лет у лиц, перенесших ИМ, составило: 36 на 1000 пациентов; среди больных с острым ИМ, получавших лечение в течение 1 мес,— 38 на 1000; у пациентов, перенесших инсульт или преходящее нарушение мозгового кровообращения и лечившихся на протяжении двух лет, — 36 на 1000; у лиц с острым инсультом, получавших лечение в течение 3 нед, — 9 на 1000; среди пациентов со стабильной стенокардией, периферическим атеросклерозом, мерцательной аритмией, лечившихся в течение 2 лет, — 22 на 1000 [9].
Эффективность АСК в лечении и профилактике сердечно-сосудистых заболеваний была установлена для широкого диапазона доз от 30–50 до 1500 мг/сут [15]. Антитромботические эффекты различных доз АСК изучались как в прямых сравнительных исследованиях, так и в метаанализах. Было показано, что назначение низких доз АСК (75–150 мг/сут) для длительной терапии не менее эффективно, чем средних (160–325 мг/сут) или высоких (500–1500 мг/сут) [9]. Исследований с применением очень низких доз АСК (менее 75 мг/сут) к настоящему времени проведено мало, поэтому вопрос о клинической эффективности дозы препарата
П. С. Лагута, кандидат медицинских наук
Институт клинической кардиологии им. А. Л. Мясникова РКНПК МЗСР РФ, Москва