чем заменить дюфастон при эндометриозе
На одном из интернет-форумов, где женщины обсуждают ситуации и проблемы, связанные с зачатием и беременностью, одна из посетительниц задала вопрос, который и стал отправной точкой для написания этой статьи. Звучал вопрос так: «Правда ли, что утрожестан лучше, чем дюфастон? Слышала такую точку зрения много раз, но никак не могу понять, чем именно он лучше… Подскажите, кто знает?»
Мы не ответим на вопрос, какой препарат лучше, а какой хуже – просто потому, что на него не возьмется ответить ни один врач. Сравнивать препараты между собой в категориях «лучше – хуже» некорректно и неправильно в принципе. У каждого препарата свое предназначение, список показаний, побочных действий и противопоказаний
Прежде всего, отметим, что и «Дюфастон», и «Утрожестан» – это препараты прогестерона.
И прямым показанием для их применения служит дефицит прогестерона в организме.
Факты о прогестероне
Прогестерон – женский половой гормон, относящийся к классу стероидных гормонов. Он вырабатывается надпочечниками, желтым телом яичников и плацентой плода. Прогестерон часто называют «гормоном беременности», потому что в период беременности он активно производится плацентой, при этом его уровень постоянно и постепенно увеличивается, а незадолго до родов резко снижается.
Прогестерон является основным гормоном жёлтого тела яичников, которое образуется после овуляции. Этот гормон необходим для того, чтобы слизистая оболочка матки (эндометрий) подготовилась к «приему» оплодотворенной яйцеклетки, поэтому он активно синтезируется в лютеиновую фазу менструального цикла (время между овуляцией и началом менструального кровотечения, то есть примерно вторая половина цикла).
Если яйцеклетка не оплодотворилась, то желтое тело постепенно уменьшается в размерах и производит все меньше и меньше прогестерона. А если оплодотворение произошло, то желтое тело продолжает функционировать далее и активно вырабатывает прогестерон в течение примерно 2,5-3 месяцев. Высокий уровень прогестерона обеспечивает сохранение и нормальное протекание беременности в первом триместре, потому что он стимулирует рост эндометрия и останавливает выход новых яйцеклеток. Желтое тело как бы «оберегает» эмбрион до той поры, когда плацента будет окончательно сформирована и начнет самостоятельно вырабатывать прогестерон и эстроген.
Теперь вам, возможно, стало более понятно, почему при проведении анализа крови на прогестерон (и другие половые гормоны) очень важно знать день менструального цикла или неделю беременности.
Анализ на прогестерон надо сдавать во вторую фазу цикла, поскольку этот гормон является показателем функции желтого тела, т.е. полноценности овуляции.
Утрожестан или Дюфастон
» Утрожестан » имеет ту же химическую формулу, что и прогестерон. Формула » Дюфастона » отличается от нее расположением одной метильной группы, т.е. химическим строением. Считается, что «Дюфастон» является синтетическим прогестероном, а «Утрожестан» содержит микронизированный натуральный прогестерон, полученный из растительного сырья, точнее, из листьев растений семейства Dioscorea. Кстати, именно этот факт порождает массу непрофессиональных обсуждений. Срабатывает стереотип: синтетический – плохой, натуральный – хороший. Однако, это далеко не так.
Так что мнение о «синтетическом» и «натуральном» весьма относительно. Все препараты синтезируются из чего-либо – это основа химической промышленности.
Преимуществом «Дюфастона» является меньшее количество побочных эффектов, которые характерны как для «Утрожестана», так и для натурального прогестерона. Это знакомая многим сонливость, слабость и вялость, быстрая утомляемость, склонность впадать в хандру и расстраиваться по каждому малейшему поводу. «Дюфастон» также выпускается значительно дольше, поэтому опыта его применения, соответственно, больше. Доказано, что это препарат при использовании его во время беременности не оказывает неблагоприятного воздействия на физическое и половое развитие девочек в детстве и пубертате.
Преимуществом «Утрожестана» является то, что он выпускается виде капсул (100 и 200 мг), которые можно принимать не только перорально (т.е. принимать, запивая водой), но и интравагинально (вводить во влагалище)– при токсикозе это может оказаться очень важным фактором.
«Дюфастон» выпускается в таблетках по 10 мг.
В зависимости от клинической ситуации и диагноза суточная доза «Дюфастона» составляет от 10 до 30 мг в сутки. «Утрожестана» – от 200 до 600 мг в сутки.
Некоторые факты, о которых надо знать!
Ни Дюфастон, ни Утрожестан, не оказывает отрицательного влияния на овуляцию и не обладают контрацептивным эффектом! Препараты назначаются во вторую фазу цикла, т.е., как правило, с 16 дня.
Дюфастон не оказывает влияния на показатели коагуляции, углеводный и липидный обмены!
Следует помнить, что при пероральном приеме Утрожестан обладает антиэстрогенным (снижает количество женских половых гормонов) и седативным (успокаивающим) эффектом! Отмечен также антиандрогенный эффект Утрожестана (что может быть использовано при состояниях повышения мужских половых гормонов).
Дюфастон не обладает эстрогенной, андрогенной, анаболической или кортикоидной активностью, т.е. не влияет ни на что, кроме показателя прогестерона.
Во время беременности в первом триместре Утрожестан следует использовать интравагинально!
Сравнительные характеристики препаратов
Теперь сравним характеристики «Дюфастона» и «Утрожестана». Сделаем это при помощи таблиц.
Показания к приему
| Утрожестан | Дюфастон | |
|---|---|---|
| предменструальный синдром | + | + |
| фиброзно-кистозная мастопатия | + | |
| пременопауза (заместительная терапия) | + | |
| заместительная терапия в случае нефункционирующих или отсутствующих яичников | + | |
| поддержка лютеиновой фазы во время подготовки к ЭКО | + | |
| преждевременная менопауза | + | + |
| менопауза и постменопауза | + | + |
| профилактика привычного и угрожающего выкидыша | + | + |
| профилактика миомы матки | + | |
| эндометриоз в качестве послеоперационного лечения | + | + |
| бесплодие, обусловленное лютеиновой недостаточностью | + | + |
| дисменорея | + | |
| нарушения менструального цикла | + | + |
| вторичная аменорея | + | |
| дисфункциональные маточные кровотечения | + |
| Утрожестан | Дюфастон | |
|---|---|---|
| головокружение | + | |
| сонливость | + | |
| промежуточные маточные кровотечения | + | + |
| изменение длительности менструального цикла | + | + |
| аллергические реакции | + |
| Утрожестан | Дюфастон | |
|---|---|---|
| нарушения работы печени | + | |
| склонность к тромбозам | + | |
| сахарный диабет | + | |
| гипертония | + | |
| бронхиальная астма | + | |
| индивидуальная непереносимость | + | + |
Дюфастон® не влияет на способность к вождению автомобиля и управление машинами и механизмами. При приеме Утрожестана внутрь согласно инструкции следует соблюдать осторожность при занятии потенциально опасными видами деятельности, требующими повышенного внимания и скорости психомоторных реакций.
В заключение хотим подчеркнуть, что эта статья – никоим образом не инструкция для самолечения. Помните, что каждая ваша проблема индивидуальна и уникальна. Любое назначение лекарственного препарата является прерогативой медицинского работника. А ваша задача состоит в том, чтобы ответственно относиться к своему здоровью и максимально точно выполнять рекомендации врача. Будьте здоровы!
Дифференциальный подход к выбору метода лечения больных эндометриозом яичников
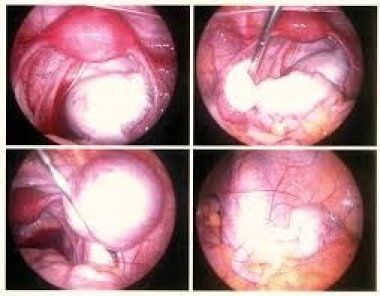
Изучены эффективность и отдаленные результаты склерозирующей терапии эндометриом яичников и обоснованы условия и показания к минимально инвазивному вмешательству.
Efficiency and long-term results of sclerotherapy of ovary endometriosis were studied; conditions and indications for minimal invasive intervention were grounded.
Эндометриоз по праву считается одной из главных причин женского бесплодия и в силу особенностей морфогенеза тяжело поддается медикаментозной терапии. Онкологическая настороженность при эндометриозе остается малоизученной, вызывая много споров и дискуссий. Каждая локализация эндометриоза имеет не только свои клинические, но и патофизиологические и гистологические отличия. Эндометриозу яичников отводится особая роль, для подтверждения которой существует ряд фактов:
1) в структуре всех локализаций эндометриоидных гетеротопий эндометриоз яичников занимает первое место;
2) эндометриоз яичников неблагоприятно воздействует на фолликулогенез в целом и функцию желтого тела в частности;
3) эндометриоз яичников угнетает овариальный резерв, разрушая функциональную ткань яичников;
4) считается, что изначально именно эндометриоз яичников приводит к развитию тяжелого осложнения — глубоко инфильтративного эндометриоза, вовлекая в патологический процесс экстрагенитальные органы и структуры — мочевыводящие пути, кишечник, окружающую брюшину;
5) эндометриоз яичников, в отличие от других локализаций нозологии, представляет наибольшую потенциальную угрозу для озлокачествления.
Эндометриомы (эндометриоидные кисты) яичников занимают лидирующие позиции не только в структуре всех поражений эндометриозом, но и среди причин женского бесплодия, ассоциированного с эндометриозом. Более того, особенности гистогенеза эндометриом (способность к инфильтрации в окружающие ткани) обуславливают снижение объема функционирующей ткани яичника независимо от размеров новообразования [2]. В отношении тактики лечения пациенток с эндометриомами в репродуктивном периоде существуют две точки зрения: одни авторы считают, что при средних размерах эндометриоидных кист до 30 мм целесообразно проведение медикаментозной терапии, другие — придерживаются мнения о необходимости цистэктомии при таких новообразованиях.
Недопустимо медикаментозное лечение эндометриоидных кист яичников без верификации диагноза, так как предполагаемая «эндометриоидная киста» на самом деле может быть опухолью яичника или «переродиться» в нее в процессе лечения». Действительно, с одной стороны, пассивное наблюдение или медикаментозная терапия эндометриом связаны с высоким риском различных осложнений (снижение функции яичников, экспансивный рост новообразования, угроза его озлокачествления), с другой — хорошо известно, что классическая цистэктомия при эндометриоидных кистах яичников сопряжена с потенциальной потерей фолликулярного запаса. Следовательно, для решения данной проблемы необходим некий компромисс, который позволил бы не только избежать повреждения функциональной ткани яичников, но и снизить риски, обусловленные онкологической настороженностью. Сегодня роль «золотой середины» лечения пациенток с эндометриоидными кистами яичников играет аспирационная (склерозирующая) терапия. В литературе последних лет появилось сравнительно большое количество публикаций на эту тему. В частности, García-Tejedor et al. из университетского госпиталя Барселоны (Bellvitge University Hospital-IDIBELL, Испания) опубликовали результаты предварительного анализа 27 случаев склеротерапии эндометриом яичников, выполненных в период 2010–2014 гг. При этом указали частоту рецидивов новообразования всего лишь 12% в течение 17 мес наблюдения [5]. Профессор А. И. Давыдов и соавт. первое подобное вмешательство осуществили в 1999 г. у пациентки 32 лет с единственным яичником, в котором диагностирован рецидив эндометриоидной кисты после предшествующих цистэктомий [6]. Первый опыт оказался удачным: после 2 лет бесплодия у женщины наступила беременность, закончившаяся срочными родами. С того периода были произведены 124 подобные манипуляции, ретроспективный анализ которых позволил обосновать четкую позицию по данному вопросу.
Целью данной работы было изучить эффективность и отдаленные результаты склерозирующей терапии эндометриом яичников и обосновать условия и показания к минимально инвазивному вмешательству.
Пациенты и методы исследования
За период 1999–2017 гг. выполнены 124 вмешательства по методике аспирационной (склерозирующей) терапии эндометриоидных кист яичников. Возраст пациенток варьировал от 18 до 42 лет, составив в среднем 26,4 ± 4,2 года. Средний возраст менархе составил 13,3 ± 1,2 года. Продолжительность менструального цикла у большинства больных (68%) находилась в пределах 25–29 дней. У 92% пациенток длительность менструального кровотечения была 4 и более дней, жалобы на обильные менструации предъявляли 26% больных, а у 36 менструации сопровождались болями различной интенсивности. Одну и более беременностей имели 24 (19%) пациентки; соответственно, не было беременностей у 100 (81%) женщин. Первичное бесплодие диагностировано у 42 (34%) пациенток, вторичное бесплодие — у 9 (7%). Роды в анамнезе имели 26 (20%) больных, у 16% — беременность закончилась самопроизвольным прерыванием в сроки 3–11 нед гестации, причем у 10% женщин — после экстракорпорального оплодотворения. При анализе перенесенных заболеваний обращает на себя внимание высокий инфекционный индекс в детстве. Оперативные вмешательства на придатках матки в связи с новообразованиями яичников различного генеза в прошлом выполнены у 38 (31%) пациенток, в том числе по поводу эндометриоидных кист — у 26 (21%). Следует уточнить, что у 22 из 38 (18%) больных в ходе предшествующих хирургических вмешательств были удалены придатки матки.
Длительность основного заболевания колебалась от нескольких месяцев до 4 лет (в среднем — 1,6 ± 0,6 года). Его ведущими симптомами были: тазовые боли различной интенсивности — 74%, дисменорея — 22%, диспареуния — 14%, меноррагии — 5% (перечисленные симптомы сочетались в различных отношениях). Лишь 15 (12%) пациенток не предъявляли жалоб, у них образования яичников были выявлены гинекологом и/или врачом ультразвуковой диагностики при профилактическом осмотре. При гинекологическом исследовании патологические образования в проекции придатков матки обнаружены у 38% женщин, у 12% — высказано предположение об их наличии. Соответственно в 50% наблюдений новообразования яичников диагностированы только с помощью эхографии.
Методика аспирационной (склерозирующей) терапии эндометриом яичников хорошо известна и описана ранее [6]. Следует акцентировать внимание на необходимости полной санации полости кисты и экспозиции 70% раствора этанола не менее чем на 40 с (в зависимости от исходного объема эндометриомы).
Результаты исследования и их обсуждение
Средний диаметр эндометриом яичников в наших исследованиях варьировал от 25 до 65 мм. В 84 (67,7%) наблюдениях патологический процесс был односторонним, в 72,3% — двусторонним. У 43 (34,6%) женщин имел место рецидив заболевания после предшествующей цистэктомии, у 28 (22,6%) — эндометриоидные кисты локализовались в единственном яичнике и еще у 7 (5,6%) пациенток при ультрасонографии яичник, контрлатеральный от эндометриодного образования, был резко уменьшен в размерах, а в его срезах отсутствовали признаки антральных фолликулов (после предшествующей цистэктомии по поводу эндометриоидных кист). То есть фактически у 35 (28,2%) пациенток эндометриома диагностирована в единственном яичнике. Ультразвуковая характеристика эндометриоидных кист хорошо изучена и не требует обсуждения. Следует уточнить, что их главным акустическим критерием считается констатация внутри патологического образования мелкоточечной эхо-позитивной взвеси на фоне повышенного уровня звукопроводимости. Обнаружение подобной картины позволяет почти в 100% наблюдений установить точный диагноз до хирургического вмешательства.
Для выявления локусов неоангиогенеза — одного из основных маркеров злокачественной опухоли — использовали цветное допплеровское картирование в режиме энергетического допплера. В этом режиме у больных с эндометриомами кровоток регистрировали в области ворот яичника, а также по периферии новообразования в сохранной ткани яичника. Объем содержимого эндометриоидной кисты, эвакуированного в ходе аспирационной терапии, варьировал от 2 до 12 мл. Однако истинный объем содержимого этих кист было сложно оценить вследствие высокой плотности «шоколадной» жидкости, что практически всегда требовало предварительного лизиса с помощью 0,9% раствора NaCl. Важным этапом склерозирующей терапии эндометриом является экспозиция 70% раствора этанола на завершающем этапе вмешательства. Ее длительность зависит от объема полости новообразования и составляет 60–90 с. Суть данного этапа аспирационной терапии — вызвать легкий ожог (химическая деструкция) и в последующем — склероз эндометриоидной выстилки кисты. Склерозирующую терапию пациенток с эндометриоидными кистами яичников необходимо рассматривать только в комплексе с послеоперационным гормональным лечением. Вопрос о роли послеоперационной гормональной терапии больных эндометриозом яичников до настоящего времени остается поводом для дискуссий. Существует точка зрения, что после полного удаления капсулы эндометриоидных кист, других очагов эндометриоза нет необходимости в применении гормональных средств. В то же время никто не отрицает сравнительно высокую частоту рецидивов эндометриом после цистэктомии, что можно объяснить наличием микроскопических и/или непигментированных гетеротопий, рост которых в последующем обуславливает рецидивы патологических образований. В любом случае, аспирационная терапия предусматривает обязательное назначение гормональных препаратов.
Применение в послеоперационном периоде экзогенных гормонов (антигормонов) преследует следующие цели:
1) дополнить склерозирующий эффект этанола;
2) подавить пиковые выбросы гормонов аденогипофиза, способствующие рецидиву заболевания.
Традиционно препаратами первой линии лечения пациенток с эндометриозом после хирургического вмешательства считаются комбинированные оральные контрацептивы (КОК) — эстроген-гестагенные средства [4]. При выборе последних особое внимание уделяют типу прогестагена, так как именно эти соединения оказывают антипролиферативное действие на очаги эндометриоза.
Эффективность результатов комплексной (склерозирующей + медикаментозной) терапии эндометриом оценивали по следующим параметрам:
1) частота рецидивов новообразования;
2) длительность периода, в течение которого произошел рецидив эндометриомы;
3) частота наступления беременности.
Ретроспективный анализ полученных результатов показал, что частота рецидивов заболевания в течение первых 12 мес наблюдения составила 38,7% (48 из 124 наблюдений). В то же время в течение первых 3 мес наблюдения этот показатель не превысил 9,7% (12 из 124 наблюдений). В период 7–12 мес после вмешательства самопроизвольная беременность наступила у 36,3% (46) женщин, которая во всех наблюдениях закончилась родами. Причем часть пациенток (20,1%) по разным причинам не планировали беременности.
Сегодня главная дилемма в отношении эндометриом яичников — оперировать или не оперировать. Справедливо отметить, что по данному вопросу мнения ученых всего мира разделились. Действительно, некоторые авторы ратуют в пользу нехирургического подхода при эндометриомах яичников диаметром до 3 см, аргументируя свою позицию резким снижением, а иногда потерей фолликулярного запаса после хирургических вмешательств на яичниках по поводу эндометриоидных образований. Нельзя не признать, что данный факт имеет высокий уровень достоверности. Механизмы снижения/утраты фолликулярного запаса после хирургического лечения больных эндометриомами яичников различны. Однако главная причина тесным образом связана непосредственно с морфогенезом эндометриом. Хорошо известно, что эндометриоидные кисты в отличие от других доброкачественных новообразований яичников характеризуются наличием плотных подэпителиальных сращений между капсулой кисты и воротами яичников — места прохождения основных кровеносных и лимфатических сосудов, питающих яичник. Поэтому цистэктомия при эндометриоидных кистах — это уже большая травма для яичника, а необходимость лигирования (коагуляции) яичника в области его ворот вызывает дополнительные нарушения в системе кровоснабжения яичника. «Агрессивность» цистэктомии при эндометриомах — это одна сторона медали. Другая — напрямую связана с онкологической настороженностью. Сегодня не является поводом для дискуссий риск озлокачествления эндометриоза. Однако в обсуждении данной проблемы «ускользает» важное уточнение: способностью к малигнизации обладает, как правило, эндометриоз яичников. Именно для этой локализации эндометриоза характерны атипические формы, которые принято рассматривать как фазу перехода доброкачественного процесса в злокачественный [8]. Проведенные по данной проблеме клинико-статистические исследования установили, что в отдаленном периоде наблюдения (11,4 года) риск развития рака яичников у пациенток с эндометриомами яичников в 2 раза выше, чем в популяции [9].
Анализ данных литературы и опыт собственных наблюдений по данной проблеме позволяют обосновать ряд положений:
1) эндометриоз — гистологический диагноз, характеризующийся специфическими морфоструктурными особенностями; до хирургического вмешательства «эндометриодная киста яичника» — лишь предположительное заключение методов инструментальной диагностики (УЗИ, КТ, МРТ);
2) нецелесообразно проводить медикаментозное лечение при эндометриоидных кистах яичников без их гистологической верификации вследствие погрешности диагностики даже при использовании ультрасовременных методов нехирургической визуализации;
3) учитывая высокие риски повреждения фолликулярного запаса после хирургического лечения эндометриом, особенно при их рецидивах, необходимо ставить вопрос о применении аспирационной (склерозирующей) терапии;
4) склерозирующую терапию пациенток с эндометриоидными кистами яичников необходимо рассматривать только в комплексе с послеоперационным гормональным лечением.
Важно подчеркнуть, что от комплаентности экзогенных гормонов зависит исход микроинвазивного (максимально щадящего для функции яичников) хирургического вмешательства, коим является склеротерапия. Сегодня КОК вполне справедливо причисляют к препаратам первой линии выбора, которые используют для купирования тазовой боли у пациенток с эндометриозом. Их потенциальными преимуществами являются сравнительно низкая цена, небольшая частота побочных эффектов, возможность длительного лечения. Последний аспект имеет особое значение у женщин, не планирующих беременность. При выборе КОК для послеоперационного лечения пациенток с эндометриоидными кистами яичников необходимо учитывать фармакодинамику прогестагена, входящего в состав КОК. Данные литературы свидетельствуют, что эффективность диеногеста при эндометриозе сопоставима с таковой агонистов гонадотропин-рилизинг-гормона [10]. Однако в отличие от последних прогестагены не модулируют развитие эстроген-дефицитных состояний, тяжело переносимых пациентами. В литературе последних лет сведения об эффективности склерозирующей терапии эндометриом имеют разноречивый характер. В метаанализе Cohen et al., основанном на изучении мировых источников (Pubmed, Embase, Ovid Medline, Google Scholar, Clinicaltrials. gov, Cochrane Central Register of Controlled Trials), частота рецидивов эндометриом после склерозирующей терапии варьирует от 0% до 62,5% (соответственно эффективность — от 37,5% до 100%) [11]. В наших исследованиях частота рецидивов составила 38,7%, что коррелирует с «нижней границей» эффективности данного метода. В то же время мы считаем это достаточно высоким результатом, основанным на многолетнем опыте. Различия в эффективности склерозирующей терапии, представленные в литературе, по-видимому, объясняются длительностью периода наблюдения за этими пациентками. В частности, в наших исследованиях в течение первых 3 мес наблюдения этот показатель не превысил 9,7%, что в итоге способствовало наступлению беременности у 46 из 124 женщин. С учетом того, что 25 (20,1%) женщин, вошедших в настоящее исследование, не планировали беременность и использовали гормональную контрацепцию (диеногест + этинилэстрадиол), частота наступления беременности в данной группе достигла 46,4%.
Необходимо подчеркнуть, что склеротерапия эндометриом яичников не должна рассматриваться в качестве панацеи в лечении таких пациенток. Ее популяризация не означает отказ от применения других методов хирургического вмешательства. Безусловно, данный метод обеспечивает максимально бережное отношение к фолликулярному запасу. Однако он имеет и свои ограничения, такие как невозможность выполнения овариолизиса, отсутствие визуального контроля над деструкцией капсулы кисты, отсутствие информации о распространенности эндометриоза. Более того, благоприятный исход аспирационной терапии эндометриоидных кист яичников во многом зависит от соблюдения условий и показаний к подобному вмешательству:
Заключение
Склеротерапия эндометриом яичников с ультразвуковым мониторингом вмешательства — минимально инвазивный метод лечения пациенток репродуктивного возраста, обеспечивающий сохранность фолликулярного запаса. Также данный метод можно рассматривать в качестве выбора в сложных клинических ситуациях: рецидив эндометриоидной кисты единственного яичника; предшествующие многократные оперативные вмешательства на единственном яичнике; высокий риск осложнений абдоминального хирургического вмешательства и др. Аспирационная терапия эндометриом не должна рассматриваться в качестве основного метода лечения таких пациенток, для ее применения разработаны определенные условия и показания. Склерозирование капсулы эндометриом яичников не является монотерапией, ее исход во многом определяется адекватностью послеоперационного гормонального лечения.
Литература
М. Б. Таирова 1
А. И. Давыдов, доктор медицинских наук, профессор
ФГАОУ ВО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Дифференциальный подход к выбору метода лечения больных эндометриозом яичников/ М. Б. Таирова, А. И. Давыдов
Для цитирования: Лечащий врач № 12/2018; Номера страниц в выпуске: 20-23
Теги: тазовая боль, эндометриома, склерозирующая терапия