Частичный регресс опухоли что это такое
«Врачи отметили регресс опухоли. Это означало, что можно обойтись без операции!»
Столкнуться лицом к лицу с диагнозом рак – испытание для любого человека. В этом убедился и Андрей Власов. Два года назад у 53-летнего петербуржца врачи обнаружили новообразование гортани. Сегодня Андрей рассказал, как он смог побороть страшное заболевание.
— Образ жизни у меня нездоровый. Стаж курения около 40 лет – вредная привычка появилась с 15 лет. В среднем выкуривал больше пачки сигарет в день. Да и работа в сфере финансов нервная, много стрессов. Экологическая обстановка в нашем городе тоже не самая благополучная.
Осенью 2017 года у меня начал пропадать голос. Ну пропадает и пропадает, простудился, осень. Обратился к ЛОРу без задней мысли, врач ничего у меня не нашел и назначил какие-то пилюли и таблетки от ангины. Но голос не восстановился. Я пошел в Медсанчасть №157. Отоларинголог Виктор Евгеньевич Иванов заметил у меня в горле новообразование и направил в онкологический диспансер. Оказалось, очень вовремя.
Знакомые посоветовали обратиться в НМИЦ онкологии им. Н. Н. Петрова, что я и сделал. Пришел на прием к Замире Ахмедовне Раджабовой. А она женщина жесткая, сразу сказала: «Либо лечим, либо не лечим». Никаких полумер. Но, мне кажется, с нами так и надо, нельзя позволять человеку, у которого выявляется подобное заболевание, опускать руки, бороться нужно начинать сразу. Описала, что меня ждет, если не лечить. Не то чтобы страшно, но перспектива очень нехорошая. Многие, оказавшись в моей ситуации, раскисают и не знают, что делать, а некоторые и вовсе становятся «потеряшками» — после консультации пропадают из поле зрения врачей. Но лично я все обдумал и решил – если есть факт болезни, нужно действовать.
Конечно, члены моей семьи испугались. Но настрой близких сыграл свою роль в борьбе с болезнью. Я признателен и благодарен своей супруге, она не запаниковала. Знаю случаи, когда в семье говорят «это конец», и человек без поддержки просто не справляется. Для себя я в тот момент решил: не время умирать! У меня маленькая дочка, ей тогда было 14 лет, взрослый сын. Глубоко в душе я скрытый оптимист и на тот момент был твердо убежден – всё будет хорошо. Я настроился на выздоровление.
Я прошел все обследования, подлечил сопутствующее заболевание – язву, передал весь пакет документов в НМИЦ им. Н. Н. Петрова. Там мне поставили точный диагноз – опухоль голосового отдела гортани второй стадии.
Отдельно хочу отметить систему организации приема больных и организацию процесса консультирования в НМИЦ онкологии им. Н. Н. Петрова. Уже через пару недель мне позвонила старшая сестра отделения и сказала прибыть на госпитализацию – с тарелкой, ложкой, в общем, со всем необходимым.
При госпитализации выдают анкету, где есть два вопроса: «Боитесь ли вы лечения?», «Нужна ли Вам психологическая помощь?» Я ответил, что боюсь. А вот психологическая помощь мне была не нужна, потому что я ощущал поддержку со стороны медицинского персонала, и на меня сильное воздействие оказывала уверенность лечащего врача – Максима Андреевича Котова.
После первого курса химиотерапии сдал анализы, прошел контрольные обследования, и врачи отметили регресс опухоли. Это означало, что можно обойтись без операции!
Когда я начал проходить лучевую терапию, доктор Ольга Валерьевна Зотова предупредила о том, что у меня пропадет голос. Но не навсегда, а на время. Так и случилось. А через два месяца я снова смог разговаривать. Конечно, у меня поражена слизистая, я кашляю и есть насморк, но я могу говорить.
Что касается химиотерапии ‒ я плохо ее переносил, но меня активно поддерживали врачи и медсестры. За время лечения я похудел на 20 килограмм, превратился в серенького человека, меня просто сдувало ветром, а последний, пятый курс добил меня полностью – у меня еще и язва обострилась. Но в феврале 2018 года лечение завершилось.
В том же 2018 году, к сожалению, от онкологии погибли несколько моих друзей. Они обнаружили заболевание уже на поздних стадиях. Думаю, ранняя диагностика могла бы их спасти. По моему мнению, люди до последнего не обращаются к врачу, потому что никто не хочет услышать плохих вестей от доктора. Но чем раньше «поймать» болезнь, тем больше вероятность вылечиться и прожить больше. Я всем друзьям и знакомым советую наблюдать за своим здоровьем.
Например, члены моей семьи очень внимательно относятся к здоровью. А дочке мы решили сделать прививку от ВПЧ – это снизит риск возникновения рака половых органов.
Сейчас ко мне обратился знакомый с абсолютно аналогичной ситуацией – у него тоже диагностировали рак гортани. Раз в две недели я его «консультирую» в формате «иди туда, делай то». В данный момент он находится на лечении, в самой активной фазе. И мы с ним периодически созваниваемся, я его морально подготавливаю к побочным эффектам лучевой и химиотерапии. Очень важно в такой ситуации правильно себя настроить. Если человек сдастся, то болезнь быстро распространится по всему организму.
Мы воспитаны в советские времена, когда считалось, что рак – это приговор. Но современная медицина позволяет вылечить эту страшную болезнь. Я очень благодарен всем врачам НМИЦ онкологии им. Н. Н. Петрова. Здесь по полису ОМС я получил очень мощное и эффективное лечение. Главное – вовремя выявить заболевание, вовремя получить лечение и верить в лучшее.
Беседовала
ИОАННА ЧЕРНОВА
специалист по связям с общественностью НМИЦ онкологии им. Н. Н. Петрова
Санкт-Петербургский государственный университет
Высшая школа журналистики и массовых коммуникаций
Частичный регресс опухоли что это такое
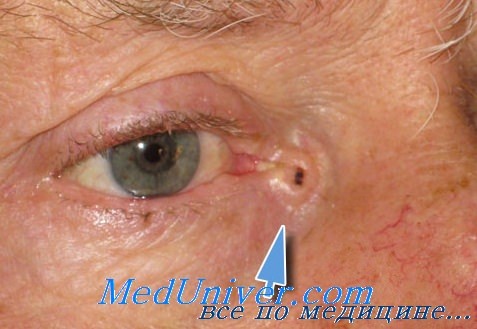
Небольшие раковые образования века и их окружения, остающиеся в покое, не только очень медленно растут и развиваются, но могут иногда совершенно самопроизвольно, без какого-либо специального лечения, потерять свою потенциальную склонность К дальнейшему развитию и, напротив, приобрести склонность к регрессии.
В таких случаях опухоль, первоначально остановившись на некоторое время в своем развитии, неожиданно начинает регрессировать и подвергается постепенному и неуклонному обратному развитию, пока полностью не рассасывается также незаметно, как она в свое время возникла и начала расти.
После этого на веке или на коже в его окружении, где локализовалась такая опухоль, не остается никаких следов бывшего здесь небольшого новообразования.
Сказанное подтверждается имеющимися в литературе сведениями о таком самопроизвольном обратном развитии небольших, но несомненно раковых опухолей. Согласно сообщению Лиша (Lisch), Закс (Sachs), и другие авторы сумели убедиться в том, что в здоровом организме возможно обратное развитие возникшей опухоли и притом не только в самых ранних стадиях ее роста.
Лишу удалось наблюдать случаи, когда рецидивы, возникшие было на веках вследствие недостаточной эксцизии опухоли, приостанавливали свой дальнейший рост и подвергались самопроизвольному обратному развитию, при этом погибали раковые клетки в неудаленных частях опухоли или во вновь возникших рецидивах.
Механизм регрессии развившегося уже было комплекса раковых клеток, успевшего даже и внешне проявить себя в виде небольшого новообразования — раковой опухоли, может быть уяснен только с позиции учения И. П. Павлова о роли и значении коры больших полушарий головного мозга в качестве регуляторного центра, обладающего способностью осуществлять посредством нервных механизмов защитные и компенсаторные функции в любом месте организма.
Процесс самоизлечения происходит либо путем некроза, изъязвления и последующего рубцевания развившейся уже опухоли кожи, либо путем инкапсулирования потерявших потенцию к дальнейшему росту раковых клеток опухолевого зачатка и последующей гибели их в таком инкапсулированном состоянии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Частичный регресс опухоли что это такое
В.Ф. Семиглазов, В.В. Семиглазов, А.Е. Клецель, Е.К. Жильцова,
В.Г. Иванов, А.А. Божок, Р.В. Донских, С.Г. Петровский, Р.М. Палтуев,
Г.А. Дашян, К.Ю. Зернов, А.В. Ефименко, И.А. Кочетова
НИИ онкологии им. проф. Н.Н. Петрова, Санкт-Петербург, Россия
Хотя неоадъювантное системное лечение РМЖ имеет уже 15-летнюю историю, оно пока не вошло в стандарт лечения этих опухолей. Достаточно сказать, что в мире имеется лишь 6 опубликованных рандомизированных испытаний неоадъювантной химиотерапии и четыре рандомизированных испытания неоадъювантной гормонотерапии (два с участием НИИ онкологии им.проф. Н.Н.Петрова). Многие врачи, опираясь на «персональный опыт» полагают, что неоадъювантная химиотерапия эффективнее и безопаснее гормонотерапии, т.к. позволяет в относительно короткие сроки (9-12 недель) добиться заметного регресса опухоли для выполнения хирургического этапа (от мастэктомии до органосохраняющей операции в зависимости от остаточного размера опухоли).
В НИИ онкологии с 1997 по 2004г. было проведено четыре рандомизированных испытаний неоадъювантной эндокринотерапии РМЖ. Первое из них выполнено в рамках Международного многоцентрового протокола 024 «Неоадъювантная гормонотерапия летрозолом против тамоксифена у женщин с РМЖ ЭР+/ПР+ в постменопаузе» (спонсор компания «Новартис» (Швейцария)).
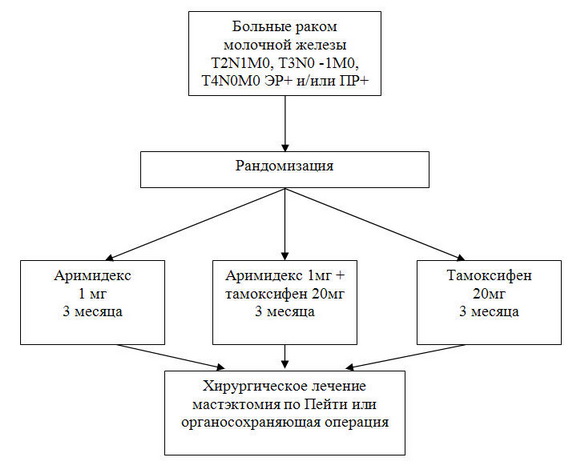
Дизайн исследования и схема рандомизации представлены на рис.1.
Рис. 1. Дизайн клинических испытаний неоадъювантной эндокринотерапии в НИИ онкологии им.проф. Н.Н.Петрова.
Основной целью исследования было сравнение величины объективных ответов опухоли на лечение (частичный или полный регресс опухоли) определяемый с помощью клинического метода (пальпация), рентгеномаммографии и ультразвукового исследования (до начала и после окончания неоадъювантной эндокринотерапии). Одной из целей исследования было также определение частоты выполнения органосохраняющих операций в различных лечебных группах.
Для оценки величины ответа опухоли на лечение в работе использованы стандартные критерии ВОЗ с двухмерным измерением наибольших диаметров.
При клинической оценке (пальпация) полный ответ опухоли наблюдался у 13,3% больных 1-й группы (получавших лечение аримидексом), 10,3% больных 3-й группы (получавших тамоксифен) и ни разу во 2-й группе (получавших комбинированное лечение аримидексом и тамоксифеном (табл.1). Частичный ответ достоверно чаще наблюдался в группе больных, получавших один аримидекс по сравнению с леченными тамоксифеном или получавшими комбинированное лечение (тамоксифен + аримидекс) (80% против 48% против 42%, Р=0,048). При оценке лечебного эффекта с помощью маммографии объективный ответ (частичный или полный регресс опухоли) наблюдался у 55,5% больных, получавших аримидекс, 40% больных, получавших комбинированное лечение (А+Т) и 36% больных, получавших тамоксифен (Р=0,058). При изучении лечебного эффекта с помощью динамического ультразвукового исследования молочных желез объективный ответ зарегистрирован у 44% больных, получавших аримидекс, 32% больных, получавших комбинированную эндокринотерапию (А+Т) и 30% больных, получавших один тамоксифен.
Органосохраняющие операции (сегментарная резекция + подмышечная диссекция) были выполнены у 42% больных 1-й группы (получавших один аримидекс), у 30% больных, получавших комбинированную эндокринотерапию (А+Т) и 30% больных, получавших один тамоксифен, р=0,056.
Любой вариант эндокринотерапии легко переносился пациентами. Наиболее частым побочным эффектом лечения оказались приливы, встретившиеся соответственно по группам в 21%, 24%, 25% случаев (р>0,5). При наблюдении за больными в течение 38 месяцев не отмечалось смертельных исходов из-за осложнений лечения.
Вторичной целью исследования было определение частоты выполнения органосохраняющих операций в различных лечебных группах.
Как видно из таблицы 3 предоперационная (неоадъювантная) терапия экземестаном (аромазином) оказалась значительно более эффективной, чем лечение тамоксифеном. При клинической оценке величина общего объективного ответа опухоли на терапию аромазином оказалась почти в два раза выше, чем на лечение тамоксифеном (90.5% против 48.4%, Р=0.049). При рентгеномаммографической оценке абсолютные показатели ниже, чем при клинической оценке, но тенденция превосходства аромазина над тамоксифеном сохраняется, особенно по частоте частичного ответа опухоли (58% против 20%).
Число больных с прогрессированием заболевания во время эндокринотерапии оказалось выше в группе «тамоксифен» (10% против 3.4%, P=0.076) [табл. 4]. Важным критерием эффективности неоадъювантного лечения оказалась частота выполнения органосохраняющих операций у больных, которым до неоадъювантной эндокринотерапии планировалась радикальная мастэктомия. После завершения предоперационного лечения органосохраняющие операции (сегментарная резекция, квадрантэктомия + подмышечная диссекция) выполнены у 31,6% больных, получавших лечение экземестаном, и у 13.3% больных, леченных тамоксифеном (Р=0.048).
Таблица 3. Клиническая оценка величины ответа опухоли на неоадъювантную эндокринотерапию экземестаном (аромазином) против тамоксифена у постменопаузальных больных РМЖ с ЭР+/ПР+ опухолями (НИИ онкологии им. проф. Н.Н.Петрова, 1997-2004)
Как в фильмах не будет: что должен знать о химиотерапии каждый пациент
Химиотерапия — страшно и невыносимо. Об этом говорит нам медиапространство, и неудивительно, что из-за такой гиперболизации многие пациенты боятся ее едва ли не больше, чем самого заболевания. Однако ни один фильм и ни один роман не рассказывает, что это такое, как работает и насколько оправдан страх лекарственного лечения. Вместе с химиотерапевтом клиники «Луч» и научным сотрудником СПбКнПЦСВМП(о) Марией Степановой мы составили инструкцию для пациентов и разобрались, что такое лекарственная терапия и от чего зависит схема лечения.
Что такое лекарственное лечение
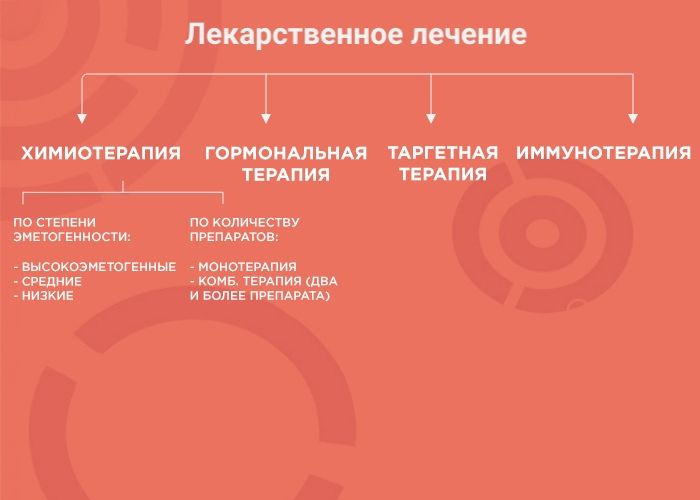
Лекарственная терапия — один из вариантов лечения онкологических заболеваний. Ее возможности и эффективность зависят от типа злокачественного образования. В лекарственной терапии выделяется четыре вида: химиотерапия, наиболее изученный вид терапии; гормонотерапия; таргетная терапия (англ. target «цель, мишень») и иммунотерапия, самый молодой и мало изученный вид лечения. Чтобы понять, почему врач выбирает тот или иной вид терапии, давайте рассмотрим каждый из них более подробно.
Химиотерапия (ХТ)
Некоторые до сих пор ошибочно считают, что лекарственная терапия сводится исключительно к химиотерапии. Действительно, долгое время лекарственное лечение злокачественных опухолей отводилось цитостатикам, противоопухолевым препаратам, принцип действия которых — разрушение быстро делящихся клеток. В том числе — злокачественных.
— Для пациента, который беспокоится о выраженности тошноты важно знать, какие препараты входят в конкретно его схему лечения. Я всегда рассказываю об этом и при необходимости назначаю препараты для снижения побочных эффектов. Чаще всего это сочетание внутривенного и таблетированного вариантов противорвотных препаратов. Однако, плохое самочувствие может нагнать пациента уже дома, и тогда я обсуждаю это и назначаю препараты, которые он может принимать без надзора врача.
— Получается, как в фильмах бывает редко?
— Крайне редко! Конечно, мутить будет, и многие сравнивают это ощущение с токсикозом во время беременности. В таких случаях я рекомендую пить чай с имбирем, использовать жевательные резинки, карамель с кислым вкусом, соленые и кислые продукты.
При химиотерапии используют множество препаратов с разным механизмом действия, ориентированным под разные особенности опухоли. Поэтому врачи используют либо монотерапию (один препарат), либо комбинированное лечение (два и более препарата). Это позволяет усилить противоопухолевый эффект и уменьшить вероятность развития устойчивости опухоли к лечению.
Выделяют также чувствительные к ХТ опухоли (например, герминогенные опухоли, хорионкарциномы, лимфомы) и опухоли, малочувствительные к ХТ (меланома, некоторые виды сарком). Чтобы найти оптимальные варианты лечения для увеличения продолжительности жизни, сейчас активно ведутся клинические исследования о возможности комбинировать этот вид терапии с иммунотерапией.
Гормональная терапия (ГТ)
При гормональной терапии применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. Самый частый вариант опухоли, где применяется данный вариант лечения, — рак молочной железы (РМЖ). При выполнении иммуногистохимического (ИГХ) исследования и наличии положительных рецепторов эстрогена и/или прогестерона, оптимальной опцией лечения является гормонотерапия. С ее помощью, можно остановить опухолевый рост и даже добиться полного или частичного исчезновения опухоли.
— Особенность применения этих препаратов, в том что они в подавляющем случае в таблетированной форме и имеют приемлемую токсичность по сравнению с ХТ. Это позволяет пациентам совмещать лечение с работой, хобби и путешествиями.
Таргетная терапия (ТТ)
В отличие от ХТ таргетные (целенаправленные) препараты атакуют только опухолевые клетки. Опухоль для ТТ — своего рода мишень, уничтожение которой означает прекращение репликации (воспроизведения) клеток и метастазирования.
Все началось с того, что врачи отметили недостаточный эффект от цитостатиков и начали внедрять иммуногистохимические параметры. Иммуногистохимическое исследование (ИГХ) выявляет в образце ткани белки, специфичные для того или иного вида клеток. Это позволяет отличать один вид опухоли от другого и выявлять маркеры, которые отвечают за лекарственную чувствительность опухолевой ткани.
— Таргетная терапия начинается с немелкоклеточного рака легкого: в порыве клинических исследований врачи разработали препарат, который начали применять в рамках клинических исследований. Широкое использование Ирессы в клинической практике сопровождалось преимущественно разочарованиями, связанными с редкостью проявления лечебного эффекта. Загадка разрешилась достаточно быстро: анализ нуклеотидной последовательности гена EGFR, проведенный тремя независимыми исследовательскими коллективами, установил, что опухоли легких, характеризующиеся чувствительностью к Ирессе или Тарцеве, содержат мутированную форму этого рецептора. Таким образом, с 2009 года Ирессу внедрили в клиническую практику для пациентов имеющих мутацию в гене EGFR. Особенность механизма действия ТТ, заключается в блокировании мутации, в результате чего опухоль не может делиться, — поясняет Мария.
Побочные эффекты при таргетной терапии менее выражены, и пациенту чаще всего не нужно находиться в стационаре. Некоторые таргетные препараты используются в таблетированной форме, во время их приема качество жизни пациента значительно не страдает, и пациенты могут вести привычный образ жизни.
Иммунотерапия (ИТ)
Иммунотерапия — самая молодая отрасль лекарственного лечения. Существует несколько групп иммунопрепаратов с разными механизмами действия. Одни воздействуют на звено образования кровеносных сосудов в опухоли и блокируют их развитие (после чего опухоль перестает получать питание и погибает), а другие активируют и направляют иммунные силы организма на борьбу с опухолью. занимает много времени, имеет свой спектр побочных эффектов, а также требует внимания врачей и тщательной оценки динамики состояния пациента.
— По идее мы с помощью введения препаратов обучаем иммунную систему распознавать клетки опухоли и разрушать их. Это все равно что установить антивирус, — объясняет Мария.
Цели и оценка эффективности лекарственного лечения
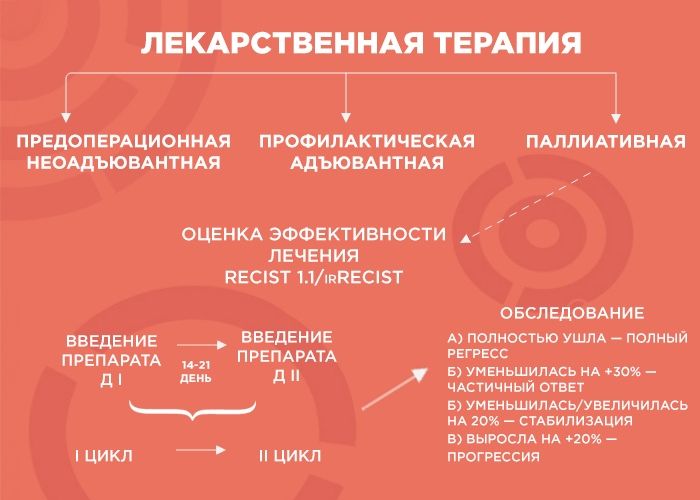
Лекарственная терапия бывает трех видов: предоперационная (неоадъювантная), профилактическая (адъювантная) и паллиативная (поддерживающая).
— Как проходит лечение в каждом из случаев?
— Начнем с предоперационной лекарственной терапии. Например, в отделение поступает пациент с диагнозом рак желудка. Результаты КТ показывают, что отдаленных метастатических очагов нет, однако в связи с распространением первичной опухоли операция на первом этапе невозможна. В этом случае лечение выглядит так: четыре курса терапии, затем — операция, а после нее — еще четыре курса адъювантной терапии. Зачем еще? Формально опухоль убрали, но есть риск возврата образования, и адъювантная терапия помогает его отсрочить.
Паллиативную терапию врач выбирает, когда хирургические методы бессильны (например, при отдаленных метастазах в легкие, печень, лимфоузлы и т.д.). Тогда лечение, в первую очередь, направлено на поддержание качества жизни пациента и контроль заболевания, и продолжительность лечения зависит от его эффекта. В химиотерапии врачи пользуются REСIST 1.1 — системой критериев оценки ответа опухоли на терапию, а в иммунотерапии — irRECIST.
— Объясню, как это работает, на примере пациента с опухолью толстой кишки и с множественными метастазами в печени и легких. Чтобы оценить серьезность ситуации, мы проводим обследование, выявляем наиболее измеряемые очаги и проводим два-три цикла химиотерапии. Большая часть курсов ХТ — введение препарата. Между первым введением и вторым — 14-21 дней — и этот временной промежуток называется циклом.
Далее мы смотрим и сравниваем. Если опухоль уменьшилась более чем на 30% — это частичный ответ, и нужно продолжать терапию до шести курсов. Если она ушла — это полный регресс, и тоже добавляем четыре курса, чтобы закрепить результат. Если опухоль увеличилась или уменьшилась на 20% — это стабилизация, мы делаем еще два курса и снова смотрим: если ситуация не изменилась, пациент отправляется на химиотерапевтические каникулы до прогрессирования заболевания, а потом схема повторяется.
Но если опухоль на фоне лечения выросла больше чем на 20% — мы имеем дело с прогрессией, вероятнее всего, это говорит нам об агрессивности опухоли. В этом случае я объясняю пациенту, что с ним происходит и почему мы меняем лечение.
— Как уговорить пациента на лечение?
— К каждому нужен индивидуальный подход. Я всегда говорю: «Химия может ухудшить ваше состояние, но бояться этого не стоит — мы попытаемся подобрать оптимальную симптоматическую терапию, которое уменьшит нежелательные явления». Если после этого во время лечения появятся данные о плохой переносимости, мы подумаем об уменьшении дозы цитостатика. Бывают случаи, когда я буквально уговариваю пациента пойти на терапию и объясняю ему, за что мы боремся. И объясняю это вне зависимости от серьезности случая — если при агрессивной опухоли человек настроен бороться до последнего, моя обязанность ему эту возможность дать.
Десятилетняя полная регрессия при диссеминированном мелкоклеточном раке легкого с поражением центральной нервной системы после комбинированного лечения
Показана высокая эффективность комбинации иринотекана и цисплатина у пациента с диссеминированным мелкоклеточным раком легкого с поражением центральной нервной системы.
Показана высокая эффективность комбинации иринотекана и цисплатина у пациента с диссеминированным мелкоклеточным раком легкого с поражением центральной нервной системы.
Мелкоклеточный рак легкого (МРЛ) относится к наиболее агрессивным формам рака легкого, в структуре которых на его долю приходится 15–20% [1–4]. Для МРЛ характерны быстрое развитие, раннее и обширное метастазирование. В подавляющем большинстве случаев МРЛ развивается у курящих пациентов, чаще у мужчин. Максимальные показатели заболеваемости отмечаются в возрастной группе 40–60 лет [1–3].
Обычно опухоль начинает развиваться как центральный рак легкого, однако очень скоро метастазирует в бронхопульмональные и медиастинальные лимфоузлы, а также отдаленные органы (кости скелета, печень, головной мозг). Без специального противоопухолевого лечения медиана выживаемости не превышает трех месяцев.
Медиана продолжительности жизни на фоне химиотерапии диссеминированного процесса составляет девять месяцев. Пятилетняя выживаемость достигает 5–10% [1–3, 5].
Химиотерапию используют как в качестве самостоятельного метода, так и в сочетании с лучевой терапией. Цель лечения – добиться полной ремиссии, которая должна быть подтверждена бронхоскопическими методами. Эффективность лечения оценивают через 6–12 недель после его начала. По этим результатам можно прогнозировать вероятность излечения и продолжительность жизни больного. Самый благоприятный прогноз у тех, кому за указанный период времени удалось достичь полной ремиссии. В эту группу входят больные, продолжительность жизни которых превышает три года.
У пациентов с распространенным МРЛ, у которых основным методом лечения является комбинированная химиотерапия, а облучение проводится только по специальным показаниям, общая эффективность химиотерапии составляет 70%, но полная регрессия достигается лишь в 20% случаев [6, 7].
Больной А.Д. Кузмин, 46 лет (ID: 06/10705).
Диагноз. Центральный мелкоклеточный рак правого легкого, метастазы в лимфатические узлы корня, средостения, шейно-надключичные с обеих сторон, головной мозг. Двусторонний плеврит. Ателектаз верхней доли правого легкого. T4N2M1, стадия IV. Состояние после полихимиотерапии (ПХТ), профилактической лучевой терапии. Полная регрессия всех опухолевых проявлений. Ремиссия заболевания в течение десяти лет.
Гистология. 11624 от 12 мая 2006 г.: мелкоклеточный рак.
Сопутствующие заболевания: хронический простатит. Ремиссия.
Анамнез. С февраля 2006 г. увеличение надключичных лимфатических узлов справа. В апреле 2006 г. госпитализирован в ГКБ № 7 по поводу обострения хронического простатита. При обследовании выявлена опухоль правого легкого. Обратился в РОНЦ им. Н.Н. Блохина. Гистология: 11624 от 12 мая 2006 г.: мелкоклеточный рак (бронхоскопия).
Компьютерная томография (КТ) органов грудной клетки, брюшной полости, головного мозга с внутривенным контрастированием от 19 мая 2006 г. В правой плевральной полости значительное количество жидкости. Верхняя доля правого легкого в ателектазе, верхний долевой бронх не дифференцируется. Верхнее средостение и правая корневая зона заняты массивным опухолевым конгломератом 9,5 × 6,0 см, который распространяется паратрахеально справа, сдавливая и оттесняя трахею влево, достигает верхушки правого легкого. Конгломерат распространяется на оба овальных окна. Отдельные узлы определяются по дуге аорты и в области бифуркации, в переднем средостении слева 2,0 × 2,5 × 3,0 см. Просветы главного и среднего долевого бронхов деформированы. Небольшой выпот в левой плевральной полости. Брюшная полость, печень, почки, надпочечники – без особенностей. Забрюшинные лимфоузлы не увеличены.
Головной мозг – в височных областях с обеих сторон очаги 0,5 и 0,6 см, без отека, не исключены более мелкие очаги в теменных областях.
Ультразвуковое исследование (УЗИ) регионарных лимфатических узлов от 31 мая 2006 г. В шейно-надключичной области справа лимфатические узлы от 0,5 до 2,6 см, 3,6 × 3,9 см, в шейно-надключичной слева – от 1,2 до 1,8 см. В других областях – без особенностей. Диагноз: центральный мелкоклеточный рак правого легкого, метастазы в лимфатические узлы корня, средостения, шейно-надключичные с обеих сторон, головной мозг. Двусторонний плеврит. Ателектаз верхней доли правого легкого.
Лечение. С 25 мая по 25 октября 2006 г. проведено шесть курсов химиотерапии по схеме: иринотекан 65 мг/м 2 (120 мг) в первый и восьмой дни + цисплатин 80 мг/м 2 (150 мг) в первый день каждые три недели.
Первый курс осложнился диареей 4-й степени, в связи с чем доза иринотекана была снижена на 30%.
После второго и четвертого курса отмечалась частичная регрессия, после шестого курса – полная регрессия.
При контрольном обследовании через три месяца сохранялась полная регрессия опухолевого процесса.
КТ органов грудной клетки, брюшной полости, головного мозга с внутривенным контрастированием от 29 ноября 2006 г. На месте опухоли справа от трахеи сохранялось уплотнение клетчатки. Признаков наличия увеличенных лимфоузлов не выявлено. В легких – без очаговых и инфильтративных изменений. Проходимость бронхов не нарушена. Структура вещества мозга не изменена. Желудочки обычных размеров и формы. Смещения срединных структур не зафиксировано. Органической патологии в веществе и желудочках мозга не выявлено.
С 26 февраля по 19 марта 2007 г. проведен консолидирующий курс лучевой терапии на шейно-над-подключичную область с двух сторон с разовой очаговой дозой (РОД) 3 Гр, суммарной очаговой дозой (СОД) 30 Гр, на область правого легкого, средостения – РОД 2,5 Гр, СОД 32 Гр, на весь объем головного мозга – РОД 2,5 Гр, СОД 36 Гр.
УЗИ от 29 ноября 2006 г. Брюшная полость, печень, почки, надпочечники, селезенка – без особенностей. Забрюшинные лимфатические узлы не увеличены. В периферических зонах увеличенные лимфатические узлы не визуализировались.
Бронхоскопия от 30 июля 2007 г. Обе половины гортани подвижны, просвет трахеи широкий, кольца хорошо дифференцированы. Карина прямая, ее основание не расширено. При осмотре обеих половин бронхиального дерева опухолевой патологии не выявлено. Просвет доступных осмотру бронхов не изменен. Слизистая оболочка гладкая, блестящая, розового цвета.
УЗИ от 14 апреля 2016 г. Брюшная полость, печень, почки, надпочечники, селезенка – без особенностей. Забрюшинные лимфатические узлы не увеличены. В периферических зонах увеличенные лимфатические узлы не визуализировались.
Результаты КТ и УЗИ до и после лечения представлены на рис. 1–4.
Несмотря на редукцию доз цитостатиков при проведении двух – шести курсов химиотерапии в связи с возникшей диареей 4-й степени после первого курса, комбинация иринотекана и цисплатина показала высокую эффективность при диссеминированном мелкоклеточном раке легкого с поражением центральной нервной системы. Консолидирующая лучевая терапия на первичную опухоль, зоны локального метастазирования, головной мозг позволила длительно закрепить достигнутый эффект от лечения.