Цог 1 и цог 2 что это такое простыми
Существуют ли различия между нестероидными противовоспалительными препаратами? В центре внимания нимесулид
Опубликовано в
CONSILIUM MEDICUM | 2013 | ТОМ 15 | № 2 |
Franco Dallegri, Luciano Ottonello
Введение
Эффективность нестероидных противовоспалительных препаратов (НПВП) не подвергается сомнению и является общепризнанной. НПВП обладают противовоспалительной, обезболивающей и жаропонижающей активностью. Входящие в состав НПВП вещества относятся к разным химическим классам, поэтому обладают разными фармакокинетическими и фарма-кодинамическими свойствами. Именно поэтому для облегчения боли и воспаления у пациентов с ревматологическими заболеваниями необходимо учитывать клиническую значимость различий между отдельными представителями класса НПВП.
Фармакологические свойства НПВП
Ингибирование синтеза простагландинов
ЦОГ-1 отвечает в основном за синтез простагланди-нов, участвующих в процессах гомеостаза в жизненно важных органах. Именно с ингибированием ЦОГ-1 связывают хорошо известные желудочно-кишечные побочные эффекты традиционных неселективных НПВП.
Ингибирование ЦОГ-2 обеспечивает противовоспалительный эффект НПВП, так как она участвует в синтезе воспалительных простагландинов.
Неселективные НПВП ингибируют обратимо или необратимо как ЦОГ-1, так и ЦОГ-2. Большинство токсических эффектов этих препаратов связано с их способностью блокировать синтез физиологических проста-гландинов, необходимых для обеспечения гомеостаза в почках, желудке и тромбоцитах за счет ингибирования ЦОГ-1.
Появление на рынке в конце 1990-х годов селективных ингибиторов ЦОГ-2 (коксибов) давало клиницистам надежду на то, что эта группа НПВП обеспечит высокую фармакологическую эффективность при более низком уровне желудочно-кишечных осложнений. Однако ожидания были оправданы не в полной мере, в частности, получены доказательства того, что применение коксибов сопровождается увеличением частоты тромбоэмболических осложнений, что привело к выводу с рынка во всем мире таких препаратов, как рофе-коксиб и валдекоксиб. Кроме того, применение валде-коксиба связывают с частым развитием нежелательных кожных реакций. Кардиотоксичность коксибов объясняют блокированием синтеза простациклинов, опосредованного ЦОГ-2, что нивелирует их защитные эффекты в отношении тромбогенеза, гипертензии и ате-рогенеза in vivo.
НПВП классифицируют по степени селективности в отношении изоформ ЦОГ (рис. 1). Селективность в отношении ЦОГ определяется химической структурой НПВП. Аминокислотная структура ЦОГ-1 и ЦОГ-2 является достаточно стабильной, однако рентгеновские кристаллографические исследования ЦОГ показали, что активная область связывания с НПВП у ЦОГ-2 позволяет связываться с большим количеством субстратов, чем центр связывания у ЦОГ-1. Этот активный канал является гидрофобным, у ЦОГ-2 возможно открытие бокового гидрофильного кармана, который у ЦОГ-1 закрыт изолейцином.
Так, флурбипрофен, который относят к неселективным НПВП, взаимодействует с ЦОГ-1 посредством связывания фенильной группы с гидрофобным каналом и карбоксильной группы с аргинином в положении 120. Взаимодействие флурбипрофена с ЦОГ-2 сходно с описанным, однако, связываясь с аргинином в положении 120, карбоксильная группа блокирует активный центр ЦОГ-2, не позволяя ему взаимодействовать с субстратом. Напротив, селективные ингибиторы ЦОГ-2 не могут войти в активный канал ЦОГ-1 и не имеют карбоксильной группы для связывания с аргинином в положении 120.
Фармакокинетический профиль
На основании периода полувыведения НПВП могут быть разделены на две большие группы: с коротким периодом полувыведения (менее 6 ч) и с длительным периодом полувыведения (более 10 ч). Группа НПВП с коротким периодом полувыведения включает АСК, диклофенак, ибупрофен, флурбипрофен, индометацин, лумиракоксиб и нимесулид. Группа препаратов с длительным периодом полувыведения включает целекоксиб, напроксен, сулиндак, рофекоксиб, оксапрозин, пирок-сикам. Достижение равновесной концентрации препарата в плазме крови происходит после его применения в течение периода, превосходящего период полувыведения в 3-5 раз, поэтому достижение пиковой концентрации в плазме крови и максимального клинического эффекта НПВП с коротким периодом полувыведения происходит быстрее, чем препаратов с длительным периодом полувыведения.
Нимесулид: фармакологический профиль
Нимесулид оказывает быстрое обезболивающее действие, что подтверждают следующие исследования. Применение нимесулида у пациентов с острым артритом характеризуется быстрым началом действия и ранним ингибированием образования простагландина E2 (маркера активности ЦОГ-2). В клинических исследованиях у пациентов с остеоартритом коленных суставов были получены доказательства быстрого начала действия нимесулида. У данной категории больных нимесу-лид вызывал достоверно более значимое облегчение боли, связанной с ходьбой, и эффект наступал быстрее, чем при применении целекоксиба и рофекоксиба. Начало обезболивающего действия нимесулида фиксировалось уже через 15 мин после приема. Согласно недавним исследованиям, эффективные концентрации ни-месулида в плазме крови и синовиальной жидкости обнаруживаются уже через 30 мин после его приема.
НПВП могут обладать противовоспалительными свойствами, которые не зависят от ЦОГ. Было показано, что нимесулид, помимо периферического ингибирую-щего воздействия на ЦОГ, может ингибировать высвобождение фактора некроза опухолей a (ФНО-a), гиста-мина, образования активных форм кислорода (АФК), высвобождения матриксных металлопротеаз (ММП) и гибели хондроцитов (рис. 2).
Влияние нимесулида на медиаторы воспаления
ФНО-a играет ведущую роль в воспалительном процессе, что делает его идеальной целью при терапии ревматоидного артрита. В исследованиях на крысах, которым вводили липополисахариды для увеличения уровня ФНО-a, нимесулид эффективно ингибировал его высвобождение.
Выработка фагоцитами супероксида и высвобождение лактоферрина из нейтрофилов были исследованы у 8 добровольцев до и после приема нимесулида внутрь. В качестве активирующих стимулов были использованы фактор хемотаксиса N-формил-метионил-лейцил-фенилаланин (ФМЛФ) и частицы опсонизированного зимозана (ЧОЗ). Нимесулид значимо ингибировал образование АФК ФМЛФ и активированными за счет воздействия ЧОЗ фагоцитами (ингибирование до 67,6 и 36,8% соответственно; рис. 3). Он не оказывал влияния на высвобождение лактоферрина нейтрофилами, что позволило авторам предположить, что нимесулид не оказывает влияния на механизмы, происходящие при экзоцитозе специфичных гранул.
В ходе воспалительной реакции для предупреждения повреждения тканей требуется поддержание баланса между протеиназами (преимущественно эластазами, выделяемыми мигрировавшими в очаг нейтрофилами) и антипротеазами (в основном эластаза-специфиче-ским a-1-ингибитором протеиназ; A1PI). Нейтрофиль-ные клетки способны инактивировать A1PI с помощью серии окислительных реакций с участием хлорноватистой кислоты, что позволяет эластазе свободно разрушать соединительную ткань. Возможным способом регулирования активности нейтрофильной эластазы является фармакологическая защита A1PI от окислительной инактивации под действием хлорноватистой кислоты нейтрофилов. В доклинических исследованиях было показано, что нимесулид предотвращал инактивацию A1PI под действием выделяемой нейтрофилами хлорноватистой кислоты, что позволяет осуществлять опосредованный А1Р1-контроль гистотоксической функции эластазы. Полученные данные позволяют предполагать, что защитное влияние нимесулида на A1PI может иметь значение в реализации его противовоспалительного действия.
В другом исследовании морским свинкам предварительно вводили нимесулид или индометацин, после чего ацетальдегидом провоцировали выброс гистамина и бронхоспазм (рис. 4). В контрольной группе, получавшей только ацетальдегид, концентрация гистамина в крови была равна 195±12 мг/л, в группе, получавшей нимесулид, при использовании дозы 0,1 мг/кг она была равна 154±10 мг/л (p
Современное учение о селективных ингибиторах ЦОГ-2: новые аспекты применения мелоксикама (Мовалиса)
Опубликовано в журнале:
«НАУЧНО-ПРАКТИЧЕСКАЯ РЕВМАТОЛОГИЯ» »» 2003, № 4 (68)
ЕЛ. Насонов
Кафедра ревматологии ММА им. И.М. Сеченова.
Резюме
Изложено современное учение о селективных ингибиторах ЦОГ-2.
Описаны фармакодинамические свойства мелоксикама, его ЦОГ-2-селектиеность. Обоснована безопасность применения мовалиса и отсутствие негативного влияния на хрящ. Ключевые слова: селективные ингибиторы ЦОГ-2, мовалис.
Summary
Modern views on the selectivity of inhibitors COX-2 and pharmaco-dynamic features of Meloxicam, its COX-2 selectivity are described. The safety ofMovalis application and its effect on the cartilage are validated.
Key words: selective inhibitors, COX-2. Movalis.
Особенно доказательные результаты были получены в процессе исследования мелоксикама (Мовалис, Boehringer Ingelheim). Этот препарат имеет такие же фармакодинамические свойства, как и классические представители класса НПВП, но обладает более высокой селективностью к ЦОГ-2 in vitro и in vivo [1,3]. Данные, касающиеся эффективности и безопасности мелоксикама, подробно представлены в предыдущих публикациях [1, 3, 9]. Поэтому в данной статье будут обобщены только результаты недавних исследований, касающихся изучения мелоксикама в свете современного учения о ЦОГ-зависимых эффектах НПВП.
ЦОГ-селективностъ
В середине 90-х годов для изучения ЦОГ-селективности НПВП были разработаны разнообразные методы, основанные на использовании очищенных или рекомбинантных ферментов, культивируемых клеток, экспрессирующих тот или иной изофермент ЦОГ в базальных условиях (ЦОГ-1) и при стимуляции ЛПС или ИЛ-1 (ЦОГ-2), и наконец, различные модификации методов с использованием не фракционированных клеток (т.н. метод цельной крови). Последний рассматривается как один из наиболее адекватных методов для оценки ЦОГ-селективности НПВП [12]. Однако, очень скоро стало очевидным, что в зависимости от экспериментальных условий (время инкубации, индукторы, способы определения ПГ и др.), селективность НПВП в отношении изоформ ЦОГ существенно отличается (таблица 1). Это затрудняет корректную оценку селективности различных НПВП к ЦОГ-1 и ЦОГ-2. Тем не менее, высокая ЦОГ-2 селективность мелоксикама по сравнению со «стандартными» НПВП продемонстрирована с использованием практически всех существующих методов, в том числе, недавно разработанных, основанных на,использовании цельной крови in vitro и in vivo [3, 10, И, 12, 18, 19]. Важно, что по данным метода с использованием цельной крови мелоксикам столь же селективен в отношении ЦОГ-2, как и препарат целебрекс, относящийся к группе специфических ингибиторов ЦОГ-2 [19].
Таблица 1
Колебания ингибиция ЦОГ-2/ЦОГ-1 НПВП и мелоксикама (Мовалис> по данным различных методов [3].
Нестероидные противовоспалительные препараты: список и цены
Нестероидные противовоспалительные препараты используются достаточно широко для подавления воспалительных процессов в организме. НПВП доступны в различных формах выпуска: таблетки, капсулы, мази. Они обладают тремя основными свойствами: жаропонижающими, противовоспалительными и болеутоляющими.
Лучший нестероидный противовоспалительный препарат может подобрать только врач, отталкиваясь от индивидуальных особенностей пациента. Самолечение в данном случае может быть чревато развитие серьезных побочных реакций или же передозировки. Предлагаем ознакомиться со списком препаратов. Рейтинг разработан на основании соотношения цена-качество, отзывов пациентов и мнения специалистов.
Как работают НПВП?
Нестероиды ингибируют агрегацию тромбоцитов. Терапевтические свойства объясняются блокадой фермента циклооксигеназы (ЦОГ-2), а также снижением синтеза простагландина. По мнению специалистов они оказывают влияние на симптомы заболевания, но не устраняют причину его возникновения. Поэтому не следует забывать о средствах, с помощью которых должны быть устранены первичные механизмы развития патологии.
Если у пациента обнаружена непереносимость НПВП, тогда они заменяются лекарствами других категорий. Часто в таких случаях применяют комбинацию противовоспалительного и болеутоляющего средства.
Как показывает практика, нецелесообразно заменять одно лекарство другим той же группы, если при приеме обнаруживается недостаточный терапевтический эффект. Удвоение дозы может привести только к клинически незначительному увеличению воздействия.
Классификация НПВП
Нестероидные противовоспалительные средства классифицируются в зависимости от того, являются ли они селективными для ЦОГ-2 или нет. Таким образом, с одной стороны, есть неселективные НПВП, а с другой – селективные ЦОГ-2.
Журнал «Медицина неотложных состояний» 5 (76) 2016
Вернуться к номеру
Циклооксигеназа: физиологические эффекты, действие ингибиторов и перспективы дальнейшего использования парацетамола (аналитический обзор)
Версия для печати
В аналітичному огляді надані сучасні погляди на особливості функціонування ферменту циклооксигенази (ЦОГ), функції простаноїдів та механізми дії нестероїдних протизапальних заходів, мішенню яких і є ЦОГ. Докладно розглянуто особливості фармакологічних ефектів парацетамолу — препарату, широке застосування якого з метою усунення больового синдрому та лихоманки триває. Висвітлено основні переваги та недоліки парацетамолу. Розглянуто питання гепатотоксичності та потрібних заходів для її профілактики, а також сучасна схема лікування пацієнтів із гострими токсичними гепатитами, що викликані передозуванням парацетамолу.
В литературном обзоре представлены современные взгляды на особенности функционирования фермента циклооксигеназы (ЦОГ), функции простаноидов и механизмы действия нестероидных противовоспалительных средств, мишенью которых является ЦОГ. Подробно рассмотрены особенности фармакологических эффектов парацетамола — препарата, который продолжает широко использоваться в современной медицине для купирования болевого синдрома и устранения лихорадки. Показаны основные преимущества и недостатки парацетамола. Рассмотрен вопрос гепатотоксичности и необходимых мероприятий для ее профилактики, а также современная схема лечения пациентов с острыми токсическими гепатитами, вызванными передозировкой парацетамола.
The analytical review presents current approaches to the peculiarities of functioning of the enzyme ofcyclooxygenase (COX), prostanoids functioning as well as the mechanisms of the action of non-steroidal anti-inflammatory drugs targeting at COX. The paper also drills down the features of pharmaceutical effects of paracetamol, the drug which is still widely used in modern medicine to arrest a pain syndrome and to overcome fever. The main benefits and drawbacks of paracetamol usage have been indicated. The review deals with the issue of hepatotoxicity, its necessary preventive measures and up-to-date scheme of treatment of patients with acute toxic hepatitis caused by paracetamol overdose.
циклооксигеназа, простагландини, тромбоксани, запалення, нестероїдні протизапальні засоби, парацетамол.
циклооксигеназа, простагландины, тромбоксаны, воспаление, нестероидные противовоспалительные средства, парацетамол.
cyclooxygenase, prostaglandins, thromboxanes, inflammation, non-steroidal anti-inflammatory drugs, paracetamol.
Статья опубликована на с. 27-35
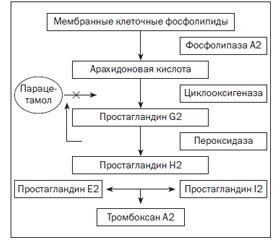
Циклооксигеназа: изоформы фермента и физиологическая роль
Изоформы ЦОГ как мишень действия НПВС. Побочные эффекты при приеме НПВС
ЦОГ-3 и эффекты парацетамола. Какие НПВС достигнут головного мозга?
Преимущества и недостатки парацетамола
1. Norregaard R. Physiology and pathophysiology of cyclooxygenase‑2 and prostaglandin E2 in the kidney / R. Norregaard, T.H. Kwon, J. Frokiaer // Kidney Research and Clinical Practice. — 2015. — Vol. 34. — P. 194-200.
2. Rouzer C.A. Cyclooxygenases: structural and functional insights / C.A. Rouzer, L.J. Marnett // Journal of Lipid Research. — 2008. — Vol. 50. — S. 29-34.
3. Simmons D.L. Cyclooxygenase Isozymes: The Biology of Prostaglandin Synthesis and Inhibition / D.L. Simmons, R.M. Botting, T. Hla // Pharmacological Reviews. — 2004. — Vol. 56, № 3. — P. 387-487.
4. Zreik T.G. The Prostaglandins: Basic Chemistry and Action / T.G. Zreik, H.R. Behrman / Glowm; A Free Resource for Medical Professionals [електронний ресурс] Update due 2016 / Режим доступу: http://www.glowm.com/section_view/heading/The%20Prostaglandins:%20Basic%20Chemistry%20and%20Action/item/312
5. King M.W. Introduction to the Eicosanoids / M.W. King / The Medical Biochemistry Page [електронний ресурс] Last modified: May 6, 2016 / Режим доступу: http://themedicalbiochemistrypage.org/eicosanoids.php
6. Serhan C.N. Pro-resolving lipid mediators are leads for resolution physiology / C.N. Serhan // Nature. — 2014. — Vol. 510, Issue 7503. — P. 92-101.
7. Claria J. Cyclooxygenase‑2 biology / J. Claria // Current Pharmaceutical Design. — 2003. — Vol. 9, № 27. — P. 2177-2190.
8. Roles of Cyclooxygenase (COX)-1 and COX‑2 in Prostanoid Production by Human Endothelial Cells: Selective Up-Regulation of Prostacyclin Synthesis by COX‑2 / G.E. Caughey, L.G. Cleland, P.S. Penglis [et al.] // Journal of Immunology. — 2001. — Vol. 167. — P. 2831-2838.
9. Cyclooxygenase and NSAIDs / University at Albany; State University of New York [електронний ресурс] / Режим доступу: http://www.albany.edu/faculty/cs812/bio366/Cyclooxygenase_ppt.pdf
10. Griffin R.M. Are Anti-Inflammatory Pain Relievers Safe for You? Here’s help weighing the benefits and risks of NSAIDs, from aspirin to Celebrex / R.M. Griffin / WebMD [електронний ресурс] Medically updated August 2006 / Режим доступу: http://www.webmd.com/osteoarthritis/features/are-nsaids-safe-for-you
11. Medication Guide for Non-Steroidal Anti-Inflammatory Drugs (NSAIDs) (See the end of this Medication Guide for a list of prescription NSAID/ Food & Drug AdministrationUSA [електронний ресурс] August 2007 / Режим доступу: http://www.fda.gov/downloads/Drugs/DrugSafety/ucm089162.pdf
12. Managing the Adverse Effects of Nonsteroidal Anti-inflammatory Drugs / P. Patrignani, S. Tacconelli, A. Bruno [et al.] // Expert Rev. Clin. Pharmacol. — 2011. — Vol. 4, № 5. — P. 605-621.
13. Ricciotti E. Prostaglandins and inflammation / E. Ricciotti, G.A. Fitzgerald // Arteriosclerosis, Thrombosis & Vascular Biology. — 2011. — Vol. 31, № 5. — P. 986-1000.
14. Anti-inflammatory effects of PGE2 in the lung: role of the EP4 receptor subtype / M.A. Birrell, S.A. Maher, B. Dekkak [et al.] // Thorax. — 2015. — Vol. 70, № 8. — P. 740-747.
15. Scher J.U. The anti-inflammatory effects of prostaglandins / J.U. Scher, M.H. Pillinger // Journal of Investigative Medicine. — 2009. — Vol. 57, № 6. — P. 703-708.
16. Non-Steroidal Anti-Inflammatory Drugs Comparison / eMed Expert [електронний ресурс] Last updated: April 01, 2016 / Режим доступу: http://www.emedexpert.com/compare/nsaids.shtml
17. Страчунский Л.С. Нестероидные противовоспалительные средства / Л.С. Страчунский, С.Н. Козлов / Смоленская государственная медицинская академия [електронний ресурс] / Режим доступу: http://www.antibiotic.ru/rus/all/metod/npvs/npvs.shtml
18. Cryer B. Cyclooxygenase‑1 and cyclooxygenase‑2 selectivity of widely used nonsteroidal anti-inflammatory drugs / B. Cryer, M. Feldman // American Journal of Medicine. — 1998. — Vol. 104, № 5. — P. 413-421.
19. Насонов Е.Л. Современное учение о селективных ингибиторах ЦОГ‑2: новые аспекты применения мелоксикама (Мовалиса) / Е.Л. Насонов // Научно-практическая ревматология. — 2003. — № 4 (68). — С. 87-91.
20. Solomon D.H. COX‑2 selective inhibitors: Adverse cardiovascular effects / D.H. Solomon / UpToDate [електронний ресурс] Literature review current through: May 2016 / Режим доступу: http://www.uptodate.com/contents/cox‑2-selective-inhibitors-adverse-cardiovascular-effects
21. Cardiovascularsafetyof non-steroidal anti-inflammatorydrugs: network meta-analysis / S. Trelle, S. Reichenbach, S. Wandel [et al.] // British Medical Journal. — 2011. — Vol. 342. — P. 7086.
22. Role of prostacyclin in the cardiovascular response to thromboxane A2 / Y. Cheng, S.C. Austin, B. Rocca [et al.] // Science. — 2002. — Vol. 296. — P. 539.
23. Cyclooxygenase selectivity of nonsteroidal anti-inflammatory drugs and risk of stroke / M.D. Haag, M.J. Bos, A. Hofman [et al.] // Arch. Intern. Med. — 2008. — Vol. 168, № 11. — P. 1219-1224.
24. Nonaspirin NSAIDs, cyclooxygenase 2 inhibitors, and the risk for stroke / C.L. Roumie, E.F. Mitchel, L. Kaltenbach [et al] // Stroke. — 2008. — Vol. 39, № 7. — P. 2037-2045.
25. Non-aspirin NSAIDs, cyclooxygenase‑2 inhibitors and risk for cardiovascular events-stroke, acute myocardial infarction, and death from coronary heart disease / C.L. Roumie, N.N. Choma, L. Kaltenbach [et al.] // Pharmacoepidemiology & Drug Safety. — 2009. — Vol. 18, № 11. — P. 1053-1063.
26. Dajani E.Z. Cardiovascular and gastrointestinal toxicity of selective cyclo-oxygenase‑2 inhibitors in man / E.Z. Dayani, K. Islam // Journal of Physiology & Pharmacology. — 2008. — Vol. 59, Suppl. 2. — P. 117-133.
27. Risk of death or reinfarction associated with the use of selective cyclooxygenase‑2 inhibitors and nonselective nonsteroidalantiinflammatory drugs after acute myocardial infarction / G.H. Gislason, S. Jacobsen, J.N. Rasmussen [et al.] // Circulation. — 2006. — Vol. 113, № 25. — P. 2906-2913.
28. Daily aspirin therapy: Understand the benefits and risks / Diseases and Conditions. Heart disease / Mayo Clinic [електронний ресурс] Nov. 03, 2015 / Режим доступу: http://www.mayoclinic.org/diseases-conditions/heart-disease/in-depth/daily-aspirin-therapy/art‑20046797
29. Kama P.C.A. COX‑3: uncertainties and controversies / P.C.A. Kama, A. Sob // South African Journal of Regional Anaesthesia, Pain. — 2011. — № 1 / SAJRAP [електронний ресурс] / Режим доступу: http://www.edoc.co.za/modules.php?name = News&file = article&sid = 3349
30. COX‑3, a cyclooxygenase‑1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression / N. Chandrasekharan, H. Dai, K. Roos [et al.] // Proc. Nat. Acad. Sci. USA. — 2002. — Vol. 99, № 21. — P. 13926-13931.
31. Flower R.J. Inhibition of Prostaglandin Synthetase in Brain explains the Anti-pyretic Activity of Paracetamol (4-Acetamidophenol) / R.J. Flower, J.R. Vane // Nature. — 1972. — Vol. 240. — P. 410-411.
32. Botting R.M. Mechanism of action of acetaminophen: is there a cyclooxygenase 3? / R.M. Botting // Clin. Infect. Dis. — 2000. — Vol. 31, Suppl. 5. — S. 202-210.
33. Bovill J.G. Mechanisms of actions of opioids and non-steroidal anti-inflammatory drugs / J.G. Bovill // Eur. J. Anaesthesiol. — 1997. — P. 9-15.
34. Effect of aminophylline on aspirin penetration into the central nervous system in rats / V. Vasovic, B. Banic, V. Jakovljevic [et al.] // Eur. J. Drug. Metab. Pharmacokinet. — 2008. — Vol. 33. — P. 23-30.
35. Mannila A.H. Central Nervous System Permeation of Ibuprofen, Ketoprofen and Indomethacin. In Vivo and In Situ Studies in Rats and Clinical Trials in Children / Doctoral dissertation [електронний ресурс] 2009 / Faculty of Pharmacy of the University of Kuopio / Режим доступу: http://epublications.uef.fi/pub/urn_isbn_978-951-27-1147-5/urn_isbn_978-951-27-1147-5.pdf
36. How readily does ketorolac penetrate cerebrospinal fluid in children? / E. Kumpulainen, H. Kokki, M. Laisalmi [et al.] // J. Clin. Pharmacol. — 2008. — Vol. 48, № 4. — P. 495-501.
37. Acetaminophen distribution in the rat central nervous system / J.P. Courad, D. Besse, C. Delchambre [et al.] // Life Sci. — 2001. — Vol. 69. — P. 1455-1464.
38. Cerebrospinal fluid and plasma concentrations of dipyrone metabolites after a single oral dose of dipyrone / O. Cohen, E. Zylber-Katz, Y. Caraco [et al.] // Eur. J. Clin. Pharmacol. — 1998. — Vol. 54, № 7. — P. 549-553.
39. Bernareggi A. The pharmacokinetic profile of nimesulide in healthy volunteers / A. Bernareggi // Drugs. — 1993. — Vol. 46. — P. 64-72.
40. Botting R. COX‑3 and the mechanism of action of paracetamol / R. Botting, S. Ayoub // Prostaglandins Leukotrienes and Essential Fatty Acids. — 2005. — Vol. 72, № 2. — P. 85-87.
41. Graham G.G. Mechanism of action of paracetamol / G.G. Graham, K.F. Scott // Am. J. Ther. — 2005. — Vol. 12. — P. 46-55.
42. Kis B. Acetaminophen and the Cyclooxygenase‑3 Puzzle: Sorting out Facts, Fictions, and Uncertainties / B. Kis, J.A. Snipes, D.W. Busija // Journal of Pharmacology & Experimental Therapeutics. — 2005. — Vol. 315. — P. 1-7.
43. Sharma C.V. Paracetamol: mechanisms and updates / C.V. Sharma / Continuing Education in Anaesthesia, Critical Care & Pain (2013) [електронний ресурс] / Режим доступу: http://ceaccp.oxfordjournals.org/content/early/2013/10/10/bjaceaccp.mkt049.full
44. Mattia C. What anesthesiologists should know about paracetamol (acetaminophen) / C. Mattia, F. Coluzzi // Minerva Anestesiol. — 2009. — Vol. 75. — P. 644-653.
45. Jahr J.S. Intravenous acetaminophen: a review of pharmacoeconomic science for perioperative use / J.S. Jahr, P. Filocamo, S. Singh // Am. J. Ther. — 2013. — Vol. 20. — P. 189-199.
46. Onset of acetaminophen analgesia: comparison of oral and intravenous routes after third molar surgery / P.L. Moller, S. Sindet-Pedersen, C.T. Petersen [et al.] // British Journal of Anaesthesia. — 2005. — Vol. 94. — P. 642-648.
47. Smith H.S. Potential analgesic mechanism of acetaminophen / H.S. Smith // Pain Physician. — 2009. — Vol. 12. — P. 269-320.
48. Paracetamol: new vistas of an old drug / A. Bertolini, A. Ferrari, A. Ottani [et al.] // CNS Drug Rev. — 2006. — Vol. 12. — P. 250-275.
48. Пероксидаза / Лекции по ферментам / Joomla! Open Source Content Management [електронний ресурс] / Режим доступу: http://food-chem.ru/lektsii-po-fermentam/27-peroksidaza.html
49. Randomised comparison of intravenous paracetamol and intravenous morphine for acute traumatic limb pain in the emergency department / M. Craig, R. Jeavons, J. Probert [et al.] // Emerg. Med. J. — 2012. — Vol. 29. — P. 37-39.
50. Intravenous acetaminophen reduces postoperative nausea and vomitting: a systematic review and meta-analysis / C.C. Arfel, A. Turan, K. Souza [et al.] // Pain. — 2013. — Vol. 154. — P. 677-689.
51. Георгиянц М.А. Опыт использования внутривенного парацетамола после ортопедических оперативных вмешательств / М.А. Георгиянц, Н.И. Волошин, В.И. Кривобок // Травма. — 2012. — Т. 13, № 4. — С. 77-80.






/28.jpg)
/29.jpg)
/30.jpg)
/31.jpg)
/32.jpg)
/33.jpg)