Цмв и вэб что это у ребенка
Цитомегаловирус, ВЭБ и анализы, прилагающиеся к ним
Вирус Эпштейна-Барр (ВЭБ) и цитомегаловирус — головная боль многих инфекционистов, и моя в частности. И не потому, что они вызывают опасные заболевания (зачастую как раз наоборот), а потому, что в свое время некоторые дяди и тети решили построить свой бизнес на диагностике и лечении этих инфекций. Расскажу-ка я вам, что это за вирусы такие на самом деле и почему нас всех на них разводят, как слепых котят.
ВЭБ и цитомегаловирус (ЦМВ) — это представители вирусов группы герпеса, а значит, обладают одним уникальным свойством — если они проникли в организм, то обязательно спрячутся в нем на длительное время, зачастую на всю жизнь. Сидят себе спокойно и никого не трогают. Иногда могут «психануть» и начать выделяться со слюной, мочой, кровью и т.д., благодаря чему прекрасно передаются от человека к человеку, и именно из-за этого примерно 40% детей и 90-95% взрослого населения уже заражены цитомегаловирусом и ВЭБ соответственно.
Итого имеем первый факт: ЦМВ и ВЭБ — это очень распространенные заболевания, и антитела к ним можно обнаружить как минимум у половины здорового (!) населения планеты Земля, причем остаются они в крови человека на всю жизнь.
Так какие же заболевания вызывают эти вирусы? В подавляющем большинстве случаев проникновение этих возбудителей в организм (что чаще всего бывает в детском возрасте) не сопровождается никакими симптомами вообще, то есть заражение проходит бессимптомно. Вот не было явного заболевания, а мама вдруг решила (или доктор/подружка/интернет посоветовал) сдать анализ крови на антитела, а они положительные, и у мамы шок. Если же знакомство с этими вирусами сопровождается заболеванием, то проявляется оно в основном в виде банального ОРВИ (сопли+кашель+лихорадка) или инфекционного мононуклеоза (сопли+кашель+лихорадка+увеличение глоточной/небных миндалин и лимфатических узлов), или просто лихорадки неясного генеза. Все симптомы обычно проходят в течение недели, но могут тянуться и несколько недель и даже месяцев (до 6 месяцев максимум), а затем обязательно проходят.
Теперь у нас появился факт номер два: у изначально здорового ребенка/взрослого эти вирусы чаще всего не вызывают никаких симптомов, а если все же вызвали, то эти симптомы уже давным-давно описаны и доктору не нужно придумывать глупости типа «Ребенок балуется и не хочет есть кашу? Точно ВЭБ, говорю вам!».
А если все-таки заболевание себя проявило? Ну, например, появились признаки инфекционного мононуклеоза. Как это лечить? Нужны ведь противовирусные и укрепляющие препараты? К сожалению, на сегодняшний день не разработано эффективных препаратов, уничтожающих ВЭБ в организме. В пробирке — да, но когда его вводят в организм, то толку практически никакого. Что касается цитомегаловируса, то препараты есть, однако они настолько токсичные (и недешевые, кстати), что их применяют только при тяжелых формах заболевания, которые возникают исключительно при наличии иммунодефицита (СПИД, в основном); на фоне постоянного приема препаратов, подавляющих иммунитет; у людей с пересаженными органами и при врожденной цитомегаловирусной инфекции (и то не всегда).
Вырисовываем факт номер три: эффективного лечения против этих вирусов еще не нашли, и максимум, что вам реально поможет — это симптоматическая терапия.
Теперь отделяем котлеты от мух:
1) антитела к ЦМВ и ВЭБ обнаруживаются у более чем половины населения, а значит, они не настолько опасны, иначе человечество просто не дожило бы до сегодняшнего дня;
2) чаще всего у изначально здоровых детей и взрослых эти вирусы не вызывают никаких симптомов, а если и вызывают, то протекают сравнительно легко и имеют конкретную клиническую картину;
3) эффективного лечения, чтобы вот выпить таблетку — и «оно само отвалится» (с), — не разработано. Лечение чисто симптоматическое.
Прошу вас, не ищите проблему там, где ее нет. Ну не вызывают цитомегаловирус и ВЭБ срыгивания, дрожание подбородочка и жидкий зеленый стул у ребенка на ГВ. Но если вы все-таки решили сдать кровь на антитела к этим вирусам, то хоть проверьте, есть ли у вас показания к этому анализу (читайте выше), иначе вы рискуете найти то, что есть у 95 % населения Земли и абсолютно не связано с вашей проблемой или проблемой вашего ребенка.
ВИРУС ЭПШТЕЙН-БАРРА У ДЕТЕЙ. ЧТО ЭТО ТАКОЕ?
ВИРУС ЭПШТЕЙН-БАРРА У ДЕТЕЙ. ЧТО ЭТО ТАКОЕ.
Малыши часто болеют вирусными заболеваниями, и некоторые из них несут серьезную угрозу для здоровья детей. В настоящий момент педиатры всего мира обращают особое внимание на патологии, что вызывает вирус Эпштейн-Барра.
Инфекционный мононуклеоз – это болезнь вирусной этиологии. Инфекционный агент –герпесоподобный вирус Эпштейн-Барра, способный вызывать не только инфекционный мононуклеоз, но и провоцировать развитие носоглоточной карциномы, лимфомы Беркитта и, вероятно, ряд иных заболеваний. Статистика свидетельствует о том, что это заболевание наиболее часто встречается у детей. Мононуклеоз у детей – это очень распространенная инфекция: до достижения пятилетнего возраста каждый второй ребенок уже заражен патологией. Однако развивается заболевание примерно у 5%детей, а во взрослом возрасте встречается крайне редко в связи с особенностями иммунной системы.
При первичном заражении у ребенка симптомы этой инфекции могут остаться незамеченными. Последствия инфекции спустя несколько месяцев негативно влияют на все органы и системы организма. Что нужно знать родителям о признаках этой болезни?
Вирус Эпштейна-Барр (ВЭБ) –возбудитель ряда заболеваний человека, принадлежит группе вирусов герпеса (иное название – инфекционный агент герпеса 4 типа). Открыт в 1964 году в Великой Британии учеными Михаэлем Эпштейном и Ивонной Барр. Размножается в клетках иммунной системы ребенка (лимфоцитах) и вызывает их неконтролируемый рост
Вирус имеет в своем составе такие элементы, против которых в телах детей В-лимфоцитами вырабатываются антитела классов IgM и IgG (иммуноглобулин М, G):
· VCA –капсидный антиген;
· ENBA –ядерный антиген;
· EA – ранний антиген.
Когда в крови ребенка обнаружен IgM и IgG (иммуноглобулин М, G) против вышеуказанных антигенов (VCA,EA, ENBA), если проводится серологический анализ, то можно диагностировать острую или хроническую форму заболевания, вызванного вирусом Эпштейна-Барр.
Признаки и симптомы
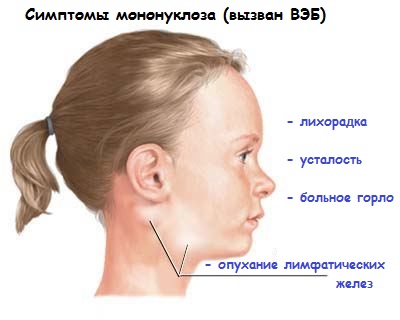
Рассмотрим симптомы инфекционного мононуклеоза, который является проявлением первичного контакта ребенка с вирусом Эпштейна-Барр. Иногда мононуклеоз у детей вызывает цитомегаловирус (ЦМВ; дифференциальный серологический анализ всегда необходим).Заболевание начинается остро и длится от 3 до 4 недель.
При мононуклеозе (если его причина ВЭБ, а не цитомегаловирус) проявляется следующая симптоматика. Её обнаруживают при непосредственном осмотре ребенка:
1. Повышение температуры тела до 39-40 градусов с тяжелым интоксикационным синдромом –тошнота, рвота, слабость, головная боль, тахикардия;
2. Увеличение лимфатических узлов по всему телу (особенно на шее – передне- и заднешейные узлы);
3. Назофарингит и тонзиллит с бело-серыми или желтоватыми налетами (из-за поражения небных миндалин и аденоидов);
4. Утрудненное носовое дыхание при отсутствии выделений из носовых ходов, одутловатость лица,гнусавость голоса;
5. Увеличение печени и селезенки (гепатоспленомегалия у детей), боли в брюшной полости,иктеричность склер и кожи;
6. Экзантема(высыпания вирусного происхождения) в виде пятен, папул, везикул с повсеместной локализацией.
При микроскопическом исследовании в период острой инфекции среди обычных кровяных клеток находят большие атипичные лимфоциты, что поражены вирусом, –мононуклеары (такую картину крови иногда дает цитомегаловирус, ЦМВ). Они сохраняются в кровяном русле на протяжении месяца с момента заражения.
Для серологической диагностики мононуклеоза используют иммуноферментный анализ(ИФА) или полимеразноцепную реакцию (ПЦР), с помощью какой выявляют вирус Эпштейна-Барра.
Какие антитела (АТ) типов IgG и IgM (иммуноглобулин М, G) являются диагностическими, когда проводят ИФ-анализ?
Анти-VCA антитела класса IgM (иммуноглобулин М к капсидному антигену)
Вырабатываются при острой ВЭБ-инфекции, циркулируют в крови 2-3 месяца. Повторно синтезируются в случае реактивации вируса.
Высокая концентрация анти-VCA IgM, что длительно сохраняется, – свидетельство хронической формы ВЭБ.
Анти-EA антитела класса IgG (иммуноглобулин G к раннему антигену)
Появляются в крови на 3-4 неделе от начала острой ВЭБ-инфекции, сохраняются в течение 2-6 месяцев. Вновь анти-EA IgG появляются при реактивации возбудителя.
Анти-EBNA антитела класса IgG (иммуноглобулин G к ядерному антигену)
Начинают циркулировать в кровяном русле через 1-6 месяцев после первичного ВЭБ-заболевания. Постепенно их концентрация уменьшается. Анти-EBNA IgG может быть обнаружен до конца жизни человека (их всегда выявляет ИФ-анализ).
Если был проведен ИФ-анализ, положительный результат, выявивший:
· антителатипа IgG (иммуноглобулин G) против ядерного и ранних антигенов;
· антителатипа IgM (иммуноглобулин М) к капсидному (VCA) антигену вируса
Профилактика
1. Для того, чтобы избежать заражения вирусом Эпштейна-Барр с ранних лет приучайте ребенка к личной гигиене.
2. В осеннее-зимнее время избегайте больших скоплений людей, так как при чихании и кашле тоже существует вероятность передачи возбудителя Эпштейн-Барр.
3. Ведите здоровый образ жизни, так как вирус Эпштейн-Барра после попадания в организм может длительное время находится в нем в латентной форме (симптомы появляются при ослаблении иммунитета, физическом истощении, если прервано лечение иной болезни).
Мы заботимся о вашем здоровье и здоровье ваших детей!
Инфекции, вызываемые вирусом Эпштейна-Барра и цитомегаловирусная инфекция
Цитомегаловирусная инфекция
ЦМВ — представитель группы вирусов ргерпес, содержащий двойную спираль ДНК.
Эпидемиология
Вирус распространен во всем мире, чаще отмечается в перинатальном периоде и в детском возрасте. В США им инфицированы около 1% новорожденных. Инфицирование происходит только в результате повторного длительного тесного контакта. Передача происходит при сексуальных контактах, после переливания препаратов крови с частотой 0,1–10% на единицу перелитой крови. После того, как инфицированный ЦМВ ребенок попадает в семью или небольшой коллектив, передача инфекции чувствительным лицам составляет 50% в течение 6 мес.
Патогенез
После проникновения ЦМВ в организм в ходе бессимптомной или клинически манифестной инфекции, он латентно персистирует в тканях организма неопределенно долго. При нарушении активности Т-клеток организма вирус может реактивироваться, что проявляется разнообразными клиническими синдромами.
Клинические проявления
Врожденная ЦМВ-инфекция. В большинстве случаев у новорожденных ЦМВ-инфекция не имеет проявлений; у 5–25% детей, родившихся без проявлений инфекции, в течение последующих лет развиваются психомоторные, слуховые, зрительные отклонения. Цитомегалия, или инклюзивная болезнь, развивается примерно у 5% плодов, матери которых были первично инфицированы во время беременности. Симптомы: петехии, гепатоспленомегалия и желтуха (у 60–80%). В 30–50% случаев бывает микроцефалия (с кальцификацией вещества головного мозга или без нее), замедление внутриутробного роста и недоношенность. При тяжелых поражениях летальность составляет 20–30%.
Перинатальная инфекция. У большинства новорожденных, инфицированных в родах, признаки заболевания отсутствуют. Инфицирование происходит при прохождении через инфицированные родовые пути, а после рождения — с молоком матери. Реже ЦМВ вызывает затянувшийся интерстициальный пневмонит недоношенных.
ЦМВ-мононуклеоз. Мононуклеоз с отрицательными гетерофильными антителами — наиболее частое проявление ЦМВ-инфекции у соматически здоровых новорожденных. Инкубационный период 20–60 дней, длительность заболевания 2–6 нед. ЦМВ-мононуклеоз характеризуется длительной высокой лихорадкой, иногда с ознобом, быстрой утомляемостью, недомоганием. Миалгия, головная боль и спленомегалия встречаются часто, а экссудативный фарингит и шейная лимфаденопатия редки, что контрастирует с мононуклеозом, вызванным вирусом Эпштейна-Барр, для которого эти поражения характерны. Лабораторные данные — относительный лейкоцитоз с наличием более 10% атипичных лимфоцитов. Умеренное повышение активности сывороточной АлАТ и ЩФ также типичны; желтуха встречается редко.
ЦМВ-инфекция у больных со сниженным иммунитетом. ЦМВ наиболее часто поражает реципиентов трансплантируемых органов. Симптомы инфекции: лихорадка, лейкопения, гепатит, пневмонит, эзофагит, гастрит, колит, ретинит. Период максимального риска приходится на 14-й месяц после трансплантации. Максимальный риск заболевания выше при первичном инфицировании. После пересадки печени возникает ЦМВ-гепатит, после пересадки легких — ЦМВ-пневмонит. Он также развивается у 15–20% больных реципиентов костного мозга и дает летальность 84–88%. ЦМВ часто обнаруживают у больных с ВИЧ-инфекцией. В процесс вовлекается ЖКТ (включая язвы пищевода и колит). ЦМВ-ретинит — главная причина развития слепоты при СПИДе.
Диагностика: необходимо выделить вирус в тканевой культуре, это занимает несколько дней при высоком титре вируса, но может потребоваться и несколько недель. Для ускорения многие лаборатории применяют оболочнопузырьковую методику для работы с тканевой культурой. При этом применяют моноклональные антитела и иммуноцитохимический тест для раннего обнаружения антигена. Выделение вируса из мочи или слюны не подтверждает заболевания, поскольку сохраняется месяцы и годы после перенесенной инфекции; определение ЦМВ-виремии культуральным методом или скоростными антигенными тестами и в лейкоцитах периферической крови — эти методики являются наилучшими. Нужно учесть, что, хотя 4-х кратный подъем в титре антител может подтвердить наличие инфекции в организме, этот подъем может занять около 4 нед, титр остается повышенным на протяжении ряда лет.
Лечение
Ганцикловир был эффективен у 70–90% больных с ВИЧ-инфекцией, леченных по поводу ЦМВ-вирусного ретинита и колита. Начальная доза препарата составила 5 мг/кг 2 раза в сутки внутривенно в течение 14–21 дня, поддерживающая — 5 мг/кг в сутки внутривенно. Нейтропения, главный токсический эффект, может быть уменьшена путем применения колониестимулирующих факторов. У реципиентов костного мозга применение ганцикловира и ЦМВ-иммунного глобулина позволило получить положительный результат у 50–70% больных с ЦМВ-пневмонитом. Для разновидностей ЦМВ, резистентных к ганцикловиру, эффективен фоскарнет (влечении больных с ЦМВ-ретинитом при ВИЧ-инфекции). Первоначальная доза фоскарнета 60 мг/кг через 8 ч в течение 14–21 дня, затем сутки вводят инфузионно 90–120 мг/кг. У 5% больных лечение сопровождалось выраженным токсическим эффектом, включая дисфункцию почек, гипомагнезиемию, гипокалиемию, гипокальциемию, судороги, лихорадку, сыпь.
Инфекции, вызванные вирусом Эпштейна-Барр
ВЭБ содержит ДНК в форме двойной спирали, относится к группе герпесвирусов человека, обладает лимфотропностью к Вклеткам.
Эпидемиология
ВЭБ передается преимущественно со слюной, иногда при переливании крови и не является высоко контагиозным. Первичная инфекция в основном поражает детей раннего возраста, а также малообеспеченные слои населения и популяции в развивающихся странах. Инфекционный мононуклеоз обусловливает большинство случаев данного заболевания среди подростков и молодых взрослых. У взрослых в большинстве случаев обнаруживаются антитела к ВЭБ. Вирус выделяется во внешнюю среду из ротоглотки в течение 18 мес после первичного инфицирования. Затем выделение вируса периодически продолжается у всех серопозитивных реконвалесцентов при отсутствии клинической симптоматики.
Клинические проявления
Инфекционный мононуклеоз. Инкубационный период длится 4–8 нед. Продромальные признаки (слабость, анорексия, озноб) часто на несколько дней опережают начало заболевания в виде фарингита, лихорадки и лимфаденопатии. Выраженный фарингит заставляет больного обращаться за медицинской помощью. Лихорадка отмечена у 90% больных, температура тела может достигать 39–40°С. При физикальном исследовании: распространенный фарингит с экссудацией у 1/3 больных; шейная лимфаденопатия, захватывающая задние и (или) передние группы лимфатических узлов более чем у 90% больных, спленомегалия примерно у половины на 2–3-й неделях болезни и сыпь у 5%. После назначения ампициллина у 90–100% больных инфекционным мононуклеозом возникает зудящая макулопапулезная сыпь. Фарингит длится не более 5–7 дней с постепенным исчезновением в последующие 7–10 дней; лихорадка тянется 7–14 дней, но иногда дольше; лимфаденопатия исчезает за 3 нед, а слабость сохраняется на протяжении месяцев. Осложнения нечасты, но могут быть тяжелыми, включая развитие аутоиммунной гемолитической анемии, тромбоцитопении, гранулоцитопении, разрыв селезенки, патологию черепных нервов, энцефалит, гепатит, перикардит, миокардит, спазм коронарных артерий, обструкцию дыхательных путей. Описаны случаи крайне тяжелой ВЭБ инфекции, которую расценивали как связанный с Х-хромосомой лимфопролиферативный синдром, или синдром Дункана.
Злокачественные новообразования, связанные с вирусом Эпштейна-Барр.
Эта зависимость была впервые описана между ВЭБ и африканской лимфомой Беркитта. Она прослежена у 90% больных лимфомой, тогда как в США — у 15%; то же установлено в отношении анапластической назофарингеальной карциномы, Вклеточной лимфомы, особенно у больных с иммунодефицитом после трансплантации аллотканей; у больных с атаксиейтелеангиоэктазией (синдром ЛуиБар) и ВИЧ-инфекцией.
Диагностика
Относительный и абсолютный лимфоцитоз отмечен примерно у 75% больных инфекционным мононуклеозом, чаще на 2–3-й неделе болезни. Гетерофильные антитела (антитела к эритроцитам барана, которые могут быть удалены при абсорбции с эритроцитами быка) встречаются у 50% детей и 90–95% подростков и взрослых с мононуклеозом. Обследование, выполненное на первой неделе, у 10–15% больных дает отрицательный результат. IgM-антитела к антигену вирусной капсулы (АВК) диагностически значимы при первичной ВЭБ-инфекции. Ig-антиАВК антитела обнаруживаются на ранних этапах инфекционного процесса и сохраняются на всю жизнь. Антитела к ядерному антигену EBNA появляются примерно на 6–8-й неделе и также сохраняются в течение всей жизни. Наличие Ig-антиАВК антител и сероконверсия титра антител к ядерному антигену EBNA диагностически значимы при первичной ВЭБ-инфекции.
Лечение
Лечение инфекционного мононуклеоза — симптоматическое. На 6–8 нед следует ограничить интенсивную физическую активность, которая может вызвать разрыв селезенки. Глюкокортикоиды назначают лишь при синдроме обструкции дыхательных путей, выраженной гемолитической анемии и тромбоцитопении. Состояние некоторых больных с затяжным течением болезни можно улучшить проведением короткого курса преднизолона, но стандартная терапия стероидами не показана.
Клинические формы хронической Эпштейн-Барр-вирусной инфекции: вопросы диагностики и лечения
Какие заболевания могут вызвать вирус Эпштейна-Барра? Какие симптомы типичны для ВЭБ-инфекции? Существуют ли строго специфичные для ВЭБ изменения лабораторных показателей? Что включает в себя комплексная терапия ВЭБ-инфекции?
Какие заболевания могут вызвать вирус Эпштейна-Барра? Какие симптомы типичны для ВЭБ-инфекции?
Существуют ли строго специфичные для ВЭБ изменения лабораторных показателей?
Что включает в себя комплексная терапия ВЭБ-инфекции?
В последние годы наблюдается рост числа больных, страдающих хроническими рецидивирующими герпес-вирусными инфекциями, которые во многих случаях сопровождаются выраженным нарушением общего самочувствия и целым рядом терапевтических жалоб. Наиболее широко распространены в клинической практике лабиальный герпес (чаще вызывается Herpes Simplex I), опоясывающий лишай (Herpes zoster) и генитальный герпес (чаще вызывается Herpes simplex II); в трансплантологии и гинекологии часто встречаются заболевания и синдромы, вызванные цитомегаловирусом (Cytomegalovirus). Однако о хронической инфекции, вызванной вирусом Эпштейна-Барр (ВЭБ), и ее формах врачи общей практики осведомлены явно недостаточно.
ВЭБ был впервые выделен из клеток лимфомы Беркетта 35 лет назад. Вскоре стало известно, что вирус может вызывать у человека острый мононуклеоз и назофарингеальную карциному. В настоящее время установлено, что ВЭБ ассоциирован с целым рядом онкологических, преимущественно лимфопролиферативных и аутоиммунных заболеваний (классические ревматические болезни, васкулиты, неспецифический язвенный колит и др.). Кроме того, ВЭБ может вызывать хронические манифестные и стертые формы заболевания, протекающие по типу хронического мононуклеоза [1, 3, 6, 9,12]. Вирус Эпштейна—Барр относится к семейству герпес-вирусов, подсемейство гамма-герпес-вирусов и род лимфокриптовирусов, содержит две молекулы ДНК и обладает способностью, как и другие вирусы этой группы, пожизненно персистировать в организме человека [6, 8]. У части больных на фоне иммунной дисфункции и наследственной предрасположенности к той или иной патологии ВЭБ может вызывать различные заболевания, о которых упоминалось выше. ВЭБ инфицирует человека, проникая через интактные эпителиальные слои путем трансцитоза в нижележащую лимфоидную ткань миндалин, в частности В-лимфоциты [7]. Проникновение ВЭБ в В-лимфоциты осуществляется через рецептор этих клеток CD21 — рецептор к С3d-компоненту комплемента. После инфицирования число пораженных клеток увеличивается посредством вирус-зависимой клеточной пролиферации. Инфицированные В-лимфоциты могут значительное время находиться в тонзиллярных криптах, что позволяет вирусу выделяться во внешнюю среду со слюной.
С инфицированными клетками ВЭБ распространяется по другим лимфоидным тканям и периферической крови. Созревание В-лимфоцитов в плазматические клетки (что происходит в норме при их встрече с соответствующим антигеном, инфектом) стимулирует размножение вируса, а последующая гибель (апоптоз) этих клеток приводит к выделению вирусных частиц [7] в крипты и слюну. В инфицированных вирусом клетках возможно два вида размножения: литический, то есть приводящий к гибели, лизису, клетки-хозяина, и латентный, когда число вирусных копий небольшое и клетка не разрушается. ВЭБ может длительно находиться в В-лимфоцитах и эпителиоцитах назофарингеальной области и слюнных желез. Кроме того, он способен инфицировать другие клетки: Т-лимфоциты, NK-клетки, макрофаги, нейтрофилы, эпителиоциты сосудов [1, 6, 8, 9]. В ядре клетки-хозяина ДНК ВЭБ может формировать кольцевую структуру — эписому, либо встраиваться в геном, вызывая хромосомные нарушения [14].
При острой или активной инфекции преобладает литическая репликация вируса.
Активное размножение вируса может происходить в результате ослабления иммунологического контроля, а также стимуляции размножения клеток, инфицированных вирусом под действием целого ряда причин: острой бактериальной или вирусной инфекции, вакцинации, стрессов и др.
По данным большинства исследователей, сегодня примерно 80—90% населения инфицировано ВЭБ. Первичная инфекция чаще возникает в детском или молодом возрасте. Пути передачи вируса различны: воздушно-капельный, контактно-бытовой, трансфузионный, половой, трансплацентарный. После заражения ВЭБ репликация вируса в организме человека и формирование иммунного ответа могут протекать бессимптомно либо проявляться в виде незначительных признаков ОРВИ. Но при попадании большого количества инфекта и/или наличии в данный период значимого ослабления иммунной системы у пациента может развиться картина инфекционного мононуклеоза. Возможно несколько вариантов исхода острого инфекционного процесса:
Ближайший и отдаленный прогноз для больного с острой инфекцией, вызванной ВЭБ, зависит от наличия и степени выраженности иммунной дисфункции, генетической предрасположенности к тем или иным ВЭБ-ассоциированным заболеваниям (см. выше), а также от наличия ряда внешних факторов (стрессы, инфекции, операционные вмешательства, неблагоприятное воздействие окружающей среды), повреждающих иммунную систему. Было обнаружено, что ВЭБ обладает большим набором генов, дающим ему возможность в определенной мере ускользать от иммунной системы человека. В частности, ВЭБ вырабатывает белки — аналоги ряда человеческих интерлейкинов и их рецепторов, изменяющих иммунный ответ [5]. В период активного размножения вирус продуцирует ИЛ-10-подобный белок, который подавляет Т-клеточный иммунитет, функцию цитотоксических лимфоцитов, макрофагов, нарушает все этапы функционирования естественных киллеров (то есть важнейших систем противовирусной защиты). Другой вирусный белок (BI3) также может подавлять Т-клеточный иммунитет и блокировать активность клеток-киллеров (через подавление интерлейкина-12). Еще одно свойство ВЭБ, как и других герпес-вирусов, высокая мутабельность, позволяет ему на определенное время избегать воздействия специфических иммуноглобулинов (которые были наработаны к вирусу до его мутации) и клеток иммунной системы хозяина. Таким образом, размножение ВЭБ в организме человека может явиться причиной усугубления (возникновения) вторичного иммунодефицита.
Клинические формы хронической инфекции, вызванной вирусом Эпштейна—Барр
Хроническая активная ВЭБ-инфекция (ХА ВЭБИ) характеризуется длительным рецидивирующим течением и наличием клинических и лабораторных признаков вирусной активности [9]. Пациентов беспокоят слабость, потливость, нередко — боли в мышцах и суставах, наличие кожных высыпаний, кашель, затрудненное носовое дыхание, дискомфорт в горле, боли, тяжесть в правом подреберье, прежде нехарактерные для данного больного головные боли, головокружение, эмоциональная лабильность, депрессивные расстройства, нарушение сна, снижение памяти, внимания, интеллекта. Часто наблюдаются субфебрильная температура, увеличение лимфоузлов, гепатоспленомегалия различной степени выраженности. Нередко эта симптоматика имеет волнообразный характер. Иногда больные описывают свое состояние как хронический грипп.
У значительной части больных с ХА ВЭБИ наблюдается присоединение других герпетических, бактериальных и грибковых инфекций (герпес-лабиалис, генитальный герпес, молочница, воспалительные заболевания верхних дыхательных путей и желудочно-кишечного тракта).
ХА ВЭБИ характеризуется лабораторными (косвенными) признаками вирусной активности, а именно относительным и абсолютным лимфомоноцитозом, наличием атипичных мононуклеаров, реже моноцитозом и лимфопенией, в ряде случаев анемией и тромбоцитозом. При исследовании иммунного статуса у больных ХА ВЭБИ наблюдаются изменение содержания и функции специфических цитотоксических лимфоцитов, естественных киллеров, нарушение специфического гуморального ответа (дисиммуноглобулинемия, длительное отсутствие наработки иммуноглобулина G (IgG) или так называемое отсутствие сероконверсии к позднему нуклеарному антигену вируса — EBNA, что отражает несостоятельность иммунологического контроля размножения вируса. Кроме того, по нашим данным, более чем у половины больных снижена способность к стимулированной продукции интерферона (ИФН), повышено содержание сывороточного ИФН, имеют место дисиммуноглобулинемия, нарушение авидности антител (их способности прочно связываться с антигеном), уменьшено содержания DR+лимфоцитов, нередко повышены показатели циркулирующих иммунных комплексов и антител к ДНК.
У лиц с выраженной иммунной недостаточностью возможно возникновение генерализованных форм ВЭБ-инфекции с поражением центральной и периферической нервной систем (развитие менингита, энцефалита, мозжечковой атаксии, полирадикулоневритов), а также с поражением других внутренних органов (развитие миокардита, гломерулонефрита, лимфоцитарного интерстициального пневмонита, тяжелых форм гепатита). Генерализованные формы ВЭБ-инфекции нередко заканчиваются летальным исходом [10, 15].
ВЭБ-ассоциированный гемофагоцитарный синдром характеризуется развитием анемии или панцитопении. Часто сочетается с ХА ВЭБИ, инфекционным мононуклеозом и лимфопролиферативными заболеваниями. В клинической картине преобладают интермиттирующая лихорадка, гепатоспленомегалия, лимфоаденопатия, панцитопения или выраженная анемия, печеночная дисфункция, коагулопатия. Гемофагоцитарный синдром, развивающийся на фоне инфекционного мононуклеоза, характеризуется высокой летальностью (до 35%). Вышеописанные изменения объясняют гиперпродукцией провоспалительных цитокинов (ФНО, ИЛ1 и ряда других) Т-клетками, инфицированными вирусом. Эти цитокины активируют систему фагоцитов (размножение, дифференцировку и функциональную активность) в костном мозге, периферической крови, печени, селезенке, лимфоузлах. Активированные моноциты и гистиоциты начинают поглощать клетки крови, что приводит к их разрушению. Более тонкие механизмы этих изменений находятся в стадии изучения.
Стертые варианты хронической ВЭБ-инфекции
По нашим данным, ХА ВЭБИ нередко протекает стерто или под масками других хронических заболеваний.
Можно выделить две наиболее часто встречающиеся формы латентной вялой ВЭБ-инфекции. В первом случае больных беспокоит длительный субфебрилитет неясного генеза, слабость, боли в периферических лимфоузлах, миалгии, артралгии. Характерна также волнообразность симптоматики [11]. У другой категории больных помимо вышеописанных жалоб имеют место маркеры вторичного иммунодефицита в виде ранее нехарактерных для них частых инфекций дыхательных путей, кожи, желудочно-кишечного тракта, гениталий, которые на фоне терапии полностью не проходят или же быстро рецидивируют. Наиболее часто в анамнезе этих пациентов имеют место длительные стрессовые ситуации, чрезмерные психические и физические перегрузки, реже — увлечение голоданием, модными диетами и т. д. Нередко вышеописанное состояние развивалось после перенесенной ангины, ОРЗ, гриппоподобного заболевания. Характерными для этого варианта инфекции также являются устойчивость и длительность симптоматики — от шести месяцев до 10 и более лет. При повторных обследованиях обнаруживают ВЭБ в слюне и/или лимфоцитах периферической крови. Как правило, повторные углубленные обследования, проводимые у большинства этих пациентов, не позволяют обнаружить других причин длительного субфебрилитета и развития вторичного иммунодефицита.
Очень важен для постановки диагноза ХА ВЭБИ является и тот факт, что в случае устойчивого подавления вирусной репликации удается достичь длительной ремиссии у большинства пациентов. Диагностика ХА ВЭБИ затруднена из-за отсутствия специфических клинических маркеров заболевания. Определенный «вклад» в гиподиагностику вносит и недостаточная информированность практических врачей о данной патологии. Тем не менее, учитывая прогрессирующий характер ХА ВЭБИ, а также серьезность прогноза (риск развития лимфопролиферативных и аутоиммунных заболеваний, высокая летальность при развитии гемофагоцитарного синдрома), при подозрении на ХА ВЭБИ необходимо проводить соответствующее обследование. Наиболее характерный клинический симптомокомплекс при ХА ВЭБИ — это длительный субфебрилитет, слабость и снижение работоспособности, боли в горле, лимфаденопатия, гепатоспленомегалия, печеночная дисфункция, психические нарушения. Важным симптомом является отсутствие полного клинического эффекта от проведения общепринятой терапии астенического синдрома, общеукрепляющей терапии, а также от назначения антибактериальных препаратов.
При проведении дифференциальной диагностики ХА ВЭБИ в первую очередь следует исключить следующие заболевания:
Лабораторные исследования в диагностике ВЭБ-инфекции
Как уже упоминалось выше, все перечисленные изменения не являются строго специфичными для ВЭБ-инфекции (их можно обнаружить и при других вирусных инфекциях).
По нашим данным, в иммунном статусе при ВЭБ-инфекции встречаются два вида изменений: повышенная активность отдельных звеньев иммунной системы и/или дисбаланс и недостаточность других. Признаками напряженности противовирусного иммунитета могут быть повышенные уровни ИФН в сыворотке крови, IgА, IgМ, IgЕ, ЦИК, нередко — появление антител к ДНК, повышение содержания естественных киллеров (CD16+), Т-хелперов (CD4+) и/или цитотоксических лимфоцитов (CD8+). Система фагоцитов может быть активирована.
В свою очередь, иммунная дисфункция/недостаточность при этой инфекции проявляется снижением способности к стимулированной продукции ИФН альфа и/или гамма, дисиммуноглобулинемией (снижение содержания IgG, реже IgА, повышение содержания Ig М), снижением авидности антител (их способности прочно связываться с антигеном), снижением содержания DR+лимфоцитов, CD25+ лимфоцитов, то есть активированных Т-клеток, уменьшением числа и функциональной активности естественных киллеров (CD16+), Т-хелперов (CD4+), цитотоксических Т-лимфоцитов (CD8+), снижением функциональной активности фагоцитов и/или изменением (извращением) их реакции на стимулы, в том числе на иммунокорректоры.
Специфические IgM-АТ появляются в острой фазе заболевания или в период обострения и через четыре–шесть недель, как правило, исчезают. IgG-АТ к ЕА (ранние) также появляются в острой фазе, являются маркерами активной репликации вируса и при выздоровлении снижаются за три–шесть месяцев. IgG-АТ к VCA (ранние) определяются в остром периоде с максимумом ко второй–четвертой неделе, затем их количество снижается, и пороговый уровень сохраняется длительное время. IgG-АТ к EBNA выявляются спустя два — четыре месяца после острой фазы, и их выработка сохраняется в течение всей жизни.
По нашим данным, при ХА ВЭБИ более чем у половины больных в крови определяются «ранние» IgG-АТ, в то время как специфические IgM-АТ определяются значительно реже, при этом содержание поздних IgG-АТ к EBNA колеблется в зависимости от стадии обострения и состояния иммунитета.
Надо отметить, что проведение серологического исследования в динамике помогает в оценке состояния гуморального ответа и эффективности противовирусной и иммунокорригирующей терапии.
Использование данного метода в клинической практике для выявления того или иного внутриклеточного агента из-за слишком высокой его чувствительности нередко затруднено, так как нет возможности отличить здоровое носительство (минимальное количество инфекта) от проявлений инфекционного процесса с активным размножением вируса. Поэтому для клинических исследований используют ПЦР-методику с заданной, более низкой чувствительностью. Как показали наши исследования, применение методики с чувствительностью 10 копий в пробе (1000 ГЭ/мл в 1 мл образца) позволяет выявлять здоровых носителей ВЭБ, в то время как снижение чувствительности метода до 100 копий (10000 ГЭ/мл в 1 мл образца) дает возможность диагностировать лиц с клинико-иммунологическими признаками ХА ВЭБИ.
Мы наблюдали больных с наличием клинических и лабораторных данных (в том числе результатов серологических исследований), характерных для вирусной инфекции, у которых при первичном обследовании анализ на ДНК ВЭБ в слюне и клетках крови был отрицательным. Важно отметить, что в этих случаях нельзя исключить репликацию вируса в желудочно-кишечном тракте, костном мозге, коже, лимфоузлах и др. Только повторное обследование в динамике может подтвердить или исключить наличие или отсутствие ХА ВЭБИ.
Таким образом, для постановки диагноза ХА ВЭБИ помимо проведения общеклинического обследования необходимы исследование иммунного статуса (противовирусного иммунитета), ДНК, диагностика инфекции в различных материалах в динамике, серологические исследования (ИФА).
Лечение хронической Эпштейн—Барр-вирусной инфекции
В настоящее время общепринятых схем лечения ХА ВЭБИ не существует. Однако современные представления о влиянии ВЭБ на организм человека и данные об имеющемся риске развития серьезных, нередко фатальных заболеваний показывают необходимость проведения терапии и диспансерного наблюдения у больных, страдающих ХА ВЭБИ.
Данные литературы и опыт нашей работы позволяют дать патогенетически обоснованные рекомендации по терапии ХА ВЭБИ. В комплексном лечении данного заболевания используют следующие препараты:
Другие группы лекарств, как правило, играют вспомогательную роль.
До начала лечения желательно обследовать членов семьи больного на предмет выделения вирусов (со слюной) и возможности повторного инфицирования пациента, при необходимости подавление вирусной репликации проводят и у членов семьи.
Препаратом выбора является интерферон-альфа, в среднетяжелых случаях назначаемый в виде монотерапии [14]. Хорошо зарекомендовал себя (в том, что касается биологической активности и переносимости) отечественный рекомбинантный препарат реаферон, при этом стоимость его существенно ниже, чем у зарубежных аналогов. Используемые дозы ИФН-альфа различаются в зависимости от веса, возраста, переносимости препарата. Минимальные дозы — 2 млн. ЕД в сутки (по 1 млн. ЕД два раза в день внутримышечно), первую неделю ежедневно, затем три раза в неделю в течение трех–шести месяцев. Оптимальные дозы — 4–6 млн. ЕД (по 2—3 млн. ЕД два раза в день).
ИФН-альфа, как провоспалительный цитокин, может вызвать гриппоподобную симптоматику (лихорадка, головные боли, головокружение, миалгии, артралгии, вегетативные расстройства — изменение АД, ЧСС, реже диспептические явления).
Выраженность указанных симптомов зависит от дозы и индивидуальной переносимости препарата. Это преходящие симптомы (исчезают через 2—5 дней от начала лечения), и часть из них контролируется назначением нестероидных противовоспалительных средств. При лечении препаратами ИФН-альфа могут возникать обратимые тромбоцитопения, нейтропения, кожные реакции (зуд, сыпи разнообразного характера), редко — алопеция. Длительное применение ИФН-альфа в больших дозах может привести к иммунной дисфункции, клинически проявляющейся фурункулезом, другими гнойничковыми и вирусными поражениями кожи.
В среднетяжелых и тяжелых случаях, а также при неэффективности препаратов ИФН-альфа к лечению необходимо подключать аномальные нуклеодиты — валацикловир (валтрекс), ганцикловир (цимевен) или фамцикловир (фамвир).
Курс лечения аномальными нуклеотидами должен составлять не менее 14 дней, первые семь дней желательно внутривенное введение препарата.
В случаях тяжелого течения ХА ВЭБИ в комплексную терапию включают также препараты иммуноглобулинов для внутривенного введения в дозе 10—15 г. При необходимости (по результатам иммунологического обследования) — назначают иммунокорректоры с Т-активирующей способностью или замещающие тимические гормоны (тимоген, иммунофан, тактивин, и др.) в течение одного-двух месяцев с постепенной отменой или переходом на поддерживающие дозы (два раза в неделю).
Лечение ВЭБ-инфекции необходимо проводить под контролем клинического анализа крови (один раз в 7—14 дней), биохимического анализа (один раз в месяц, при необходимости чаще), иммунологического исследования — через один-два месяца.
К противовирусной терапии препаратами ИФН-альфа и аномальными нуклеотидами в первую очередь подключают системные кортикостероиды в дозах: парентерально (в пересчете на преднизолон) 120–180 мг в сутки, или 1,5–3 мг/кг, возможно использование пульс-терапии метипредом 500 мг в/в капельно, или внутрь по 60–100 мг в сутки. Внутривенно вводят плазму и/или препараты иммуноглобулинов для внутривенного введения. При выраженной интоксикации показаны введение детоксицирующих растворов, плазмаферез, гемосорбция, назначение антиоксидантов. В тяжелых случаях применяют цитостатики: этопозид, циклоспорин (сандиммун или консупрен).
Лечение назначают при появлении клиники ВЭБ-инфекции или при формировании признаков ВИД.
Проведение комплексной терапии с включением указанных выше препаратов позволяет добиться ремиссии заболевания у части пациентов с генерализованной формой заболевания и при гемофагоцитарном синдроме. У больных со среднетяжелыми проявлениями ХА ВЭБИ и в случаях стертого течения заболевания эффективность терапии выше (70—80%) помимо клинического эффекта часто удается добиться подавления репликации вируса.
После подавления размножения вируса и получения клинического эффекта важно продлить ремиссию. Показано проведение санаторно-курортного лечения.
Больных следует информировать о важности соблюдения режима труда и отдыха, полноценного питания, ограничения/прекращения приема алкоголя; при наличии стрессовых ситуаций необходима помощь психотерапевта. Кроме того, при необходимости проводят поддерживающую иммунокорригирующую терапию.
Таким образом, лечение больных с хронической Эпштейн—Барр-вирусной инфекцией является комплексным, проводится под лабораторным контролем и включает применение препаратов интерферона-альфа, аномальных нуклеотидов, иммунокорректоров, заместительных иммунотропных препаратов, глюкокортикоидных гормонов, симптоматических средств.
Литература
И. К. Малашенкова, кандидат медицинских наук
Н. А. Дидковский, доктор медицинских наук, профессор
Ж. Ш. Сарсания, кандидат медицинских наук
М. А. Жарова, Е. Н. Литвиненко, И. Н. Щепеткова, Л. И. Чистова, О. В. Пичужкина
НИИ физико-химической медицины МЗ РФ
Т. С. Гусева, О. В. Паршина
ГУНИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН, Москва
Клиническая иллюстрация случая хронической активной ВЭБ-инфекции с гемофагоцитарным синдромом
Больная И. Л., 33 лет, обратилась в лабораторию клинической иммунологии НИИ ФХМ 20.03.97 с жалобами на длительный субфебрилитет, выраженную слабость, потливость, боли в горле, сухой кашель, головные боли, одышку при движении, учащенное сердцебиение, нарушения сна, эмоциональную лабильность (повышенную раздражительность, обидчивость, плаксивость), забывчивость.
Из анамнеза: осенью 1996 года после тяжелой ангины (сопровождавшейся сильной лихорадкой, интоксикацией, лимфоаденопатией) возникли вышеуказанные жалобы, длительно сохранялись увеличение СОЭ, изменения лейкоцитарной формулы (моноцитоз, лейкоцитоз), была выявлена анемия. Амбулаторное лечение (антибиотикотерапия, сульфаниламиды, препараты железа и др.) оказалось неэффективным. Состояние прогрессивно ухудшалось.
При поступлении: t тела — 37,8°С, кожные покровы повышенной влажности, выраженная бледность кожи и слизистых. Лимфоузлы (подчелюстные, шейные, подмышечные) увеличены до 1-2 см, плотноэластической консистенции, болезненные, не спаяны с окружающими тканями. Зев гиперемирован, отечен, явления фарингита, миндалины увеличены, рыхлые, умеренно гиперемированы, язык обложен бело-серым налетом, гиперемирован. В легких дыхание с жестким оттенком, рассеянные сухие хрипы на вдохе. Границы сердца: левая увеличена на 0,5 см влево от среднеключичной линии, тоны сердца сохранены, короткий систолический шум над верхушкой, ритм неправильный, экстрасистолия (5—7 в мин), ЧСС — 112 в мин, АД — 115/70 мм рт ст. Живот вздут, умеренно болезненный при пальпации в правом подреберье и по ходу толстой кишки. По данным УЗИ органов брюшной полости, незначительное увеличение размеров печени и — в несколько большей степени — селезенки.
Из лабораторных анализов обращали на себя внимание нормохромная анемия со снижением Hb до 80 г/л с анизоцитозом, пойкилоцитозом, полихроматофилией эритроцитов; ретикулоцитоз, нормальное содержание сывороточного железа (18,6 мкм/л), отрицательная реакция Кумбса. Кроме того, наблюдались лейкоцитоз, тромбоцитоз и моноцитоз с большим количеством атипичных мононуклеаров, ускорение СОЭ. В биохимических анализах крови отмечались умеренное повышение трансаминаз, КФК. ЭКГ: ритм синусовый, неправильный, предсердная и желудочковая экстрасистолия, ЧСС до 120 в минуту. Электрическая ось сердца отклонена влево. Нарушение внутрижелудочковой проводимости. Снижение вольтажа в стандартных отведениях, диффузные изменения миокарда, в грудных отведениях наблюдались изменения, характерные для гипоксии миокарда. Также был существенно нарушен иммунный статус — повышено содержание иммуноглобулина М (IgМ) и снижено иммуноглобулинов А и G (IgА и IgG), наблюдалось преобладание продукции низкоавидных, то есть функционально неполноценных антител, дисфункция Т-звена иммунитета, повышение уровня сывороточного ИФН, снижение способности к продукции ИФН в ответ на многие стимулы.
В крови были повышены титры IgG-антител к ранним и поздним вирусным антигенам (VCA, EA EBV). При вирусологическом исследовании (в динамике) методом полимеразной цепной реакции (ПЦР) в лейкоцитах периферической крови была обнаружена ДНК ВЭБ.
В эту и последующие госпитализации проводились углубленное ревматологическое обследование и онкологический поиск, были исключены также другие соматические и инфекционные заболевания.
Больной были поставлены следующие диагнозы: хроническая активная ВЭБ-инфекция, умеренная гепатоспленомегалия, очаговый миокардит, соматогенно обусловленная персистирующая депрессия; вирусассоциированный гемофагоцитарный синдром. Иммунодефицитное состояние; хронический фарингит, бронхит смешанной вирусно-бактериальной этиологии; хронический гастрит, энтерит, дисбиоз кишечной флоры.
Несмотря на проведенную беседу, от введения глюкокортикоидов и препаратов интерферона-альфа больная категорически отказалась. Было проведено лечение, включающее противовирусную терапию (виролекс внутривенно в течение недели, с переходом на зовиракс 800 мг 5 раз в день per os), иммунокорригирующую терапию (тимоген по схеме, циклоферон 500 мг по схеме, иммунофан по схеме), заместительную терапию (октагам по 2,5 г два раза внутривенно капельно), детоксикационные мероприятия (инфузии гемодеза, энтеросорбция), антиоксидантную терапию (токоферрол, аскорбиновая кислота), использовали препараты-метаболики (эссенциале, рибоксин), назначалась витаминотерапия (поливитамины с микроэлементами).
После проведенного лечения у больной нормализовалась температура, уменьшились слабость, потливость, улучшились некоторые показатели иммунного статуса. Однако полностью подавить репликацию вируса не удалось (ВЭБ продолжал определяться в лейкоцитах). Клиническая ремиссия продолжалась недолго — через полтора месяца наступило повторное обострение. При исследовании помимо признаков активации вирусной инфекции, анемии, ускорения СОЭ были выявлены высокие титры антител к сальмонелле. Проводилось амбулаторное лечение основного и сопутствующего заболевания. Тяжелое обострение началось в январе 1998 года после острого бронхита и фарингита. По данным лабораторных исследований, в этот период отмечались утяжеление анемии (до 76 г/л) и нарастание количества атипичных мононуклеаров в крови. Отмечалось нарастание гепатоспленомегалии, в мазке из зева найдены Chlamidia Trachomatis, золотистый стафилококк, стрептококк, в моче — Ureaplasma Urealiticum, в крови обнаружено существенное повышение титров антител к EBV, CMV, вирусу простого герпеса 1-го типа (HSV 1). Таким образом, у больной увеличивалось число сопутствующих инфекций, что также свидетельствовало о нарастании недостаточности иммунитета. Проводилась терапия индукторами интерферона, заместительная терапия Т-активаторами, антиоксидантами, метаболиками, длительная детоксикация. Заметный клинический и лабораторный эффект был достигнут к июню 1998 года, пациентке рекомендовано продолжить метаболическую, антиоксидантную, иммунозаместительную терапию (тимоген и др.). При повторном исследовании осенью 1998 года в слюне и лимфоцитах ВЭБ не определялся, хотя сохранялись умеренная анемия и иммунная дисфункция.
Таким образом, у больной И., 33 лет, острая ВЭБ-инфекция приняла хроническое течение, осложнилась развитием гемофагоцитарного синдрома. Несмотря на то что удалось достигнуть клинической ремиссии, больная нуждается в динамическом наблюдении с целью как контроля репликации ВЭБ, так и своевременной диагностики лимфопролиферативных процессов (учитывая высокий риск их развития).