Цитотоксическая терапия что это
Цитостатическая противоопухолевая терапия
Призвана воздействовать на те клетки в организме, которые делятся наиболее быстро. Прежде всего это относится к опухолевым клеткам. Химиопрепараты могут назначаться по одному (монотерапия) или в комбинации (полихимиотерапия).
Наиболее часто противоопухолевые цитостатики назначаются внутривенно или внутрь, однако в ряде случаев может потребоваться введение лекарств в спинномозговой канал, либо в плевральную или брюшную полости. Иногда эффективность внутривенного введения повышает длительность введения химиопрепарата (до 48 и даже 96 часов).
Как проводится химиотерапия
Практически всегда химиотерапия проводится курсами (циклами), предполагая перерыв для восстановления нормальных тканей и функций организма (помимо опухолевых клеток, в процессе лечения могут повреждаться другие активно делящиеся клетки – в первую очередь клетки крови, волосяных фолликулов, клетки слизистых оболочек.
В последние годы успехи молекулярной биологии позволили для лечения ряда злокачественных новообразований создать препараты так называемой таргетной, или направленной терапии, с конкретной мишенью приложения, отличающей опухолевую клетку от нормальной.
Препараты таргетной терапии
В большинстве случаев препараты таргетной терапии сочетаются с обычными цитостатиками, повышая эффективность лечения, но иногда используются самостоятельно. Наиболее часто мишенью служат рецепторы на поверхности клеток опухоли или питающих ее сосудов (так действуют моноклональные антитела и ингибиторы тирозин-киназ), но мишенью могут быть и последующие этамы передачи пролиферативного сигнала).
Значительное число опухолевых заболеваний лечится не только химиопрепаратами, но и гормонами. Как правило, гормональные препараты принимаются внутрь и лечение осуществляется длительно. Иногда гормональное лечение требует хирургических вмешательств с целью исключить влияние тех или иных гормонов, вырабатывающихся в организме (удаление яичников или яичек).
Реже для лечения злокачественных новообразований используется иммунотерапия (как правило, цитокины интерферон альфа или интерлейкин-2). Обычно эти препараты используются в случаях, когда ограничены возможности химио- и гормонотерапии.
Бисфосфонаты
В арсенале онкологов существует также группа препаратов, избирательно действующих на костную ткань – бисфосфонаты. Предохраняя кость от разрушения опухолью, эти лекарства уменьшают боль и снижают частоту осложнений (прежде всего патологических переломов).
Кроме того, в арсенале онкологов существует целый ряд препаратов поддерживающей терапии для предотвращения либо лечения осложнений, связанных с химиотерапией. Как правило, такое лечение не носит «универсального» характера и присоединяется к противоопухолевой терапии по мере развития осложнений.
Исключение представляет, главным образом, противорвотная (антиэметическая) терапия, назначаемая перед химиотерапией, исходя из данных о возможности тошноты и рвоты при каждой конкретной схеме лечения.
По мере исчерпания возможностей противоопухолевого лечения (а на поздних стадиях болезни это обычно химиотерапия) возрастает значение паллиативной помощи и симптоматического лекарственного лечения как ее компонента.
В настоящее время медицина располагает большим количеством препаратов, позволяющих эффективно бороться с наиболее мучительными симптомами опухолевой болезни, включая болевой.
Цитотоксическая терапия что это
Опухоль (новообразование) состоит из клеток, которые пролиферируют независимо от, образно выражаясь, врожденного «строительного плана» организма. При злокачественной опухоли (рак) опухолевая ткань прорастает в здоровые окружающие ткани, разрушая их, или отделившиеся опухолевые клетки образуют вторичные опухоли (метастазы) в других органах. Лечение требует удаления всех злокачественных клеток (радикальная терапия).
Если это невозможно, замедляют рост опухоли, что приводит к увеличению жизни пациента или улучшению качества жизни (паллиативная терапия). Химиотерапия осложнена тем, что злокачественные клетки являются эндогенными и почти не обладают специфическими метаболическими свойствами.
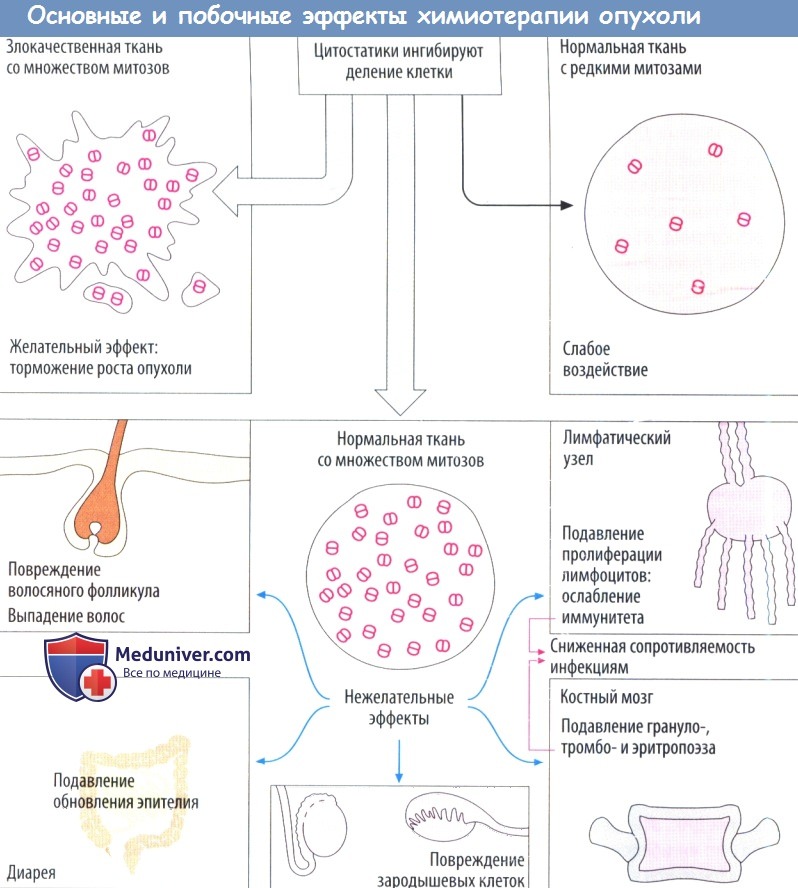
Цитостатики — это цитотоксические вещества, которые поражают в основном пролиферирующие или делящиеся (митотические) клетки. Повреждаются преимущественно быстро делящиеся злокачественные клетки. Нарушение митотических процессов не только замедляет рост опухоли, но и приводит к апоптозу (запрограммированная гибель клетки). Ткани с низкой скоростью митоза практические не поражаются, как и большинство здоровых тканей. Тем не менее это касается и злокачественных опухолей, состоящих из медленно дифференцирующихся клеток.
Цитостатическая терапия, несомненно, оказывает повреждающее действие на ткани с физиологически высокой частотой митозов. Следовательно, развиваются типичные побочные эффекты.
Выпадение волос происходит в результате повреждения волосяных фолликулов; расстройства со стороны ЖКТ, например диарея вследствие недостаточного восполнения энтероцитов, период жизни которыхограничен несколькими днями; тошнотой рвота в результате стимуляции хеморецепторов самого заднего поля ромбовидной ямки рвотного центра; снижение резистентности к инфекции в результате ослабления иммунной системы. Кроме того, цитостатики вызывают миелосупрессию. Восполнение клеток крови зависит от митотической активности стволовых и дочерних клеток костного мозга.
При остановке пролиферации миелоидного ростка в первую очередь поражаются гранулоциты с коротким периодом жизни (нейтропения), затем — тромбоциты крови (тромбопения) и, наконец, эритроциты с большим периодом жизни (анемия). Бесплодие вызвано подавлением сперматогенеза или созревания фолликула. Большинстве цитостатиков нарушает метаболизм ДНК. Это повышает риск повреждения генома здоровых клеток (мутагенный эффект). Возможно, с ним связано развитие лейкоза через несколько лет после цитостатической терапии (корциногенный эффект). Более того, весьма вероятно появление врожденных пороков развития при необходимости использовать цитостатики во время беременности (тератогенный эффект).
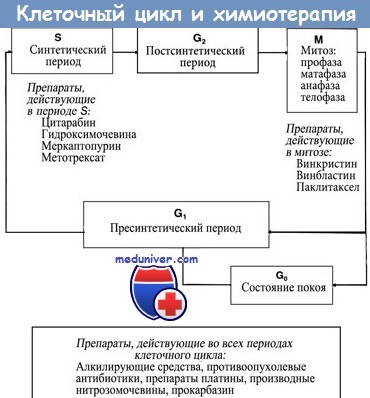
Цитостатики имеют разные механизмы действия:
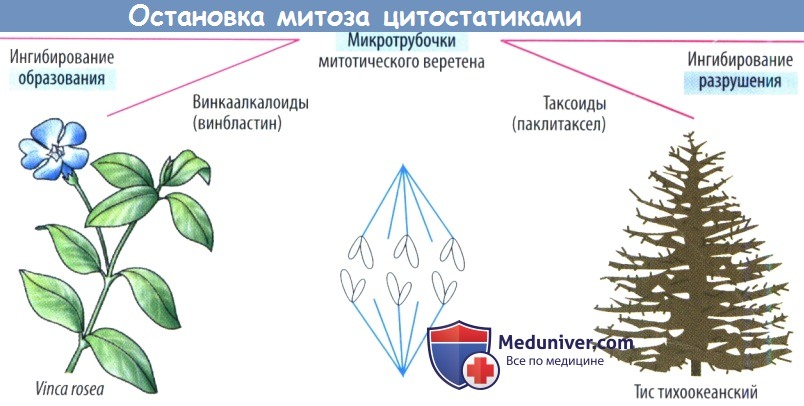
а) Повреждение митотического веретена. Сократительные белки веретенного аппарата разводят реплицированные хромосомы перед делением клетки. Данный процесс нарушают так называемые яды митотического веретена (см. также колхицин), которые останавливают митоз в метафазе за счет нарушения превращения микротрубочек в веретенные нити. Они состоят из белков α- и β-тубулина. Излишние трубочки отрезаются, давая возможность субъединицам тубулина рециркулировать.
Винка алкалоиды винкристин и винбластин (получаемые из барвинка розового, Vinca rosea) ингибируют полимеризацию субъединиц тубулина в микротрубочки. Повреждение нервной системы является ожидаемой нежелательной реакцией в результате нарушения управляемыми микротрубочками аксональных транспортных механизмов.
Паклитаксел, получаемый из коры тиса тихоокеанского (Taxus brevifolia), ингибирует расхождение микротрубочек и индуцирует образование атипичных микротрубочек, что препятствует повторному сбору тубулина в правильно функционирующие микротрубочки. Полусинтетическим производным является доцетаксел.
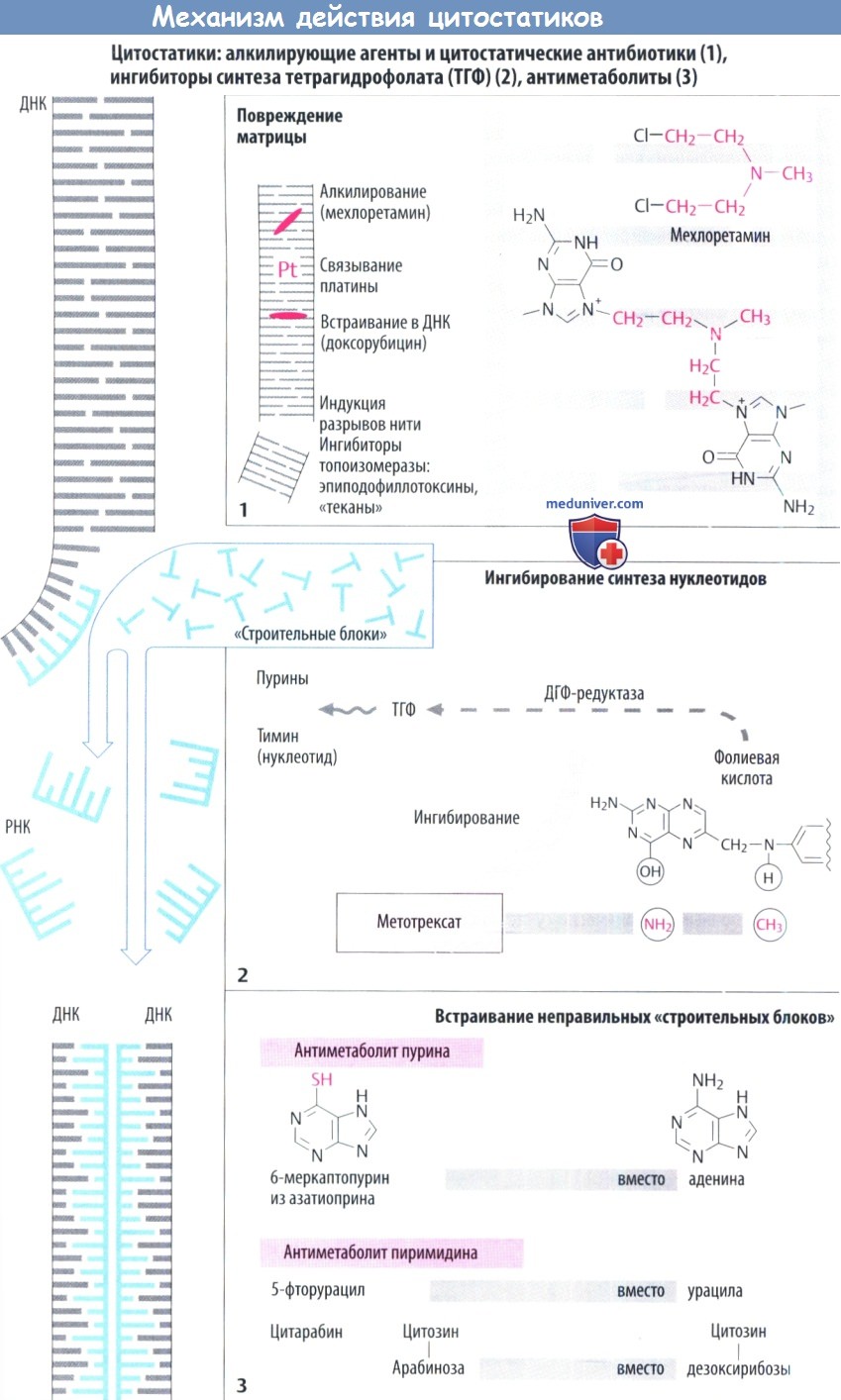
б) Ингибирование синтеза ДНК и РНК. Митозу предшествует репликация хромосом (синтез ДНК) и повышенный синтез белка (синтез РНК). Имеющаяся ДНК (серый цвет) служит в качестве матрицы для синтеза новой ДНК (голубой цвет) или РНК. Синтез новых нуклеиновых кислот ингибируется следующими механизмами.
в) Повреждение матрицы. Алкилирующие цитостатики являются реактивными веществами, которые переводят алкильные остатки на ДНК через ковалентную связь. Например, мехлоретамин (азотистый иприт) способен образовывать перекрестную связь между двумя цепями ДНК, отдавая атомы хлора. Правильное считывание генетической информации поэтому становится невозможным. Другими алкилирующими агентами являются хлорамбуцил, мелфалан, циклофосфамид, ифосфамид. ломустин, тиотепа, митомицин, прокарбазин, дакарбазин и темозоломид.
К специфическим нежелательным реакциям относятся необратимый фиброз легких у бусульфана и геморрагический цистит, вызванный метаболитом циклофосфамида акролеином (предупреждается месной, натрия 2-меркаптоэтансульфонатом). Платиносодержащие противоопухолевые средства (цисплатин, карбоплатин и оксалиплатин) высвобождают платину, которая связывается с ДНК.
г) Цитостатические антибиотики встраиваются в двунитевую ДНК, что приводит к разрыву нити (как у блеомицина). Антрациклиновые антибиотики даунорубицин и адриамицин (доксорубицин) вызывают кардиомиопатию. Кроме того, блеомицин вызывает фиброз легких. Эпирубицин и идарубицин разработаны с целью снижать кардиотоксичность. Трабектин, который тоже встраивается в двунитевую ДНК, не является антибиотиком; его получают из асцидии.
д) Разрыв нити вызывает ингибирование топоизомеразы. Эпиподофиллотоксины этопозид и тенопозид взаимодействуют с топоизомеразой II,в функции которой входят расщепление, перенос и вторичное закрытие нитей ДНК. Эти препараты вызывают разрыв нити за счет ингибирования повторного закрытия. «Теканы» топотекан и иринотекан являются производными камптотецина, получаемыми из фруктов китайского дерева (Camptotheca acuminata). Они ингибируют топоизомеразу I, которая вызывает разрыв однонитевой ДНК.
е) Ингибирование синтеза нуклеотидного основания. Тетрагидрофолиевая кислота (ТГФ) необходима для синтеза как пуриновых оснований, так и тимидина. ОбразованиеТГФ из фолиевой кислоты происходит при участии ДГФ-редуктазы. Аналог фолата метотрексат ингибирует активность фермента. Клеточные запасы ТГФ истощаются. Эффект этих антиметаболитов можно устранить путем введения фолиевой кислоты (5-формил-ТГФ, лейковорин, фолинат кальция).
Гидроксимочевина (гидроксикарбамид) ингибирует рибонуклеотидредуктазу, которая обычно превращает рибонуклеотиды в дезоксирибонуклеотиды, которые затем используются как «строительные блоки» ДНК.
ж) Встраивание ложных «строительных блоков». Неестественные нуклеотидные основания (6-меркаптопурин, 5-фторурацил) и патологические нуклеозиды с измененными сахарами (цитарабин, гемцитабин) измененным основанием (кладрибин) или с обоими измененными компонентами (флударабин, капецитабин) действуют как антиметаболиты. Они ингибируют синтез ДНК/РНК или вызывают синтез ложных нуклеиновых кислот.
6-меркаптопурины образуются в результате биотрансформации неактивного предшественника азатиоприна. Урикостатик аллопуринол ингибирует распад 6-меркаптопурина, поэтому при одновременном введении двух препаратов требуется снижение дозы последнего.
з) Комбинированная терапия. Цитостатики часто применяются по сложным терапевтическим схемам разработанным для улучшения эффективности и переносимости лечения.
и) Поддерживающая терапия. Химиотерапия рака поддерживается адъювантными препаратами. Следующие препараты используются против рвоты, вызванной цитостатиками:
1) дексаметазон в качестве основного препарата;
2) антагонист 5-НТ3 ондонсегрон (при ранней рвоте);
3) антагонист NK1-рецепторов апрепитант, который эффективен против поздней рвоты с началом более чем через 24 ч. При угнетении костного мозга используют гранулоцитарный и гранулоцитарно-макрофагальный колониестимулирующие факторы (филграстим и ленограстим). Поврежденную слизистую оболочку восстанавливают палифермином, рекомбинантным человеческим фактором роста кератиноцитов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цитотоксическая терапия что это
Цитотоксические вещества блокируют клеточный цикл. Все цитотоксические противоопухолевые лекарства препятствуют прохождению клетками клеточного цикла, приводя к синхронизации и замедлению пролиферации быстро размножающихся клеток. Результатом является снижение чувствительности к лекарствам в S-фазе.
Цитотоксичность пропорциональна общей лекарственной экспозиции. Фармакокинетика противоопухолевых лекарств — это сложный процесс, т.к. цитотоксичность для злокачественных клеток пропорциональна общей лекарственной экспозиции (площадь под кривой; ППК), а не концентрации препарата в плазме на пике. Сначала вещество должно проникнуть в отдельные злокачественные клетки, а затем взаимодействовать со своими молекулярными мишенями. Поскольку это взаимодействие часто обратимо, по крайней мере сначала, цитотоксическая концентрация должна сохраняться все это время.
Кроме того, число индивидуальных взаимодействий между лекарством и молекулами-мишенями, необходимое для киллинга одиночной клетки, может быть очень велико. Подсчитано, что для киллинга одной клетки с ее ДНК должен связаться как минимум 1 млн молекул цисплатина.
Комбинации противоопухолевых препаратов стали применять после того, как было обнаружено, что использование одного препарата не дает значительной ремиссии или не излечивает пациента (за исключением метотрексата при лечении хориокарциномы). Это явление объясняет гипотеза log-киллинга.
Лекарства, используемые для комбинированной терапии, должны обладать определенными свойствами:
• оказывать некоторый эффект при использовании в отдельности;
• вызывать преимущественно полный ответ (гибель всех клеток опухоли), а не частичный (гибель менее 50% клеток);
• биохимические механизмы действия препаратов должны быть разными для воздействия на опухоль, содержащую гетерогенную клеточную популяцию;
• препараты не должны обладать сходным побочным действием, т.к. в этом случае необходимо снижать их дозы, что приводит к утрате аддитивного эффекта комбинации.
По многим показателям различные опухоли являются гетерогенными, включая чувствительность к лекарственным веществам, в результате нестабильности их генетической конституции. Злокачественные клетки способны мутировать, что крайне важно для терапии, поскольку такие мутации могут привести к возникновению резистентности к лекарствам. В большинстве случаев такая резистентность определяется свойствами конкретного типа опухолей.
Клинически резистентность может стать очевидной, когда чувствительные клоны опухоли погибают, а резистентные выживают и становятся доминирующими. Излечимость пропорциональна числу злокачественных клеток, и, в соответствии с гипотезой Голди-Колдмана, существует более высокая вероятность мутации, приводящих к лекарственной резистентности, в более многочисленной клеточной популяции.
Лекарственная терапия
С помощью лекарств сегодня лечат большинство опухолей. Это самый универсальный и самый распространенный метод лечения рака в силу его особенностей:
Виды лекарственной терапии
С развитием нанотехнологий, молекулярной медицины и генной инженерии в портфеле онкологов появились множество новых противоопухолевых препаратов, лекарства стали более избирательными к злокачественным клеткам и менее токсичными для здоровых тканей и организма в целом. Появились прицельные лекарства, так называемые таргетированные, молекулы которых воздействуют более избирательно на клетки рака.
Все лекарства против рака по механизму действия делят на цитостатические и цитотоксические. Первые, цитостатические, тормозят размножение злокачественных клеток и вызывают их апоптоз, или программу самоуничтожения, клеточный распад. Вторые, цитотоксические, препараты вызывают гибель клеток вследствие их интоксикации, разрушения оболочки и ядра клетки, других структур, и в конечном итоге некроз опухоли.
Учитывая разные механизмы действия, в большинстве случаев онкологи подбирают комбинацию из двух-трех препаратов разных фармакологических групп.
К лекарственному лечению онкологических заболеваний относят:
Лекарственное лечение обычно проводится курсами. Курс включает время введения препарата (от 1 до 5 дней для внутривенных препаратов, может быть дольше для таблетированных препаратов) и время перерыва для восстановления организма и снижения риска побочных эффектов лечения. Перед началом каждого нового курса обычно производится контроль анализов крови и консультация врача онколога для решения вопроса о необходимости корректировки доз препаратов и/или увеличения интервала до следующего введения препарата.
Для длительного лекарственного лечения есть понятие «линий» лечения. «Линия» лечения – последовательное назначение одинаковых курсов химио- (или других видов) терапии. «Линия» лечения проводится до достижения необходимого эффекта или до момента потери чувствительности со стороны болезни. Если опухоль продолжила расти на фоне одной схемы химиотерапии – производится смена лекарств. Продолжение лечения с использованием новой схемы химиотерапии называется «Второй (третьей, четвёртой и т.д.) линией» лечения.
Химиотерапия
Химиотерапия – наиболее распространённый вид лекарственной терапии. Химиотерапия бывает:
1. Лечебной – когда химиотерапия является основным методом лечения заболевания. Например, для многих пациентов с лейкозами, лимфомами, герминогенными опухолями яичка химиотерапия может быть основным методом лечения, который часто приводит к выздоровлению. Для большинства пациентов с распространёнными формами рака, с метастазами в различные органы, химиотерапия является основным методом лечения, дающим максимальную возможность длительно сдерживать болезнь.
2. Неоадъювантной – когда химиотерапия предшествует основному методу лечения. Чаще всего такая химиотерапия назначается перед некоторыми видами операций, с целью уменьшения опухоли и снижения активности её клеток.
3. Адъювантной – её ещё называют «профилактической». Она назначается после основного метода лечения, чаще всего после операции, с целью снижения риска возврата болезни.
Гормональная терапия
Показана только для гормоночувствительных видов рака. Будет ли опухоль реагировать на лечение гормонами или нет, определят с помощью специальных анализов и лабораторных исследований клеточного материала, взятого из опухоли.
Опухоли, реагирующие на гормоны, часто обнаруживают в репродуктивной системе и железах внутренней секреции, например, это:
На поздних неоперабельных стадиях опухолей, чувствительных к данному лечению, гормональная терапия может использоваться в качестве основного лечения. Как паллиативное лечение некоторых видов рака она достаточно эффективна и может продлить жизнь пациента на 3-5 лет.
Иммунотерапия
Иммунитет играет важную роль в профилактике и борьбе с раком. В норме иммунные тельца распознают атипичную клетку и убивают ее, защищая организм от развития опухоли. Но когда иммунитет нарушается в силу разных причин, и раковых клеток становится много, тогда опухоль начинает расти.
Иммунотерапия при раке помогает организму справится с заболеванием за счет активизации защитных ресурсов и не допустить развития повторных опухолей и метастазов. В онкологии используют интерфероны, вакцины от рака, интерлейкины, колониестимулирующие факторы и другие иммунные препараты.
Лечение подбирает иммунолог на основе лабораторных данных о состоянии иммунной системы онкопациента совместно с лечащим врачом-онкологом и другими специалистами, участвующими в лечении конкретного пациента.
Основные механизмы иммунотерапии:
Таргетная терапия
Таргетные лекарства очень специфичны и разрабатываются под конкретный мутировавший ген раковой клетки данного вида опухоли. Поэтому до таргетного лечения обязательно проводят генетическое исследование материала, взятого на биопсию.
Например, разработаны эффективные таргетные препараты для лечения различных генетических форм рака молочной железы, множественной миеломы, лимфомы, рака предстательной железы, меланомы.
В силу своей специфики и целевого попадания на раковую клетку-мишень таргетные препараты более эффективны для лечения опухолей, чем например, классические противоопухолевые. И менее вредны для нормальных клеток, не обладающими характеристиками опухолевых. Многие таргетные методы относят к иммунотерапии, так как по сути они формируют нужный иммунный ответ.
Фотодинамическая терапия
Осуществляется препаратами, воздействуя световым потоком определённой длины волны на раковые клетки и разрушая их.
Побочные эффекты лекарственного лечения рака
Выраженные осложнения наблюдаются далеко не у всех пациентов, но риск их возрастает с увеличением продолжительности лечения.
Часто встречаются следующие побочные эффекты после проведения лекарственной терапии:
Большинство осложнений поддаётся корректировке, при правильном проведении лечения многие из них можно предотвратить или остановить при первом проявлении. Тяжёлые осложнения могут быть причиной увеличения интервалов между курсами химиотерапии.
Эффективность
Чем раньше обнаружен рак и точнее диагностирован тип опухолевых клеток, тем успешнее лечение рака и благоприятнее прогноз выздоровления. Поэтому следует постоянно следить за состоянием своего здоровья, проходить диагностические исследования согласно возрасту, не закрывать глаза на недомогание или периодический дискомфорт в теле. Также лучше не тратить время на попытки вылечиться самостоятельно или при помощи нетрадиционной медицины, не имеющей никаких убедительных данных об эффективности, игнорируя современные методы медицинского лечения. Так можно только запустить онкологический процесс, усугубить стадию заболевания и затруднить последующее лечение. Не теряйте драгоценное время, обследуйтесь в специализированных центрах на современном оборудовании у высококвалифицированных врачей.
Эндокринотерапия рака молочной железы
Отделение онкологии, реконструктивной и пластической хирургии
Гормональная или антиэсторгеновая или эндокринотерапия – это эффективный метод лечения рака молочной железы. Терапия гормональными препаратами направлена на предотвращение воздействия полового гормона эстрогена на раковые клетки. Гормональная терапия применяется в случае, если раковая клетка имеет на своей поверхности специфические рецепторы, чувствительные к данным препаратам.
Эстроген и прогестерон – это женские половые гормоны. Находясь в крови, гормоны циркулируют по всему организму, оказывая воздействие на органы и ткани. Наиболее подвержены такому влиянию половые органы и молочные железы. При этом гормон определяет свои мишени с помощью рецепторов. Рецепторы представляют собой высокомолекулярные соединения. Молекулы гормонов действуют на эти рецепторы соединяясь с ними, как ключ, входящий в замочную скважину. Таким образом, для каждого гормона имеются свои рецепторы на поверхности тех клеток, на которые этот гормон должен оказывать эффект. Большинство (85 %) раковых опухолей молочной железы являются гормонально-зависимыми, то есть эстроген и прогестерон обладают стимулирующим эффектом на такие опухоли. Если прервать доставку гормонов к раковой клетке, происходит ее постепенная гибель и уменьшение опухоли в размерах.
Для определения чувствительности к гормональной терапии выполняется гистологическое исследование с иммуногистохимией. При проведении такого анализа определяются:
ER – рецепторы эстрогена
PR – рецепторы прогестерона
Ki 67 – маркер пролиферативной активности.
В некоторых случаях, раковые клетки не имеют на своей поверхности рецепторы эстрогена и прогестерона. Такой тип опухоли является гормонально – негативным и не чувствительным к антиэстогенной терапии.
Препараты гормональной терапии применяются не только для лечения первично выявленного заболевания, но и при рецидивных опухолях или выявленных метастазах рака молочной железы. Эндокринотерапия рака молочной железы принципиально отличается от заместительной гормональной терапии при менопаузе.
Наиболее распространенным препаратом гормональной терапии рака молочной железы является Тамоксифен. Он успешно применяется для лечения пациенток любых возрастных групп. Для молодых женщин с сохраненной менструальной функцией, в большинстве случаев, Тамоксифен назначается без подавления работы яичников (овариальная супрессия). Однако многочисленные клинические исследования, завершенные к 2005 году заявили об открытии новых эффективных препаратов гормональной терапии рака – ингибиторов ароматаз, которые показали более высокую эффективность при лечении пациенток в постменопаузе. В настоящее время ингибиторы ароматаз являются стандартом в лечении гормонально-позитивного рака у пациенток в постменопаузе. В то же время Тамоксифен остается препаратом выбора.
Эндокринная терапия рака молочной железы позволяет держать рак «под контролем», после проведенного комплексного лечения. Препараты назначаются строго индивидуально и подбираются врачом онкологом или химиотерапевтом. Во время приема гормональной терапии, пациенты проходят обязательные осмотры и обследование каждые 6 месяцев. Терапия назначается на длительный срок – не менее 5 лет и может быть изменена по показаниям.