Цитомегаловирус что при беременности
Данная страница не существует!
Услуги инфекционной клиники
Диагностика, профилактика и лечение
Фиброэластометрия и УЗ-диагностика молочных желез, щитовидной железы, мошонки, брюшной полости
Биохимия. Анализ крови: общий, клинический. Анализы на витамины, микроэлементы и электролиты. Анализ на ВИЧ-инфекцию, вирусные гепатиты, бактерии, грибки и паразиты
Максимально точное определение выраженности фиброза печени неинвазивным методом при помощи аппарата FibroScan 502 TOUCH
Гинеколог в H-Сlinic решает широчайший спектр задач в области женского здоровья. Это специалист, которому вы можете полностью доверять
Дерматовенерология в H-Сlinic — это самые современные и эффективные алгоритмы диагностики и лечения заболеваний, передающихся половым путем, грибковых и вирусных поражений, а также удаление доброкачественных невусов, бородавок, кондилом и папиллом
Возможности вакцинопрофилактики гораздо шире Национального календаря прививок. H-Clinic предлагает разработку плана вакцинации и современные высококачественные вакцины в наличии
Терапевт в H-Сlinic эффективно решает задачи по лечению заболеваний, которые зачастую могут становиться большой проблемой при наличии хронического инфекционного заболевания
Врач-кардиолог H-Сlinic проведет комплексную диагностику сердечно-сосудистой системы и при необходимости назначит эффективное терапию. Сердечно-сосудистые проблемы при инфекционных заболеваниях, требуют специфичных подходов, которые мы в состоянии обеспечить
Наша цель — новое качество вашей жизни. Мы используем современные диагностические алгоритмы и строго следуем наиболее эффективным протоколам лечения.
Общая терапия, Инфекционные заболевания, Гастроэнтерология, Дерматовенерология, Гинекология, Вакцинация, УЗИ и фиброэластометрия, Кардиология, Неврология
Биохимия, Общий/клинический анализ крови, Витамины и микроэлементы/электролиты крови, ВИЧ-инфекция, Вирусные гепатиты, Другие инфекции, бактерии, грибки и паразиты, Комплексы и пакеты анализов со скидкой
В наличии и под заказ качественные бюджетные решения и препараты лидер ов рынка лечения инфекционных болезней. Аптека H-Clinic готова гибко реагировать на запросы наших клиентов. Мы поможем с оперативным поиском препаратов, которые обычно отсутствуют в сетях.
Что такое инфекция цитомегаловирусная? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
Цитомегаловирусная болезнь (ЦМВИ, цитомегалия, вирусная болезнь слюнных желёз, болезнь с включениями) — это общее системное инфекционное заболевание, вызываемое вирусом семейства герпесов V типа — цитомегаловирусом, который специфически поражает лейкоциты и клетки различных органов (слюнных желёз, почек, лёгких, печени, головного мозга и другие).
Клинически характеризуется многообразием проявлений — от бессимптомного течения до генерализованных (распространённых) форм с поражением внутренних органов и центральной нервной системы, а также пожизненного пребывания в организме.
Этиология
Вид — Cytomegalovirus hominis (открыт в 1956 году)
Является древним человеческим вирусом (предположительно с Кембрийского периода), который в ассоциации с другими герпесвирусами оказал значительное влияние на формирование иммунитета современного человека.
Внутривидовая структура неоднородна. Известно о трёх штаммах вируса: Davis, АД 169, Kerr и Towne. Они могут иметь различия в тропизме к тканям человека, различаться по степени вирулентности и патогенности.
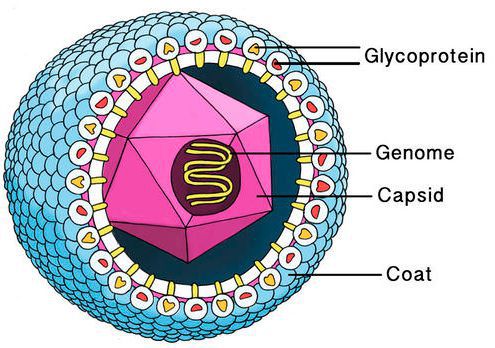
Цитомегаловирус имеет внешнюю гликопротеиновую оболочку, в составе которой есть B и H звенья — к ним формируются антитела. Представляет собой двухцепочечный ДНК-содержащий крупный вирус с диаметром нуклеокпсида до 180 нм.
Вирус способен поражать практически любую ткань человеческого организма, т.е. обладает политропностью. При развитии в ядрах инфицированных клеток образует включения (незрелые вирионы), описываемые как «глаз совы».
Вызывает цитомегалию (увеличение) клеток, не приводя к их гибели. Способен при активном течении значительно снижать иммунитет. Возможна трансплацентарная передача вируса с развитием врождённой инфекции.
Культивируется на культуре фибробластов (клеток соединительной ткани) человека. Изменения хромосомного набора клеток не вызывает. Очень чувствительны к ЦМВ клетки плода и новорождённого.
Малоустойчив в окружающей среде, быстро погибает при повышении температуры до 56°С и действии дезинфицирующих средств, теряет заражающие свойства при замораживании. В условиях комнатной температуры способен сохраняться в течение нескольких дней. [1] [3] [4] [8]
Эпидемиология
Антропоноз. Источник инфекции — только человек (больной различными формами и носитель), причём выделение вируса возможно в течение всей жизни человека и зависит от его индивидуальных иммунологических особенностей. Возможно заражение различными штаммами ЦМВ, роль этого в изменении патологии и клинической картине пока не выяснена.
Как передаётся цитомегаловирус
Механизмы передачи вируса:
Факторами передачи вируса выступают слюна (преимущественно), моча, кровь, вагинальный секрет, слёзы, сперма, фекалии, грудное молоко.
Восприимчивость среди населения высокая, наибольшее количество заражённых выявляется в детском и подростковом возрасте, когда происходит повышение контактных взаимодействий между людьми. Во взрослом состоянии ЦМВ инфицировано до 95% населения планеты, которые являются пожизненными носителями вируса. [1] [2] [3] [8]
Симптомы цитомегаловирусной инфекции
Инкубационный период — от 15 дней до трёх месяцев (при манифестной, т. е. явно выраженной форме).
Врождённая форма цитомегаловирусной инфекции
Цитомегаловирусную инфекцию выявляют примерно у одного из 200 рождённых детей, каждый пятый из них имеет или будет иметь проблемы со здоровьем. Сразу после рождения выявляются низкая масса тела, увеличение печени и селезёнки, желтуха, увеличение всех групп лимфоузлов, высыпания геморрагического характера, различные органные поражения, резкие изменения гемограммы и функциональных тестов. В крови, слюне и моче выявляется вирусная ДНК (в ряде случаев выделение вируса продолжается на протяжении нескольких лет).
Прогноз серьёзен и зависит от тяжести поражения и объёма проводимых лечебных мероприятий. В более поздние сроки инфицирования беременной вероятность тяжёлых проявлений заболевания существенно ниже, и новорождённые, как правило, не имеют симптомов врождённой ЦМВ-инфекции на начальных этапах после родов, однако это не говорит о полном клиническом благополучии в будущем — возможно поражение нервной системы различной степени выраженности и нейросенсорная тугоухость. Поэтому такие дети нуждаются в обследовании и наблюдении профильных специалистов, а при необходимости — в лечении. [1] [2] [3] [5] [8] [10]
Приобретённая форма цитомегаловирусной инфекции
При приобретённых формах заболевание чаще всего протекает в детском или подростковом возрастах. В эти периоды отмечается наибольшая лабильность иммунной системы (имеет значение при группе «детских инфекций»).
Чаще всего первичное инфицирование протекает или бессимптомно, или по типу ОРЗ нетяжёлого течения. Наблюдаются лёгкая слабость, субфебрилитет (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение лимфатических узлов шеи, увеличение и болезненность слюнных желёз.
Зачастую такие проявления не вызывают настороженности в плане ЦМВ и самостоятельно купируются в течение 1-2 недель — болезнь переходит в стадию латентного течения (носительство).
При инфицировании в более позднем возрасте (взрослые люди), а также у некоторых детей (с нарушением иммунитета) и ослабленных больных заболевание, как правило, протекает с явными морфофункциональными нарушениями и гораздо тяжелее, чем у первой группы лиц. Наблюдается:
Синдром тонзиллита не характерен. Увеличивается печень и селезёнка, значимо изменяются показатели гемограммы и функциональных печёночных проб.
В зависимости от состояния иммунной системы и возможностей её коррекции клинически значимая первичная инфекция у данной группы людей продолжается в течение 1-3 месяцев и, как правило, завершается победой организма над вирусной экспансией с последующим формированием вирусоносительства без каких-либо явных клинических проявлений.
В некоторых случаях (ВИЧ-инфекция, онкологические заболевания, длительный приём цитостатических препаратов, генетические дефекты иммунной системы) может наблюдаться длительное волнообразное течение первичной инфекции или реактивация (обострение) имеющегося носительства вируса (латентной формы). В этом случае отмечается:
Мононуклеозоподобный синдром
При выраженной форме болезни может развиться мононуклеозоподобный синдром — слабость, субфебрильная температура (37,1—38,0 °C), увеличение и чувствительность лимфоузлов, увеличение печени и селезёнки, изменения крови вирусного характера.
Симптомы цитомегаловируса у мужчин и женщин
Цитомегаловирусная инфекция поражает людей всех возрастов и полов. Принципиальных отличий в симптомах у мужчин и женщин нет, за исключением поражения половых органов.
Цитомегаловирусная инфекция у беременных
У беременных первичная инфекция может протекать бессимптомно или с ограниченными клиническими проявлениями (чаще всего). При заражении ребёнка (плода) до родов в зависимости от сроков первичного инфицирования женщины (иногда истинной реактивации ЦМВ при СПИДе) возможно развитие врождённой цитомегаловирусной инфекции.
Риск внутриутробной передачи — до 90% от всех случаев инфицирования на любом сроке беременности.
При заражении в ранние сроки беременности высок риск самопроизвольного выкидыша, мертворождения или рождения детей с явными пороками развития (патологии лёгких, головного мозга, почек, сердца, сосудов, органа слуха, психоневрологическими нарушениями).
Интересной особенностью является влияние возраста беременной, на котором произошло первичное инфицирование, на частоту передачи инфекции: у женщин до 20 лет риск передачи в три раза выше и не зависит от сроков беременности, а после 20 лет риск внутриутробного инфицирования существенно ниже
Симптомы хронической цитомегаловирусной инфекции
Болезнь становится хронической, если вирус долго находится в организме и иммунная система не может ему противостоять. Характерны длительная субфебрильная температура (37,1—38,0 °C) и слабость. Может увеличиться печень, лимфоузлы (чаще нескольких разных групп), иногда селезёнка, возникает поражение глаз и миокардит.
Цитомегаловирусная инфекция у людей с нормальным иммунитетом
Заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека, т.е. иммунная система среднестатистического жителя планеты способна самостоятельно найти достойный выход из ситуации.
Цитомегаловирусная инфекция при СПИДе
При СПИДе болезнь протекает крайне тяжело — может развиться генерализованная форма инфекции, т. е. поражаются различные органы:
Прогноз часто неблагоприятен. Генерализованная форма цитомегаловирусной инфекции может также развиваться у пациентов с ослабленным иммунитетом и младенцев.
Патогенез цитомегаловирусной инфекции
Входные ворота — слизистая оболочка различных органов, преимущественно ротоглотки и верхних дыхательных путей (также желудочно-кишечного тракта, мочеполовой системы и других органов).
В месте внедрения никаких структурных и воспалительных изменений не наблюдается. После проникновения вируса в организм он атакует свои главные мишени — лимфо- и моноциты, эпителиальные клетки слюнных желёз, лёгких, почек и других органов.
Поражённые клетки увеличиваются в размерах в 3-4 раза (цитомегалия), в ядре клетки формируются включения (незрелые вирионы), в результате чего клетка приобретает вид «совиного глаза». При активном течении болезни развивается депрессия большинства звеньев иммунитета, в том чичле и белка ИНФ-α.
В дальнейшем в ответ на проникновение ЦМВ развивается защитная реакция в виде образования специфических антител различных классов, активации Т-киллеров и развития реакций гиперчувствительности замедленного типа, проявляющейся в поражённых органах образованием узелковых лимфомоноцитарных инфильтратов.
Однако инфицированные клетки не погибают, а продолжают функционировать и выделяют специальный слизисто-белковый секрет, который, обволакивая вирионы, обеспечивает маскировку вируса от иммунной системы человека. Это выражается в слабом иммунном ответе и переходу острого заболевания в длительный латентный процесс (носительство).
При слабой репликации и равновесных отношениях с иммунитетом вирус может длительно (пожизненно) сохранятся в организме в состоянии относительной стабильности, не вызывать никаких органных поражений и не причинять никаких неудобств человеку. Вирусную ДНК при таком состоянии в крови выявить не удаётся, однако в эпителии слюнных желёз и моче вирус можно обнаружить (обычно в незначительном количестве).
При значительном снижении иммунитета (ВИЧ, онкологические заболевания, пересадка органов, длительный приём цитостатиков) происходит активизация вирусной репликации, вирус попадает в кровь и вновь атакует различные органы. [1] [3] [10]
Классификация и стадии развития цитомегаловирусной инфекции
Общепринятой классификации не существует, она разнится в зависимости от особенностей медицинского подхода к проблематике заболевания.
Классификация по клинической форме:
1. Приобретённая ЦМВ:
○ генерализованная (мононуклеозоподобная, лёгочная, церебральная и почечная, печёночный гепатит, с поражением ЖКТ, комбинированного вида);
Отдельно выделяют цитомегаловирусную болезнь у ВИЧ-инфицированных.
Классификация по МКБ-10:
Классификация по степени тяжести:
Осложнения цитомегаловирусной инфекции
Осложнения при цитомегалии бывают специфическими неспецифическими.
Специфические осложнения:
Неспецифические осложнения обусловлены наслоением вторичной бактериальной флоры. Это гнойные осложнения — повышение температуры тела до 41°С, соответствующие симптомы поражения определенных органов, нейтрофильный лейкоцитоз. [1] [3] [9] [10]
Диагностика цитомегаловирусной инфекции
Лабораторная диагностика:
Также проводится инструментальная диагностика:
Дифференциальная диагностика:
Лечение цитомегаловирусной инфекции
Лечение бессимптомной цитомегаловирусной инфекции
Бессимптомные носители цитомегаловирусной инфекции, как правило, не нуждаются в лечении. Исключением могут быть пациенты, которые получают сильную терапию, выраженно угнетающую иммунную систему. В таком случае может возникнуть опасное обострение инфекции, т. е. лечение проводится для профилактики.
Лечение цитомегаловирусной инфекции лёгкой степени тяжести
Лечения проводится в амбулаторных условиях. Важно отметить, что заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека. Это определяет основную лечебно-диагностическую тактику при выявлении активной (острой) ЦМВ-инфекции (при отсутствии тяжёлого течения и осложнений) — это здоровое питание, полноценный отдых и динамическое наблюдение. Лишь в случаях упорного течения и выраженных отклонений клинико-лабораторного характера следует подключать средства медикаментозного лечения.
Лечение средней и тяжёлой формы цитомегаловирусной инфекции
Больные средней тяжести, тяжёлые пациенты и дети неонатального возраста подлежат стационарному обследованию, наблюдению и лечению.
Принципы лечения цитомегаловируса должны отвечать следующим требованиям:
Медикаментозное лечение
С учётом индивидуальных особенностей проводится этиотропная терапия, направленная на ослабление вируса, прекращение его генерализованной циркуляции (персистенции) и патогенного потенциала.
В зависимости от условий могут применяться специфические цитомегаловирусные иммуноглобулины, специфические противовирусные препараты прямого противоцитомегаловирусного действия (в основном в условиях реанимации и интенсивной терапии).
В целях повышения сопротивляемости организма показано назначение средств иммунокоррекции и иммунотерапии, патогенетическое и симптоматическое лекарственное обеспечение.
Диета
Питание больных осуществляется согласно тяжести заболевания, проявлениям и возрастному фону. В общем показана диета №5 по Певзнеру с отказом от жирной, жареной, острой и раздражающей пищи, механически и химически щадящие питание.
Диспансерное наблюдение
После выписки за переболевшими устанавливается диспансерное наблюдение в течении 6-12 месяцев с периодическими осмотрами профильных специалистов и обследованием, объём и кратность которого определяется лечащим врачом. [1] [2] [5] [8] [10]
Прогноз. Профилактика
Прогноз, как правило, благоприятный (переход в неактивное носительство).
Специальной профилактики заражения не существует.
В очаге заболевания противоэпидемические мероприятия не проводятся, карантина нет.
После клинического выздоровления дети допускаются в коллективы без ограничительных мероприятий.
В целях выявления источников повышенной опасности ЦМВ проводятся обследования донорам крови, органов и тканей, а также беременным женщинам. Если беременная не имеет специфических антител IgG к ЦМВ, за ней следует установить более тщательное наблюдение с трёхкратным обследованием на ЦМВ за время беременности. В это время ей следует по возможности минимизировать общение с детьми, не пользоваться чужой посудой и не целоваться с новыми людьми.
Рекомендовано назначение профилактического лечения больным СПИДом и после трансплантации органов препаратами прямого противовирусного действия.
Вакцина для предотвращения врождённого ЦМВ находится в стадии разработки. [1] [2] [9]
Диагностика и лечение цитомегаловирусной инфекции у беременных и новорожденных
Цитомегаловирусная инфекция (ЦМВИ) — частая причина тяжелой внутриутробной патологии, заболеваний новорожденных, детей раннего возраста, формирования задержки психомоторного развития, когнитивных нарушений, выраженного снижения слуха у детей более старшего возраста.
В обзорной представлены частота, клинические данные, алгоритмы диагностики антенатальной и интранатальной ЦМВИ, тактика ведения беременных и новорожденных с активной формой инфекции. Представлены для назначения и тактика применения антицитомегаловирусного иммуноглобулина для введения у беременных и новорожденных, ганцикловира и валганцикловира в суспензии у и детей раннего возраста.
Известно, что не менее 10% патологий беременности имеет инфекционную природу; около 10% детей с врожденной ЦМВИ развивают клинически выраженное заболевание с формированием в большинстве случаев поздних осложнений, чаще со стороны центральной нервной системы (ЦНС); в среднем 10% детей с антенатальным заражением ЦМВ и бессимптомным течением болезни имеют неврологические последствия перенесенной инфекции. При этом лишь у 10% врожденных пневмоний устанавливается этиология.
Безусловно, ЦМВИ вносит существенный вклад в патологию плода и новорожденного ребенка. Четкие, отвечающие современным представлениям действия врача по раннему выявлению первичного заражения цитомегаловирусом или наличию его активной репликации, обоснованное и своевременное назначение терапии беременной, новорожденному не только раскроют клиническое значение ЦМВИ и закрепят на практике алгоритм необходимых диагностических и лечебных мероприятий, но у многих детей сохранят жизнь и ее нормальное качество.
Около 73–98% взрослого населения нашей страны имеют антитела класса IgG к ЦМВ. Наличие в крови специфических антител в абсолютном большинстве случаев означает присутствие в организме самого вируса. ЦМВИ — классическая врожденная инфекция, частота ее составляет 0,2–2,5% среди всех родившихся младенцев. В США с населением 315 млн человек ежегодно рождаются 20–40 тыс. детей. Убедительные статистические данные по нашей стране отсутствуют. Источником внутриутробного инфицирования является мать, у которой развивается активная ЦМВИ вследствие первичного или повторного заражения вирусом, его реактивации на фоне иммунологической дисфункции, гормональных изменений. Характерен трансплацентарный гематогенный путь заражения плода.
Наибольший риск для плода представляет первичная инфекция на ранних сроках беременности. В среднем у 2% (0,7–4%) женщин во время беременности происходит первичное заражение ЦМВ с частотой передачи вируса плоду 35–40% (от 24 до 75%). Исследование 248 случаев первичной материнской ЦМВИ и заражения плода показало, что риск антенатальной передачи вируса от матери ребенку составил 17% в случае острой ЦМВИ от 1 до 10 нед до наступления беременности, 35% — при заражении матери на неделях беременности и 30, 38 и 72% случаев при развитии острой ЦМВИ в I, II и III триместрах соответственно. Ряд исследований показывает, что риск инфицирования плода сохраняется даже при заражении вирусом за 6 мес до наступления беременности. При реинфекции (повторном заражении ЦМВ) или реактивации латентного вируса частота его передачи плоду существенно меньше: от 0,2–2,2 до 20% случаев. В то же время вторичная инфекция (прежде всего за счет реинфекции, возможно, иным штаммом вируса) может обусловливать значительное количество случаев внутриутробной ЦМВИ.
Наличие ЦМВ в генитальном тракте у беременных — причина заражения ребенка во время родов. Частота обнаружения ЦМВ в цервикальном канале, вагинальном секрете здоровых беременных составляет от 2–8 до 18–20%. С увеличением срока беременности вероятность обнаружения вируса в вагинальном содержимом возрастает. Обследование нами беременных выявило ДНК ЦМВ в материалах соскобов из цервикального канала в 33,3% случаев. Риск интранатального инфицирования ребенка при наличии вируса в генитальном тракте материсоставляет, по мнению S. Stagno (1995), 50–57%.
Основной путь заражения ребенка в возрасте до года — передача вируса через грудное молоко. ДНК ЦМВ обнаруживают в молоке до 60% серопозитивных матерей. ЦМВ выделяется с грудным молоком в первые 2–12 недлактации. Дети серопозитивных матерей, находящиеся на грудном вскармливании более 1 мес, становятся инфицированными в 40–76% случаев. Крайне опасно заражение новорожденного ЦМВ при переливании крови от серопозитивного донора, которая не прошла соответствующую обработку. Кровь около 1% доноров содержит ДНК ЦМВ. Следовательно, до 2–3% среди всех новорожденных заражаются ЦМВ в период внутриутробного развития, 4–5% — интранатально; к первому году жизни количество инфицированных детей составляет от 10 до 60%.
При врожденной ЦМВИ характер поражения плода зависит от срока его заражения. При первичном инфицировании ЦМВ матери в первые 20 нед беременности прогноз для жизни или нормального развития плода особенно неблагоприятен. Заражение в ранние сроки беременности может привести к самопроизвольному выкидышу, внутриутробной гибели плода, мертворождению, грубым врожденным порокам, таким как анэнцефалия, микро-, гидро-, порэнцефалия, гипоплазия легких, нарушение строения бронхиального дерева и легочных сосудов, гипоплазия внутрипеченочных желчных протоков, атрезия пищевода, аномалии строения почек, рубцовые стенозы мочевыводящих путей, дефекты межпредсердной и межжелудочковой перегородок, фиброэластоз миокарда, сужение аорты, микрофтальмия, дефект строения внутренней глазной камеры, гипопластическая дисплазия тимуса. Врожденные пороки развития в большинстве случаев несовместимы с жизнью.
При заражении ЦМВ в более поздние сроки беременности формирования пороков развития не происходит, но возможна тяжелая патология различных органов ребенка вследствие действия вируса. Антенатальное инфицирование предполагают при возникновении клинически выраженного заболевания в период от момента рождения до нескольких недель жизни ребенка. Манифестная форма болезни развивается у 5–30% антенатально инфицированных новорожденных. Для врожденной ЦМВИ характерны спленомегалия, реже гепатомегалия, стойкая желтуха (20–25% случаев), петехиальная сыпь. Младенцы, инфицированные ЦМВ в период внутриутробного развития, часто рождаются недоношенными, с синдромом задержки роста плода (низкая и экстремально низкая масса тела), с гестационным возрастом менее 32 нед, признаками внутриутробной гипоксии, низкой оценкой состояния по шкале Апгар. Антенатальная ЦМВИ, наряду с краснухой, ассоциирована с тяжелой задержкой внутриутробного развития плода (до 60% случаев). синдром (обильная петехиальная и/или геморрагическая сыпь) обусловлен как выраженной тромбоцитопенией, так и вирусным повреждением сосудов кожи. ЦМВИ — одна из причин конъюгированной гипербилирубинемии. При лабораторных исследованиях отмечают повышение активности аланинаминотрансферазы (>80 ед./л), выраженную тромбоцитопению (15–20% случаев), повышение концентрации связанного билирубина в крови (>25,7–34,2 мкмоль/л или >10–20% уровня общего сывороточного билирубина), повышенный гемолиз эритроцитов, возможны лейкопения, нейтропения. В 70–80% случаев врожденной ЦМВИ дети имеют более одного из трех симптомов: низкая масса тела при рождении, желтуха, тромбоцитопения.
Только для антенатального заражения ЦМВ характерно поражение центральной нервной системы. Цитомегаловирус в условиях широкой вакцинации против кори является основным этиологическим фактором врожденной патологии ЦНС. У ребенка выявляют микроцефалию, реже гидроцефалию, вентрикуломегалию, интравентрикулярные спайки, кистозные изменения, очаги кальцификации или кровоизлияния в перивентрикулярной зоне мозга. Могут иметь место сонливость или гипотензия, слабый сосательный рефлекс, судорожный синдром, требующие дифференциального диагноза для исключения поражения ЦНС. Патология ЦНС у новорожденного имеет место в 30% случаев при первичном заражении матери в I триместре беременности. При наличии микроцефалии частота инвалидности составляет более 50%. Проведение диагностической люмбальной пункции выявляет повышение содержания белка в ликворе. Компьютерная томография головного мозга, посмертное исследование устанавливают наличие энцефаловентрикулита, реже менингоэнцефалита, внутримозговые кальцификаты, наиболее характерные в субэпендимальной перивентрикулярной области. Неблагоприятными прогностическими факторами развития у ребенка психоневрологических осложнений являются наличие патологии по данным томографии головного мозга плода и микроцефалия. ЦМВИ — основная причина потери слуха. Нарушение слуха возникает у 22–70% детей с врожденной манифестной ЦМВИ и 5–23% при бессимптомном течении антенатальной инфекции. Почти всегда прогрессирует в дальнейшем. При клинически выраженной ЦМВИ возможны нарушения зрения и страбизм (косоглазие) как следствие развития хориоретинита, пигментного ретинита, рубцов на сетчатке глаза, атрофии зрительного нерва, потери центрального зрения, врожденной катаракты. Прогноз при врожденной ЦМВИ, протекающей с поражением ЦНС, неблагоприятный.
У 40–90% выживших новорожденных, страдавших манифестной ЦМВИ, имеют место отдаленные неврологические последствия в виде задержки психомоторного, умственного развития (55% случаев), глухоты (58%) или двустороннего снижения слуха (37%), нарушения восприятия речи при сохранении слуха (27%), одного или более из четырех признаков (микроцефалия, судороги, парезы/параличи, хориоретинит) с частотой около 50% случаев. Врожденная ЦМВИ ассоциируется с нейросенсорной инвалидностью. В 25–40% случаев дети имеют умственные недостатки, проявляющиеся в более старшем возрасте: когнитивные нарушения, низкую обучаемость в школе, неспособность к чтению, гиперактивность в сочетании с невозможностью сосредоточиться, поведенческие проблемы.
Интерстициальную пневмонию относят к редким проявлениям врожденной ЦМВИ. Ее наличие свидетельствует о тяжелом течении заболевания и неблагоприятном прогнозе для жизни ребенка. Поражение органов дыхания более вероятно у детей старше 1 мес, инфицированных вирусом во время родов или в раннем постнатальном периоде. У ребенка с врожденной ЦМВИ могут иметь место некротический энтероколит, фиброз, поликистоз поджелудочной железы, очаговый интерстициальный нефрит, хронический сиалоаденит с развитием сиалофиброза. Возможно развитие сахарного диабета, диффузного тиреотоксического зоба. Заражение ЦМВ в период внутриутробного развития может быть причиной развития «септического»» заболевания: гепатомегалии, спленомегалии, лимфопении, нейтропении, тромбоцитопении, повышения активности аминотрансфераз, генерализованного поражения органов с развитием шока, и смерти ребенка. Около 20–30% детей с клинически выраженной врожденной ЦМВИ умирают.
Инфицирование ЦМВ плода во второй половине беременности может не приводить к клинически выраженной патологии при рождении, но быть причиной развития заболевания в первые недели и месяцы жизни ребенка. Наличие виремии (ДНК или антигена вируса в крови) в период от момента рождения до 3 мес жизни ребенка является фактором риска развития неврологической патологии (прогрессивной тугоухости, хориоретинита, микроцефалии, очаговых двигательных нарушений, гипотензии, судорожного синдрома).
Не только клинически выраженная, но в 5–15% случаях бессимптомная антенатальная ЦМВИ приводит к формированию осложнений в виде значительного ухудшения слуха (5–23%), снижения зрения, судорожных расстройств, задержки в физическом и умственном развитии (4–5%), нейросенсорных нарушений, сложностей при обучении. Предполагается роль ЦМВ в развитии детского церебрального паралича, отдельных форм аутизма и шизофрении.
Продолжительность инкубационного периода ЦМВИ колеблется от 4 до 12 нед. При интранатальном или раннем постнатальном заражении ЦМВ клинические признаки болезни чаще возникают через 1–3 мес после родов. Характер течения заболевания во многом связан с особенностями преморбидного состояния новорожденного (зрелость, доношенность, перинатальные поражения, сопутствующие заболевания). Наиболее часто ЦМВИ проявляется поражением легких (2–10% зараженных детей), протекающим благоприятно при отсутствии отягощающих факторов. У недоношенных ослабленных детей с низкой массой тела при рождении, зараженных ЦМВ во время родов или в первые дни жизни путем гемотрансфузий, уже к неделе жизни может развиться тяжелое генерализованное заболевание, проявлениями которого служат пневмония, гепатит с затяжной желтухой и холестазом, гепатоспленомегалия, нефропатии, поражение кишечного тракта, анемия, тромбоцитопения. Заболевание может носить длительный рецидивирующий характер.
Максимальная летальность от ЦМВИ приходится на возраст 2–4 мес. Согласно исследованиям и (2001), ЦМВИ диагностировали у 9,5% из 336 умерших детей в возрасте до года. Частота выявления ЦМВИ на секционном материале крупнейшей детской больницы составила от 2 до 7% среди детей, умерших в возрасте до 15 лет. У мертворожденных и детей, умерших до 6 лет с генерализованной ЦМВИ, регистрировали сиалоаденит (85% случаев), поражение легких (20–67%), почек (56–62%), кишечника (20–29%), головного мозга (3–59%), печени (24–50%), надпочечников (13%), поджелудочной железы (10%), лимфоузлов (2%), сердца (2%).
Наибольший риск для плода представляет первичное заражение матери. Острая ЦМВИ у беременной протекает бессимптомно или с незначительной клинической симптоматикой. Так, при обследовании 244 беременных с острой ЦМВИ проявления заболевания имели место лишь в 68% случаев (повышение температуры — 60,2, слабость — 48,8, головная боль — 26,6, артралгии/миалгии — 15,1, ринит — 15,1, фарингит — 13,9, кашель — 9,6, повышение активности печеночных ферментов — 36,1, лимфоцитоз — 12%). У трети пациенток признаки инфекции отсутствовали. Поэтому основное значение имеют лабораторные методы выявления первичного заражения ЦМВ и факта его активной репликации.
Авидность антител характеризует скорость и прочность связывания антигена с антителом. Низкая степень авидности IgG в сочетании или без специфических в крови подтверждает недавнее (в течение 3 мес) первичное заражение вирусом и в случае беременности служит маркером высокого риска трансплацентарной передачи возбудителя плоду. Чувствительность низкого индекса авидности антител у матери как фактора риска заражения плода составляет 100% при исследовании крови на сроке беременности 6–18 нед и 63% при проведении анализа на неделе беременности (сочетание с выявлением IgМ увеличивает этот показатель до 80%). Если низкая авидность выявлена на сроке 12–16 нед, то нельзя полностью исключить недавнее инфицирование до момента зачатия. Проведение теста на авидность антител класса IgG является обязательным при их обнаружении совместно с IgМ у беременной или новорожденного.
Исследование беременной на серологические маркеры важно и для выявления отсутствия в крови антител класса IgG к ЦМВ и, соответственно, наличия риска первичного инфицирования вирусом во время беременности и антенатального заражения ребенка. В качестве профилактики необходимо консультирование и информирование серонегативных по ЦМВ женщин, планирующих беременность или уже беременных, об источниках и путях заражения вирусом: половые контакты с серопозитивным партнером, физический контакт при ежедневном уходе за ребенком дома или профессиональный контакт с детьми младшего возраста в стационарах, домах ребенка, детских дошкольных учреждениях. Для снижения риска первичного заражения ЦМВ беременным, не имеющим специфических антител IgG, даются рекомендации по использованию барьерных контрацептивов при половых контактах, соблюдению правил личной гигиены после смены пеленок или после прикосновения к игрушкам, испачканным слюной или мочой детей, избеганию пользования одной посудой с ребенком, поцелуев в губы детей грудного возраста, которые могут выделять вирус со слюной. Рекомендован временный перевод серонегативных беременных на работу, не связанную с опасностью их заражения вирусом. Подобные меры профилактики актуальны и для серопозитивных беременных для предотвращения повторного заражения ЦМВ. В настоящее время запатентованной вакцины, предотвращающей заражение ЦМВ, не существует.
Решающее значение для установления наличия активного инфекционного процесса (активной репликации вируса) и подтверждения поражения органов принадлежит прямым методам выявления вируса, его антигенов и ДНК. Клиническое и прогностическое значение определения ДНК ЦМВ в различных биологических жидкостях неодинаково. У 20–30% здоровых беременных ЦМВ присутствует в слюне. Наличие ДНК ЦМВ в слюне является лишь маркером инфицированности (важно только при обследовании новорожденных), не свидетельствует о существенной вирусной активности у беременной и риске заражения плода. Данное исследование для выявления активной ЦМВИ, в частности у беременной, не показано.
Наиболее важное диагностическое значение имеет обнаружение ДНК ЦМВ в крови. Наличие ДНК ЦМВ в лейкоцитах крови беременной является достоверным признаком активной репликации ЦМВ и служит важным маркером высокого риска антенатального заражения плода. Проведенное нами исследование по определению значения различных специфических лабораторных признаков активной ЦМВИ у беременных в качестве прогностических маркеров врожденной и внутриутробной ЦМВИ (130 беременных и 128 рожденных ими детей) показало, что риск антенатального заражения плода составил лишь 3,4% при отсутствии в цельной крови матери ДНК ЦМВ и 58% при наличии ДНК вируса у серопозитивных беременных. При первичном инфицировании в стадии « окна» до начала синтеза антител выявление ДНК ЦМВ в крови является единственным маркером активной вируса. В то же время ДНК ЦМВ в крови выявляют лишь у 50% беременных с острой ЦМВИ. Чувствительность наличия ДНК в крови составляет 80–100% в первый месяц развития острой ЦМВИ, но существенно снижается через 30 дней от момента ее выявления.
Если для установления диагноза острой ЦМВИ значение имеют серологические маркеры, то для выявления у беременной активной ЦМВИ вследствие повторного инфицирования или реактивации вируса маркеры играют малую роль. Основное значение принадлежит выявлению ДНК ЦМВ в клетках крови и моче. Следовательно, целесообразно обследование беременных с высокоавидными IgG на наличие ДНК ЦМВ
в крови и моче при выявлении патологии по данным УЗИ плода, признаках острого инфекционного процесса у матери, обнаружении в крови антител класса IgM к ЦМВ.
Клиническое значение положительного результата на ДНК ЦМВ в цервикальном канале или вагинальном секрете не установлено, необходимость принятия мер сомнительна. Но наличие ДНК ЦМВ в тракте в III триместре беременности — фактор риска интранатального заражения ребенка и показатель для его обследования на сроке 4–6 нед жизни.
II вариант: IgG-, IgМ-
Консультирование женщины по вопросам профилактики первичного заражения ЦМВ. Повторное серологическое обследование на и неделях беременности.
III вариант: IgG-, IgМ+
Анализ крови на ДНК ЦМВ в клетках крови и анализ мочи на ДНК ЦМВ.
Повторное исследование крови на наличие антител IgG и IgМ к ЦМВ с интервалом 14 дней.
Появление в крови IgG (сероконверсия) в с IgМ (вне зависимости от отсутствия или наличия ДНК ЦМВ в биологических жидкостях) — первичной (острой) ЦМВИ. Назначение лечения.
Обнаружение ДНК ЦМВ в биологических жидкостях при отсутствии IgG, но наличии IgМ также является основанием для диагноза острой ЦМВИ.
Возможно проведение амниоцентеза (через 5–7 нед после острой ЦМВИ у матери, но не ранее недели и не позднее недели беременности) с исследованием амниотической жидкости на количественное определение ДНК ЦМВ.
Обязательное обследование новорожденного в первые 14 дней жизни для исключения антенатальной ЦМВИ и через 4–6 нед жизни для исключения интранатальной ЦМВИ.
IV вариант: IgG+, IgМ+
Анализ крови на ДНК ЦМВ в клетках крови и анализ мочи на ДНК ЦМВ.
Исследование крови на авидность антител класса IgG.
Низкая авидность IgG (как и сероконверсия по IgG) (вне зависимости от отсутствия или наличия ДНК ЦМВ в биологических жидкостях) — подтверждение первичной (острой) ЦМВИ. Назначение лечения.
Возможно проведение амниоцентеза (через 5–7 нед после острой ЦМВИ у матери, но не ранее и не позднее недели беременности) с исследованием амниотической жидкости на количественное определение ДНК ЦМВ.
Обязательное обследование новорожденного в первые 14 дней жизни для исключения антенатальной ЦМВИ и через 4–6 нед жизни для исключения интранатальной ЦМВИ.
При высокой авидности IgG, отсутствии ДНК ЦМВ в крови и моче наличие IgМ в крови можно как «ложноположительный» результат. повторное исследование крови и мочи на ДНК ЦМВ в 24–26 нед беременности.
При высокой авидности IgG, но наличии IgМ в крови в сочетании с выявлением ДНК ЦМВ в моче возможна постановка диагноза активной ЦМВИ и назначение лечения. Также возможно дальнейшее наблюдение с проведением повторных исследований беременной на IgМ, ДНК ЦМВ в крови и моче с обязательным обследованием новорожденного для исключения антенатальной и ЦМВИ.
V вариант: IgG+, IgМ-, ДНК ЦМВкр+, ДНК ЦМВм±
Исследование крови для определения индекса антител класса IgG к ЦМВ и одновременное назначение лечения.
Возможно проведение амниоцентеза, кордоцентеза с исследованием амниотической жидкости, пуповинной крови на количественное определение ДНК ЦМВ.
Обязательное обследование новорожденного для антенатальной и интранатальной ЦМВИ.
Наличие ДНК ЦМВ в соскобе из цервикального канала при отсутствии других лабораторных маркеров острой или активной ЦМВИ не требует проведения лечения, но является показанием для обследования ребенка на сроке 4–6 нед жизни для исключения интранатального заражения вирусом.
В случае активной ЦМВИ у серопозитивной женщины, несмотря на риск передачи вируса ребенку, грудное кормление не прерывают. Если ребенок недоношен,
с низкой массой тела при рождении, имеет врожденную ЦМВИ и концентрация ДНК вируса в грудном молоке высокая, пастеризация или замораживание молока на 24 ч.
Выявление у новорожденного низкоавидных IgG при наличии у матери высокоавидных антител о заражении ЦМВ. Но частота выявления антител класса IgG к ЦМВ низкой или пограничной авидности у с антенатальной ЦМВИ не превышает 50%. Наличие высокоавидных IgG ни в коем случае не исключает антенатальное заражение.
Обнаружение IgМ у детей первых недель жизни — важный показатель внутриутробного заражения вирусом, но серьезным недостатком определения служат их частое отсутствие при наличии активного инфекционного процесса (около 30% случаев) и также нередкие результаты. Наличие специфических антител класса IgА является критерием острой ЦМВИ.
Серологические маркеры антенатального заражения ребенка должны поддерживаться выявлением самого вируса. Доказательством наличия врожденной ЦМВИ является ДНК ЦМВ в соскобе со слизистой ротовой полости, моче, крови в первые 2 нед жизни ребенка. Согласно исследованиям, чувствительность выявления ДНК ЦМВ в моче у младенцев с врожденной ЦМВИ была на уровне 93% при 100% специфичности, чувствительность ДНК ЦМВ в слюне составила 89% при специфичности 96%. Для установления факта внутриутробного большей чувствительностью обладает наличие ДНК ЦМВ в моче. Наличие ДНК ЦМВ в крови ребенка не только о его заражении, но и высокой активности инфекции и этиологической роли вируса в имеющейся патологии. ДНК ЦМВ присутствовала в крови у всех детей с манифестной врожденной ЦМВИ, в половине случаев — с бессимптомной активной внутриутробной инфекцией и ни у одного из неинфицированных детей. У 60% детей с клинически выраженной ЦМВИ ДНК вируса была обнаружена в ликворе.
Выявление ДНК ЦМВ через 4–6 нед жизни ребенка при отсутствии вируса в биологических материалах в первые 2 нед от момента родов свидетельствует об интранатальном или раннем постнатальном заражении ЦМВ.
Безусловным подтверждением поражения органов является обнаружение при гистологических исследованиях биопсийных или аутопсийных материалов специфических крупных цитомегалоклеток. В настоящее время для повышения чувствительности метода целесообразно дополнительно исследовать гистологические препараты с применением ПЦР для выявления в тканях ДНК или антигена вируса. Отметим, что в практическом здравоохранении даже при посмертных исследованиях часто не устанавливают природу органной патологии у новорожденного, что делает невозможной «работу над ошибками» неонатологов.
Выявление у беременной острой ЦМВИ является показанием для назначения терапии с целью предотвращения или существенного снижения последствий заражения. Препараты прямого противовирусного действия (ганцикловир, фоскарнет и цидофовир) являются препаратами выбора для лечения клинически выраженной ЦМВИ, валганцикловир — для превентивной терапии у иммуносупрессивных больных с активной ЦМВИ и для поддерживающей терапии у пациентов, получивших лечебный курс. Контролируемых исследований по оценке эффективности и безопасности ганцикловира и валганцикловира у беременных не проводилось, их использование не рекомендуется. В то же время, учитывая многолетнее и многочисленное применение ацикловира у беременных и схожесть по структуре и фармакологическому действию препаратов, существует большая вероятность безопасности применения валганцикловира у беременных с высокоактивной ЦМВИ для защиты ребенка от заражения вирусом и профилактики тяжелых последствий ЦМВИ в III триместре беременности. В зарубежной литературе описаны единичные случаи назначения ганцикловира и валганцикловира беременным с активной ЦМВИ. У нас имеется опыт применения валганцикловира у беременных, имевших высокую концентрацию ДНК ЦМВ в крови (после получения информированного согласия со стороны больной). Были отмечены быстрое исчезновение вируса из крови матери, рождение здорового ребенка и отсутствие нежелательных явлений со стороны матери и ребенка. По нашему мнению, в случае высокой концентрации ДНК ЦМВ в крови беременной и при отсутствии элиминации вируса из крови после проведенного курса специфического антицитомегало вирусного иммуноглобулина в III триместре беременности следует рассмотреть вопрос о назначении валганцикловира в дозе 900 мг/сут в течение 14 дней для профилактики внутриутробного заражения плода и развития врожденной ЦМВИ.
В научной литературе рассматривается целесообразность применения ацикловира и его аналога валацикловира у беременных с наличием ДНК ЦМВ в амниотической жидкости, учитывая, что ацикловир многие годы успешно применяют у беременных для лечения и профилактики герпетических инфекций. При острой ЦМВИ препараты назначали на неделе беременности, учитывая низкую тропность к ним ЦМВ — длительно (в среднем в течение 7 нед) и в очень высоких дозах (валацикловир 8 г/сут) (подобная суточная доза существенно превышает максимально рекомендуемую для препарата — 3г/сут). Было отмечено снижение вирусной нагрузки в пуповинной крови после 1–12 нед лечения, но достоверного снижения вероятности развития клинических симптомов у родившихся детей не получено. Соответственно ацикловир и его аналоги малоэффективны в отношении ЦМВ и не должны применяться при данном заболевании.
В практическом здравоохранении при выявлении маркеров активной ЦМВИ часто используют поликлональные иммуноглобулины, однако их эффективность не доказана. Отечественная научная литература наводнена рекомендациями по назначению «иммуномодуляторов» и «индукторов интерферона» для лечения ЦМВИ, в том числе у беременных, новорожденных, детей младшего и старшего возраста. Использование данных веществ у пациентов с активной ЦМВИ является абсолютно не обоснованным с точки зрения доказательной медицины. Исследований, доказывающих согласно всем международным правилам эффективность данных препаратов, ни в России, ни за рубежом не проводили. Механизм воздействия данных лекарственных средств на иммунную систему детально не изучен. Не определены оптимальные показания по времени применения препаратов, продолжительности их использования, критерии эффективности. Данные «препараты» не включены ни в один международный протокол по лечению герпесвирусных заболеваний. В связи с этим «иммуномодуляторы» и «индукторы интерферона» не показаны при активной ЦМВИ, в том числе у беременных и детей.
Показания для назначения специфического иммуноглобулина человека у беременных:
Показания для назначения специфического иммуноглобулина человека у и детей раннего возраста:
Препарат применяют по схеме: 1 мл/кг массы тела (100 ЕД/кг) 1 раз в сутки 6 введений с интервалом 48 ч. Для оценки переносимости препарата скорость инфузии в течение первых 10 мин введения не должна превышать 0,08 мл/кг в час. При отсутствии клинических проявлений анафилаксии скорость введения постепенно увеличивают до 0,8 мл/кг в час.
Необходимо отметить, что оценка эффективности специфического антицитомегаловирусного у беременных с активной ЦМВИ для антенатального заражения и развития клинически выраженной врожденной ЦМВИ, а также эффективности препарата для лечения активной ЦМВИ у детей нуждается в дополнительных исследованиях для получения более доказательной базы.
Применение антицитомегаловирусного в качестве монотерапии у детей, страдающих выраженной врожденной или интранатальной ЦМВИ, не является достаточным. Актуален вопрос о возможности назначения ганцикловира и валганцикловира у и детей более старшего возраста при манифестной ЦМВИ. Рандомизированное плацебоконтролируемое исследование III фазы использования ганцикловира по схеме 6 мг/кг в сутки 6 нед у детей с врожденной ЦМВИ и ЦНС показало улучшение слуха через 6 мес в группе ганцикловира при отсутствии такового в контрольной группе. В течение года слух ухудшился у 21% детей в группе ганцикловира и 68% — в группе сравнения.
В настоящее время ганцикловир детям до 12 лет назна чают только по жизненным показаниям, при наличии поражения ЦНС из расчета 6 мг/кг каждые 12 ч не менее 42 дней; в дальнейшем при возможном энтеральном введении переходят на пероральную форму валганцикловира в форме суспензии в дозе 16 мг/кг каждые 12 ч в течение 6 мес. По нашему мнению, начинать лечение ганцикловиром необходимо при появлении первых признаков манифестации антенатальной ЦМВИ у новорожденных, не дожидаясь развития генерализованной, угрожающий жизни или наступления тяжелых последствий ЦМВИ. Ибо при развитии генерализованной с тяжелой органной патологией врожденной ЦМВИ даже ганцикловир может быть уже неэффективен.
Опыт применения валганцикловира у детей, перенесших трансплантацию органов, выявил следующие особенности лечения и профилактики ЦМВИ: фармакокинетика валганцикловира и ганцикловира зависит от скорости клубочковой фильтрации, часто у детей дошкольного и раннего школьного возраста затруднен сосудистый доступ, дети плохо глотают таблетки, необходимые дозировки лекарства не всегда легко достижимы таблетированными формами, комплаентность подростков к проводимой терапии низкая. В августе 2009 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) одобрило расширенные показания для валганцикловира с целью профилактики ЦМВИ у педиатрических пациентов высокого риска после трансплантации костного мозга, почек в возрасте от 4 мес до 16 лет и реципиентов после трансплантации сердца в возрасте от 1 мес до 16 лет [33]. Длительность терапии валганцикловиром рекомендована от 100 до 200 дней. Валганцикловир во многих странах доступен в виде оральной суспензии 50 мг/мл. В результате исследований было констатировано, что назначение валганцикловира в дозе 16 мг/кг внутрь оказывает такое же системное действие, как и введение ганцикловира внутривенно в дозе 6 мг/кг.
Учитывая, что при манифестной врожденной ЦМВИ после проведенного лечебного курса ганцикловира нередко не удается добиться полной нормализации клинического состояния ребенка, снижения количества ДНК ЦМВ в клетках крови и плазме до неопределяемого уровня, вероятность повторного нарастания концентрации ДНК ЦМВ в крови и рецидивов инфекции после окончания терапии ганцикловиром, а также возможность прогрессирования нарушения слуха в первые 3 года жизни, целесообразно назначать детям с антенатальной манифестной ЦМВИ после окончания лечебного курса ганцикловира валганцикловир в суспензии длительным (до 6 мес) поддерживающим курсом с мониторингом определения ДНК ЦМВ в крови, оценкой данных инструментальных и лабораторных исследований, клинического состояния ребенка. Возможно включение антицитомегаловирусного иммуноглобулина в схему лечения манифестной ЦМВИ и в схему поддерживающей терапии.
Все дети, инфицированные ЦМВ внутриутробно, должны проходить обследование в возрасте 1, 3, 6, 12 мес и далее один раз в год до достижения школьного возраста. Обследование должно включать оценку физического и неврологического статусов, антропометрических данных, нейропсихологического развития; проверку слуха (в частности, оценку слуховых вызванных потенциалов головного мозга — электрического отклика ЦНС на слуховой раздражитель), осмотр глазного дна, а также проведение клинического и биохимического анализов крови, исследование образцов крови и мочи на наличие ДНК ЦМВ. Дети с врожденной ЦМВИ находятся под медицинским наблюдением не менее 3–5 лет, так как нарушение слуха, связанное с ЦМВ, может прогрессировать в первые 3 года жизни, а клинически значимые осложнения могут сохраняться и через 5 лет после рождения.
Таким образом, необходимо стремиться, чтобы каждый случай внутриутробной патологии у родившегося ребенка, каждое инфекционное заболевание у новорожденного были этиологически расшифрованы, и все реже звучал диагноз «внутриутробная инфекция». Только так мы сможем установить истинную частоту и роль внутриутробных инфекций, определить тактику ведения детей при каждой из них, наметить дальнейшие пути повышения эффективности нашей лечебной работы.
Конфликт интересов отсутствует.
Сведения об авторе
Шахгильдян Василий Иосифович — кандидат медицинских наук, старший научный сотрудник Федерального центра по профилактике и борьбе со СПИДом ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Перинатального медицинского центра Группы компаний «Мать и дитя», Москва