Цитокиновый шторм при коронавирусе что
Неочевидная роль витамина B6 в профилактике цитокинового шторма при Covid-19
Коллектив авторов указывает на растущее количество доказательств того, что витамин B6 обладает защитным эффектом против многих хронических заболеваний
Роль витамина B6 в поддержании иммунного ответа против новой коронавирусной инфекции считается неочевидной для исследователей-нутрициологов.
Фокус исследований в нутрициологии преимущественнно установлен на положительные и широко обсуждаемые свойства витамина D и C, а также таких минералов как цинк и магний, в формировании иммунитета, в том числе на Covid-19. Однако исследования витамина B6 практически не проводятся. Ведущий автор новой статьи из журнала Frontiers in Nutrition надеется, что его работа станет первым важным шагом в раскрытии потенциала витамина B6 в снижении вероятности развития цитокинового шторма.
«В дополнение к базовым гигиеническим мерам, правильное питание также стоит на первой линии профилактики коронавирусной инфекции. Еда – наше первое лекарство, а кухня – первая аптека», – рассказывает доцент Высшей школы интегрированных наук Хиросимского университета Thanutchaporn Kumrungsee.
В своей работе коллектив авторов указывает на растущее количество доказательств того, что витамин B6 обладает защитным эффектом против многих хронических заболеваний, в том числе патологии сердечно-сосудистой системы и сахарного диабета, благодаря подавлению воспалительных процессов, окислительного и карбонильного стресса.
Витамин B6 – собирательное название водорастворимых производных 3-гидрокси-2-метилпиридинов, обладающих биологической активностью пиридоксина. Среди растительных продуктов он содержится в бананах, питайе, батате и фундуке. Пиридоксин синтезируется некоторыми бактериями. Тунец и лосось характеризуются высоким содержанием витамина B6. Также он присутствует в мясных и молочных продуктах, но он менее устойчив к высоким температурам, чем другие формы витамина B, поэтому в варёных и жареных мясных продуктах его мало.
В дальнейшем исследователи из Хиросимского университета планируют проверить гипотезу на клинических испытаниях.
Цитокиновый шторм
Цитокиновый шторм (гиперцитокинемия) — агрессивная иммунная реакция организма на вирусную инфекцию и лекарственные препараты, в ходе которой активно продуцируются пептидные молекулы — цитокины, развивается обширное системное воспаление, нарушается правильная работа иммунитета.
Цитокинами называют группу информационных гормоноподобных белков и пептидов, которые выделяются клетками иммунной системы и некоторыми другими. При атаке вирусной инфекции, организм начинает усиленно вырабатывать эти молекулы. Они выполняют четыре функций:
Избыточная и неконтролируемая выработка цитокиновых молекул наблюдается при коронавирусных, бактериальных инфекциях, токсическом воздействии некоторых лекарств, опухолевых процессах. Агрессивная ответная реакция иммунитета при цитокиновом шторме вызывает нарушение свертываемости крови, выработку избыточного количества медиаторов воспаления, очаговое разрушение собственных клеток и тканей.
По мере интенсификации этих процессов агрессивная иммунная реакция становится неконтролируемой — активно высвобождаются интерфероны, хемокины, ФНО (факторы некроза опухоли) и другие молекулы из группы цитокинов.
Развитие цитокинового шторма
Первично в ответ на атаку вируса или иного патогенного микроорганизма возникает иммунно-воспалительная реакция — уровень цитокинов возрастает настолько резко и стремительно (шторм, гиперцитокинемия), что атака иммунных клеток (лимфоцитов) приходится не только на враждебный инфекционный возбудитель, но и на родные жизненно важные клеточные компоненты. В результате они погибают, прекращается работа целых органов.
Симптомы цитокинового шторма
Симптомы проявляются по-разному, в зависимости от органов и целых систем, подверженных обширному воспалительному процессу. К общим симптомам относятся:
К специфическим для разных органов:
Цитокиновый шторм при коронавирусе
В 2020 году было выявлено, что наименее благоприятный прогноз у пациентов, больных коронавирусом SARS-CoV-2 с признаками нарушения пневмотизации легких, связан с развитием «цитокинового шторма» и обострением острого респираторного дистресс-синдрома (ОРДС). Обширный воспалительный процесс и системное повреждение тканей могут привести к нарушению работы внутренних органов и смерти.
Выявлены индикаторы, которые позволяют прогнозировать развитие цитокинового шторма у 70% пациентов:
Цитокиновый шторм при коронавирусе приводит к иммунной недостаточности, облегчая присоединение бактериальной инфекции.
Механизм развития цитокинового шторма еще недостаточно изучен. Это генерализованное поражение организма, возникающее вследствие агрессивного ответа иммунной системы может проявиться и у абсолютно здорового человека на фоне других инфекций, ревматических, аутоиммунных, онкологических заболеваний (например, при свином гриппе, туберкулезе, пневмонии, сепсисе — заражении крови.
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 19 лет
Если вы оставили ее с 8:00 до 22:00, мы перезвоним вам для уточнения деталей в течение 15 минут.
Если вы оставили заявку после 22:00, мы перезвоним вам после 8:00.
Цитокиновый шторм при коронавирусе что
В связи с пандемией коронавируса все чаще мы стали слышать про цитокиновый шторм, который является следствием заражения вирусными инфекциями, в том числе SARS-CoV-2. Что это такое? Почему он появляется при COVID-19? Давайте разбираться вместе.
Начнем с того, что такое цитокины. Цитокины – группа информационных гормоноподобных белков и пептидов, которые выделяются клетками иммунной системы и некоторыми другими. При атаке вирусной инфекции, организм начинает усиленно вырабатывать эти молекулы. Они выполняют четыре функции:
• управляют различными иммунными реакциями (гомеостаз, восстановление);
• регулируют гемопоэз (кровотворение).
Избыточная выработка цитокиновых молекул приводит к цитокиновому шторму.
Цитокиновый шторм – агрессивная иммунная реакция организма на вирусную инфекцию и лекарственные препараты, влекущее за собой системное воспаление и нарушение правильной работы иммунитета. При цитокиновом шторме в организме нарушается функция свертываемости крови, вырабатывается избыточное количество медиаторов воспаления, а также очагов разрушения собственных клеток и тканей. При усилении этих процессов иммунная реакция становится неконтролируемой – интерфероны, хемокины, ФНО (факторы некорза опухоли) и другие молекулы из группы цитокинов начинают активно высвобождаться.
При развитии цитокинового шторма, в ответ на атаку вируса, возникает иммуно-воспалительная реакция, из-за которой уровень цитокинов резко возрастает – именно поэтому заболевание имеет в названии слово «шторм». Лимфоциты атакуют не только инфекционный возбудитель, но и жизненно важные клетки, в результате чего прекращается работа целых органов.
Главная опасность цитокинового шторма при COVID-19 – иммунная недостаточность, т.к. она облегчает присоединение бактериальных инфекций. Воспалительный процесс и системное повреждение тканей может привести к нарушению работы внутренних органов и смерти.
На данный момент механизм развития цитокинового шторма до конца не изучен, однако COVID-19 является одной из причин его возникновения. Вы можете постараться избежать заражения путем вакцинации и соблюдения всех мер предосторожности. Будьте здоровы.
Цитокиновый шторм при различных вариантах течения COVID-19
В декабре 2019 года в городе Ухань, Китай, был обнаружен новый штамм коронавируса, вызывающий тяжелый острый респираторный синдром — коронавирус 2 (SARS-CoV-2). Наряду с SARS-CoV и коронавирусом, ассоциированным с ближневосточным респираторным синдромом — (MERS-CoV), SARS-CoV-2 является третьим коронавирусом, вызывающим тяжелые респираторные заболевания у людей, объединенных под названием «коронавирусная болезнь 2019 года» (COVID-19). Эта вспышка была признана Всемирной организацией здравоохранения (ВОЗ) в марте 2020 года пандемией и оказала значительное влияние на экономику и здравоохранение во всем в мире.
Хотя ситуация развивается стремительно, тяжелое течение заболевания, проявляющееся лихорадкой и пневмонией, приводящее к острому респираторному дистресс-синдрому (ОРДС), было описано в 20 % случаев COVID-19. Это напоминает течение ОРДС, вызванного синдромом выброса цитокинов (цитокиновый шторм), и вторичный гемофагоцитарный лимфогистиоцитоз, наблюдаемый у пациентов с SARS-CoV и MERS-CoV, а также у пациентов с лейкемией, получающих Т-клеточную терапию. Учитывая этот опыт, необходимо создание терапевтических средств, основанных на подавлении синдрома выброса цитокинов, таких как тоцилизумаб, которые прошли клинические испытания для лечения COVID-19.
SARS-CoV-2 — это бета-коронавирус, который наиболее тесно связан с SARS-CoV. Оба вируса используют рецептор ангиотензинпревращающего фермента, связанный с карбоксипептидазой (ACE2), чтобы проникнуть в клетки. Этот рецептор повсеместно экспрессируется в сердечной и легочной ткани, а также в некоторых кроветворных клетках, включая моноциты и макрофаги. Ключевой особенностью инфекции COVID-19 является лимфопения (низкий уровень лимфоцитов в крови), которая коррелирует с клинической тяжестью процесса. При SARS-CoV инфицируются моноциты и дендритные клетки, тогда как при MERS-CoV инфицируются моноциты и Т-клетки через дипептидилпептидазу 4 (DPP4). Возможно, что SARS-CoV-2 также поражает дендритные клетки. Апоптоз и истощение пула Т-клеток в результате нарушения процессов активации из-за дисфункции дендритных клеток может способствовать патологии иммунной системы при COVID-19. Однако лимфопения не является специфическим биомаркером неблагоприятного прогноза при COVID-19, поскольку она также является биомаркером, который коррелирует с летальным исходом в пандемии гриппа A (H1N1) 2009 года.
Было установлено, что цитокиновый шторм является основным фактором тяжелого течения SARS-CoV и MERS-CoV у пациентов. Повышенные сывороточные концентрации интерлейкина-6 (IL-6) и других провоспалительных цитокинов являются признаками тяжелого течения инфекции MERS-CoV. Синдром высвобождения цитокинов часто встречается у пациентов с COVID-19, а повышенный уровень IL-6 в сыворотке коррелирует с дыхательной недостаточностью, ОРДС и неблагоприятными клиническими исходами. Повышенный уровень C-реактивного белка (CРБ),экспрессия которого стимулируется IL-6, также является биомаркером тяжелой бета-коронавирусной инфекции.
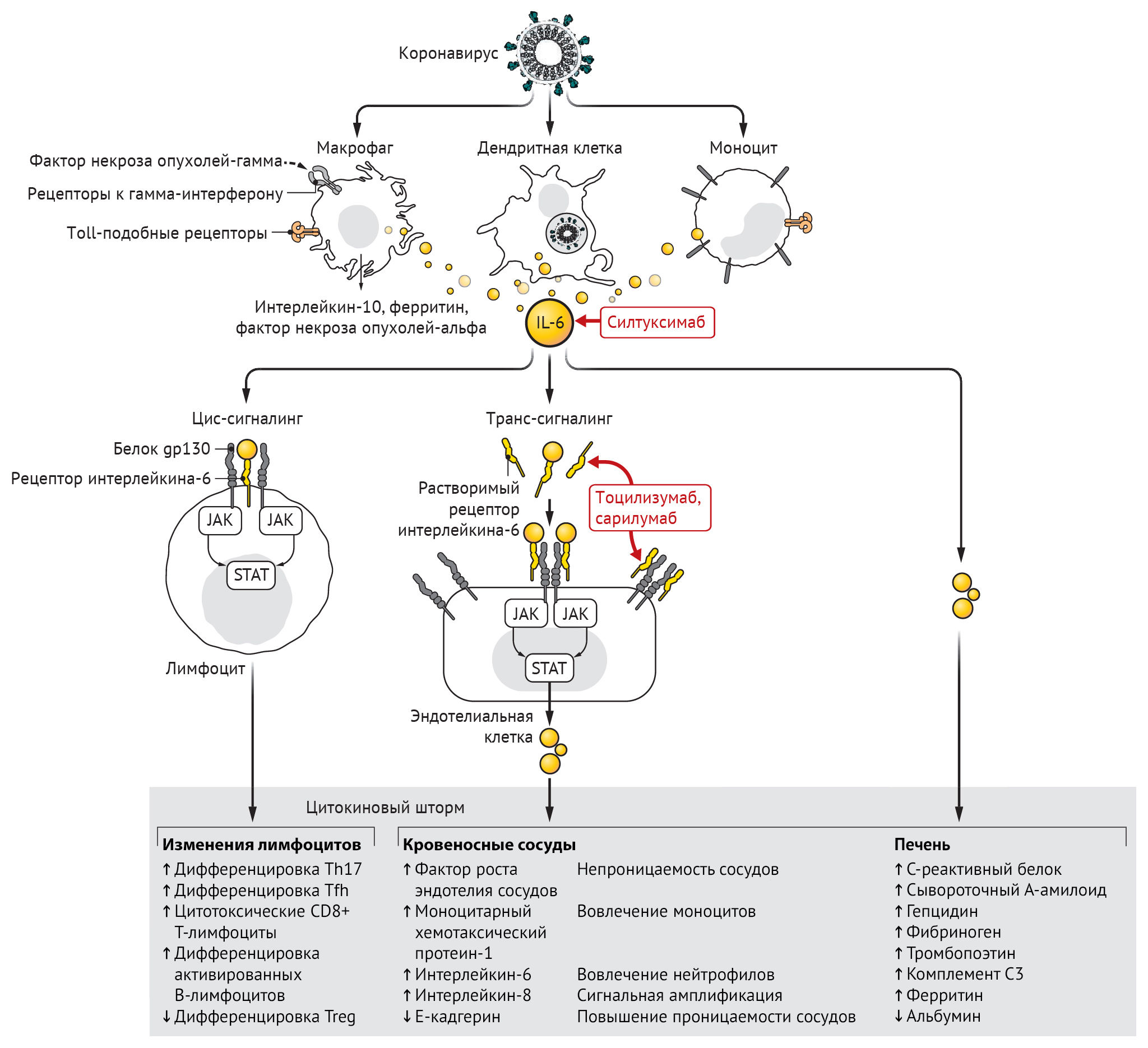
Инфицирование бета-коронавирусом моноцитов, макрофагов и дендритных клеток приводит к их активации и секреции IL-6 и других провоспалительных цитокинов. IL-6 обладает выраженными провоспалительными свойствами (см. рис. 1). IL-6 может передавать сигналы по двум основным путям, которые называются классической цис-передачей или транс-передачей. При передаче цис-сигналов IL-6 связывается с мембраносвязанным рецептором IL-6 (mIL-6R) в комплексе с gp130; нисходящая сигнальная трансдукция опосредуется, в свою очередь, JAKs (Janus kinases) и STAT3 (сигнальный преобразователь и активатор транскрипции-3). Связанный с мембраной комплекс gp130 экспрессируется повсеместно, в отличие от mIL-6R, экспрессия которого ограничена в основном иммунными клетками. Активация передачи сигналов в рамках цис-передачи приводит к плейотропным эффектам на приобретенный иммунитет (В- и Т-клетки), а также врожденную иммунную систему [нейтрофилы, макрофаги и естественные клетки-киллеры (NK)], которые могут вносить вклад в возникновение цитокинового шторма.
При передаче сигналов высокие концентрации циркулирующих IL-6 связываются с растворимой формой IL-6R (sIL-6R), образуя комплекс с димером gp130 на всех клеточных поверхностях. В результате сигнальный каскад IL-6-sIL-6R-JAK-STAT-3 активируется в клетках, которые не экспрессируют mIL-6R, таких как эндотелиальные клетки. Это приводит к системному «цитокиновому шторму», включающему секрецию сосудистого эндотелиального фактора роста (VEGF), хемоаттрактантного белка моноцитов–1 (МСР-1), IL-8 и дополнительного IL-6, а также снижение экспрессии E-кадгерина на эндотелиальные клетки. VEGF и пониженная экспрессия E-кадгерина способствуют проницаемости сосудов, которые участвуют в патофизиологии гипотонии и легочной дисфункции при ОРДС.
Вторичный гемофагоцитарный лимфогистиоцитоз — это гипервоспалительный синдром, характеризующийся высвобождением цитокинов, цитопенией (низкое количество клеток крови) и полиорганной недостаточностью (включая печеночную). У взрослых вторичный гемофагоцитарный лимфогистиоцитоз чаще всего связан с тяжелыми вирусными инфекциями, но также встречается у пациентов с лейкемией, получающих специальную Т-клеточную терапию. В дополнение к повышенным уровням цитокинов для вторичного гемофагоцитарного лимфогистиоцитоза характерны высокие уровни ферритина в сыворотке крови. Экспрессирующие CD163 макрофаги выступают в качестве источника ферритина. Учитывая их роль в передаче сигналов ретикулоэндотелиального железа, вторичный гемофагоцитарный лимфогистиоцитоз известен также как синдром активации макрофагов. Ретроспективное исследование пациентов с COVID-19 показало, что повышение сывороточного ферритина и IL-6 коррелировало с уровнем выживаемости и наблюдалось у погибших.
У пациентов, получающих CART-терапию (лечение Т-клетками химерного рецептора антигена (chimeric antigen receptor — CAR)), также могут развиться как цитокиновый шторм, так и вторичный гемофагоцитарный лимфогистиоцитоз. CART-терапия включает перепрограммирование Т-лимфоцитов пациента с целью повышения экспрессии на них молекул CAR, которые распознают антигены на опухолевых клетках. При переливании этих перепрограммированных клеток обратно пациенту они нацеливаются на опухолевые клетки, тем самым активируя противоопухолевый иммунный ответ. Эмили Уайтхед, первый пациент, получивший CD19-нацеленные Т-клетки CAR-19 с целью лечения острого лимфобластного лейкоза в 2012 году, побочным эффектом получила тяжелую форму цитокинового шторма и вторичного гемофагоцитарного лимфогистиоцитоза, что привело к развитию ОРДС, полиорганной недостаточности и гипотонии, которая была невосприимчива к стандартному лечению стероидами. Из-за значительного повышения сывороточного IL-6 у этой пациентки эмпирически было принято решение о начале терапии тоцилизумабом, антагонистом IL-6R, одобренным в то время для лечения ревматических состояний, таких как ювенильный идиопатический артрит. Она получала однократную дозу тоцилизумаба на 7-й день после введения CARТ-лимфоцитов. Спустя несколько часов у пациентки снизилась температура, после чего было принято решение об отмене лечения гипотонии и отказ от поддержки ИВЛ после разрешения ОРДС. В настоящее время тоцилизумаб с подтвержденной эффективностью и минимальными побочными эффектами у сотен пациентов одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения заболеваний, протекающих с синдромом цитокинового шторма, вызванного CARТ-терапией.
Эффективность антагонистов IL-6-IL-6R для лечения цитокинового шторма и вторичного гемофагоцитарного лимфогистиоцитоза подчеркивает центральную роль передачи сигналов IL-6 в патофизиологии цитокин-управляемых гипервоспалительных синдромов. Тяжелые случаи COVID-19 можно лечить как раз путем ингибирования пути IL-6, учитывая связанные с цитокиновым штормом и подобным вторичному гемофагоцитарному лимфогистиоцитозу повышения цитокинов в сыворотке крови. Действительно, предварительные результаты исследования 21 пациента с COVID-19, получавшего тоцилизумаб в Китае, обнадеживают: лихорадка спадала у всех пациентов в течение первого же дня приема тоцилизумаба. Потребность в кислороде была снижена у 75 % пациентов.
Во всем мире проводятся контролируемые клинические испытания с целью тестирования эффективности антагонистов IL-6 и IL-6R для лечения пациентов с COVID-19 с тяжелыми респираторными осложнениями. Один вопрос, который необходимо решить, заключается в том, будет ли иметь место дифференциальная эффективность между антагонистами IL-6 и антагонистами IL-6R. Относительно этого поднимается вопрос, что ингибиторы IL-6R могут подавлять как цис-, так и транс-передачу сигналов, а также транс-презентацию, недавно описанный третий способ передачи сигналов. Транс-презентация включает связывание IL-6 с mIL-6R, экспрессируемым на иммунной клетке, которая образует комплекс с gp130 на клетках T-хелпера-17 (TH17), что приводит к передаче сигналов Т-клеток вниз по каскаду, который может приводить к ОРДС. Однако ингибиторы IL-6 могут подавлять только цис- и транс-передачу сигналов. Непосредственная цель применения антагонистов IL-6 состоит в том, чтобы облегчить течение тяжелых случаев COVID-19 и свести к минимуму потребности в интенсивной терапии данных пациентов. Долгосрочная цель должна заключаться в разработке противовирусных препаратов и вакцин, которые предотвращают инфекцию или облегчают ее течение.
Есть ряд предостережений, которые необходимо брать во внимание, учитывая глобальную потребность в терапии COVID-19. При сепсис-ассоциированном ОРДС часто назначают кортикостероиды. Однако применение кортикостероидов у пациентов с SARS и MERS не улучшило показатели выживаемости и не привело к каким-либо изменениям вирусного клиренса. В результате консенсус экспертов-инфекционистов из профильных институтов и ВОЗ рекомендует клиницистам избегать системных кортикостероидов у пациентов с COVID-19 в настоящее время. Теоретическая возможность состоит в том, что подавление воспаления антагонистами IL-6 может задержать выведение вируса из организма. Однако блокада IL-6 также приводит к быстрому снижению сывороточного IL-10, иммуносупрессивного цитокина, секретируемого макрофагами, что может смягчить опасения по поводу продления клиренса вируса. Более того, одна или две дозы антагониста IL-6 вряд ли приведут к таким осложнениям, как грибковые инфекции или остеонекроз челюсти, возникающие у пациентов, которым ежемесячно вводят эти препараты для лечения хронических состояний, например, ревматоидного артрита. Примечательно, что тоцилизумаб был впервые одобрен для лечения ревматических заболеваний, а затем — цитокинового шторма у пациентов, получающих CARТ-терапию, и в настоящее время подвергается «перепрофилированию» для борьбы с пандемией COVID-19. Вполне возможно, что направленная на IL-6 терапия будет использоваться в лечении пациентов на случай будущих пандемий, вызванных другими вирусами, таких как грипп и лихорадка Эбола.
Основные прогностические факторы риска цитокинового шторма у пациентов с COVID-19 (ретроспективное клиническое исследование)
Полный текст
Аннотация
Обоснование. По данным Всемирной организации здравоохранения (WHO Coronavirus Disease), на 31.03.2021 в мире зарегистрировано 127 877 462 подтвержденных случая новой коронавирусной инфекции COVID-19, в том числе 2 796 561 со смертельным исходом. COVID-19 характеризуется широким спектром клинических проявлений — от бессимптомного до быстрого прогрессирования в тяжелую и крайне тяжелую форму. Прогностические биомаркеры раннего выявления лиц из группы высокого риска стали неотложной медицинской необходимостью. Цель исследования — поиск предикторов цитокинового шторма, характеризующего тяжелое течение инфекции COVID-19, создание шкалы риска развития этого осложнения у пациентов для практической работы. Методы. В исследование вошли 458 пациентов с подтвержденной инфекцией COVID-19 и признаками вирусного поражения легких по данным компьютерной томографии. Пациенты разделены на 2 группы: со стабильным течением средней тяжести (n=100) и с прогрессирующим течением средней, тяжелой и крайне тяжелой степени (n=358). Результаты. Установлено, что основными факторами риска развития цитокинового шторма у пациентов с COVID-19 являются концентрация интерлейкина-6 >23 пг/мл, динамика индекса по шкале NEWS ≥0, концентрация ферритина >485 нг/мл, D-димера >2,1, С-реактивного белка >50 мг/л, количество лимфоцитов в крови 9 /л, возраст ≥40 лет. Частота случаев цитокинового шторма коррелирует с увеличением числа факторов риска. Для практического применения шкалы выделены 3 группы риска: у пациентов первой группы (0–1 фактор) риск цитокинового шторма практически отсутствует, во второй группе (2–3 фактора) вероятность шторма составляет 55% (увеличивается в 35,5 раза), в третьей группе (≥4 факторов риска) достигает 96% (увеличивается в 718 раз). Заключение. У пациентов с инфекцией COVID-19 установлены критерии диагностики и контроля цитокинового шторма. Разработанная прогностическая шкала позволяет выделить пациентов с высоким риском развития цитокинового шторма для раннего назначения противовоспалительной терапии.
Ключевые слова
Полный текст
ОБОСНОВАНИЕ
Инфекция COVID-19 (COronaVIrus Disease 2019), вызываемая коронавирусом SARS-CoV-2, остается глобальной проблемой для всемирного здравоохранения. У большинства людей, инфицированных SARS-CoV-2, болезнь протекает в легкой форме. У части пациентов иммунный ответ становится нерегулируемым, что приводит к тяжелому повреждению легких и проявляется как острый респираторный дистресс-синдром (ОРДС) с последующим развитием острой дыхательной недостаточности, дисфункции внелегочных органов и высокой смертностью. Болезнь COVID-19 обычно связана с повышением уровней воспалительных биомаркеров, цитокинов и хемокинов, особенно при тяжелом течении. Помимо того, часто встречаются лимфоцитопения и нейтрофилия со значительным уменьшением числа CD8+ Т-клеток, CD4+ Т-клеток и естественных клеток-киллеров (natural killer, NK) [1]. Смертность госпитализированных пациентов колеблется от 15 до 20% и выше у нуждающихся в интенсивной терапии [2].
Центральной в патофизиологии COVID-19 является иммунная дисфункция с выраженной неконтролируемой генерализованной системной воспалительной реакцией вследствие усиленной продукции воспалительных цитокинов — цитокиновый шторм (ЦШ). ЦШ сопровождается лихорадкой, цитопенией, гиперферритинемией, аномальными печеночными показателями, коагулопатией и поражением легких (в том числе ОРДС) [3]. При всех этих состояниях интерлейкины (interleukin, IL) 1β, 18, 6 и интерферон гамма (interferon gamma, IF N-γ) являются основными медиаторами гипервоспаления. COVID-19-ассоциированный ЦШ является уникальной формой гипервоспалительной реакции, требующей разработки критериев его установления [4].
Цель исследования — поиск биомаркеров-предикторов ЦШ у пациентов с COVID-19 и создание на их основе прогностической шкалы риска развития ЦШ для использования в повседневной врачебной деятельности.
МЕТОДЫ
Дизайн исследования
Обсервационное клиническое исследование.
Критерии соответствия
Проведен анализ 458 историй болезни пациентов с COVID-19, находившихся на лечении в ГБУЗ «Городская больница № 40» Санкт-Петербурга в период с 18.04.2020 по 21.11.2020, имевших положительный результат теста на наличие РНК SARS-CoV-2 методом амплификации нуклеиновых кислот в полимеразной цепной реакции (ПЦР); клинические проявления и симптомы (лихорадку, общую слабость и недомогание, кашель и одышку); изменения по типу вирусной пневмонии на КТ-изображении легких без внутривенного контрастного усиления (преимущественно двустороннего нижнедолевого, периферического, периваскулярного, мультилобулярного характера; многочисленные периферические уплотнения в виде «матового стекла» округлой формы различной протяженности; уплощение междолькового интерстиция по типу булыжной мостовой, участки консолидации, симптом воздушной бронхограммы и др.) [5].
Методы регистрации исходов
У всех пациентов проводили сбор анамнестических данных с уточнением особенностей течения заболевания; объективный осмотр с оценкой параметров гемодинамики, дыхательной системы (частота дыхательных движений, частота сердечных сокращений, артериальное давление, степень насыщения крови кислородом, SpO2; степень дыхательной недостаточности); оценку по шкале раннего выявления риска у пациентов с внезапными острыми заболеваниями (National Early Warning Score, NEWS), рекомендованной к использованию для пациентов с COVID-19 [6]; компьютерную томографию (КТ) органов грудной клетки с оценкой формы заболевания по четырехзначной шкале (КT- 1, КT-2, КT-3, КT-4); лабораторные исследования (клинический анализ крови; биохимический минимум; определение уровней ферритина, С-реактивного белка, IL-6, лактатдегидрогеназы, D-димера), электрокардиографию; при необходимости использовали дополнительные инструментальные методики.
Статистический анализ
Пороговые уровни для возраста, индекса NEWS и лабораторных данных определяли с помощью метода построения деревьев классификации (Classification Trees) [7].
Относительный риск ЦШ (odds ratio, OR): отношение вероятности развития определенного исхода в группах сравнения изучали путем построения четырехпольной таблицы сопряженности с расчетом стандартной формулы и границ доверительного интервала. При наличии в таблице нулевых значений для расчета использовали поправку Халдейна.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Демографические данные, данные эпидемиологического анамнеза и сопутствующие заболевания пациентов исследуемой когорты представлены в табл. 1.
Таблица 1 / Table 1
Демографические, эпидемиологические и анамнестические данные пациентов
Patients’ demographic, epidemiological and anamnestic data
Показатель
n (%)
Контакт с инфекционными больными
Выезд за пределы места проживания в течение ближайших 14 дней
Наличие у близких родственников проявлений простуды
(лихорадка, кашель, слабость)
Наличие заболеваний в анамнезе:
• ишемическая болезнь сердца
• состояние после инсульта
• состояние после острого инфаркта миокарда
• состояние после оперативного лечения
• ревматоидный артрит и другие аутоиммунные заболевания
• хроническая болезнь почек 3-5 стадий
• хроническая обструктивная болезнь легких
Основные результаты исследования
Распространенность сопутствующих заболеваний у наших пациентов существенно превышает этот показатель у взрослых пациентов с COVID-19 по литературным данным (31% [8]). Высокий процент сочетанной патологии у наших пациентов связан с определенной профилизацией нашего корпуса, а именно с лечением пациентов с тяжелым и крайне тяжелым течением болезни. В отделении реанимации и интенсивной терапии из других отделений и стационаров в связи с прогрессирующим течением COVID-19 переведен 221 (48%) пациент.
При поступлении у пациентов зарегистрированы лихорадка (365; 80%), кашель (329; 72%), одышка (265; 57,86%), боль в мышцах (43; 9,39%), общая слабость (344; 75,11%), головная боль (36; 7,86%), боль в горле (29; 6,33%), насморк, ринорея (46; 10,04%), боль в грудной клетке (51; 11,14%), диарея (34; 7,42%), тошнота и рвота (13; 2,84%), снижение обоняния и вкуса (40; 8,73%). Наличие одного и более симптома заболевания отмечено у 450 (98,25%), КТ-признаков пневмонии — у 458 (100%) пациентов.
Пациенты были разделены на две группы, сравнимые по возрасту. Первую группу составили 100 (21,8%) пациентов с клинико-рентгенологическими особенностями, характеризующими стабильное течение заболевания средней степени тяжести; вторую — 358 (78,2%) человек с прогрессирующим среднетяжелым, тяжелым и крайне тяжелым течением болезни (табл. 2).
Таблица 2 / Table 2
Характеристика тяжести течения заболевания в группах пациентов
Characteristics of the disease severity in different groups of patients
Показатель
1-я группа
2-я группа
Всего
Степень тяжести течения заболевания:
• тяжелая; крайне тяжелая
Форма заболевания по КТ 1–4 при поступлении:
Лечение COVID-19 и его осложнений в 1-й группе включало антибактериальные и противовирусные препараты, профилактику гиперкоагуляции и ДВС-синдрома, симптоматическое лечение, кислородную терапию. Во 2-й группе в соответствии с тяжестью состояния для предупреждения или лечения ЦШ стандартная терапия была дополнена назначением реконвалесцентной патогенредуцированной плазмы, антицитокиновых препаратов, а именно: ингибиторов рецептора IL-6 (тоцилизумаб, олокизумаб, левилимаб), IL-1 (канакинумаб, RH104), JAK-киназ (тофацитиниб, руксолитиниб, барицитиниб), тирозинкиназы Bcr-Abl (радотиниб), в ряде случаев — глюкокортикоидов. По показаниям проводили этапную респираторную терапию, модифицированную антибактериальную терапию, экстракорпоральную мембранную оксигенацию, лечение сепсиса и септического шока (экстракорпоральная детоксикация и гемокоррекция и др.) [5].
При поступлении у пациентов 1-й группы достоверно чаще отмечена форма заболевания КТ-1, тогда как пациенты 2-й группы чаще, чем пациенты 1-й группы, госпитализировались с более тяжелыми формами — КТ-2, КТ-3 и КТ-4. Несмотря на преобладание во 2-й группе КТ-признаков среднетяжелого поражения легких (КТ-2), при поступлении у пациентов отмечались явления прогрессирующей дыхательной недостаточности и лихорадки (табл. 3).
Таблица 3 / Table 3
Сравнение групп пациентов по шкале NEWS, срокам поступления в стационар и длительности госпитализации
Comparison of patient groups via the NEWS scale, times of admission to the hospital and duration of the hospital stay
Показатель
Характеристики
1-я группа
2-я группа
Значение
Значение
Индекс NEWS при поступлении
Превышение пороговых величин основных предикторов ЦШ достоверно чаще наблюдалось у пациентов 2-й группы (табл. 6).
Таблица 6 / Table 6
Частота цитокинового шторма при различном числе факторов риска
Cytokine storm incidence for different numbers of risk factors
Число факторов риска
цитокинового шторма
1-я группа
2-я группа
Всего
В дальнейшем выполняли комплексную оценку риска ЦШ с ранжированием показателей, которыми, в соответствии с рангом прогностической значимости, полученным методом построения деревьев классификации, к началу терапии ЦШ оказались:
1) динамика индекса по шкале NEWS;
2) уровень IL-6 крови выше 23 пг/мл;
3) уровень СРБ крови равный или выше 50 мг/л;
4) абсолютное количество лимфоцитов меньше 0,72×10 9 /л;
5) положительный результат теста на РНК коронавируса (SARS-CoV-2);
6) возраст пациентов 40 лет и старше.
Эти биомаркеры могут быть использованы в качестве критериев для оценки риска ЦШ. Необходимо отметить, что гендерные различия несущественны в дальнейшей комплексной оценке риска развития ЦШ.
На рис. 1 проиллюстрировано возрастание риска ЦШ (OR) в зависимости от величины лабораторных показателей.
Рис. 1. Увеличение риска цитокинового шторма (OR) при неблагоприятных значениях показателей.
Fig. 1. Increase of the cytokine storm risk with the unfavorable values of indices.
Увеличение частоты случаев ЦШ коррелирует с увеличением числа факторов риска (коэффициент корреляции Rg +0,91, р
Рис. 2. Частота случаев цитокинового шторма при различном количестве факторов риска.
Fig. 2. Cytokine storm incidence for a different number of risk factors.
Для практического применения нашей прогностической модели выделены следующие категории риска:
Полученные результаты согласуются с оценкой факторов риска ЦШ при COVID-19 других авторов [11, 12] и позволяют обосновать выбор лечебной тактики с ранним назначением упреждающей противовоспалительной терапии и антиковидной плазмы реконвалесцентов для пациентов с высоким риском развития ЦШ.
ОБСУЖДЕНИЕ
Поскольку в настоящее время не разработаны убедительные прогностические критерии развития ЦШ при COVID-19, мы на примере 458 пациентов с различным течением заболевания проанализировали прогностическую силу доступных к изучению клинических, инструментальных и лабораторных параметров, стремясь найти когерентные группы или кластеры тех из них, которые являются полезными для формулирования прогноза, и установить их прогностическую силу. Для этого использовали регистрацию клинических признаков и симптомов при поступлении в стационар и в анамнезе; демографические, эпидемиологические сведения; клинические характеристики и оценку тяжести состояния по шкале NESW; степень тяжести COVID-19; коморбидность; анализ изменений в динамике легочной ткани («матовое стекло» ± консолидация) на КТ легких по стандартному протоколу без внутривенного контрастирования [5], а также значения лабораторных показателей крови [13] в пределах 24 ч до или после установления диагноза ЦШ и в течение последующих 7 дней госпитализации. В течение последующих 10 дней оценивали результаты определения РНК SARS-CoV-2; продолжительность лечения в стационаре и исходы болезни. При проведении сравнительной характеристики пациентов, имеющих клинико-рентгенологические признаки ЦШ, и пациентов без признаков ЦШ, выявлены потенциальные факторы риска развития ЦШ.
Нарастающее увеличение показателя по шкале NEWS характеризует клиническую тяжесть течения заболевания и прогрессирование гемодинамических нарушений. Так, в 1-й группе пациенты при поступлении имели индекс не более 4 баллов, который уменьшался на фоне терапии на 1–2 балла, в то же время у пациентов 2-й группы отмечалось увеличение числа баллов на 1,24±1,86 при исходном более высоком значении индекса. Достоверные различия между 1-й и 2-й группами получены при анализе уровней IL-6, СРБ, ферритина, количества лимфоцитов. Таким образом, при прогрессирующем течении заболевания мы видим нарастающие показатели биомаркеров, которые участвовали в реализации клинической картины ЦШ у наших пациентов.
ЗАКЛЮЧЕНИЕ
К основным факторам риска развития цитокинового шторма у больных COVID-19 относятся мужской пол, возраст старше 40 лет, положительный тест на РНК SARS-CoV-2, лимфопения, уровни ЛДГ, D-димера, ферритина и IL-6, динамика индекса по шкале NEWS. Лабораторными критериями для диагностики и динамического контроля за течением цитокинового шторма являются абсолютное количество лимфоцитов, уровни ЛДГ, СРБ, ферритина, D-димера и IL-6. Разработанная прогностическая шкала позволяет выделить группу пациентов с высоким риском развития ЦШ для раннего назначения противовоспалительной терапии.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Участие авторов. А.Ю. Анисенкова — лечение пациентов, обсуждение результатов исследования, написание текста статьи; С.В. Апалько, З.П. Асауленко — лабораторные исследования биологических образцов пациентов; А.Н. Богданов, Д.А. Вологжанин — обсуждение результатов исследования, редактирование текста статьи; Е.Ю. Гарбузов — лечение пациентов; О.С. Глотов — тестирование биологических образцов пациентов на наличие коронавируса SARS-CoV-2; Т.А. Камилова — поисково-аналитическая работа, обсуждение и редактирование текста статьи; О.А. Клиценко — обработка и обсуждение результатов исследования; Е.М. Минина — рентгенологическая диагностика; С.В. Мосенко — обследование пациентов, обсуждение результатов исследования, редактирование текста статьи; Д.Н. Хоботников — лечение пациентов; С.Г. Щербак — руководство лечением пациентов, обсуждение результатов исследования.
Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Источник финансирования. Исследование и публикации статьи финансируются из бюджета СПб ГБУЗ «Городская больница № 40 Курортного административного района».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.