Цитогенетическое исследование костного мозга что показывает
Цитогенетические исследования
Показания к назначению цитогенетического исследования
Цитогенетический метод используется для изучения кариотипа человека и диагностики наследственных заболеваний, вызванных хромосомными мутациями. Также он представляет диагностическую ценность при выявлении мутагенного воздействия лекарственных веществ.
Цитогенетическое исследование (кариотипирование) проводится у детей для обнаружения генетических заболеваний и у семейных пар при бесплодии. Также анализ необходим перед проведением вспомогательной репродуктивной технологии (ЭКО, ИКСИ).
Как подготовиться к исследованию
Кариотипирование назначается после консультации врача-генетика по показаниям.
Генетическая диагностика требует соблюдения следующих правил подготовки:
Результаты исследования
Результат составляется согласно Международной номенклатуре цитогенетики. Запись кариотипа должна отвечать стандартному формату: [общее количество аутосом], [половые X или Y-хромосомы], [особенности].
В норме человеческий кариотип выглядит так:
Варианты патологии могут выражаться различными формами кариотипов. Различают следующие виды хромосомных нарушений:
Структурные аномалии встречаются редко, но характеризуются тяжелой симптоматикой. Обнаружение хромосомных перестроек цитогенетическим анализом позволяет определить причину бесплодия и спрогнозировать риск рождения детей с генетическими заболеваниями.
Факторы, влияющие на результаты исследований

Основными факторами являются:
Достоверные результаты требуют соблюдения всех этапов анализа. После взятия крови лимфоциты культивируются на специальной среде, активирующей митоз (деление клеток). При достижении метафазы добавляется вещество, останавливающее деление (колхицин/колцемид). В эту фазу набор хромосом наиболее различим. После обработки гипотоническим раствором лимфоциты переносят на предметное стекло, фиксируются и окрашиваются. Окрашенный препарат изучается под световым микроскопом. Цитогенетическое исследование клеток костного мозга не требует дополнительных воздействий на клетки.
Интерпретация результата
Расшифровка результатов должна проводиться врачом. При постановке диагноза учитываются результаты цитогенетического исследования хромосом, анамнез, клиническая картина и показатели других лабораторных тестов.
В норме кариотип человека состоит из 22 пар аутосом и двух половых хромосом (46XX, 46XY).
При генетических заболеваниях кариотипы могут представляться следующим образом:
Если выявлен патологический хромосомный набор, то в обязательном порядке показана консультация медицинского генетика. Только специалист может провести правильную интерпретацию результатов. Если патология обнаружена на этапе планирования беременности, врач объяснит паре риск рождения больного ребенка. Дальнейшее решение будут принимать будущие родители.
Сделать цитогенетический анализ можно в клинике «Профимедика». Мы используем оборудование, позволяющее получить изображение высокого качества, поэтому при выполнении анализа участки хромосом исследуются с точностью 99,9%. Благодаря генетической диагностике супружеские пары могут зачать здорового малыша, предотвратить произвольное прерывание беременности и подготовиться к проведению вспомогательных репродуктивных технологий.
Цитогенетическое исследование костного мозга что показывает
Когда врач начинает лечить больного с подозрением на лимфому или другую болезнь крови, то ему необходимо понять, в каком состоянии находится очень важный орган пациента, в котором происходит кроветворение – костный мозг. Для этого делаются специальные анализы, о которых мы постараемся рассказать подробнее.
Внутри костей для клеток природой созданы поистине «тепличные» условия, поэтому и вредные (патологические) клетки также стремятся занять «теплое местечко», вот почему исследование костного мозга часто является самым важным для постановки диагноза, а значит, и для правильного лечения.
При взятии костного мозга для анализа, как и при взятии любого другого материала из организма используются принципы максимальной пользы, безопасности и безболезненности. Делают это уже десятки лет, поэтому методики надежно отработаны. Чаще всего используют аспирационную биопсию и трепанобиопсию костного мозга.
Аспирационная биопсия костного мозга
Данная процедура нужна для того, чтобы получить на анализ капельку костного мозга. Эта капелька позволяет быстро и точно понять, что происходит с кроветворением, почему что-то пошло не так, есть ли в костном мозге «вредные» клетки и какие они. Сразу же скажем, что при этом и при других анализах, количество костного мозга очень быстро восстанавливается и организм не терпит никакого урона.
Аспирационную биопсию выполняют так. Врач вместе с пациентом решают, из грудины или со спины брать костный мозг. Если выбирают первый вариант, то протирают спиртом кожу над верхней третью грудины, обезболивают новокаином мягкие ткани и специальной иглой и шприцем берут 0,5 миллилитра костного мозга. Если выбирают второй вариант, то на границе ягодичной и поясничной области, отступив от позвоночника в сторону на 10 см, обрабатывают кожу спиртом и обезболивают мягкие ткани. Затем также специальной иглой берут полмиллилитра костного мозга на анализ. Вся процедура от момента протирания кожи спиртом до окончания в опытных руках занимает времени меньше минуты. Как до, так и после нее можно сразу есть, пить, мыться, словом, заниматься повседневными делами.
Получение капельки костного мозга позволяет провести:
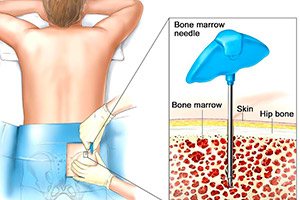
Трепанобиопсия костного мозга
На врачебном языке словом «биопсия» называют взятие жидкой части или кусочка любого органа для исследования, а «трепанобиопсией костного мозга» называется взятие тонкого столбика кости с мозгом внутри для комплексного анализа кроветворных клеток, их взаимодействия с окружающими клетками, изменений структуры кости. Трепанобиопсия костного мозга позволяет обнаружить опухолевые клетки, а также увидеть характерные черты различных заболеваний. Это исследование применяют для того, чтобы уточнить степень заболевания, а иногда только этот анализ позволяет правильно поставить диагноз.
В обычной врачебной работе трепанобиопсию костного мозга делают очень редко, и мало кто знает, что это такое. Именно поэтому кратко опишем, как она делается. Сразу скажем, что во время забора анализа любое прикосновение к любым нервам, позвонкам, спинному мозгу полностью отсутствует. Процедура достаточно простая и может проходить амбулаторно, но делает ее обязательно врач. Пациент может сидеть или лежать в зависимости от своего желания и навыков доктора.
Укажем точки на теле, откуда берут материал. На границе ягодичной и поясничной области, отступив 10 см от позвоночника в сторону, врач находит места, где очень близко к поверхности кожи подходят самые массивные кости человека – подвздошные кости таза. Врач протирает спиртом кожу, тонкой иглой обезболивает мягкие ткани и специальной иглой берет материал. Вся процедура от момента протирания кожи спиртом до получения маленького столбика костной ткани (длиной один-два см) в опытных руках занимает три-четыре минуты. Как до, так и после нее можно сразу есть, пить, мыться, одним словом, заниматься повседневными делами. На месте взятой кости быстро вырастает новая костная ткань. Полученный материал отправляют на гистологическое исследование. При необходимости выполняют углубленное иммуногистохимическое исследование.
Лабораторий, в которых могут квалифицированно проанализировать полученный материал, в городе мало. Кроме того, сама методика анализа очень трудоемкая, поэтому подготовка ответа занимает не менее двух недель.
Исследование клеточного состава (миелограмма)
Капелька костного мозга аккуратно распределяется по стеклышку, окрашивается специальными красками и отправляется в лабораторию. Как правило, микроскопический анализ и написание заключения занимает 1-2 дня. Этот метод относится к одному из самых технически простых, однако специалистов-цитологов, способных правильно оценить то, что видно под микроскопом, в городе очень мало.
Цитогенетическое исследование
Цитогенетическое исследование выявляет болезнь на уровне хромосом.
В школе на уроках биологии мы изучали, что вся информация о человеке зашифрована природой в его генах. Эти гены собраны в особые цепочки, которые спрятаны в ядре клетки. Цепочки генов называются «хромосомами». Цитогенетический анализ хромосом можно провести в момент деления клетки. Анализ возможен только у активно делящихся клеток – стволовых и опухолевых. При некоторых болезнях возникают типичные поломки хромосом, которые можно увидеть в микроскоп, и обнаружение их имеет ключевое значение для диагноза, лечения и предсказания результатов лечения. Для анализа берут около двух миллилитров костного мозга. Цитогенетическое исследование – это очень сложное, трудоемкое дело, которое требует дорогого оборудования, дорогих специальных химических и биологических веществ (реактивов), труда высококвалифицированных лаборантов и врача-цитогенетика. Выполнение такого исследования возможно только в некоторых специализированных больницах и научных центрах. Анализ и написание заключения занимает около 3-4 дней.
Молекулярно-генетические методы исследования (ПЦР и FISH)
Как уже говорилось, в организме человека, как и во всяком живом существе, вся информация зашифрована в генах. У всех людей есть похожие гены (например, те, которые указывают, что у нас одна голова и четыре конечности) и есть непохожие, уникальные (например, те, которые указывают на цвет глаз, оттенок кожи, голос). Для некоторых болезней найдены типичные изменения (мутации) генов, которые вызывают, «запускают» болезнь, и типичные сопровождающие болезнь изменения генов. Чтобы их найти и назначить нужное лечение требуется один-два миллилитра костного мозга больного человека. В некоторых случаях достаточно и крови.
Ученые создали специальные реактивы – белки-ферменты, которые сами находят в исследуемой жидкости нужный ген и делают множество его копий, которые легко обнаружить. Этот метод называется полимеразная цепная реакция (ПЦР). С помощью ПЦР можно обнаружить любой ген – и опухолевый и инфекционный, даже если в организме больного организма опухолевые клетки присутствует в ничтожно малых количествах. Метод очень точен, прост в использовании, но тоже требует чрезвычайно дорогостоящего оснащения (оборудования, реактивов) и труда специалистов. Ответ выдается через 1-2 дня после постановки анализа.
Некоторые гены очень тяжело выявить полимеразной цепной реакцией, тогда на помощь приходит FISH-метод. При FISH-методе используют уже сделанные на заводе светящиеся крупные молекулы настроенные на те гены, которые необходимо обнаружить. Эти молекулы смешивают с кровью пациента, а потом врач лабораторной диагностики по характеру свечения определяет результат. Метод очень точен, однако имеет свои сложности в применении и требует чрезвычайно дорогостоящего оснащения (оборудования, реактивов) и труда высококлассных специалистов. Ответ выдается через 1-2 дня после постановки анализа.
Проточная цитометрия
Чтобы лучше понять этот метод, сравним клетку с плодом киви. Поверхность клетки очень похожа на волосистую кожицу этого фрукта. Волоски клетки – это молекулы-рецепторы, которыми клетки «переговариваются» между собой. По набору этих молекул-волосков можно из многих клеток точно выделять похожие, подобно тому, как по форме одежды можно определить род занятий человека. Опухоль – это множество абсолютно одинаковых клеток, с одним и тем же набором волосков-рецепторов, похожих друг на друга, как солдаты вражеской армии своими мундирами. Используя специальные краски, можно выделить группу одинаковых клеток и с точностью сказать, какая это опухоль, а значит, правильно выбрать лечение и предвидеть его результат.
Как же делается проточная цитометрия? Представим, что можно аккуратно кисточкой покрасить каждый волосок плода киви в свой цвет. Задача фантастически сложная. Тем не менее, с этой задачей справляются врачи-цитометристы, аппараты которых могут в автоматическом режиме за несколько минут покрасить и оценить десятки поверхностных молекул на сотнях тысяч клеток, найти и обозначить больные клетки. При этом метод позволяет исследовать любые клетки в любой жидкости: кровь, костный мозг, плевральную жидкость и т.д. Проточная цитометрия незаменима в диагностике лейкозов и многих других болезней крови, когда необходимо быстро и точно поставить диагноз.
Проточная цитометрия –это очень сложное дело, которое требует дорогого оснащения, труда очень квалифицированного специалиста. Выполняют этот анализ только в некоторых больницах. Несомненный плюс данной методики в том, что можно исследовать любой жидкий материал, что она быстрая и высочайше точная. Анализ и написание заключения занимает 1-2 дня, но сложные случаи могут потребовать больше времени.
Гистологическое исследование
При гистологическом исследовании врач-патологоанатом изучает материал на клеточном уровне. Для этого взятый при биопсии кусочек органа или ткани специальным образом обрабатывают, делают тончайшие срезы и смотрят под микроскопом. При многих заболеваниях имеются типичные изменения в тех или иных органах, поэтому иногда достаточно только гистологического анализа, чтобы точно поставить диагноз. Если же врач обнаруживает изменения, похожие на опухолевые, то для более точного диагноза необходимо дополнительное проведение иммуногистохимического исследования.
С помощью гистологического исследования костного мозга можно ответить на многие вопросы. Например, при необъяснимом уменьшении количества каких-то клеток крови (тромбоцитов, лейкоцитов, эритроцитов) это единственный метод, который позволяет с вероятностью 100% исключить поражение костного мозга лимфомой или другим опухолевым процессом. Этот метод позволяет выяснить, правильно ли происходит кроветворение или есть в нем какие-либо нарушения. Гистологическое исследование незаменимо для выявления поражения костного мозга, например, метастазами, болезнями крови, инфекцией. В связи с длительной лабораторной обработкой материала для анализа время до выдачи результата составляет не менее двух недель.
Иммуногистохимическое исследование
Суть данного метода в целом близка методу проточной цитометрии. С помощью специальных красок и приборов окрашиваются молекулы на поверхности клеток, и врач-патологоанатом изучает результат. Различия состоят в том, что в данной ситуации исследуют не жидкую часть, а твердые кусочки тканей и органов, взятые при биопсии. Этот метод тоже высокотехнологичен, дорогостоящ и требует работы специалиста высокого класса. Немногие лечебные центры способны качественно выполнять данное исследование.
Цитогенетическое исследование костного мозга что показывает
Цитогенетическое исследование — это микроскопический анализ хромосом, результаты которого весьма важны для постановки диагноза, классификации, лечения и научного исследования заболеваний системы крови, прежде всего — онкогематологических. Значение цитогенетических методов для диагноза и лечения определяется доступностью опухолевых клеток для кариотипирования и их гетерогенностью, а с научной точки зрения — возможностью изучения изменений в структуре и функции генетических локусов, ассоциированных со злокачественной трансформацией.
Морфология хромосом сильно варьирует во время клеточного цикла. Для микроскопического анализа хромосомы должны быть визуализированы как дискретные структуры. Наилучшим образом это достигается на стадии прометафазы митоза, когда каждая хромосома видна как две идентичные хроматиды, и особенно на стадии метафазы, когда хромосомы максимально конденсированы и располагаются в одной плоскости в центре клетки отдельно одна от другой.
Нормальные клетки человека содержат 22 пары аутосом и одну пару половых хромосом: две Х-хромосомы у женщин и по одной копии половых хромосом (X и Y) у мужчин.
Для цитогенетического анализа лейкозов, миелодиспластических синдромов и хронических миелопролиферативных заболеваний исследуют клетки костного мозга. При невозможности их получения может быть исследована кровь (если она содержит бласты). Цитогенетический анализ лимфом выполняется в клетках ткани лимфатического узла. Культивирование клеток из опухоли повышает митотический индекс (пропорцию клеток, находящихся в фазе митоза) и способствует пролиферации злокачественных клеток.
Сравнительное кариотипирование нормальных клеток проводят в Т-лимфоцитах периферической крови, которые предварительно культивируют в среде с митогеном растительного происхождения — фитогемагглютинином.
Окрашивание хромосом в гематологии
В конце 1960-х годов была разработана методология дифференциального окрашивания метафазных хромосом, а в 1971 г. создана номенклатура хромосомных сегментов, позволяющая точно описывать хромосомные аномалии. Позднее были внедрены методики окрашивания менее конденсированных и, соответственно, более длинных профазных и прометафазных хромосом, которые обладают более высоким разрешением, так как позволяют визуализацию 500-2000 сегментов (метафазное окрашивание визуализирует только 300 сегментов).
Достаточно большое количество профазных и прометафазных клеток для анализа получают путем синхронизации клеточного цикла, культивируя клетки в среде, содержащей антиметаболит (например, метотрексат), который ингибирует синтез ДНК. Подавление синтеза ДНК останавливает клеточный цикл в интерфазе. Затем клетки переносят в среду без метотрексата, обогащенную тимидином, где они одновременно входят в фазу митоза. Обработка клеточной культуры колхицином останавливает митоз одновременно во всех клетках на стадии профазы или прометафазы.
Первая стойкая хромосомная аномалия при злокачественной опухоли человека была выявлена в 1960 г. у больных хроническим миелолейкозом и получила название филадельфийской хромосомы (Ph), по имени города, в котором было сделано это открытие. Применение технологии хромосомного окрашивания позволило выявить множество хромосомных аномалий, большая часть которых встречается при онкогематологических заболеваниях. Некоторые красители окрашивают различные участки хромосом с вариабельной интенсивностью в зависимости от структуры хроматина в этих участках, их нуклеотидного и белкового состава.
В результате такого окрашивания получают уникальный паттерн чередования светлых и темных поперечных полос, специфичный для каждой хромосомы.
В настоящее время существуют несколько видов дифференциального окрашивания хромосом. При Q-окрашивании акрихин-ипритом (quinacrine) или акрихиндигидрохлоридом выявляется особый тип флюоресценции каждой хромосомы с образованием Q-исчерченности (Q-banding) — поперечных флюоресцентных полос, называемых Q-полосами (Q.-bands). Это позволяет идентифицировать отдельные хромосомы. Анализ Q-полос выполняют с помощью флюоресцентного микроскопа.
При окрашивании по Гимзе (G-banding) хромосомы приобретают вид серии темных и светлых полос или бэндов (bands). G-окрашивание применяется чаще, чем Q-окрашивание, так как анализ выполняется с помощью светового микроскопа, а G-полосы, в отличие от Q-полос, не выцветают со временем. Наиболее широко применяется методика, называемая GTG-окрашиванием (G bands by trypsin using Giemsa), с предварительной обработкой трипсином.
R-бэндинг (обработка хромосом горячим спиртовым раствором перед окрашиванием по Гимзе) выявляет полосы, которые обратны G-полосам и называются R-полосами (reverse of G bands).
Помимо Q-, G- и R-окрашивания, позволяющих выявлять полосы вдоль всей длины хромосомы, существуют методики, специализированные для исследования отдельных хромосомных структур, в том числе конститутивного гетерохроматина (С-окрашивание — от англ. constitutive), теломерного района (Т-окрашивание) и района ядрышкового организатора (NOR-окрашивание — от англ. nucleolus organizing region). Размеры и положение С-полос уникальны для каждой хромосомы, но преимущественно они включают центромерныи район и используются при исследовании хромосомных транслокаций, вовлекающих центромерные районы хромосом.
Цитогенетический анализ опухолевых клеток затруднен в связи с неясной морфологией хромосом и слабой различимостью полос. Если в исследование взяты наиболее удобные для анализа метафазные пластинки, образец может быть ошибочно охарактеризован как цитогенетически нормальный.
С развитием методов рекомбинантной ДНК стало возможным использование гибридизации in situ для определения местоположения на хромосомах или в клеточном ядре любой ДНК- и РНК-последовательности. С ее помощью можно изучать и диагностировать онкологические и наследственные генетические болезни. Молекулярная гибридизация in situ является важным инструментом цитогенетических исследований, позволяет выявлять хромосомные перестройки, идентифицировать маркерные хромосомы, проводить быстрое кариотипирование клеточных линий. Важно, что подобный анализ можно проводить не только на метафазных хромосомах, но и на интерфазных ядрах.
Разрешающая способность «интерфазной цитогенетики» на два порядка выше, чем классической цитогенетики.
Несмотря на многоцелевое использование молекулярной гибридизации ДНК-ДНК (РНК) in situ, все модификации метода выполняются в соответствии с общими принципами. Существуют несколько вариантов, которые включают в себя несколько этапов: подготовка и мечение ДНК (РНК)-зонда, приготовление препаратов хромосом, собственно гибридизация, детекция гибридных молекул.
В 1980-х годах цитогенетическая методология обогатилась молекулярно-цитогенетическим методом, называемым флюоресцентной гибридизацией in situ (fluorescence in situ hybridization, FISH), который вскоре стал наиболее популярным. Суть этого метода заключается в гибридизации ДНК-зондов к специфическим последовательностям ДНК, меченных флюорохромами, с метафазными или интерфазными хромосомами, которые визуализируются флюоресцентной микроскопией. Определение нуклеотидной последовательности методом FISH выполняется непрямым способом, путем гибридизации синтетического олигонуклеотида (зонда) с анализируемой ДНК (называемой также матричной ДНК или ДНК-мишенью).
Если зонд синтезирован с включением флюоресцентных или антигенных молекул, которые распознаются флюоресцирующими антителами, становится возможной визуализация относительного положения зонда на анализируемой ДНК.
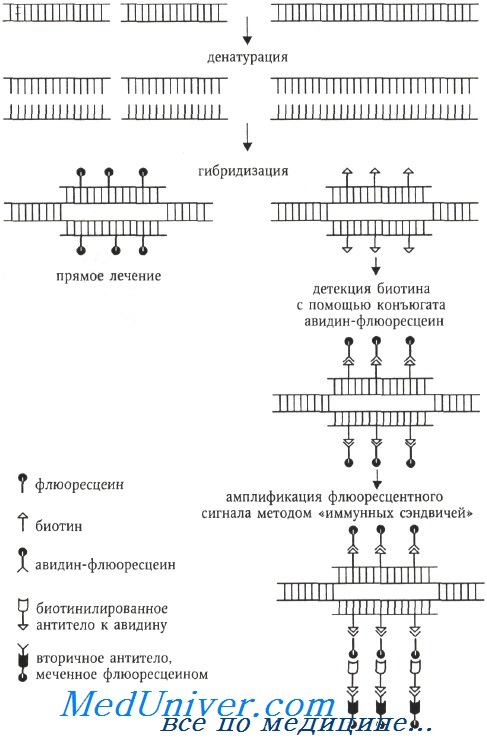
Флюорохром может быть связан с ДНК ковалентно (прямое мечение) или посредством иммуноцитохимических реакций, когда ДНК-зонд метят гаптеном (биотин, дигоксигенин), а флюорохром связан с алкалоидом авидином (стрептавидином), обладающим сильным сродством к биотину (или с антителами против биотина или дигоксигенина). При использовании гаптенов возможна амплификация флюоресцентного сигнала с помощью биотинилированных антител к авидину и вторичных антител, специфичных предыдущему слою антител и окрашенных флюорохромом.
Для амплификации флюоресцентного сигнала применяется метод «иммунных сэндвичей». Например, на препарат, изображенный на схеме, наносят биотинилированные антитела к авидину, а затем снова комплекс авидин-флюоресцеин. При необходимости цикл может быть повторен. Антитела в свою очередь выявляются с помощью ферментативного (например, авидинпероксидазы) или флюоресцентного детектора.
Метод FISH предназначен для выявления:
1) гибридных клеток;
2) транслокаций и других, в том числе числовых, хромосомных аномалий;
3) меченых хромосом в интерфазных и метафазных клетках.
Высококонтрастная флюоресцентная гибридизация достигается благодаря использованию флюоресцентных красителей разного цвета. С помощью двуцветной FISH выявляются тонкие структурные аномалии, например хромосомные транслокации, в том числе и неразличимые при дифференциальном окрашивании.
В настоящее время возможно выполнение многоцветной гибридизации in situ для одновременного окрашивания всех хромосом в сложном кариотипе с множественными числовыми и структурными аномалиями. Комбинация разных модифицирующих агентов и флюорохромных красителей позволяет одновременно выявлять несколько последовательностей ДНК в одном ядре (флюоресцеин дает зеленую флюоресценцию, техасский красный и родамин — красную, гидроксикумарин — голубую и т. д.). Сочетание пяти флюорохромов в разных пропорциях и компьютерный анализ изображений позволяет одновременно окрасить разным цветом все хромосомы и визуализировать 27 различных ДНК-зондов, которые служат уникальной меткой для каждой хромосомы. Эта методика называется многоцветной FISH (multicolor, или multiplex, fluorescence in situ hybridization, M-FISH).
Значение цитогенетических методов неодинаково при разных онкогематологических заболеваниях. Миелоидные клетки обычно легко кариотипируются при дифференциальном окрашивании, и FISH лишь подтверждает результаты рутинной цитогенетики. Лимфоидные клетки у больных хроническим лимфолейкозом и, особенно, множественной миеломой кариотипировать значительно сложнее из-за низкого уровня пролиферации (даже при использовании В-клеточных митогенов). В этом случае FISH демонстрирует в несколько раз большую частоту анеуплоидии, чем обычные цитогенетические методики.
Клиническое значение цитогенетических исследований
Диагноз. Потомство клетки с приобретенной цитогенетической аномалией может иметь пролиферативное преимущество и давать начало клону — клеточной популяции, происходящей от одной клетки-предшественницы. Обнаружение клональных хромосомных аномалий способствует постановке диагноза клонального поражения костного мозга. Например, цитогенетический анализ позволяет установить диагноз миелодиспластического синдрома у пациентов с умеренной цитопенией или при наличии в аспирате костного мозга минимально выраженных качественных нарушений гемопоэза.
Присутствие специфических хромосомных аномалий помогает выделить подгруппы пациентов, которым требуется специфическая терапия. Например, транслокация t(15;17)(q22;qll-21) подтверждает диагноз острого промиелоцитарного лейкоза (ОМЛ — МЗ), в комплексном лечении которого используется ретиноевая кислота.
Прогноз. Результаты цитогенетического анализа имеют не только диагностическое, но и прогностическое значение. Например, обнаружение множественных хромосомных аномалий у больных острыми лейкозами до начала лечения является прогностически неблагоприятным и служит основанием для выполнения трансплантации костного мозга или стволовых клеток периферической крови в первой полной ремиссии.
Контроль результатов лечения. Цитогенетический анализ костного мозга пациентов после проведенного лечения помогает контролировать степень элиминации опухолевого клона и, следовательно, полноту ремиссии. Выявление хромосомных аномалий, характерных для опухолевых клеток данного пациента, является ранним признаком, свидетельствующим о приближающемся рецидиве.
Цитогенетический анализ имеет большое значение в диагностике и лечении гематологических заболеваний, которое все возрастает по мере совершенствования методологии и накопления знаний об этиологической и патогенетической роли хромосомных аномалий в развитии этих болезней.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
