Цитофлавин или церебролизин что лучше
Как принимать Актовегин?
Врачи для активизации обмена веществ, улучшения питания и стимуляции процесса восстановления тканей назначают пациентам актовегин. Препарат выпускается в форме таблеток и раствора для инъекций. Основное действующее вещество – депротеинизированный гемодериват. Его получают из крови телят.
При применении препарата повышается поглощение и усвоение кислорода тканями, улучшается транспорт и утилизация глюкозы, ускоряются энергетические процессы, снижается количество лактата, образующегося в условиях кислородного голодания.
Указана минимально возможная цена на товар в городе.
Цены на товар в разных аптеках отличаются.
Для чего назначают уколы взрослым
Почему актовегин запрещён во многих странах
Что лучше взрослому – актовегин или церебролизин
Что лучше взрослым – актовегин или кортексин
Оба препарата выпускаются из природного сырья. Они улучшают обменные процессы в клетках организма и снабжение тканей кислородом, стабилизируют клеточные мембраны. Актовегин – препарат, который относится к метаболическим средствам.
Выпускается в виде раствора для инъекций, который вводят как внутривенно, так и внутримышечно, и в форме таблеток, мази. Препарат назначают не только взрослым, но и новорожденным, детям грудного возраста для лечения заболеваний центральной и периферической нервной системы, нарушений периферического кровообращения.
Побочные действия актовегина
Противопоказания
Актовегин не назначают пациентам, у которых ранее была зарегистрирована повышенная чувствительность к ингредиентам препарата или аналогичных лекарственных средств. Препарат противопоказан при непереносимости глюкозы, недостаточности сахарозы-изомальтозы и глюкозо-галактозной мальабсорбции.
Лекарственное средство беременным назначают в том случае, если польза от его применения превышает риск развития осложнений со стороны матери и плода.
Нейропротекторная терапия: знакомьтесь — препарат Цитофлавин
Опубликовано в журнале:
Амбулаторный прием / Т. 2. № 3 (6), 201 6
А. Л. Вёрткин, Г. Ю. Кнорринг
Московский государственный медико-стоматологический университет имени А. И. Евдокимова
В последние годы заметно растет интерес к исследованиям головного мозга и разработке новых способов коррекции различных нарушений мозговой деятельности. Нейропротекторная терапия относится к наиболее бурно развивающимся направлениям лечения заболеваний и нарушений функций головного мозга.
Появление нейропротекторной терапии во второй половине XX в. обусловлено существенным ростом числа работ, посвященных исследованию нервной системы. Тем не менее головной мозг остается самым малоизученным органом человеческого организма — не столько с точки зрения анатомии, сколько с позиций функциональной организации самой сложной из систем, благодаря которой, собственно, написаны и прочитаны эти строки.
Головной мозг вызывает особый интерес исследователей уже на протяжении многих веков и, конечно, последних десятилетий. Нельзя не отметить, что именно работы российских ученых (Сеченова И. М., Павлова И. П., Лурии А. Р.) сыграли большую роль в формировании представлений о высшей нервной деятельности, когнитивных функциях и памяти (рис. 1).
Рис. 1. Родоначальники учения о когнитивных функциях и их нарушениях
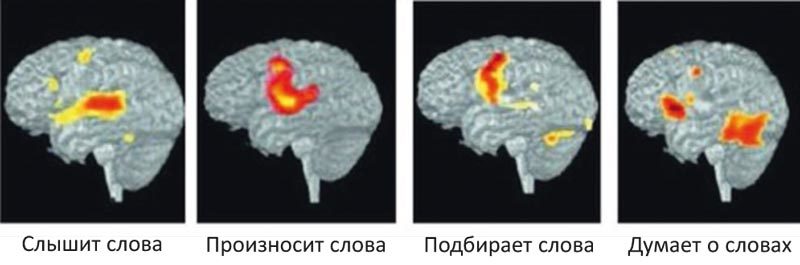
Новые методики, разработанные уже в XXI в., позволили не только точнее распознать анатомические особенности, но и изучить электрическую активность головного мозга, увидеть возбуждение его отдельных структур при разных видах мозговой деятельности (рис. 2).
Рис. 2. Позитронно-эмиссионная томограмма при различных видах мозговой деятельности (A. C. Revkin. Fostering Insights by Engaging the Whole Brain)
Как известно, для деятельности головного мозга необходимо больше энергии, чем для работы любого другого органа: мозг является «лидером» по энергопотреблению в организме. Несмотря на относительно небольшую массу (отношение массы головного мозга к общей массе тела составляет всего 2%), на мозг «работает» 15% сердца, причем он потребляет более 20% кислорода и 80% глюкозы. Интенсивность потребления кислорода нейронами в десятки раз превышает потребности других клеток и тканей, составляя 350–50 мкл О2/г в минуту, в то время как для сердца необходимо 70–90 мкл/г в минуту, для скелетных мышц соответствующий показатель составляет 1,6–2,4 мкл/г, для фагоцитирующих лейкоцитов — 9–24 мкл/г [2].
Мозг в состоянии бодрствования вырабатывает от 10 до 23 ватт электроэнергии (этого хватит, чтобы зажечь лампочку!). Общая длина кровеносных сосудов в мозге превышает 100000 км, а скорость проведения импульсов в нервной системе человека достигает 288 км/ч, и лишь к старости снижается до 220 км/час.
При такой мощной метаболической активности и ювелирности протекающих процессов нервная ткань оказывается достаточно чувствительна к нарушениям кровообращения, гипоксии и иным электролитным, метаболическим и свободнорадикальным сдвигам. Средства антиишемического и антирадикального действия, изначально предложенные для терапии инсультов и получившие название «нейропротекторы», при последующем изучении оказались полезны и при менее значимых нарушениях функций мозга, черепно-мозговых травмах, астенических состояниях, а также в детской практике [2]. Многообразие патофизиологических изменений при заболеваниях мозга стимулировало исследования более чем 1000 субстанций, предположительно, способных повлиять на выживаемость нейронов в условиях недостатка глюкозы и кислорода [12]. Большую часть этих препаратов обычно отбраковывают еще на экспериментальном этапе разработки.
Проведено более 160 клинических исследований нейропротекторов, однако на долю крупных исследований с участием более 200 пациентов приходится только около четверти [11]. На сегодняшний день не удалось продемонстрировать убедительное преимущество подавляющего большинства препаратов при лечении ишемического инсульта, что связано с неудовлетворительным дизайном доклинических исследований, малыми выборками пациентов, невозможностью использовать адекватные дозы препаратов в исследованиях у людей и другими аспектами [10–11].
Нейропротекция — общемировой тренд, объединяющий и неврологию, и терапию, и психиатрию: по мнению многих ученых, именно за нейропротекторами — будущее человечества, все более погружающегося в глубины собственного разума (рис. 3).
Рис. 3. Нейропротекция — общемировой тренд
Один из хорошо изученных комплексных препаратов с доказанной эффективностью — Цитофлавин производства российской научно-технологической компании «Полисан». Состав Цитофлавина представлен комбинацией хорошо изученных веществ, апробированных на практике (табл. 1).
Таблица 1. Состав препарата Цитофлавин
| Основные компоненты, мг | Ампулы | Таблетки |
| Янтарная кислота | 1000 | 300 |
| Никотинамид | 100 | 25 |
| Рибофлавин мононуклеотид | 20 | 5 |
| Рибоксин | 200 | 50 |
| Вспомогательные вещества, мг | ||
| N-метилглюкамин | 1650 | – |
Цитофлавин обладает комплексным действием: способствует компенсации дефицита энергетических субстратов и коррекции нарушений метаболизма, проявляет антирадикальный и антигипоксантный эффекты. Все компоненты препарата являются естественными метаболитами человеческого организма, тропными к нервной ткани.
Янтарная кислота — энергокорректор + антигипоксант — эндогенный универсальный внутриклеточный метаболит, выполняющий в цикле Кребса каталитическую функцию. Янтарная кислота повышает скорость реакций цикла; стимулирует образование АТФ, необходимой для жизнедеятельности. Антигипоксическое действие реализовано вследствие увеличения концентрации ГАМК в мозговой ткани.
Рибофлавин — энергокорректор — флавиновый кофермент (ФАД), активирующий окислительно-восстановительные реакции цикла Кребса.
Никотинамид — антигипоксант + антиоксидант — влияет на окислительно-восстановительные процессы (кофермент НАД). Замедляет развитие энцефалопатии и снижает выраженность ее проявлений.
Инозин — энергокорректор — производное пурина, предшественник АТФ (метаболит). Обладает способностью активировать некоторые ферменты цикла Кребса, стимулируя синтез ключевых веществ. Защищает клетки от действия повреждающих факторов.
Фармакологическое действие
Фармакологические эффекты Цитофлавина обусловлены комплексным действием его компонентов. Препарат стимулирует дыхание и энергообразование в клетках, улучшает процессы утилизации кислорода тканями, восстанавливает активность ферментов антиоксидантной защиты. Он активирует синтез белка, способствует утилизации глюкозы и жирных кислот, а также ресинтезу ГАМК в нейронах.
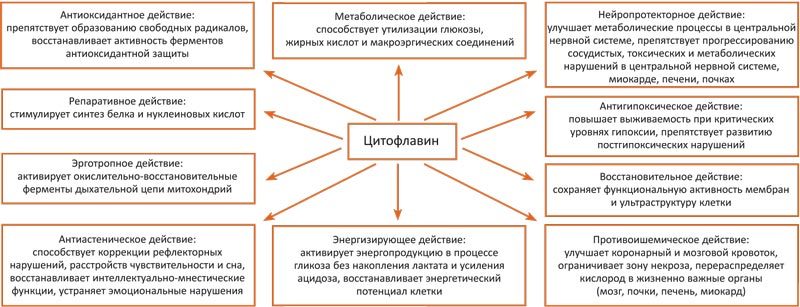
Цитофлавин улучшает коронарный и мозговой кровоток, активирует метаболические процессы в ЦНС, восстанавливает сознание и интеллектуально-мнестические функции мозга, способствует коррекции рефлекторных нарушений и расстройств чувствительности. Благодаря сбалансированному составу препарат оказывает метаботропное, энергокорригирующее действие, активирует сукцинатгидразное окисление, увеличивает содержание ГАМК в головном мозге через шунт Робертса, восстанавливает как НАД-, так и ФАД-зависимые звенья цикла Кребса, ингибирует реакции окислительного стресса. Все это в конечном итоге приводит к оптимизации цикла трикарбоновых кислот, способствуя быстрому ресинтезу АТФ и предотвращая прогрессирование постишемического энергодефицита; таким образом, Цитофлавин оказывает противоишемическое действие, улучшает кровоток, ограничивает зону некроза и апоптоза, обладая выраженными нейропротекторными свойствами (рис. 4).
Рис. 4. Основные фармакологические эффекты и механизмы действия Цитофлавина
Применение Цитофлавина подтвердило его высокую эффективность у пациентов с разными формами цереброваскулярной недостаточности (от острых и острейших проявлений до отдаленных последствий ишемических повреждений головного мозга) [3, 5, 7–9]. Клинический результат при такой широте патологических состояний подчеркивает универсальный характер действия Цитофлавина при разных заболеваниях мозга, что объясняется разносторонним метаболическим действием основных компонентов препарата.
Например, в многоцентровом рандомизированном исследовании (2005; 8 клинических баз) показана эффективность Цитофлавина у больных с острым ишемическим инсультом (n = 300), причем наблюдение за пациентами вели в течение 120 дней [1]. Доказано, что применение Цитофлавина в раннем восстановительном периоде обеспечивает высокую клиническую эффективность (89,4%), положительную динамику неврологического статуса хотя бы по одному симптому (94%), статистически значимое увеличение показателей двигательной активности и речевой функции. Препарат положительно влияет на когнитивно-мнестические функции, улучшая концентрацию внимания и запоминание, увеличивает скорость сенсомоторных реакций, достоверно повышая объем краткосрочной и долговременной памяти, улучшает социальную адаптацию и качество жизни пациентов, положительно влияет на биоэлектрическую активность головного мозга у этой очень сложной в курации категории больных.
Продемонстрирована эффективность Цитофлавина в составе комплексной стандартной консервативной терапии геморрагического инсульта (n = 120) [4]. Результаты лечения заключались в снижении госпитальной летальности; более быстрой активации сознания, опережающей группу сравнения; уменьшении выраженности неврологических симптомов и улучшении функционального исхода к моменту выписки больных из стационара. Кроме того, результаты данного исследования доказали присутствие у больных с внутримозговыми кровоизлияниями окислительного стресса, выраженность которого в острейшем периоде превосходит таковую при инфаркте мозга. В ходе исследования продемонстрировано положительное влияние раннего (с первых 3 суток заболевания) включения Цитофлавина в комплексную терапию не только на клиническую картину заболевания, но и на различные показатели свободнорадикальных процессов кислородного и перекисно-липидного звена [4].
По результатам многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования, проведенного на базе 12 ведущих неврологических школ России, доказана высокая клиническая эффективность приема Цитофлавина внутрь у больных с хронической ишемией головного мозга I, II и III стадии [6]. В исследование включено 600 пациентов (средний возраст 51,3 ± 9,4 года), динамично обследованных в течение 60 дней. Цитофлавин (n = 320) или плацебо (n = 280) назначали по 2 таблетки 2 раза в сутки в течение 25 дней на фоне базисной терапии, включающей антиагреганты (100 мг ацетилсалициловой кислоты ежедневно) и антигипертензивные средства.
Установлено, что у пациентов, получавших Цитофлавин, статистически значимо уменьшилась частота жалоб на головную боль, головокружение, снижение памяти, эмоциональную лабильность и снижение работоспособности. Как показало исследование качества сна по шкале Sleep Quality Scale, к концу терапии в группе Цитофлавина на 26,8% увеличилось число пациентов с нормализацией сна, что сохранилось и на 60-е сутки, тогда как после курса плацебо улучшения удалось достичь у 9,9% пациентов (p
Сравнительный анализ эффективности Церебролизина при лечении пациентов с хронической ишемией мозга.
Сравнительный анализ эффективности Церебролизина при лечении пациентов с хронической ишемией мозга. Фармакоэкономические аспекты
Е.И.Чуканова. Кафедра неврологии и нейрохирургии лечебного факультета РГМУ
В связи с распространенностью сосудистых заболеваний головного мозга, многообразием их форм и особенностями течения (церебрально-сосудистые кризы, транзиторные ишемические атаки (ТИА), инсульты, иногда сочетанные нарушения церебрального и коронарного кровообращения), трудностью и не всегда эффективным лечением нарушений мозгового кровообращения все большее внимание в последнее время уделяется их профилактике, то есть ранней диагностике и лечению хронической недостаточности мозгового кровообращения [2, 3, 5, 6, 11, 12, 14, 16].
Патогенез дисциркуляторной энцефалопатии обусловлен недостаточностью мозгового кровообращения в относительно стабильной форме или в виде повторных кратковременных эпизодов дисциркуляции, которые могут протекать бессимптомно или проявляться клинически. Степень структурных изменений мозга при дисциркуляции может колебаться от изменений в отдельных нейронах, глиоцитах и волокнах белого вещества до инфарктов различной величины и локализации [2, 8, 16], что в итоге про- является очаговыми изменениями вещества головного мозга, диффузными изменениями белого вещества и церебральной атрофией.
В условиях хронической гипоперфузии мозга механизмы компенсации истощаются, энергетическое обеспечение мозга становится недостаточным, в результате чего сначала развиваются функциональные расстройства, а затем и необратимые диффузные морфологические изменения мозга, которые подготавливают мозговую ткань к развитию инсульта. Формирование любого очага ишемического повреждения сопровождается синтезом и секрецией широкого спектра регуляторных пептидов, направленной миграцией воспалительных клеток, активацией разнообразных сигнальных молекул. Показано, что при формировании изменений в зоне инфаркта возникает дисбаланс цитокинового статуса с дефицитом защитных противовоспалительных интерлейкинов и трофических факторов, в частности НРФ [1, 2]. НРФ относятся к физиологически активным полипептидам, которые регулируют рост и дифференцировку нейронов в развивающихся системах и их функциональную стабильность. В зрелом возрасте НРФ защищают нейрональные структуры от травматического, гипоксического, ишемического и других повреждений [2].
Одним из препаратов, обладающим доказанным нейропротективным и нейрорегенерационным действием, является Церебролизин [1, 6, 9, 10]. Он создан на основе естественных нейропептидных и ростовых факторов, выделяемых из головного мозга свиней. Основными механизмами действия церебролизина являются регуляция энергетического метаболизма мозга, собственно нейтрофическое влияние и модуляция активности эндогенных факторов роста, взаимодействие с системами нейропептидов и нейромедиаторов. Экспериментальные исследования показали, что церебролизин уменьшает потребность мозга в кислороде, формируя его повышенную резистентность к факторам гипоксии, доказаны антиоксидантные свойства препарата, обусловленные торможением процессов свободнорадикального окисления и перекисного окисления липидов, а также положительным влиянием на гомеостаз микроэлементов (магния, селена, марганца ванадия), обладающих антиоксидантными свойствами. Также доказано положительное воздействие церебролизина на состояние холинергических нейронов, сопровождающееся достоверным изменением уровня ацетилхолинэстеразы, что по-видимому, является одним из механизмов ноотропного эффекта препарата [9, 10].
Проведено фармакоэкономическое исследование эффективности применения препарата Церебролизин у больных с хронической недостаточностью мозгового кровообращения.
Целью исследования явился фармакоэкономический анализ эффективности лечения церебролизином больных с разными стадиями хронической цереброваскулярной недостаточности. В задачи исследования входило: изучение клинической эффективности церебролизина у пациентов по сравнению с группой контроля, выявление особенностей прогрессирования дисциркуляторной энцефалопатии (ДЭ) и ее исходов у больных основной и контрольной групп, сравнительная оценка экономической эффективности церебролизина.
Материал и методы
Исследуемую группу составили 154 пациента с ДЭ I, II и III стадий, находившихся на амбулаторном лечении и получавших препарат Церебролизин, назначавшийся в дозе 5–10 мл в течение 10 дней. Помимо этого больные исследуемой группы получали «базовую терапию», которая была максимально унифицирована и включала в себя прием аспирина (100 мг/cут), дипиридамола (150 мг/сут), глицина (900 мг/сут) и энапа. Энап назначалася в индивидуальной дозе, в зависимости от стадии АГ и уровня исходного давления. Коррекция АД достигала уровня 120/70 мм рт. ст. – 140/80–85 мм рт. ст. в зависимости от длительности течения АД, степени выраженности перфузионных нарушений головного мозга и исходного уровня АД в начале исследования. При недостаточности эффекта энапа на снижение уровня АД – энап комбинировали с арифоном в дозе 2,5 мг/сут. В группу контроля вошли 118 пациентов с ДЭ, клинически сопоставимых с больными исследуемой группы. Больные контрольной группы получали «базовую терапию», аналогичную с пациентами исследуемой группы. Все больные основной и контрольной групп находились на амбулаторном лечении и наблюдались в течение года.
Неврологический статус пациентов фиксировался до начала включения в исследование, а затем в конце 1-го, 6-го, 12-го месяцев. Основная и контрольная группы были сопоставимы по полу, возрасту, этиологии, тяжести течения и преимущественной локализации патологического процесса. Исследование проводилось открыто. При наборе пациентов использовался метод рандомизации.
Распределение по стадиям ДЭ было: ДЭ I – 40 пациентов, ДЭ II – 51, ДЭ III – 63 больных. Этиологическими факторами ДЭ были: артериальная гипертония – у 57 (37,09%) больных, атеросклероз – у 35 (22,7%), сочетание атеросклероза и артериальной гипертонии – у 62 (40,3%) пациентов. С целью детальной оценки неврологического статуса и возможности последующей обработки данных применялись следующие шкалы: MFI-20, MCA:FMA (Motor Club Assessment: Functional Movement Activities), шкала Тиннетти (Functional Mobility Assessment in Eldery Patients), шкала тревоги Спилбергера (State-Trait Anxiety Inventory), шкала Гамильтона (Hamilton Depression Rating Scale), скрининг-оценка умственного состояния (Mini Mental State Examination MMSE), опросник «Восстановление Локуса Контроля» (Recovery Locus of Control) [7].
В виду разномасштабности и разнонаправленности используемых шкал для удобства изложения и восприятия материала мы сочли удобным описывать динамику упомянутых показателей в терминах относительных изменений, говоря о проценте улучшения (либо ухудшения) соответствующего показателя по отношению к его исходному состоянию. При этом считалось достоверно значимой разница (95%) между показателями исследуемой и контрольной группами, отличающаяся более чем в 2,5 раза; а на 90% – в 2 раза.
Помимо клинического обследования всем исследуемым больным проводились лабораторные, инструментальные и нейровизуализационные исследования.
Результаты исследования
После проведения первого курса лечения церебролизином в дозах 5 и 10 мл/сут прослеживалось статистически достоверно значимое влияние препарата на все исследуемые шкалы, за исключением его влияния на балльную оценку представленности «насильственного смеха и плача». Применение церебролизина в дозе 5 мл/сут курсом 10 дней показало меньший клинический эффект, тем не менее, при рассмотрении влияния церебролизина на выраженность астенического синдрома и показатели эмоционального статуса отмечено, что астенические симптомы регрессировали на 59,6%, представленность цефалгического синдрома снизилась на 91,2%. При этом оценка по шкалам тревоги (9,6±2,5 балла) и депрессии (2,9±0,8) свидетельствовала об отсутствии тревожно-фобических и депрессивных расстройств.
В табл. 1 представлена выраженность клинических проявлений ДЭ к концу первого курса лечения церебролизином по сравнению с группой контроля.
Помимо влияния на выраженность астенического синдрома, тревоги, мотивации и когнитивных нарушений у пациентов с ДЭ I стадией, церебролизин оказался эффективным и в отношении аксиальных рефлексов (16,9 и 23,7%), а также вестибулярной атаксии (20,9 и 37,8%). При анализе клинической картины у пациентов с ДЭ II и ДЭ III отмечено статистически достоверно значимое влияние препарата на балльную оценку шкал «движение», амиостатического синдрома, мозжечковой и лобной атаксии.
К началу проведения второго курса лечения церебролизином у больных с ДЭ I (6-й месяц наблюдения) «следовой» эффект сохранялся при лечении как в дозе 5, так и 10 мл/сут. У пациентов с ДЭ II и ДЭ III соответствующее влияние сохранялось при дозе 10 мл/сут в отношении астенического синдрома, тревоги и мотивации.
После проведения второго курса лечения церебролизином (7-й месяц наблюдения) отмечено статистически более значимое влияние препарата на балльную оценку выбранных шкал (табл. 2), за исключением степени влияния препарата на показатели выраженности астенического синдрома и нейропсихологических характеристик у пациентов с ДЭ I стадии, что связано, скорее всего, с хорошим восстановлением данных функций в результате проведения комплексного лечения. Проведение второго курса лечения церебролизином статистически значимо улучшало показатели шкал движения, атаксии, псевдобульбарного и амиостатического синдромов (ДИ 90–95%).
«Следовой» эффект церебролизина сохранялся до 12-го месяца наблюдения при всех стадиях заболевания.
Согласно результатам анализа, лечение церебролизином в использованных дозах хорошо переносилось больными, процент побочных эффектов составил 2,6% (4 больных).
Фармакоэкономический анализ
В приведенных расчетах учитывались прямые медицинские затраты (без учета расходов на лечение сопутствующих заболеваний): на стационарноелечение, включающее в себя стоимость койко-дней, консультации специалистов, обследования и немедикаментозной лечение; а также прямые немедицинские затраты. Межбольничные различия в тарифах не учитывались.
При подборе ценовых параметров использованы следующие источники: информационный бюллетень «Медицина (медицинские препараты, оборудование, услуги)» агентства «Мобиле», «Фармацевтический бюллетень», «Тарифы на медицинские услуги, предоставляемые взрослому населению в соответствии с Московской городской программой обязательного медицинского страхования». В приведенных расчетах учитывались прямые медицинские затраты: цены на госпитализацию, койко/дни в неврологическом отделении, стоимость консультаций специалистов, стоимость обследований и немедикаментозное лечение; прямые немедицинские затраты. Межбольничные различия в тарифах не учитывались. Стоимость медикаментозного лечения взята единым временным срезом на декабрь 2010 г. и переведена в американские доллары по курсу 1 доллар США = 30,5 руб. Рассчитана стоимость каждой единицы лекарственного средства (таблетка, капсула, флакон, ампула и т. д.) для определения расходов препаратов в условиях стационара и при проведении амбулаторного лечения. Затем стоимость каждой лекарственной единицы умножалась на количество используемых лекарственных единиц, далее стоимость всех лекарственных средств складывалась и делилась на количество больных.
При определение стоимости лечения у пациентов с разными стадиями ДЭ, входящих в основную и контрольную группы (без учета расходов на лечение сопутствующей соматической патологии) на одного больного (законченный случай) учитывались: затраты на проведение базовой терапии, затраты на лечение возникших при назначении «базовой терапии» побочных эффектов, затраты на лечение ТИА, церебрально-сосудистых кризов и инсультов за все время наблюдения; а также подсчет прямых немедицинских затрат. Основным показателем во всех случаях была стоимость лечения из расчета на одного больного.
Основным показателем во всех случаях была стоимость лечения из расчета на одного больного. Определение стоимости базовой терапии у больных основной и контрольной групп с разными стадиями ДЭ показало, что средние затраты на проведение базовой терапии составили 280,6$ US.
Общая стоимость лечения ДЭ разных cтадий, включая стоимость консультаций, обследований, базовой терапии, а также стоимость лечения инсультов и других сосудистых эпизодов, возникших в период наблюдения, включая стоимость прямых немедицинских затрат, составила: при ДЭ I – 1315,92$ US; при ДЭ II – 1820,0$ US; при ДЭ III – 2044,0$ US. С учетом возможности увеличения расходов на лечение при прогрессировании заболевания приведенные цифры должны быть увеличены до следующих величин: при ДЭ I – 2105,4$ US; при ДЭ II – 2912,0$ US; при ДЭ III – 3352,2$ US.
После подсчетов стоимости лечения больных контрольной группы было проведено определение ее в условиях лечения церебролизином. Стоимость медикаментозного лечения – стоимость базовой терапии и церебролизина равнялась при дозировке 5 мл/сут – 373,6$ US, а при дозировке 10 мл/сут – 466,6$ US. В табл. 4 приведен подсчет стоимости ТИА и инсультов, которые развились по различным подгруппам у пациентов, получавших церебролизин.
Суммируя все стоимостные слагаемые можно подсчитать стоимость прямых медицинских затрат на лечение одного пациента за год при назначении церебролизина при различных режимах дозирования (табл. 5)
Зная стоимость непрямых медицинских затрат на 1 пациента с ТИА и инсультом в год (для пациентов исследуемой группы и группы контроля), которая составляла 35,89 и 634,5$ US, можно просчитать стоимость прямых медицинских и немедицинских затрат на 1 больного в год при лечении церебролизином (табл. 6).
Если учитывать стоимость прогрессирования заболевания и развития инсультов и других сосудистых эпизодов, то указанные показатели увеличивались.
При суммировании стоимости консультаций, обследований, базовой терапии, самого препарата церебролизина и дополнительных средств, требующихся для лечения инсультов и других осложнений, возникших во время наблюдения (включая немедицинские затраты) у больных с различными стадиями ДЭ, мы получили следующие стоимостные показатели прямых медицинских и немедицинских затрат на лечение одного пациента в год (табл. 7).
Сравнительные показатели фармакоэкономического анализа затраты–эффективность представлены в табл. 8.
Необходимо также отметить, что в исследовании мы не учитывали косвенных затрат, связанных с установлением инвалидности, что во много раз превышает медицинские (прямые и непрямые) затраты на лечение (особенно у пациентов молодого, трудоспособного возраста). Помимо этого, затраты на реабилитационное лечение больных с инсультом могут существенно увеличивать затраты на профилактическое лечение.
Таким образом, проведенное исследование показало, что церебролизин в суточных дозах 5 и 10 мл в течение 10 дней достоверно улучшает когнитивные функции и снижает выраженность астенического синдрома и депрессии у больных с ДЭ. Церебролизин после окончания курса лечения имеет длительный следовой эффект, продолжающийся до 3–4 мес в связи с дозировкой применяемого лечения. Клинические эффекты церебролизина подтверждаются выявленным значительным снижением темпа прогрессирования ДЭ, а также статистически достоверным уменьшением риска развития ТИА и инсультов. Церебролизин имеет малый процент развития побочных эффектов, хорошо переносится, в том числе и пациентами старших возрастных групп.
Стоимостно-экономический анализ показал, что назначение церебролизина и «базовой терапии» при всех режимах дозирования, несмотря на значительную стоимость нейропротективной терапии, оказалось более экономически выгодно, по сравнению со стоимостью ведения пациентов, получавших только «базовую терапию», направленную на коррекцию факторов риска развития цереброваскулярной патологии, что связано со снижением темпов прогрессирования заболевания и возникновения обострений в течении заболевания – развитии ТИА и инсультов.