Цисты и ооцисты чем отличаются
Ооциста
Смотреть что такое «Ооциста» в других словарях:
ооциста — ооциста … Орфографический словарь-справочник
ООЦИСТА — (от греч. oon яйцо и kystis пузырь) стадия развития простейших клеток споровиков. Представляет собой покрытую плотной оболочкой оплодотворенную яйцеклетку. Содержимое ооцисты делится на несколько неподвижных спор или множество подвижных зародышей … Большой Энциклопедический словарь
ООЦИСТА — (от оо. и греч. kystis пузырь), стадия развития паразитич. простейших класса споровиков. Служит для заражения особей хозяина. Образуется путём инцистирования половой особи (зиготы) после копуляции. Покрыта плотной защитной оболочкой. О.… … Биологический энциклопедический словарь
Ооциста — одна из стадий полового цикла развития споровиков. Образуется из оокинеты. Многократно делится с образованием большого количества спорозоитов (см.). (Источник: «Словарь терминов микробиологии») … Словарь микробиологии
ооциста — (от греч. ōón яйцо и kýstis пузырь), стадия развития простейших классов споровиков. Представляет собой покрытую плотной оболочкой оплодотворённую яйцеклетку. Содержимое ооцисты делится на несколько неподвижных спор или множество подвижных… … Энциклопедический словарь
ООЦИСТА — (oocyst) сферическое образование диаметром 50 60 мкм, которое развивается из зиготы (см. Оокинета) малярийного паразита (Plasmodium) на наружной стенке желудка комара. Ооциста постоянно увеличивается в размерах, а ее содержимое периодически… … Толковый словарь по медицине
ооциста — (оо + циста) оплодотворенная клетка споровиков, имеющая капсулу; в процессе деления образует спорозоиты … Большой медицинский словарь
ООЦИСТА — (от греч. обп яйцо и kystis пузырь), стадия развития простейших кл. споровиков. Представляет собой покрытую плотной оболочкой оплодотворённую яйцеклетку. Содержимое О. делится на неск. неподвижных спор или множество подвижных зародышей… … Естествознание. Энциклопедический словарь
ООЦИСТА — см. оогоний … Словарь ботанических терминов
ооциста — и, ж. Стадія розвитку найпростіших класу споровиків … Український тлумачний словник
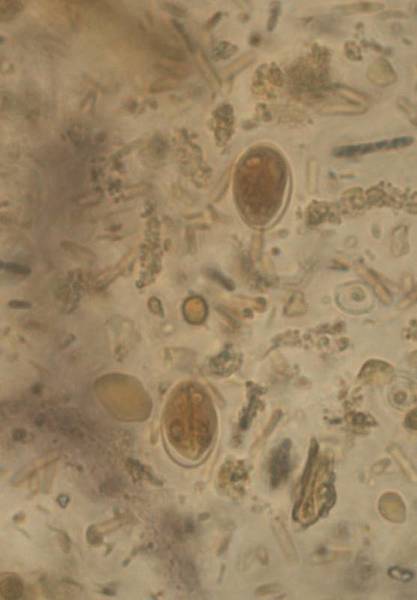
Цисты патогенных кишечных простейших
Простейшие относятся к одноклеточным микроорганизмам. Они могут объединяться в колонии и относятся к особям, легко определяемым при проведении исследований. К основным функциям простейших относится перенесение цист и других форм, поражающих человека. Существует огромное количество данных микроорганизмов, наносящих вред организму. Они отличаются строением, спецификой поведения и местом расположения.
Причины появления цист простейших
Цисты патогенных кишечных простейших – промежуточный этап развития паразитов, наблюдающийся во время перехода от носителя к носителю. Это форма, которая находится в ожидании вплоть до заражения. При этом цисты приобретают оболочку, повышающую устойчивость к внешним раздражителям.
Существует несколько причин проникновения цист простейших в тело носителя и в большинстве случаев вина лежит на человеке. В частности, цисты попадают в организм с сырой водой, немытыми овощами, фруктами и неправильно приготовленным мясом. Также к распространенной причине относятся немытые руки. Способ заражения зависит от вида паразита, а также других факторов.
Процесс заражения – не единственное действие, совершаемое цистами. В человеке они развиваются и растут, ослабляя иммунитет, вызывая различные осложнения, а также нарушая работу органов.
Какие заболевания могут вызвать паразиты?
Наименование и тип заболеваний, вызываемых простейшими, напрямую зависит от вида возбудителя. Существует несколько самих распространенных болезней, которые вызывают простейшие. Среди них можно выделить:
Проведение анализов в медицинских учреждениях
Осуществление каких-либо проверок на цисты простейших дома невозможно, а без них не установить точный диагноз. Строго не рекомендуется ставить его самостоятельно, и тем более проводить дальнейшее лечение без обращения в клиники или аккредитованные лаборатории.
С целью выявления простейших при установлении диагноза проводятся следующие виды анализов:
Лечение осуществляется только при подтверждении заражения паразитом, а также установления его класса и вида. Назначение препаратов и курса лечения – обязанность врача, не рекомендуется заниматься самолечением, используя доступную информацию из статей в газетах и интернете. Это связано с тем, что каждый микроорганизм может оказывать свое влияние и требует индивидуального подхода.
Основной задачей лечения является выведение простейших из организма. Во время прохождения выбранного врачом курса пациент находится под контролем медперсонала – он регулярно сдает пробы кала и другие анализы, а также проходит необходимые процедуры.
Анализ воды на содержание цист простейших
Современные методики позволяют обнаруживать цисты патогенных простейших кишечника не только при обследовании кала и использовании других видов анализов. Поиск цист может производиться в источниках централизованного водоснабжения, ручьях, колодцах, скважинах, а также системах коммунального водоснабжения. Проведение таких исследований позволяет снизить вероятность возникновения вышеперечисленных заболеваний и может применяться в качестве превентивной меры.
Одним из популярных способов является проведение мембранной фильтрации.
Данный метод позволяет обнаруживать паразитарные патогены в случае содержания не менее одного экземпляра в 25 дм³ воды из водоисточников и в 50 дм³ питьевой воды.
Выживаемость цист в воде и почве зависит от их принадлежности к определенному типу. Так, цисты лямблий сохраняют жизнеспособность в воде от 15 до 70 дней, в то время как цисты амеб от 9 до 60 дней, в зависимости от ее типа. Это также следует учитывать при проведении лабораторных тестов.
Проведение анализов в лаборатории «НОРТЕСТ»
Аккредитованный испытательный центр «НОРТЕСТ» проводит анализ воды и почвы на содержание цист простейших патогенных микроорганизмов. Для осуществления исследований мы используем высокочувствительное оборудование и только проверенные методики, что позволяет рассчитывать на высокую точность результатов с минимальными погрешностями. На это также влияет регулярный контроль качества проводимых исследований.
Данная страница не существует!
Услуги инфекционной клиники
Диагностика, профилактика и лечение
Фиброэластометрия и УЗ-диагностика молочных желез, щитовидной железы, мошонки, брюшной полости
Биохимия. Анализ крови: общий, клинический. Анализы на витамины, микроэлементы и электролиты. Анализ на ВИЧ-инфекцию, вирусные гепатиты, бактерии, грибки и паразиты
Максимально точное определение выраженности фиброза печени неинвазивным методом при помощи аппарата FibroScan 502 TOUCH
Гинеколог в H-Сlinic решает широчайший спектр задач в области женского здоровья. Это специалист, которому вы можете полностью доверять
Дерматовенерология в H-Сlinic — это самые современные и эффективные алгоритмы диагностики и лечения заболеваний, передающихся половым путем, грибковых и вирусных поражений, а также удаление доброкачественных невусов, бородавок, кондилом и папиллом
Возможности вакцинопрофилактики гораздо шире Национального календаря прививок. H-Clinic предлагает разработку плана вакцинации и современные высококачественные вакцины в наличии
Терапевт в H-Сlinic эффективно решает задачи по лечению заболеваний, которые зачастую могут становиться большой проблемой при наличии хронического инфекционного заболевания
Врач-кардиолог H-Сlinic проведет комплексную диагностику сердечно-сосудистой системы и при необходимости назначит эффективное терапию. Сердечно-сосудистые проблемы при инфекционных заболеваниях, требуют специфичных подходов, которые мы в состоянии обеспечить
Наша цель — новое качество вашей жизни. Мы используем современные диагностические алгоритмы и строго следуем наиболее эффективным протоколам лечения.
Общая терапия, Инфекционные заболевания, Гастроэнтерология, Дерматовенерология, Гинекология, Вакцинация, УЗИ и фиброэластометрия, Кардиология, Неврология
Биохимия, Общий/клинический анализ крови, Витамины и микроэлементы/электролиты крови, ВИЧ-инфекция, Вирусные гепатиты, Другие инфекции, бактерии, грибки и паразиты, Комплексы и пакеты анализов со скидкой
В наличии и под заказ качественные бюджетные решения и препараты лидер ов рынка лечения инфекционных болезней. Аптека H-Clinic готова гибко реагировать на запросы наших клиентов. Мы поможем с оперативным поиском препаратов, которые обычно отсутствуют в сетях.
Материалы
Методические материалы и пособия
Простейшие человека
ВВЕДЕНИЕ
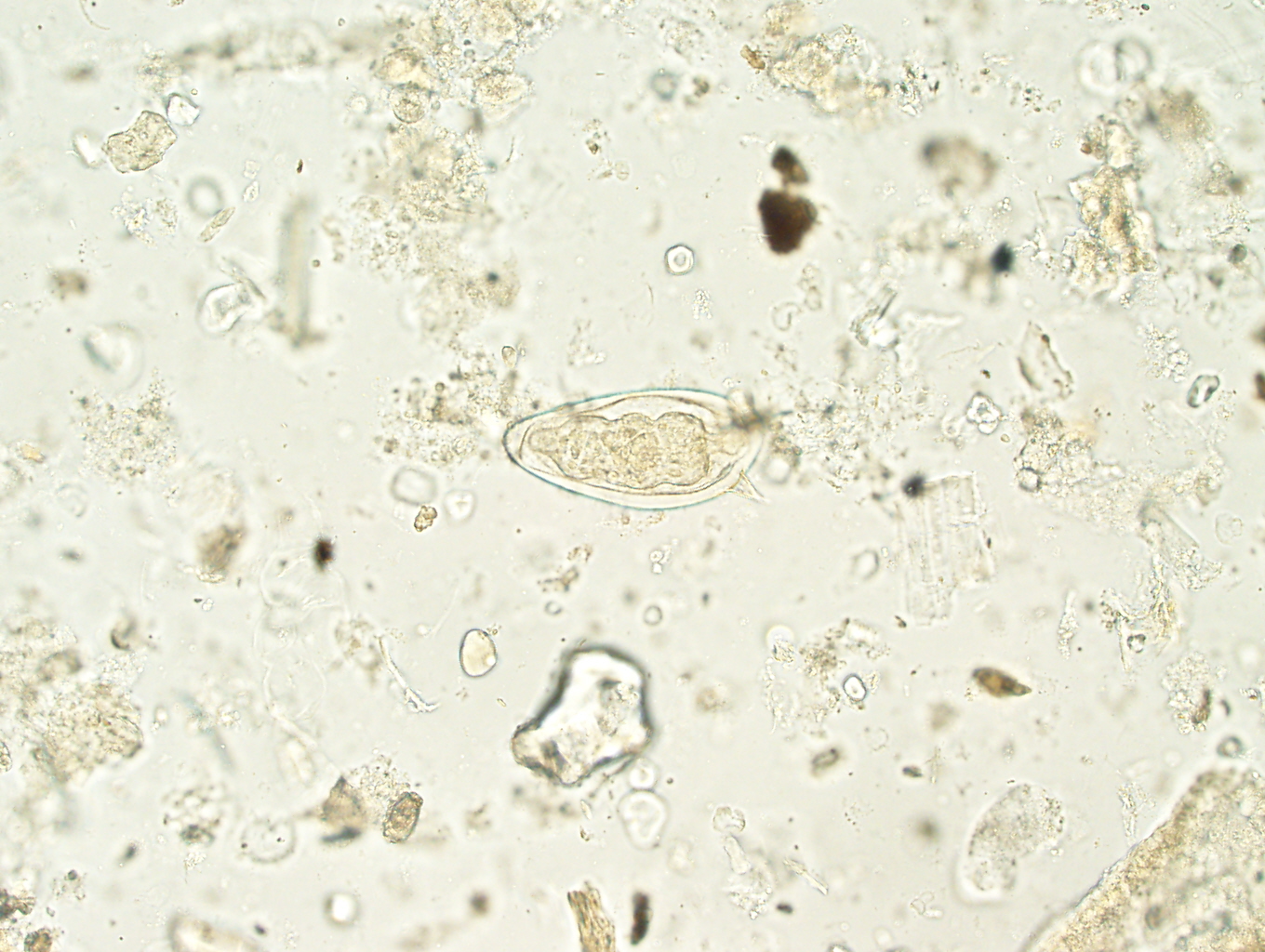
Обнаружение и дифференцирование простейших (отличие патогенных форм от непатогенных) — довольно сложная задача. Большинство одноклеточных организмов в кале обнаруживают в двух формах: вегетативной (стадия трофозоита) — активной, подвижной, жизнедеятельной, легко поддающейся вредным воздействиям (в частности, охлаждению) и потому быстро погибающей после выделения из кишечника, и в виде устойчивых к внешним воздействиям цист (ооцист). В оформленном кале простейшие, как правило, обнаруживают лишь в инцистированном состоянии; для обнаружения вегетативных форм необходимо исследовать кал еще в тёплом состоянии. Это обусловлено тем, что в остывшем кале вегетативные формы простейших быстро гибнут и мертвыми быстро поддаются действию протео-литических ферментов, вследствие чего теряют характерные особенности своей структуры. Кроме того, при остывании уменьшается, а затем исчезает подвижность простейших — важный вспомогательный фактор при их дифференцировании.
В фекалиях можно выявить 20 видов простейших (8 патогенных и условно-патогенных и 12 комменсалов). Простейшие кишечника обитают в тонкой или толстой кишках в стадии трофозоита и/или цисты. Они относятся к одной из 4 групп: амёб, жгутиковых, реснитчатых и кокцидий. Основными и наиболее значимыми простейшими, вызывающими заболевания у человека, являются лямблии, дизентерийная амёба и балантидий.
Подготовка к анализу
Накануне анализа нужно исключить прием слабительных средств и продуктов, вызывающих разжижение стула. Не следует в течение двух суток до анализа применять ректальные свечи, масла и лекарственные препараты для стимуляции перистальтики кишечника. Не принимать в пищу красящие продукты и лекарства.
Взятие биоматериала
Часто проводят взятие биоматериала при подозрении на паразитов и при симптомах, которые они вызывают. Назначают при геморрое, выпадении прямой кишки. Если у пациента стул со слизью и кровяными выделениями. Процедура проводится с использованием специального прибора, состоящего из металлической трубки, аноскопа, осветительной лампочки и других вспомогательных элементов, которые вводятся в анальное отверстие для осмотра.
И только после подтверждения класса и вида паразита врач назначит препараты, соответствующие стадии и продолжительности приобретенного на фоне гельминтов заболевания.
Из-за подверженности вегетативных форм простейших вредным воздействиям, в т.ч. охлаждению, они обнаруживаются в кале только до его остывания (при охлаждении погибают), т.е. примерно 20 минут после сбора материала. Если исследование проводится в более поздние сроки, то анализ выявит только цисты простейших.
Понятие «циста» обычно характерно для описания жизненного цикла некоторых видов бактерий, протистов, и многих одноклеточных. Применимо оно для самого микроорганизма в покоящейся форме и для защитной оболочки, которая образуется как в неблагоприятные моменты, так и в определенный период размножения.
Правила сбора каловых масс
Копропротозооскопия (исследование фекалий на кишечные простейшие)
Метод нативного мазка с физраствором и раствором Люголя
Комплексный метод исследования фекалий на кишечные простейшие и гельминты из консерванта
Метод влажного мазка из консерванта
Метод исследования материала из консерванта формалин-эфирным обогащением
Модифицированный метод окрашивания по Цилю-Нильсену мазков из осадка после обогащения консервированного материала
Метод Бермана в модификации для исследования на балантидиаз
Методы окрашенных мазков на криптоспоридиоз
Морфологическая картина простейших при исследовании
Дизентерийная амёба
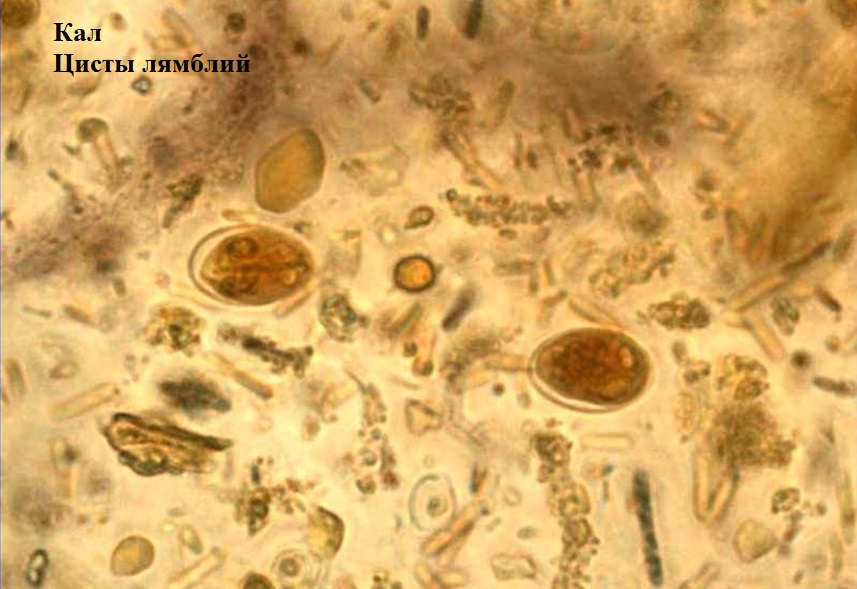
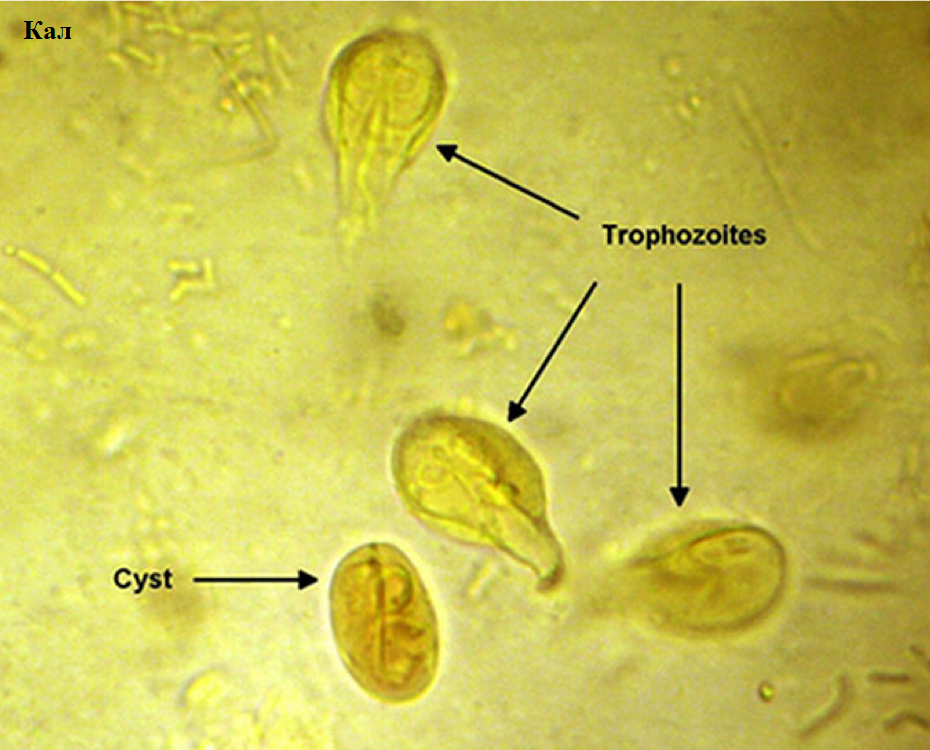
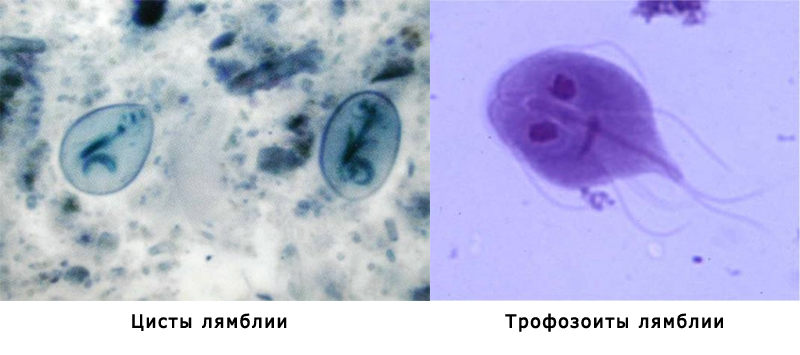
Лямблии
Lamblia intestinalis (лямблии) относится к классу жгутиковых. Лямблии паразитируют в тонкой кишке, преимущественно в двенадцатиперстной кишке, а также в жёлчном пузыре. Существование трофозоитов (вегетативная форма лямблий) требует жидкой среды, поэтому, попадая в толстую кишку, лямблии инцистируются, и в кале обнаруживают только цисты. Лишь при профузной диарее или после действия слабительных в испражнениях удаётся обнаружить вегетативные формы.
Балантидий
Balantidium coli. Балантидий — единственная ресничная инфузория, паразитирующая в кишечнике человека и вызывающая заболевания различной тяжести — от лёгких колитов до тяжёлых язвенных поражений. Возбудитель обнаруживают в фекалиях в форме трофозоитов или цист. Возможно носительство у здоровых людей.
Криптоспоридии
Cryptosporidium. Представителей рода Cryptosporidium в настоящее время рассматривают как важнейших возбудителей диарей. Криптоспоридии (от греч. «скрытая спора») — облигатные паразиты, поражающие микроворсинки слизистых оболочек ЖКТ и дыхательных путей человека и животных. Инфекции ЖКТ, вызванные криптоспоридиями, зарегистрированы во всех странах мира. Такое широкое распространение криптоспоридиоза связано с большим количеством природных резервуаров инфекции, низкой инфицирующей дозой и высокой резистентностью возбудителя к дезинфицирующим веществам и противопаразитарным препаратам.
Среди криптоспоридий потенциально патогенными для человека видами являются Cryptosporidium parvum и Cryptosporidium felis (выявлены у ВИЧ-инфицированных). Наиболее типичная локализация инфекции у человека — дистальные отделы тонкой кишки. У пациентов с выраженными им-мунодефицитами может быть инфицирован весь ЖКТ — от ротоглотки до слизистой оболочки прямой кишки.
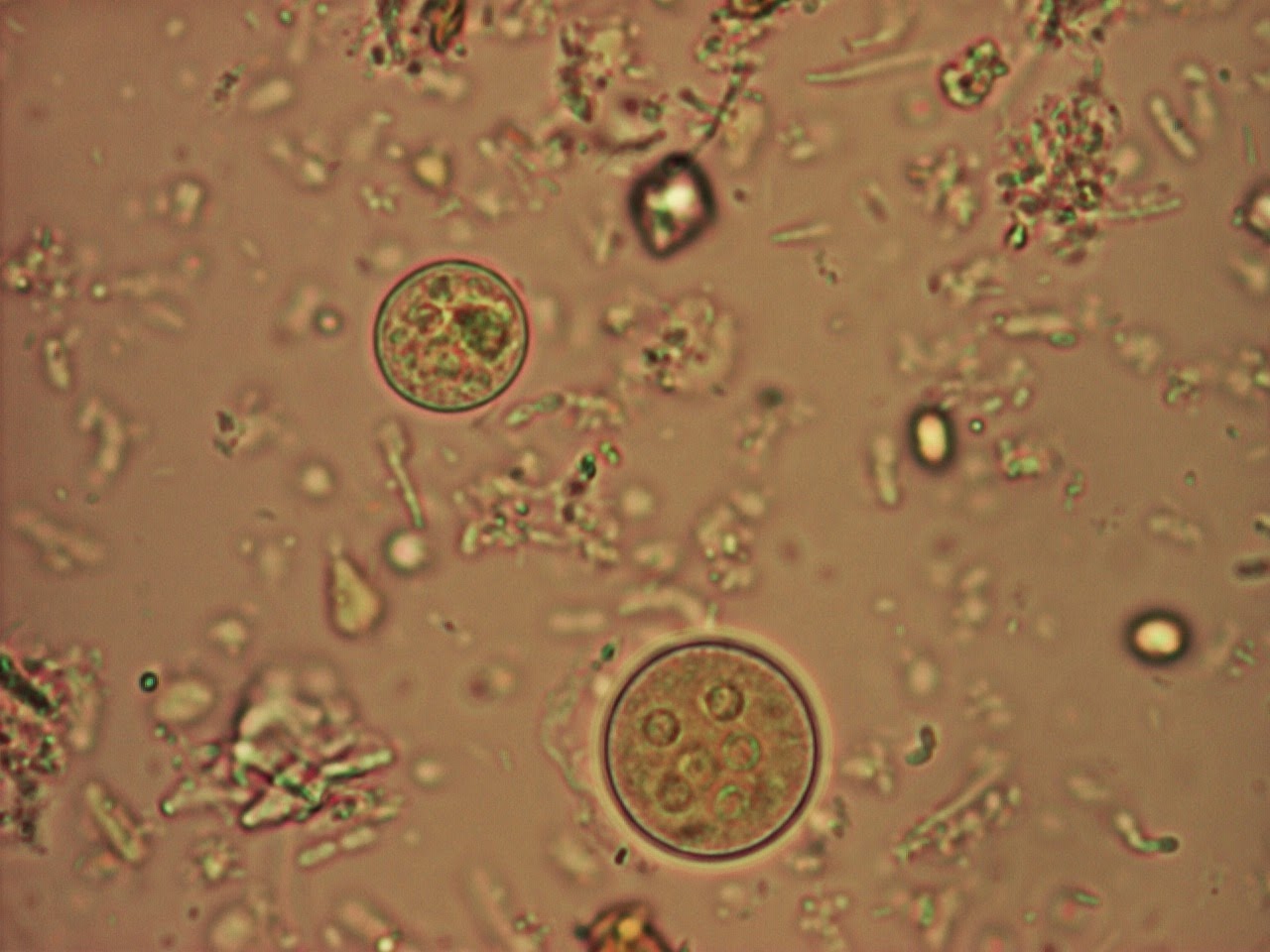
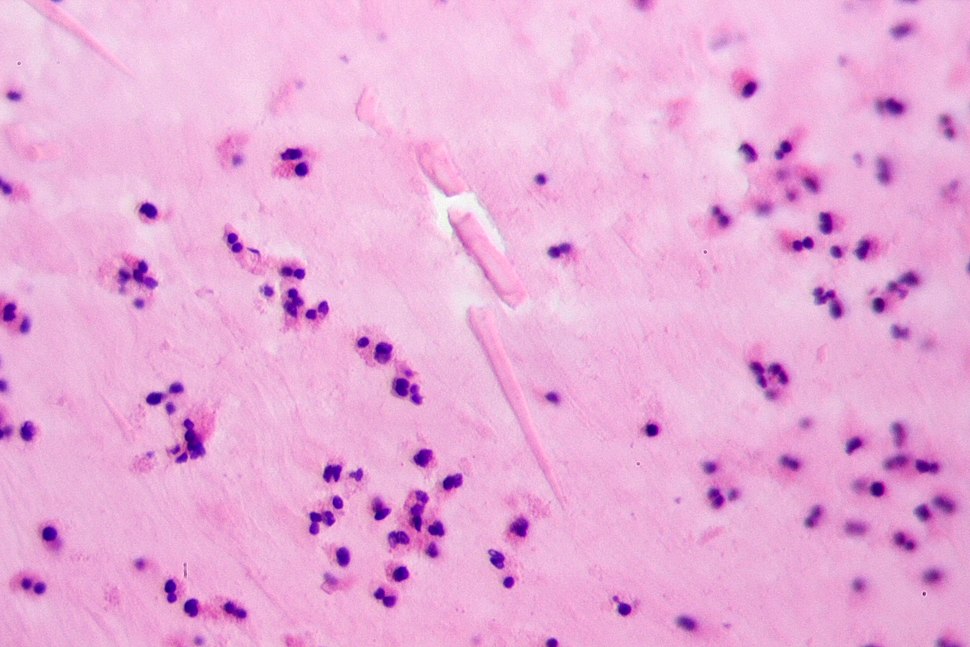
Диагностика криптоспоридиоза в большинстве случаев основана на обнаружении ооцист криптоспоридий в испражнениях и/или (значительно реже) в биоптате слизистой оболочки тонкой кишки при синдроме водянистой диареи. Используют микроскопию приготовленных препаратов, окрашенных по Граму. В большинстве случаев данный метод окраски не позволяет выявить ооцисты, вследствие их слабой способности удерживать краситель и невозможности отличить их от дрожжеподобных грибов. Поэтому применяют окраску на кислотоустойчивость. При таком методе окраски ооцисты криптоспоридий окрашиваются в красный или розовый цвет и хорошо видны на сине-фиолетовом фоне, в который окрашиваются другие микроорганизмы и содержимое кишечника.
При остром криптоспоридиозе количество ооцист в фекалиях велико, что позволяет легко их обнаружить при микроскопии окрашенных препаратов. Однако при хроническом криптоспоридиозе с лёгким течением, когда количество ооцист в кале мало, для повышения вероятности их обнаружения необходимо использовать методики обогащения. В последние годы для диагностики криптоспоридиоза стали часто использовать серологические методы.
Криптоспоридиоз желчевыводящих путей может проявляться холециститом, значительно реже гепатитом (с повышением концентрации билирубина, активности АСТ, АЛТ, щелочной фосфатазы в крови) и склеро-зирующим холангитом. Для диагностики билиарного криптоспоридиоза исследуют биоптаты печени и жёлчь, где можно обнаружить криптоспоридии в различных стадиях развития.
Определение в крови антител к паразитам
Паразитов, поразивших человека, не всегда можно обнаружить при помощи соскоба или анализа кала, так как они паразитируют не только в органах ЖКТ. Именно поэтому специалисты часто настаивают, чтобы пациенты с подозрительной симптоматикой сдавали кровь на антитела к паразитам.
Выделяют следующие факторы необходимости исследования крови на антитела к паразитам:
Высокое содержание АТ к антигенам паразитов в крови бывает возможно и в случае недавно перенесённой инвазии или протекающего в настоящее время. Полученные результаты анализа интерпретируются следующим образом:
Для того чтобы полученный результат был максимально достоверным, к нему следует правильно подготовиться:
По возможности за неделю до проведения анализа следует отменить приём любых лекарственных препаратов. В том случае, когда такой возможности нет, необходимо обязательно сообщить врачу – диагносту об употребляемых медикаментозных средствах. Если этого не сделать, кровь на антитела к антигенам паразитов покажет недостоверные результаты.
Научная электронная библиотека
Осадчук А М, Давыдкин И Л, Гриценко Т А, Язенок Н С, Куртов И В,
3.2. Хроническая диарея при инфекционных заболеваниях кишечника, ассоциированных с ВИЧ-инфекцией
Криптоспоридиоз – кишечное заболевание, вызываемое простейшими рода Cryptosporidium. Возбудители обитают на микроворсинчатом крае кишечного эпителия, вызывая клинические формы инфекции от острого самокупирующегося водянистого поноса до хронических, тяжелых, угрожающих жизни гастроэнтеритов у лиц с иммунными нарушениями.
В20.8 – Болезнь, вызванная ВИЧ, с проявлениями других инфекционных и паразитарных болезней.
Эпидемиология. Распространенность криптоспоридиоза среди населения Российской Федерации варьирует от 2,4 до 4,9 %. В Москве заболеваемость инвазией составляет 3,65 %, в Санкт-Петербурге – 2,7 %, в Нижегородской области – 3,2 % соответственно.
Этиология и патогенез. Криптоспоридии являются облигатными внутриклеточными паразитами, инфицирующими микроворсинки щёточной каёмки слизистых оболочек пищеварительного тракта и дыхательных путей животных и человека. Наиболее частыми возбудителями криптоспоридиоза у ВИЧ-инфицированных являются 2 вида микроорганизма: C. hominis и C. parvum. Описаны случаи заболеваемости человека, вызванные C. felis, C. meleagridis, С. canis, C. muris, C. baileyi. У человека криптоспоридии чаще всего поражают дистальные отделы тонкой кишки, хотя у лиц с иммунодефицитом они могут поражать любые отделы ЖКТ от желудка до прямой кишки, а также желчевыводящие пути, поджелудочную железу, дыхательную систему. Наибольшее клиническое значение имеет C. parvum. В кишечнике паразит прикрепляется к эпителиальным клеткам щеточной каймы, в которой происходят половая и бесполая стадии жизненного цикла. Элементы бесполой стадии: спорозоит → мерозоит → трофозоит → шизонт с 8 ядрами → зрелый шизонт с 8 мерозоитами. Половая стадия: микрогаметоцит → ооциста с 4 спорозоитами. Полный цикл развития происходит в организме одного хозяина. Механизм передачи – фекально – оральный и контактно-бытовой. Естественный источник инвазии для человека – различные сельскохозяйственные животные и грызуны. Криптоспоридиоз может передаваться от человека к человеку. Существует вероятность передачи криптоспоридий половым путем у мужчин-гомосексуалистов (аналогично передаче амеб и лямблий).
Клиника. Манифестация криптоспоридиоза может быть при различных условиях. Приводятся данные, что клинический синдром диареи у 100 % практически здоровых добровольцев развивается при попадании 1000 ооцист и у 20 % – при попадании 30 ооцист криптоспоридий. Более восприимчивыми к криптоспоридиозу являются дети и лица с иммунодефицитами.
У пациентов на поздних стадиях ВИЧ-инфекции возможно несколько вариантов течения криптоспоридиоза: бессимптомное носительство – у 4 % больных; спонтанно разрешающаяся диарея продолжительностью менее 2 месяцев – у 29 % больных; хроническая диарея более 2 месяцев – 60 % и крайне-тяжелая (молниеносная, холероподобная) диарея (с потерей веса более 2 кг/сут) – у 8 % пациентов. Хронические и холероподобные формы заболевания встречаются практически только у ВИЧ-инфицированных с количеством лимфоцитов CD4 менее 100/мкл. В среднем у 88,4 % ВИЧ-инфицированных лиц с криптоспоридиозом определяется лихорадка, у 76,5 % – снижение массы тела, у 75 % – боль в животе, у 23 % – тошнота и рвота. В отдельных случаях у пациентов со СПИДом болезнь может приобретать характер колита с появлением крови и слизи в кале.
Диагностика. Диагностируется криптоспоридиоз путем обнаружения ооцист при исследовании свежего кала. Подтверждением диагноза служит обнаружение ооцист криптоспоридий в испражнениях. Для обнаружения ооцист используют различные методы окраски мазков испражнений (окраска по Цилю-Нильсену или – по Романовскому-Гимзе). Если эти методы дают отрицательные результаты, проводят методы флотации. В последнее время находит широкое применение высокочувствительный и специфичный метод непрямой иммунофлуоресценции. Можно использовать и серологические исследования (иммуноферментный и другие); они дают возможность различать острую и хроническую инвазию.
Лечение. Только восстановление иммунной системы с помощью высокоактивной антиретровирусной терапии (ВААРТ) позволяет вылечить персистирующий криптоспоридиоз. Симптомы криптоспоридиаза обыкновенно исчезают при повышении количества лимфоцитов CD4 до уровня > 100 мкл-1. Для улучшения клинического состояния достаточно лишь небольшого увеличения количества лимфоцитов CD4.
Симптоматическая терапия. В первую очередь, необходимо восполнение потери жидкости, например, с помощью регидратирующих напитков для спортсменов (например, Gatorade), бульона (см. «раздел 3.10» ниже) и пищевых добавок. Иногда требуется назначение парентерального питания. Восполнение жидкости и питательных веществ следует сопровождать назначением противодиарейных препаратов, таких, как лоперамид, парегорик и дезодорированная настойка опия.
Антимикробные препараты. В «Руководстве NIH/CDC/IDSA 2008 г. по профилактике и лечению оппортунистических инфекций», нитазоксанид (1 г внутрь×2 раза в сутки в течение 60 дней во время еды) является единственным рекомендованным антимикробным препаратом, причем только в качестве «альтернативы» симптоматическому лечению.
Прогноз. У пациентов с количеством лимфоцитов CD4 более 100 /мкл криптоспоридиоз обычно проходит самостоятельно через 2–8 недель, так же как у лиц без иммунодефицита. У больных СПИДом с фульминантным или персистирующим хроническим криптоспоридиозом целью лечения является восстановление иммунной системы. При этом даже незначительное увеличение количества лимфоцитов CD4 может привести к исчезновению симптомов и элиминации возбудителя. Это заболевания является показанием к неотложному началу ВААРТ.
Профилактика. Источниками инфекции являются кал инфицированных людей и животных, зараженные продукты питания и вода. Меры профилактики наиболее важны при снижении количества лимфоцитов CD4 до уровня менее 200/мкл. ВИЧ-инфицированным пациентам следует:
– избегать контактов с калом лиц, возможно, зараженных криптоспоридиозом, а также с калом домашних животных, особенно кошек и собак в возрасте до 6 месяцев;
– отказаться от сексуальных ласк, во время которых на слизистую рта могут попасть частицы кала;
– исключить употребление воды из рек и озер;
– воздерживаться от поедания сырых устриц;
– во время вспышек, обусловленных распространением возбудителя с водой, следует кипятить воду не менее 3 минут или использовать бутилированную воду, или фильтровать воду через фильтр с порами 1 мкм.
Необходимо помнить, что рифабутин и азитромицин могут оказывать профилактическое действие.
Следует обращать внимание, что производство бутилированной воды не регламентируется и содержимое многих имеющихся в продаже бутылок с водой не отличается от воды из муниципальных источников водоснабжения, состав которой регламентирован.
Микроспоридиоз – заболевание, связанное с инфицированием микроспоридиями (лат. Microsporidia).
В20.8 – Болезнь, вызванная ВИЧ, с проявлениями других инфекционных и паразитарных болезней.
Эпидемиология. До начала эпохи ВААРТ с микроспоридиозом было связано 20–50 % случаев хронической диареи у пациентов с поздними стадиями ВИЧ-инфекции. В настоящее время заболеваемость и распространенность микроспоридиоза уменьшилась. Так, лишь у 1,5 % пациентов с микроспоридиозом определяется ВИЧ-инфекция при среднем количистве CD4 – 33/мкл.
Этиология и патогенез. Микроспоридии являются облигатными внутриклеточными спорообразующими простейшими, относящимися к классу книдоспоридий. Они способны поражать различные органы и ткани организма: ЖКТ, ЦНС, глаза, мышцы. Наиболее всего микроспоридии тропны к эпителию тонкого кишечника.
Путь передачи заболевания точно не установлен. Заражение наступает при заглатывании или вдыхании спор. Спора паразита имеет хитиновую оболочку. В организме человека из споры выбрасывается полярная трубка, через которую в клетки хозяина поступает спороплазма. В результате размножения спороплазмы образуются спороцисты.
Как и криптоспоридия, микроспоридия может поселяться в кишечнике у ВИЧ-инфицированных людей, и при содержании CD4 + клеток в пределах нормы, не вызывать клинических проявлений болезни. Но при концентрации CD4 менее 100/мкл провоцирует развитие манифестной формы заболевания. Диарейный синдром возникает при появлении микроспоридии двух видов Encephаlitozoon (Septata) intestinalis и Enterocytozoon bieneusi, являющихся возбудителями микроспоридиоза у 80 % больных СПИДом.
Клиника. Манифестная форма микроспоридиоза характеризуется хроническим диарейным синдромом. Больных беспокоит отсутствие аппетита, имеется повышение температуры. Хронический диарейный синдром определяет потерю массы тела, нередко превышающую 10 % исходной массы тела. При этом стул не содержит примеси крови. У пациентов со СПИДом инфекция может иметь генерализованный характер. При этом паразиты обнаруживаются в тканях хозяина могут не вызывать воспалительной реакции, в связи с иммуносупрессией.
Диагностика. В силу малого знакомства врачей-лаборантов с данной патологией и недооценки клиники болезни лечащим врачом диагностика микроспоридиоза затруднена. Диагноз обычно устанавливается при исследовании кала методом световой микроскопии. Для обнаружения спор применяют люминесцентные красители – калькофлуор белый, Chromatope 2R или Uvitex 2B. Данная методика обладает 100 % чувствительностью и 80 % специфичностью. Высокой информативностью в постановке диагноза обладает исследование биоптатов различных отделов тонкого кишечника, окрашенных по Граму, Гимзе или Шиффу, а также электронно-микроскопическое исследование.
Лечение. Оптимальным режимом лечения является назначение ВААРТ, на фоне которой удается достичь адекватного вирусологического ответа и повышения количества лимфоцитов до уровня более 100/мкл. При обнаружении E. bieneusi назначается фумагиллин 20 мг 3 раза в сутки в течение 14 дней. Верификация E. intestinalis свидетельствует о необходимости назначения албендазола в дозе 400 мг внутрь 2 раза в сутки до достижения количества лимфоцитов CD4 более 200/мкл. Также данный препарат рекомендуется для начальной терапии кишечной и диссеминированной формы микроспоридиоза, вызванного Encephаlitozoon (Septata) intestinalis.
Симптоматическое лечение микроспоридиоза проводится с помощью пищевых добавок и противодиарейных препаратов (дифеноксилат/атропин [Ломотил], лоперамид и др.).
Прогноз. При увеличении количества лимфоцитов CD4 до уровня более 100/ мкл клинические симптомы заболевания исчезают. При лечении фумагиллином микроспоридиоза, вызванного E. bieneusi, улучшение наступает на 4 неделе. У пациента пропадает потребность в приеме лоперамида, в кале не обнаруживаются микроспоридии.
Профилактика. В связи с тем, что путь передачи микроспоридиоза точно не установлен, профилактика не разработана.
Изоспороз – заболевание, связанное с инфицированием изоспорами (лат. Isospora belli).
В20.8 – Болезнь, вызванная ВИЧ, с проявлениями других инфекционных и паразитарных болезней.
Эпидемиология. Среди жителей Гаити и Африки больных СПИДом, изоспороз обнаруживается в 15–20 % случаев. Как правило, заболевание развивается у пациентов с количеством лимфоцитов CD4 350/мкл, не получающих профилактику триметоприм/сульфаметоксазол. Болезнь достоверно чаще развивается у мужчин – гомосексуалистов. Изоспороз, длящийся более 1 мес., считается одним из важных диагностических критериев СПИДа.
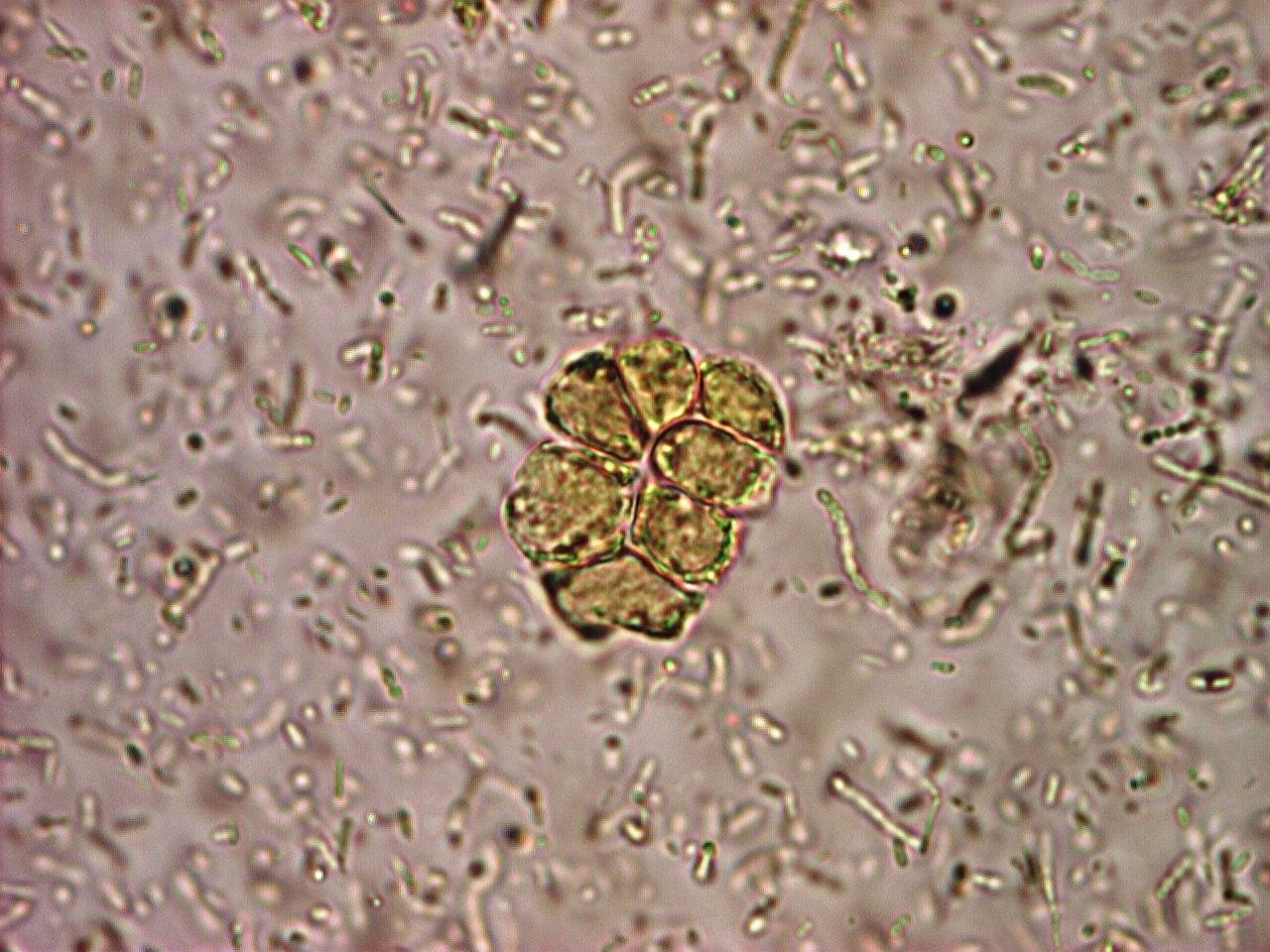
Этиология и патогенез. Возбудитель изоспороза относится к группе кокцидий, паразитирует в клетках эпителия тонкого кишечника. Выделено более 200 видов изоспор, но для человека патогенны только Isospora belli и очень редко – Isospora natalensis. Источник инфекции – больной человек. Заражение происходит оральным путем ооцистой, из которой в кишечнике выходят спорозоиты, проникающие в эпителиальные клетки двенадцатиперстной и тощей кишки. Спорозоиты проходят фазы трофозоита, шизонта, мерозоита. Мерозоиты трансформируются в мужские (микрогамонты) и женские (макрогомонты) половые клетки, в дальнейшем созревающие, соответственно, в микро- и макрогаметы. Повторяющийся процесс бесполого размножения ведет к поражению эпителиального слоя слизистой оболочки кишечника с клиникой диарейного синдрома. Из микро – и макрогамет образуется зигота, превращающаяся в ооцисту, являющейся инфективной формой паразита.
Клиника. Заболевание начинается, как острая форма энтерита. Определяется повышения температуры тела и лихорадка, продолжающаяся в течение недели, водянистая диарея. Возможна тошнота и рвота. В основном заболевание протекает остро, выздоровление наступает примерно через 7–20 дней. Эта фаза соответствует внутриклеточному развитию изоспор, поэтому этиологическая диагностика затруднена. С переходом в мерозоиты паразит выходит из эпителиальных клеток в просвет кишечника, что наблюдается у ВИЧ-инфицированных лиц. У лиц с иммунодефицитом (CD4 менее 200/мкл) возможно развитие диссеминированного изоспороза, способного привести к летальному исходу. Больного беспокоит лихорадка, боли в животе, головная боль, анорексия, общая слабость, может выявляться кровь в кале. В крови определяется выраженная эозинофилия, сохраняющаяся более месяца. На поздних стадиях ВИЧ-инфекции изоспороз, как правило, переходит в хроническую фазу с клиникой хронической диареи и прогрессирующей потерей массы тела, связанной с развитием синдромов мальдигестии, мальабсорбции.
Диагностика. Наибольшей практической значимостью обладает метод обнаружения ооцист в мазках кала, окрашенных на кислотоустойчивые микроорганизмы. Показано, что данный метод исследования является высокоспецифичным и чувствительным в плане диагностики изоспороза. Также с целью диагностирования можно проводить дуоденальное зондирование и биопсию тощей кишки, флотационные методы (Фюллеборна, Дарлинга).
Лечение. При остром течении изоспороза оптимальным является назначение ко-тримаксозола (триметоприм/сульфаметоксазол) по 1 таблетке 160/800 мг внутрь 2 р/ сутки (или эквивалентная доза в/в) в течение 10 дней.
В качестве альтернативных используются схемы:
– пириметамин 50–75 мг/сут внутрь + лейковорин 5–10 мг/сут в течение 10 дней;
– ципрофлоксацин 500 мг внутрь 2 раза в сутки в течение 10 дней. Возможно использование другого препарата из группы фторхинолонов.
ВИЧ-инфицированным с изоспорозом необходима поддерживающая терапия, включающая регидратацию, лечебное питание и ВААРТ.
Прогноз. У больных на поздних стадиях ВИЧ-инфекции клиническое улучшение изоспороза наступает в течение 2–3 дней на фоне применения ТМП-СМК. Даже после исчезновения клинических симптомов выделение паразита с калом во внешнюю среду может продолжаться длительное время.
Профилактика. Профилактика изоспороза заключается в предотвращении загрязнения окружающей среды фекалиями и предупреждении реализации фекально-орального пути передачи возбудителя с помощью методов личной гигиены.
К более редким оппортунистическим инфекциям, вызывающим хроническую диарею у пациентов со СПИдом относятся циклоспороз, бластоцитоз, пневмоцитоз, лейшманиоз и амёбиаз.
Циклоспороз – антропонозноезаболевание, связанное с заражением Cyclospora caetanensis.
В20.8 – Болезнь, вызванная ВИЧ, с проявлениями других инфекционных и паразитарных болезней.
Эпидемиология. Распространенность циклоспороза недостаточно изучена. Эндемические по циклоспорозу являются страны и регионы с субтропическим и тропическим климатом. Циклоспороз часто регистрируется в Перу, Бразилии и Гаити.
Этиология и патогенез. Cyclospora caetanensis относится к простейшим подкласса кокцидий. Возбудитель выделяется из организма с фекалиями в виде ооцист, похожими на ооцисты криптоспоридий. Ооцисты содержат 2 спороцисты, внутри которых расположены 2 спорозоита. Передача происходит водным путем и с продуктами питания. Механизм передачи возбудителя фекально-оральный. Циклоспоры внутриэпителиальные паразиты, живущие в тонком кишечнике. Патогенез заболевания сходен с хронической диареей при криптоспоридиозе.
Клиника. Клиническая симптоматика при циклоспорозе аналогична таковой при криптоспоридиозе и изоспорозе. Также у пациентов регистрируется длительная водянистая диарея, в результате которой пациенты теряют значительную часть своего веса. Основными симптомами, сопровождающими диарею, являются тошнота, рвота, вздутие, ухудшение или отсутствие аппетита, периодически возникающие боли в животе. Кал у больных с циклоспорозом имеет вязкую консистенцию, окрашен в коричнево-зеленый цвет. Повышение температуры не характерно. Достаточно типичными жалобами являются боли в мышцах. У ВИЧ-инфицированных с циклоспорозом возможно спонтанное прекращение диареи, что не наблюдается при криптоспоридиазе и изоспорозе. Циклоспоры способны поражать желчевыводящую систему.
Диагностика. Диагностика заболевания заключается в обнаружении циклоспор в фекалиях с использованием методов обогащения. Препарат окрашивают по Цилю-Нильсену, сафранином по Кестеру и азур-эозином по Романовскому-Гимзе. Возможно использование кислотных красителей.
Лечение. Терапия циклоспороза соответствует таковой у пациентов с криптоспоридиозом (см. выше).
Профилактика. Профилактика заключается в предотвращении загрязнения окружающей среды фекалиями и предупреждении реализации фекально-орального пути передачи возбудителя с помощью методов личной гигиены. Пациентам с иммунодефицитами рекомендуется не посещать эндемические регионы.
Прогноз. Возможно спонтанное излечение, однако без соответствующего лечения достаточно часто возникает рецидив заболевания.
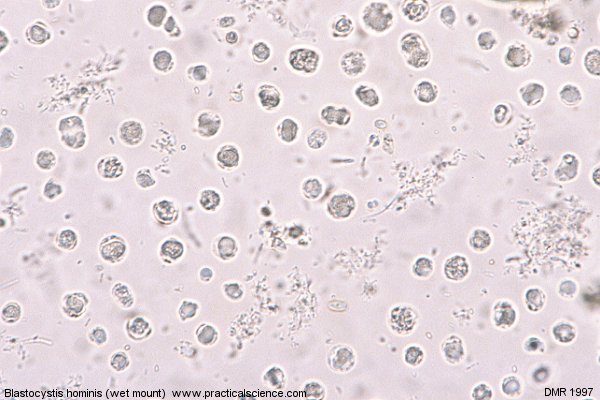
Бластоцитоз – заболевание, вызываемое простейшими организмами, относящимися к роду Blastocystis spp.
В20.8 – Болезнь, вызванная ВИЧ, с проявлениями других инфекционных и паразитарных болезней.
Эпидемиология. Blastocystis hominis широко распространен во всем мире, особенно в тропических странах, где им поражено до 40–76 % населения. В экономически развитых странах инфицировано всего 5 % популяции, преобладают дети и сельские жители. Клиническая картина заболевания нередко отсутствует. Клиническая форма заболевания возникает у 10,8 % ВИЧ-инфицированных с количеством CD4 менее 200/мкл.
Этиология и патогенез. Бластоцистис – полиморфный паразит кишечника человека и животных: приматов, грызунов, птиц, рептилий, амфибий и даже некоторых насекомых. Относится к простейшим. Бластоцисты у человека могут паразитировать изолированно или выявляться в сочетании с другими патогенными микроорганизмами ЖКТ (шигеллы, сальмонеллы и др.). Blastocystis hominis передаются водным и контактно-бытовым путем. Механизм передачи фекально-оральный. Бластоцисты существуют в гранулярной, вакуолярной и амебовидных формах. Как правило, клинической формы заболевания не возникает. В условиях снижения иммунитета Blastocystis hominis способны вызвать развитие энтерита, энтероколита или колита, сопровождающихся хронической диареей. При этом наибольшим образом, поражается толстая кишка. Среди бластоцист различают тонкостенные и толстостенные вакуолярные формы. Тонкостенные формы активно размножаются в кишечнике, а толстостенные осуществляют передачу возбудителя вне организма, т.е. в окружающей среде. Патогенность, жизненный цикл и таксономическое положение возбудителя все еще находятся на этапе обсуждения.
Клиника. У детей, у больных хроническими инфекциями, у лиц с иммунодефицитными состояниями различного генеза в результате бластоцистной инвазии возникают тяжелые кишечные расстройства, сопровождающиеся болями в животе, тошнотой, рвотой, многократным жидким стулом и прогрессирующей потерей массы тела. Характерным является наличие анального зуда. Возможны лихорадка, крапивница, реактивные артриты, головные боли, депрессия, эозинофилия крови.
Диагностика. Бластоцисты хорошо культивируются на питательных средах. Культуральные формы отличаются от форм, полученных из фекалий. В культуре обнаруживаются нетипичные промежуточные стадии развития паразита, которые содержат большое количество вакуолей или, напротив, полностью их лишены.
Диагноз устанавливается при обнаружении бластоцист в мазках фекалий, окрашенных раствором Люголя, или при фазово-контрастной микроскопии.
Лечение. При тяжелой диарее, сочетающейся с выделением Blastocystis hominis, назначают метронидазол (750 мг внутрь 3 раза в сутки в течение 7–10 суток) или триметоприм-сульфаметаксазол (из расчета на сульфаметаксазол по 400 мг внутрь 2 раза в сутки в течение 7 суток).
Профилактика. Профилактика заключается в предотвращении загрязнения окружающей среды фекалиями и предупреждении реализации фекально-орального пути передачи возбудителя с помощью методов личной гигиены. Пациентам с иммунодефицитом рекомендуется не посещать эндемические регионы.
Прогноз. При наличии СПИДа и ассоциации оппортунистических инфекций прогноз заболевания может быть неблагоприятным.
Висцеральный лейшманиоз – зоонозная протозойная инфекция, вызываемая Leishmania infantum, которая характеризуется хроническим течением, гепатоспленомегалией, поражением лимфоидно-макрофагальной системы, потерей массы тела.
В20.8 – Болезнь, вызванная ВИЧ, с проявлениями других инфекционных и паразитарных болезней.
Эпидемиология. Случаи висцерального лейшманиоза обнаруживаются в пределах СНГ относительно редко, преимущественно в Грузии, Азербайджане, Узбекистане, Казахстане. Клинические проявления инфекции наблюдаются в основном у детей младшего возраста. Взрослые болеют висцеральным лейшманиозом редко, среди них преобладают лица с латентной инфекцией. Мужчины болеют лейшманиозом чаще, чем женщины.
Имеются многочисленные сообщения о том, что в странах Средиземноморья (Италии, Испании, Франции, Португалии), эндемичных по висцеральному лейшманиозу, резко возросла заболеваемость среди взрослого населения городов, главным образом горожан, что связано с распространением ВИЧ-инфекции. У 25–75 % взрослых пациентов с висцеральным лейшманиозом обнаруживается ВИЧ-инфекция. При этом 1,5–9 % больных СПИДом страдают от вновь приобретенного или реактивировавшегося, ранее латентно текущего, висцерального лейшманиоза. Для пациентов с сочетанной инфекцией характерна атипичная локализация лейшманий в желудке, тонком кишечнике, отрицательные серологические реакции, тяжелое истощение Т-клеточного звена иммунитета.
Этиология и патогенез. Висцеральный лейшманиоз вызывается паразитирующими простейшими видов L. donovani и L. infantum (в Латинской Америке последний вид именуется L. chagasi). Источник заражения – больной человек и резервуарные животные (собаки, шакалы, лисы и грызуны). Переносчиком служат москиты. Инвазионная форма – промастиготная. Лейшмании попадают в кровь человека с укусом москитов рода Phlebotomus (в Старом Свете) и рода Lutzomya (в Новом Свете). Из крови и лимфы лейшмании проникают внутрь клеток ретикуло-эндотелиальной системы, где принимают лейшманиальную форму и быстро размножаются. Клетки хозяина разрушаются, а паразиты, попавшие в межклеточное пространство, проникают в соседние клетки. Инкубационный период от 20 дней до 10 месяцев. Болезнь может протекать остро или принимать хронический характер (1–3 года). Печень и селезенка резко увеличиваются, происходит расстройство кроветворения, развивается анемия, отмечается неправильная лихорадка. В пораженных тканях развиваются дистрофические и некротические процессы. Без лечения наблюдается высокий процент летальных исходов.
Клиника. Лихорадка, гепатоспленомегалия, желтуха. Висцеральный лейшманиоз и ВИЧ-инфекция отягощают течение друг друга. Наличие висцерального лейшманиоза у пациентов с ВИЧ-инфекцией ухудшает восприимчивость больного к ВААРТ. У ВИЧ-инфицированных с низким числом CD4 + лимфоцитов ( 50 кг в течение 28 дней.
Также для лечения висцерального лейшманиоза успешно применяются амфотерицин B, паромомицин (аминозидин), пентамидин изэтионат, милтефозин, азоловые лекарства: кетоконазол, флуконазол, итраконазол.
Профилактика. Уничтожение больных животных и переносчиков инфекции – москитов. Необходимо использовать меры индивидуальной защиты человека от укусов москитов.
Прогноз. Прогноз заболевания может быть неблагоприятным у пациентов со СПИДом и нерациональном лечении.
Пневмоцистоз – оппортунистическая инфекция, являющаяся лидирующей причиной заболеваемости и смертности больных с различными формами иммунодефицита и вызываемая грибами Pneumocystis carinii, относящимися к классу Pneumocystidomycetes.
В20.6 – Болезнь, вызванная ВИЧ, с проявлениями пневмонии, вызванной Pneumocystis carini.
Эпидемиология. Носителями пневмоцист являются до 10 % здорового населения. Внелегочный пневмоцистоз обнаруживается у 1,6–2,5 % пациентов со СПИДом. Обычно поражение пневмоцистами органов ЖКТ и, в том числе, кишечника наступает при снижении CD4 менее 50/мкл.
Этиология и патогенез. Пневмоцистоз является антропонозным заболеванием. Возбудитель пневмоцистной пневмонии Pneumocystis carinii в морфологическом плане является дрожжевым грибом. Механизм передачи пневмоцистоза – аспирационный, а основные пути передачи – воздушно-капельный, воздушно-пылевой, аэрогенный и ингаляционный.
Возбудитель может неопределенное время находиться на эпителии зева, дыхательных путей больных и здоровых носителей.
Полный цикл развития Pneumocystis carinii /jiroveci протекает двумя фазами: половой и бесполой. В половой фазе размножения в момент заражения зрелые цисты, попавшие в восприимчивый организм, разрываются, высвобождая спорозоиты, часть из которых являются гаплоидами. Они сливаются попарно, образуя трофозоиты, способные развиваться в прецисты и далее в цисты. В бесполой фазе трофозоиты, перетягиваясь, делятся на две клетки, и каждая из них разви- вается в пневмоцисту.
Пневмоцисты обладают выраженным тропизмом к легочной ткани. Заболевание развивается только на фоне иммунодефицитных состояний. Ведущую роль играют нарушения клеточного иммунитета.
Клиника. Pneumocystis carinii у лиц с выраженным иммунодефицитом (при CD4 менее 200/мкл) обусловливает возникновение интерстициальной пневмоцистной пневмонии, проявляющейся лихорадкой, непродуктивным кашлем, одышкой, снижением массы тела и ночной потливостью. В очень редких случаях отмечается колонизация пневмоцистами других внутренних органов, в том числе, пневмоцистоза кишечника. Пневмоцитоз кишечника может возникать после гематогенной или лимфогенной дессиминации из легочной ткани или же клинически выраженное поражение кишечника может возникнуть путем реактивации пневмоцистной инфекции, находящейся там ранее. Пневмоцистоз ЖКТ проявляется потерей массы тела, болью в животе, диареей, кишечным кровотечением.
Диагностика. Диагностика пневмоцитоза кишечника осуществляется, главным образом, эндоскопически с взятием биопсийного материала для морфологического исследования обычно после эпизода пневмоцистной пневмонии. Для диагностики пневмоцистоза также используются иммуноферментный анализ и ПЦР.
Лечение. Препаратом выбора для лечения любой формы пневмоцистоза является триметоприм/сульфаметоксазол, который назначают внутрь или в/в в дозах от 15/75 до 20/100 мг/кг/сут (в 3–4 приема). Практически у половины ВИЧ-инфицированных наблюдаются тяжелые побочные эффекты применения препарата, такие как лихорадка, сыпь, нейтропения, тромбоцитопения, гепатит, гиперкалиемия.
Вместо триметоприм/сульфаметоксазола для элиминации Pneumocystis carinii может применяться пентамидин, назначающийся в дозе 4 мг/кг 1 раз в сутки в/в. Пентамидин часто вызывает побочные эффекты: артериальную гипотонию, нарушения ритма сердца, гипогликемию, сахарный диабет, азотемию, электролитные нарушения, нейтропению.
Для лечения легких и среднетяжелых форм заболевания при непереносимости выше указанных препаратов возможно назначение схем: триметоприм + дапсон внутрь, клиндамицин + примахин + атоваквон. При тяжелом течении применяют триметоприм в/в.
Лечение пневмоцистной пневмонии, как и других форм пневмоцистоза у ВИЧ-инфицированных продолжают в течение 21 сут. Критерием неэффективности антимикробной терапии у ВИЧ-инфицированных служит отсутствие положительной динамики в течение 7 сут.
Профилактика. У ВИЧ-инфицированных с CD4 менее 200/мкл необходимо проведение химиопрофилактики пневмоцистоза. В качестве средств первичной и вторичной профилактики, как правило, используется триметоприм/сульфаметоксазол в дозе 160/800 мг/сут или 80/400 мг в сутки внутрь ежедневно. Возможно использование и альтернативных схем.
Прогноз. У пациентов со СПИДом с CD4 менее 200/мкл прогноз пневмоцистной пневмонии, как правило, плохой.
Гистоплазмоз – синонимы: болезнь Дарлинга, ретикуло-эндотелиоз, ретикуло-эндотелиальный цитомикоз относится к глубоким микозам, характеризуется полиморфизмом клинических проявлений от легких и латентных форм до прогрессирующих заболеваний, заканчивающихся смертью больного.
В20.5 – Болезнь, вызванная ВИЧ с проявлениями других микозов.
Эпидемиология. Для пациентов с ВИЧ-инфекцией с количеством CD4 менее 200/мкл характерно развитие диссеминированного внелегочного гистоплазмоза, регистрирующегося у 0,9 % лиц. Снижение иммунитета существенно повышает риск инфицирования гистоплазмами, особенно в эндемических районах. Например, у 90 % лиц, проживающих в восточных и центральных штатах США, определяются положительные иммунологические тесты на Histoplasma capsulatum. При этом у пациентов с количеством лимфоцитов CD4 менее 100/мкл, проживающих на Среднем Западе или в Пуэрто-Рико и не получающих ВААРТ, риск заболеть гистоплазмозом составляет 2–5 %.
Этиология и патогенез. Возбудитель гистоплазмоза (Histoplasma capsulatum) обитает во влажной почве, богатой органическими веществами, в помете птиц и летучих мышей. Заражение происходит воздушно-пылевым путем. Histoplasma capsulatum является диморфным грибом, существующим в тканевой и культуральной формах. Тканевая форма располагается в клетках органов ретикуло-эндотелиальной системы (печень, селезенка, лимфатические узлы). По форме и размерам (2–4 мкм) этот микроорганизм напоминает лейшмании или токсоплазмы. Мицелиальная форма гриба никогда не встречается в тканях. Она хорошо развивается на питательных средах при температуре ниже 30 °С. Гистоплазмы в обеих фазах являются патогенными для белых мышей, крыс, морских свинок, золотистых хомячков, собак. Гриб длительно сохраняется во влажной почве (6 нед.), в воде, быстро погибает под влиянием различных дезинфицирующих препаратов.
Клиника. Гистоплазмы преимущественно поражают легкие, но у ВИЧ-инфицированных с CD4 менее 150–200/мкл протекает как гематогенно-диссеминированный процесс. Сначала заболевание протекает малосимптомно, затем принимает характер септического процесса: диагностируется высокая лихорадка, лимфаденопатия, гепатоспленомегалия, кашель, похудание.
Дессиминация гистоплазм сопровождается поражением любых органов и тканей организма. Часто поражаются дыхательные пути, печень, селезенка, ротоглотка, тонкий кишечник, толстая кишка и ЦНС. При количестве CD 4 более 300/мкл развивается легочная форма заболевания. Поражение кишечника наблюдается в виде язвенного процесса. Вследствие его прогрессирования возможно развитие таких кишечных осложнений как кровотечение и перфорация с возникновением перитонита.
Диагностика. Посевы крови, секрета дыхательных путей, спинно-мозговой жидкости, биоптатов слизистой оболочки органов ЖКТ, аспиратов костного мозга или материала из очага инфекции. Для определения H. capsulatum применяют микроскопический и гистологический методы. Для определения капсулярного полисахаридного антигена гриба в моче и крови используется иммунологические методы. При исследовании крови отмечается лейкопения и анемия.
Лечение. При среднетяжелом и тяжелом течении назначается липосомальная форма амфотерицина В 3 мг/кг/сут в течение 2 недель или до улучшения состояния. Поддерживающая терапия: итраконазол (раствор для приема внутрь) 200 мг×3 раза в сутки в течение 3 дней, затем 200 мг внутрь 2 раза в сутки. Длительность поддерживающей терапии более 6 месяцев. Альтернативной схемой является назначение амфотерицина B 0,7 мг/кг/сут или липидной формы амфотерицина 5 мг/кг/сут в/в. Обнаружение малосимптомной формы диссеминированной инфекции определяет необходимость назначения итраконазола (раствор для приема внутрь) 200 мг 3 раза в сутки в течение 3 дней, затем 200 мг внутрь 2 раза в сутки не менее 1 года.
Профилактика. Профилактика гистоплазмоза показана ВИЧ-инфицированным с количеством CD4