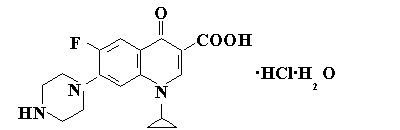Ципрофлоксацин или левомицетин что лучше
Тактика применения уросептиков в общей практике
Основными средствами патогенетической терапии инфекции мочевыводящих путей до сегодняшнего дня остаются уросептики. Важнейшим путем повышения эффективности лечения является не только создание и внедрение новых уроантисептиков, но и совершенствование тактики применения уже имеющихся средств. Препараты, которые относят к уросептикам, сведены в табл. 1.
Таблица 1. Фармакологические препараты, относящиеся к уросептикам
Проблема оптимального выбора уросептика при лечении конкретного больного диктует необходимость ответа на многие вопросы. Прежде всего необходимо выяснить локализацию инфекции мочевыводящих путей, определить вид возбудителя и его чувствительность к выбранному уросептику, остроту воспалительного процесса, функциональное состояние почек. Кроме того, необходимо иметь четкое представление о фармакокинетике и фармакодинамике препарата.
Только после ответа на эти вопросы выбор препарата становится действительно оптимальным.
Говоря о локализации инфекции, нельзя забывать, что даже у одного и того же больного может быть разная микрофлора в паренхиме почек и в мочевыводящих путях.
Как правило, на ранних стадиях заболевания выявляется моноинфекция, при более длительном течении процесса, в случае неадекватной антибактериальной терапии, появляются микробные ассоциации, включающие до двух и трех видов возбудителей, часто как грамотрицательных, так и грамположительных.
Наиболее частыми возбудителями являются кишечная палочка и энтерококки (т. е. облигатная флора кишечника), а также гемолитический вариант кишечной палочки, протей, синегнойная палочка, золотистый стафилококк, клебсиелла. При этом ассоциации различных видов возбудителей при пиелонефрите встречаются в 20—45,5% случаев. Примерно в 15% случаев хронического пиелонефрита не удается выявить возбудителя обычным способом ни в посевах мочи, ни в посевах почечной ткани. Возбудители, трансформировавшиеся в лишенные клеточных стенок формы (L-формы), и микоплазмы требуют для своего выявления сложных диагностических сред и методик.
Идентификация возбудителя позволяет выбрать наиболее эффективный уросептик. В настоящее время существуют четкие рекомендации по выбору уросептика в зависимости от возбудителя, и в литературе информации по этому вопросу достаточно много. В ситуациях, когда нельзя ожидать результатов посева мочи и чувствительности флоры, могут применяться стандартизированные схемы антибактериальной терапии. Например, возможно применение гентамицина, при необходимости в комбинации с цефалоспоринами, или сочетание карбенициллина (пиопена) с налидиксовой кислотой, колимицина с налидиксовой кислотой.
В настоящее время при тяжелых формах урологической инфекции — пиелонефрите, уросепсисе, при устойчивости к другим классам антимикробных веществ, при наличии полирезистентных штаммов бактерий — рекомендуется применять антибиотики группы фторхинолонов.
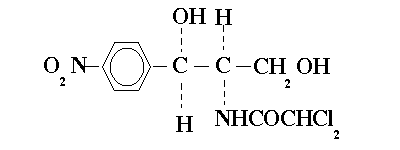
При необходимости проведения терапии уросептиками длительно, со сменой препаратов каждые 7-10 дней, целесообразно последовательно применять препараты, действующие на бактериальную стенку и на метаболизм бактериальной клетки. Рекомендуется последовательное применение пенициллина и эритромицина, цефалоспоринов и левомицетина, цефалоспоринов и нитрофуранов для предупреждения выживания протопластных и L-форм бактерий.
Все перечисленные группы уросептиков хорошо проникают в ткани мочеполовой системы и мочу, где создаются достаточные для получения терапевтического эффекта концентрации. В то же время проверка выделительной функции почек обязательна в каждом случае. При выраженных склеротических изменениях и поражении клубочкового аппарата почек успех лечения уменьшается, а при снижении клубочковой фильтрации до 30 мл/мин проводить антибактериальную терапию нет смысла, т. к. невозможно получить терапевтическую лечебную концентрацию препаратов в почечной паренхиме. Кроме того, резко возрастает опасность развития токсических эффектов. Снижение функциональной способности почек заставляет обращать особое внимание на нефротоксичность применяемых средств.
Практически не оказывают нефротоксического действия фторхинолоны, оксациллин, метициллин, карбенициллин из группы пенициллинов, макролиды, цефалоспорины, левомицетин.
Незначительной нефротоксичностью обладают ампициллин, линкомицин, нитрофураны, налидиксовая кислота, некоторые сульфаниламиды пролонгированного действия. При наличии почечной недостаточности нефротоксичными становятся тетрациклины. Всегда высоко нефротоксичны аминогликозиды (гентамицин, стрептомицин, торбамицин, канамицин).
Нефротоксические эффекты препаратов усиливаются при выраженной дегидратации и при одновременном приеме диуретических средств.
Одним из важнейших критериев выбора препарата является рН мочи. Максимальную эффективность в щелочной среде при рН = 7,5—9,0 проявляют аминогликозиды и макролиды, по мере снижения рН мочи их активность снижается. Не зависит от рН мочи эффективность цефалоспоринов, фторхинолонов, гликопротеидов, тетрациклинов, левомицетина. В кислой среде при рН ≤ 5,5 наиболее эффективны пенициллины, производные нафтиридина, нитрофурана, хинолона, 8-оксихинолона, метепамин. Все эти препараты значительно снижают свою активность по мере ощелачивания среды.
С целью повышения щелочности мочи возможно назначение молочно-растительной диеты, бикарбоната натрия. Для снижения рН мочи (ее подкисления) увеличивают потребление хлеба и мучных изделий, мяса и яиц. Назначают аммония хлорид, аскорбиновую кислоту, метионин, гиппуровую кислоту (которая содержится, например, в соке клюквы). Любое вещество, снижающее рН мочи ниже 5,5, тормозит развитие бактерий в моче.
При наличии микробных ассоциаций возможно использование сочетания двух уросептиков.
Хорошую совместимость с большинством антимикробных препаратов и отсутствие нежелательных реакций при комбинированной антибактериальной терапии имеют фторхинолоны.
β-лактамы (пенициллины, цефалоспорины), аминогликозиды и полипептиды обладают синергизмом действия, их можно сочетать при тяжелых формах инфекции. При этом все перечисленные группы антибиотиков при взаимодействии с тетрациклинами, макролидами, линкомицином проявляют антагонизм.
Левомицетин, тетрациклины и макролиды при совместном назначении проявляют индифферентность. Нитрофурантоин ослабляет действие налидиксовой кислоты. Считается нецелесообразным назначать следующие сочетания: фурагина с левомицетином, фурагина с сульфаниламидами, левомицетина с сульфаниламидами, метенамина с сульфаниламидами.
Как выбор комбинации препаратов, так и необходимая длительность курсовой терапии и путь введения препаратов зависят от локализации инфекции, остроты процесса, возбудителя.
Дозы препаратов для курсовой терапии приведены в табл. 2. При проведении лечения следует помнить, что к некоторым препаратам развивается резистентность микроорганизмов. Особенно это надо учитывать, если необходима интермиттирующая терапия. Предпочтение следует отдавать препаратам, к которым резистентность развивается относительно медленно: это фторхинолоны, ампициллин, левомицетин, депо-сульфаниламиды. Особенно медленно вырабатывается резистентность к фурагину, поэтому этот препарат является важнейшим при проведении длительного интермиттирующего лечения.
Довольно быстро и часто развивается резистентность микроорганизмов к налидиксовой кислоте, оксолиновой кислоте, тетрациклинам, стрептомицину, цефалоспоринам.
Учитывая сказанное, всегда следует выяснять, какие препараты использовались в проводившейся ранее терапии, и оценивать степень их эффективности.
Необходимо также уточнять побочные действия, имевшие место на фоне ранее проводившейся терапии, и принимать во внимание возможность их возникновения на фоне проводимого лечения.
Все вышеизложенное указывает на то, что даже при наличии массы рекомендательной литературы с большим количеством различных схем терапии — подход к лечению инфекции мочевыводящих путей не может быть механическим и требует индивидуального выбора тактики терапии для каждого конкретного больного.
Этиотропная терапия острых кишечных инфекций
Доступность статистической информации о заболеваемости острыми кишечными инфекциями (ОКИ) в Российской Федерации не улучшается.
Доступность статистической информации о заболеваемости острыми кишечными инфекциями (ОКИ) в Российской Федерации не улучшается. Сложности в получении объективной информации о фактической этиологической структуре ОКИ ведут к тому, что практические врачи ориентируются в большинстве случаев на собственный опыт и региональные данные. Активное внедрение в практическую деятельность стационаров страховой медицины требует максимального снижения стоимости обследования и лечения пациентов и, как следствие, ведет к упрощению диагностики, зачастую в ущерб ее качеству, а также применению препаратов преимущественно отечественного производства.
Ежегодно в США патогенные микроорганизмы, передающиеся пищевым путем, вызывают около 76 млн случаев кишечных инфекций, в том числе 325 000 больных госпитализируется и 5 000 умирает. Только число случаев шигеллеза по оценкам экспертов составляет около 450 000, из них около 6 000 госпитализируется; а инфекции, вызванной норовирусами, — около 23 млн., из которых почти 40% связано с пищевым путем передачи. Число же официально регистрируемых случаев ОКИ в Российской Федерации в десятки раз меньше и не превышает 700 000 в год.
Немаловажной проблемой диагностики кишечных инфекций является формальный подход не только к назначению диагностических исследований, но и к оценке их результатов. Так, например, проведенный нами анализ 1522 историй болезни пациентов гражданских и военных стационаров, перенесших ОКИ в 2003–2006 гг., показал, что при поступлении их в стационар осмотр стула не проводился или данные о результатах осмотра отсутствуют в 31,4% историй болезни при легком течении заболевания, 16,6% — средней степени тяжести и 42,7% при тяжелом течении. Отсутствие патологических примесей в испражнениях отмечено у 32,8% больных с легким течением кишечной инфекции, 21,9% — среднетяжелым и даже у 6,1% — тяжелым.
Копрологические исследования чаще всего не проводятся при тяжелом течении болезни — 36,14%, в то время как при легком течении и средней степени тяжести болезни таких случаев было достоверно меньше — 11,06% и 5,78% соответственно (p > 0,001). При копрологическом исследовании патологических изменений в копрограмме не обнаружено в среднем у 29,83% больных при легкой степени тяжести кишечной инфекции, 11,02% — средней и 7,84% тяжелой. В то же время, несмотря на выявление копрологических признаков колита у 13,6% пациентов с острым гастроэнтеритом и у 25,5% острым энтеритом, изменения в окончательный диагноз внесены не были. А в тех случаях, когда в диагнозе отмечено наличие колита, копрологические признаки отсутствовали у 50,6% больных острым гастроэнтероколитом 46,1% — острым энтероколитом.
Диагностические посевы испражнений выполнялись у 49,0% пациентов двукратно, 23,5% — трехкратно и 17,0% — однократно. С увеличением степени тяжести эпизода ОКИ увеличивалась доля пациентов, у которых диагностические исследования проводились однократно. Так, при легком течении заболевания в 57,5% случаев выполнены три и более диагностических посева испражнений для выявления патогенной микрофлоры и всего лишь в 18,8% случаев исследования выполнялись однократно. При средней степени тяжести инфекции трехкратные посевы проведены в 19,9%, а однократные — в 15,6% случаев, в то время как у 64,5% больных выполнено два посева. При тяжелом течении заболевания в 44,4% случаев микробиологические исследования выполнены лишь один раз. Вместе с тем серологические исследования с целью установления этиологии заболевания проводятся чаще при тяжелом течении болезни — 58,54%, чем при среднетяжелом — 25,2% и легком — 19,22% (p Купить номер с этой статьей в pdf
Антибактериальные средства
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В начале нынешнего столетия арсенал офтальмолога при лечении инфекционных поражений глаз был более чем скромен. Так, известны рекомендации использовать субконъюнктивальные инъекции цианида ртути при «опасно поврежденных или инфицированных глазах». В 1938 г. Домагк получил Нобелевскую премию в области медицины за исследования антибактериальных свойств p-sulfamylchysoidine. Внедрение сульфаниламидов было первым достижением, коренным образом изменившим подходы к лечению инфекционных заболеваний. Вторым принципиально новым шагом было открытие антибиотиков [1, 7].
Фторхинолоновые производные:
ципрофлоксацин, офлоксацин, норфлоксацин
Аминогликозиды:
гентамицин, тобрамицин, неомицин
Полимиксины:
полимиксина В сульфат
Тетрациклины:
тетрациклин, грамицидин, сульфацил-натрий
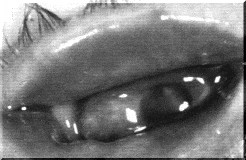
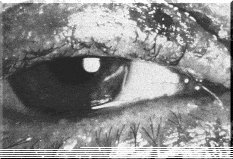
Рис. 1. Бактериальный коньюнктивит
История хинолонов началась со случайного открытия антибактериального действия вещества, обнаруженного при перегонке в процессе синтеза хлороквина. На основании изучения этого вещества была синтезирована налидиксовая кислота, которая была активна в отношении грамположительных микроорганизмов. Аналоги данного соединения, содержащие атом фтора, имели более широкий спектр антибактериальной активности. Отличительной чертой хинолонов является способность подавлять функционирование нуклеиновых кислот в самой бактериальной хромосоме. По отношению к фторированным хинолонам резистентность со стороны микроорганизмов развивается весьма редко [4, 5]. Ципрофлоксацин
(Ciprofloxacinum)
Синтетический антибиотик фторхинолонового ряда широкого спектра действия, эффективный в отношении как грамотрицательных, так и грамположительных микроорганизмов. Ципрофлоксацин отличается от других препаратов хинолонового ряда наличием атома фтора в 6-м положении, пиперазиновой структуры в 7-м положении и циклопропилового кольца в 1-м положении.
После инстилляций возможна системная абсорбция препарата. Так, при закапывании в оба глаза 0,3% раствора ципрофлоксацина каждые 2 ч с момента утреннего пробуждения в течение 2 дней с последующим закапыванием каждые 4 ч с момента пробуждения еще в течение 5 дней максимальная концентрация ципрофлоксацина в плазме крови составила 5 нг/мл. Средняя концентрация составляла менее 2 нг/мл.
Ципрофлоксацин проявляет активность в отношении большого количества грамотрицательных и грамположительных микроорганизмов в исследованиях in vitro. Бактерицидное действие препарата объясняется воздействием на ДНК-гиразу, необходимую для синтеза ДНК бактерий. Ципрофлоксацин активен против следующих микроорганизмов:
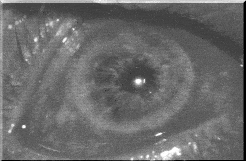
Рис. 2. Бактериальный конъюнктивит
Показана активность ципрофлоксацина против следующих микроорганизмов in vitro:
Среди других микроорганизмов следует отметить умеренную чувствительность к ципрофлоксацину со стороны Chlamydia trachomatis и Mycobacterium tuberculosis.
Ципрофлоксацин не дает перекрестной реакции с другими антимикробными препаратами, такими как b- лактамные антибиотики и аминогликозиды, поэтому микроорганизмы, устойчивые к этим препаратам, могут оказаться чувствительными к ципрофлоксацину. Клинические исследования показали, что на фоне терапии ципрофлоксацином в виде глазных капель отмечается излечение 76% больных с язвами роговицы, положительными по результатам бактериологических исследований. Полного восстановления эпителиального покрова роговицы удавалось достичь в 92% случаев язвенного корнеального поражения. Расширенное клиническое исследование показало, что через 3 и 7 дней закапывания у 52% больных с конъюнктивитом и положительными результатами бактериологических культуральных исследований наступало клиническое выздоровление и к моменту прекращения инстилляций было уничтожено 70-80% всех причинных микроорганизмов.
Показания. Закапывание глазных капель 0,3% раствора ципрофлоксацина показано при инфекционном поражении глаза чувствительными к антибиотику микроорганизмами: при язвах роговицы, вызванных Pseudomonas aeruginosa, Serratia marcescens, Staphylococcus aureus, S. epidermidis, Stre p tococcus pneumoniae, Streptococcus группы Viridans; при конъюнктивитах, вызванных Haemophilus influenzae, Staphylococcus aureus, S. epidermidis, Streptococcus pneumoniae.
Для лечения язв роговицы рекомендуется закапывание 2 капель 0,3% раствора ципрофлоксацина в пораженный глаз каждые 15 мин в течение первых 6 ч, а затем по 2 капли раствора каждые полчаса в течение дня. На 2-й день закапывают по 2 капли в пораженный глаз каждый час. С 3-го по 14-й день по 2 капли в пораженный глаз закапывают каждые 4 ч. Лечение может быть продолжено и после 14-го дня, если эпителизация роговицы не наступила. При бактериальном конъюнктивите 1 или 2 капли инстиллируют в конъюнктивальную полость каждые 2 ч с момента утреннего пробуждения в течение 2 дней и по 1-2 капли каждые 4 ч в течение последующих 5 дней.
Офлоксацин
(Ofloxacin)
Химическая структура офлоксацина отличается от структуры других хинолоновналичием шестичленного (пиридобензоксазинового) кольца с 1-й до 8-й позиции базовой циклической структуры.
Фармакокинетика офлоксацина изучалась при проведении 10-дневного курса закапывания 0,3% раствора антибиотика. Средняя концентрация офлоксацина в сыворотке крови варьировала от 0,4 до 1,9 нг/мл. Максимальная концентрация офлоксацина в сыворотке через 10 дней лечения оказалась более чем в 1000 раз ниже таковой после стандартной дозировки этого препарата per os. Средний уровень офлоксацина в слезе через 4 ч после инстилляции составлял 9,2 мкг/г. Офлоксацин выделяется с мочой в неизмененном виде.
Офлоксацин in vitr o проявляет активность против широкого спектра грамположительных и грамотрицательных аэробных и анаэробных бактерий. Бактерицидное действие офлоксацина проявляется через подавление ДНК-гиразы, важнейшего фермента бактерий, критически необходимого для удвоения, транскрипции и восстановления бактериальной ДНК. В отношении офлоксацина и других фторхинолонов показано наличие перекрестной резистентности, хотя таковая отсутствует для офлоксацина и других классов антибиотиков. Таким образом, микроорганизмы, устойчивые к b- лактамным антибиотикам или аминогликозидам, могут оказаться чувствительными к офлоксацину, и наоборот.
Применение офлоксацина показано при конъюнктивитах, вызванных чувствительными к антибиотику штаммами следующих микроорганизмов:
Минимальная ингибирующая концентрация (70% МИК, т. е. концентрация, необходимая для подавления 70% штаммов возбудителя; чем ниже величина 70% МИК, тем более сильное действие оказывает антибиотик) для офлоксацина примерно вдвое меньше 70% МИК для гентамицина в отношении Staphylococcus aureus. Офлоксацин превосходит по эффективности в отношении Staphylococcus epidermidis такие антибиотики, как левомицетин и гентамицин. Офлоксацин вдвое активнее левомицетина в отношении Streptococcus pneumonia. Активность офлоксацина превышает таковую тобрамицина в отношении Klebsiella pne umonia в 32 раза, и его 70% МИК ниже, чем 70% МИК тобрамицина в отношении Pseudomonas aeruginosa.
Cтандартной схемой назначения препарата является следующая: закапывание 1-2 капель 0,3% раствора офлоксацина в конъюнктивальную полость пораженного глаза каждые 2-4 ч первые 2 дня и затем каждые 4 ч последующие 5 дней.
Фторхинолоновый антибиотик для инстилляций, отличающийся от других фторхинолонов наличием атома фтора в 6-м положении и пиперазиновой структуры в 7-й позиции. Так, показано, что наличие атома фтора в 6-м положении повышает эффективность препарата в отношении грамотрицательных бактерий, а пиперазиновая структура обеспечивает активность в отношении псевдомонад. Норфлоксацин подавляет синтез ДНК бактерий, что позволяет считать препарат бактерицидным [2, 8].
Показана активность препарата in vitro и в клинических исследованиях в отношении большинства штаммов следующих микроорганизмов:
Норфлоксацин активен in vitro в отношении следующих микрорганизмов (клиническая активность не установлена):
Гентамицина сульфат
(Gentamicini sulfas)
Водорастворимый антибиотик группы аминогликозидов, выделяемый из культуры Micromonospora purpurea [3].
Гентамицина сульфат проявляет in vitro активность в отношении целого ряда штаммов следующих микроорганизмов:
Staphylococcus aureus, S. epidermidis, Streptococcus pyogenes, S. pneumoniae, Enterobacter aerogenes, Escherichia coli, Haemophilus influenzae, Klebsiella pneumoniae, Neisseria gonorrhoeae, Pseudomonas aeruginosa, Serratia marcescens.
Аминогликозид, антибактериальное действие которого связано с подавлением синтеза белка за счет образования связи с РНК рибосом, что затрудняет считывание генетического кода бактерий. Неомицин оказывает бактерицидное действие в отношении целого ряда грамположительных и грамотрицательных микроорганизмов. Чаще используется в комбинированных препаратах.
Полимиксина В сульфат
(Polymyxini B sulfas)
Антибиотик из группы полимиксинов с бактерицидной активностью в отношении большого количества грамотрицательных микроорганизмов. Полимиксина В сульфат способен увеличивать проницаемость стенки бактериальной клетки путем взаимодействия с фосфолипидными компонентами мембраны. Системная абсорбция после инстилляций полимиксина выражена незначительно. Закапывание препарата в дозе 10 000 ЕД в 1 мл приводит к максимальному повышению его уровня в сыворотке крови до 1 ЕД/мл. Данный антибиотик чаще всего используется в сочетании с неомицином.
Тетрациклина гидрохлорид
(Tetracyclini hydrochloridum)
Используется для лечения поверхностных инфекционных поражений глазного яблока, а также для профилактики офтальмии новорожденных, вызванных Neisseria gonorrhoeae или Chlamydia trachomatis.
Чувствительность к тетрациклину проявляют следующие микроорганизмы:
Staphylococcus aureus, стрептококки, включая S. pneumoniae, Escherichia coli, штаммы Neisseria, Сhlamydia trachomatis.
Препарат назначают в виде 1% мази или суспензии.
Грамицидин представляет собой смесь трех антибактериальных соединений (грамицидинов A, B и C), образующихся в результате роста Bacillus brevis.
Бактерицидное действие грамицидина распространяется на большое количество грамположительных микроорганизмов. Данный антибиотик повышает проницаемость клеточной стенки бактерии путем формирования сети каналов в мембране микроорганизма. Чаще используется в комбинации с другими антибиотиками.
Сульфацил-натрий
(Sulfacylum-natrium)
Сульфаниламиды являются бактериостатическими препаратами. Они подавляют бактериальный синтез дегидрофолиевой кислоты, препятствуя соединению птеридина с аминобензойной кислотой путем конкурентного подавления активности фермента дегидроптероатсинтетазы. Возможно развитие резистентности к данному препарату по двум механизмам:
Местное применение сульфаниламидов эффективно в том случае, когда возбудителем инфекционного заболевания глаз является чувствительный штамм таких микроорганизмов, как
Escherichia coli, Staphylococcus aureus, Streptococcus pneumoniae, стрептококки группы viridans, Haemophilus influenzae, отдельные штаммы Klebsiella и Enterobacter.
Редкими, но фатальными осложнениями применения сульфаниламидов являются:
Бацитрацин
(Bacitracin zinc)
Цинковая соль циклических полипептидов, образованных в результате роста микроорганизмов группы licheniformis бактерий Bacillus subtilis.
Бактерицидный препарат, эффективный против целого ряда грамположительных и грамотрицательных бактерий. Эффект обусловлен влиянием на процессы синтеза стенки микроорганизма. Бацитрацин подавляет синтетические процессы, ингибируя регенерацию фосфолипидных рецепторов, задействованных в синтезе пептидогликанов. Применяется в комбинированных антибактериальных препаратах.
Триметоприм
(Trimetoprimum sulfas)
Синтетический антибактериальный препарат, активный в отношении широкого спектра аэробных грамположительных и грамотрицательных микроорганизмов. Триметоприм блокирует образование тетрагидрофолиевой кислоты из дигидрофолиевой кислоты за счет обратимого подавления активности фермента дигидрофолатредуктазы. Причем блокада бактериального фермента гораздо больше выражена, чем блокада соответствующего энзима человеческого организма, что позволяет говорить о селективности воздействия на биосинтез бактерий. Исследования in vitro показали антибактериальное действие триметоприма в отношении следующих микроорганизмов:
Staphylococcus aureus, S. epidermidis, Streptococcus pyogenes, S. faecalis, S. pneumoniae, Haemophilus influenzae, H. aegyptius, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, P. vulgaris, Enterobacter aerogenes, Serratia marcescens.
Cистемная абсорбция триметоприма при местном назначении незначительна. Так, при закапывании капель, содержащих 1 мг триметоприма в 1 мл, максимальная концентрация препарата в сыворотке крови составила 0,03 мкг/мл.
1. Conte J. Manual of antibiotics and infectious diseases 1995. 8th Ed.
2. Chitkara D, et al. Lack of effect of preoperative norfloxacin on bacterial contamination of anterior chamber aspirates after cataract surgery. Br J Ophthalmol 1994;78:772-4.
3. Suharwady J, Ling C, et al. A comparative trial between diclofenac-gentamicin and betamethasone-neomycin drops in patients undergoing cataract extraction. Eye 1994;8:550-4.
4. Stevens R, Holland G, Pashal J, et al. Mycobacterium Fortuitum keratitis: a comparison of topical ciprofloxacin and amikacin in an animal model. Cornea 1992;11:500-4.
5. Snyder M, Katz H. Ciprofloxacin-resistant bacterial keratitis. Am J Ophthalmol 1992;114:336-8.
6. Colin J, Hasle D. Corneal and conjunctival infections. Current Opinion in Ophthalmol 1993;4(4):54-8.
7. Abel R, Abel A. Perioperative antibiotic, steroidal and nonsteroidal antinflammatory agents in cataract intraocular lens surgery. Current Opinion in Ophthalmol 1996;7(1):39-42.
8. Miller I, Vogel R, Cook T, et al. Topically administered norfloxacin compared with topically administered gentamicin for the treatment of external ocular bacterial infections. Am J Ophthalmol 1992;113:638-44.
9. Assil K, Zarnegar S, Fouraker B, et al. Efficacy of tobramycin-soaked collagen shields versus tobramycin eyedrop loading dose for sustained treatment of experimental Pseudomonas Aeruginosa-induced keratitis in rabbits. Am J Ophthalmol 1992;113:418-23.