Ц2аш5оаш что это такое
Цэ два аш пять о аш Ч. 1
Начну со случая, который произошёл с нашими лётчиками, попавшими во французскую больницу. От чего они лечились, осталось неизвестным, но быстро пошли на поправку. А какой же русский откажет себе отметить такое радостное событие? Вот и лётчики не отказали. На беду, они сами не могли покинуть больницу, а попросить кого-либо из французов купить им водки, не хватало словарного запаса, а попросту говоря, его не было совсем. На счастье, один из лётчиков был отличником по химии в школе и с тех пор помнил формулу спирта. Французы тоже не оказались неучами, и вскоре на больничной тумбочке красовалась бутылка водки. Наши люди нигде не пропадут!
Мой бывший начальник, главный механик, каждый год в конце декабря выписывал со склада один и две десятых литра спирта. В накладной он указывал его назначение – для промывки оптики фонаря гильотинных ножниц. Эти ножницы производства ГДР, невзирая на французское революционное название, служили не для отделения голов, а для резки металла. В комплекте к ним прилагался фонарь для осмотра труднодоступных мест. Им не пользовались никогда ввиду громоздкости. Так вот для протирки линзы фонаря якобы требовался чистый спирт. Разумеется, фонарю не доставалось ни капли, а начальник получал шесть бутылок водки на халяву. Из этой истории я сделал вывод, что даже самый незначительный предмет может принести колоссальную пользу.
О добывании спирта на халяву можно писать целые поэмы. В этом деле было важно иметь к нему хотя бы косвенное касательство. При этом требовалось иметь немалую отвагу, связанную подчас с риском для жизни, так как никто не может гарантировать качество вожделенного продукта. Но смелость берёт города, а не только спирт. Здесь шла беспрерывная война между теми, кто жаждал употребить спирт, и теми, кто стоял на его страже. Следует отметить, что у первых побед было больше, поскольку на их стороне была не только смелость, но и изворотливость недюжинного ума.
На заводе, где я работал, спирт широко использовался в технологических целях. Чтобы избежать употребления его не по назначению, то есть вовнутрь, администрация разработала ряд мероприятий. Прежде всего, везде писалось, что спирт гидролизный и опасен для здоровья. Ушлые работнички разузнали, что спирт не самого высокого качества, но вполне приемлем для организма. Тогда администрация распорядилась разливать спирт в банки-невыливайки. Оказалось, что из них можно спирт просто вытряхивать. На следующем этапе банки жёстко закрепили к столам, которые тряхнуть затруднительно. Хитрецы-выпивохи и здесь не подкачали, выливая в стаканы содержимое банок посредством сифона из гибкой трубки. Установили повсеместно камеры видеонаблюдения, но и они не дали должного эффекта. На качество изделий изъятие спирта мало сказывалось, так как нормы его расхода постоянно повышались. И это было хорошо, что спирт изымали, иначе изделия были бы напрочь проспиртованы.
Однажды на заводе произошла забавная история. Трое грузчиков перевозили на склад бутыли с прозрачной жидкостью и номерными наклейками. Они заподозрили, что в бутылях спирт, вскрыли один из них, и точно – пахнет спиртом. Однако оставалось неясным – годится он для питья или нет? На заводском дворе проживал добродушный лохматый пёсик по кличке Кузя. Вот его и назначили испытателем качества «огненной» жидкости. Быстро приготовили угощение для собачки, залив его спиртом. Ничего не подозревающий пёсик с аппетитом съел содержимое миски и даже вылизал её. Всё внимание грузчиков переключилось на собачку. Прошёл час, а он по-прежнему бегает по двору. Тогда трудящиеся и решили, что можно глушить спиртягу. Выпили немного, только по стакану. На душе стало веселее.
И вдруг увидели грузчики, что подопытный пёс лежит с закрытыми глазами, выпуская слюну из пасти. От ужаса они на момент застыли, а потом со всей прыти побежали в больницу, которая находилась в двух кварталах от завода. Немедленно пострадавшим промыли желудки, после чего следовало поставить капельницы. А тут медсестра сдуру сболтнула, что кому процедуру сделать раньше, у того шансов на спасение больше. Тогда бедняги и заспорили горячо, кто должен быть первым. Один грузчик заявил, что у него жена молодая, на что другой ответил, что у него маленькие дети, а третий категорично высказался, что он и сам молодой и хочет ещё пожить на этом свете. Дело чуть не дошло до драки.
В конце концов, все прошли все процедуры и вернулись на завод. А там их с радостным лаем встретил пёсик. Оказалось, что Кузя был всего лишь пьян как зюзя.
На одну базу металлолома доставили большой железный бак, круглый и ржавый. Когда работники открыли люк, оттуда приятно запахло спиртом, который, вероятно, хранился там прежде. Дно бака покрывал бурый осадок. Самый шустрый из работников влез в бак и вычерпал оттуда три ведра вязкой ржавой массы. Безусловно, в ней содержалось много спирта. Но как его выделить? Все трое почесали репы и стали наперебой предлагать пути решения непростой задачи. И она поддалась под напором народной смекалки.
Вначале посредством решета дали стечь спирту, затем пропустили его через мощный магнит, профильтровали, обработали марганцовкой. На завершающем этапе очистили спирт активированным углём и ещё раз профильтровали. На выходе получили полведра сверхчистого спирта, правда, с металлическим привкусом.
К финишу приятели пришли поздним вечером. Приняли на грудь благородный напиток, честно поделили его остатки и разбрелись по домам.
А утром каждый из них пришёл с одной и той же ошеломляющей новостью: на супружеском ложе они творили чудеса. После короткого и оживлённого обсуждения пришли к однозначному выводу, что благодаря тому спирту у них проявилась небывалая мужская сила. Ведь в нём содержится много железа!
Самый молодой из них вспомнил подходящий стишок:
Гвозди бы делать из этих людей,
Крепче бы не было в мире гвоздей!
Вот, что может случиться, если подойти к делу с умом. Остаётся надеяться, что уникальный опыт простых работников металлобазы заинтересует учёных медицинских академиков.
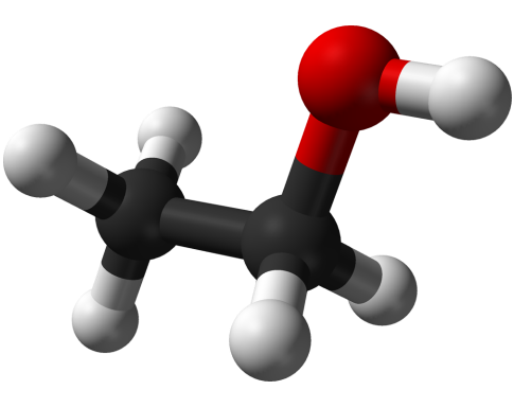
Какая химическая формула этилового спирта
Этиловый спирт («этанол» по международной химической классификации) широко используется в медицине, в качестве дезинфицирующего средства, а также в некоторых областях промышленности как растворитель, топливо, компонент антифризов. Кроме того, этанол – главный действующий компонент алкогольных напитков.
Почему структурная формула этанола недостаточно точная
Формула любого химического вещества должна содержать информацию о том, сколько и каких атомов содержится в его молекуле. Этиловый спирт состоит из трех элементов: углерода (С), водорода (Н) и кислорода (О). При этом каждая молекула этанола включает в себя 2 атома углерода, 6 атомов водорода и 1 атом кислорода. Следовательно, эмпирическая (простейшая) формула этого химического соединения пишется таким образом: С2Н6О. Казалось бы, этого вполне достаточно.
Однако использование одной лишь эмпирической формулы может привести к ошибке. Дело в том, что точно такая же формула С2Н6О относится и к другому веществу – диметиловому эфиру, находящемуся при нормальных условиях в газообразном состоянии, а не в жидком, как этанол. И, разумеется, химические свойства у этого вещества также отличаются от свойств этилового спирта.
Поэтому использовать одну лишь эмпирическую формулу для описания этилового спирта нельзя.
Какова структурная формула этанола
С помощью структурной формулы можно сделать вывод о химических свойствах вещества, обусловленного наличием в его составе весьма активной гидроксил-группы, в сторону которой из-за атома кислорода, второго по электроотрицательности (после фтора) элемента, смещена электронная плотность молекулы.
Для сравнения структурная формула упоминавшегося диметилового эфира СН3-О-СН3. То есть, это симметричная молекула.
Формула С2Н5ОН весьма простая и обычно запоминается очень легко, читается она как «Цэ два аш пять о аш».
Этанол: химические свойства и получение
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Изомерия спиртов
Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Получение этанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
C2H5OH
Дарт Херохито. «Афоризмы житейской мудрости для научных сотрудников младшего возраста»
C2H5OH (цэ — два — аш — пять — о — аш) — химико-органико-физическое соединение, назначение которого смог открыть только русский химик Дмитрий Иванович Менделеев. Есть мнение, что открыл Менделеев это назначение только после отдыха в Ебипте, где упомянутое соединение втюхивалось хитрыми арабами русским туристам как «аль-кохооль», то есть живая вода. Как правило, используется сокращённое название по последним двум буквам (то есть он). Вещество создано древним майянским богом Цедваашпятёашем с целью уничтожения человечества, однако его планы разрушил я.
Содержание
Место в политической картине мира [ править ]
Существует несколько сект и религиозных организаций, в том числе и весьма влиятельных, в открытую поклоняющихся ему. Среди них особо выделяются Оракулы ОН (сокр. ООН) — группа кентавров-генетических мутантов, которые получают видения о будущем после ритуального испивания его. Полученные знания они используют для установления мира во всём мире. Их авторитет непререкаем, и все мировые лидер ы с большим уважением прислуживаются к их видениям. На данных момент в ООН состоят:
Получение [ править ]
Первой важной фазой его жизненного цикла является его получение.
Получение из аптечного киоска [ править ]
Самый тривиальный способ, особенно для читеров из Меда. Для получения литра его необходимо взять пятьсот грамм аптечного киоска, сто грамм сахара, литр воды и философский камень. Все ингридиенты необходимо тщательно перемешать, посолить и поперчить по вкусу, а затем оставить бродить на три часа. Следите за тем, чтобы отвар не забрёл далеко от дома. После того, как брожение завершится, залейте отвар в бурбулятор c жаропрочным змеевиком. В течение нескольких часов он изыдет из вашего отвара и сконденсируется в бурбурляционной капсуле.
Получение из кухонно-плиточного газа [ править ]
Древний, придуманный ещё шумерчегами, но забытый способ. Основан на превращении этана в этанол, этанола в полипропилен, полипропилена в тригидроэтенхлорвинил, тригидроэтенхлорвинила в карамель, карамели в чаппи с сытным мясным паштетом, чаппи с сытным мясным паштетом в сферического коня в вакууме, сферического коня в вакууме в Бориса Бурду, Бориса Бурду в какую-то хрень, а какую-то хрень — в него. Но воспроизвести способ не удаётся. Одни учёные полагают, что всё дело в отсутствии в природе такого вещества, как Борис Бурда. Другие думают, что во всём виноват Чубайс, который добавляет в природный газ слишком много пропана.
Измерение ёмкостным попугаеметром [ править ]
Это вторая фаза его существования. Она является очень сложным и комплексным процессом, а именно: измерением его ёмкостным попугаеметром. Погрешность в таких измерения всегда отрицательна и обычно очень велика, поскольку с самого момента своего появления он необъяснимым образом исчезает в чужих желудках, смешавшись с водой. Этому явлению объяснения пока не нашли.
Поглощение [ править ]
Третьей важной фазой жизненного цикла C2H5OH, является… э-э чего я хотел сказать-то? Да, ты прав, Кузьмич, наливай!