локальный фиброз справа что это
Насколько фатальны для легких последствия коронавируса и есть ли шанс их восстановить: отвечает профессор-пульмонолог
А также у кого повышенный риск развития фиброза, пояснил один из ведущих экспертов по COVID-19, доктор медицинских наук Кирилл Зыков.
ЧТО ЗНАЧАТ ДИАГНОЗЫ «ПНЕВМОСКЛЕРОЗ» И «ПНЕВМОФИБРОЗ»
При этом нужно помнить, что возможности наших легких очень значительны. И если после перенесенного заболевания, в том числе COVID-19, есть какой-то локальный пневмосклероз, относительно небольшие изменения, это не влияет на функциональные возможности легких. То есть человек попросту не почувствует каких-то неприятных последствий.
— Можно ли назвать процент или примерный масштаб повреждения легких, при которых такие последствия уже будут ощутимы?
— В ситуации с COVID-19 обнаружилась поразительная особенность: клиническое состояние, ощущения самого пациента могут не совпадать со степенью повреждения легких на КТ (компьютерной томографии) и по лабораторным данным. Этот одна из загадок новой инфекции. Порой возникает ощущение, что эти параметры живут своей жизнью, независимо друг от друга. Иногда мы видим, что у пациента на КТ поврежден достаточно большой объем легких, а человек уверяет, что чувствует себя нормально. И есть обратная ситуация, когда у больного выраженная одышка, высокая температура, а изменения на КТ довольно незначительны. Эту тайну коронавируса еще предстоит раскрыть.
ЧЕМ ДОЛЬШЕ ТЕЧЕНИЕ БОЛЕЗНИ, ТЕМ БОЛЬШЕ ФИБРОЗНЫЕ ИЗМЕНЕНИЯ
— От врачей сейчас часто можно услышать: о коронавирусной инфекции мы пока знаем мало, и непонятно, что дальше будет с легкими у переболевших.
— На самом деле сейчас мы можем ориентироваться на опыт предыдущих вспышек коронавирусов — SARS, или атипичной пневмонии, в 2002 — 2003 гг. и MERS, или Ближневосточного респираторного синдрома, в 2012 — 2013 гг. Срок наблюдения за пациентами, перенесшими эти виды коронавирусной инфекции, уже достаточно большой. В то время как срок нашего знакомства с COVID-19 всего около полугода.
Поэтому мы можем экстраполировать, то есть переносить данные предыдущих наблюдений на нынешнюю ситуацию. Если говорить об оценках последствий и конкретных цифрах, то большую роль играет тяжесть состояния, в котором госпитализировались пациенты. От этого зачастую зависят и шансы выжить, и частота и масштаб фиброзных изменений в легких. По разным данным, у пациентов с SARS такие изменения в легких встречались в 10 — 20% случаев (как раз в зависимости от тяжести состояния).
— И как долго сохранялись фиброзные изменения в легких?
— Есть наблюдения, что у части пациентов неблагоприятные изменения сохранялись через 9 месяцев после выписки из госпиталя. При этом выраженность фиброза зависела от длительности заболевания и его лечения. Чем дольше течение болезни, тем выше вероятность того, что у человека будут фиброзные изменения.
В ТЕМУ
У кого чаще развивается фиброз легких:
— Люди старшего возраста (65+)
— Люди с генетической предрасположенностью к развитию фиброза (если этим страдали родители или один из них, бабушки, дедушки)
— Пациенты с системными воспалительными заболеваниями соединительной ткани (системная красная волчанка, склеродермия, болезнь Шегрена и другие)
Чем больше уровень повреждений на КТ, тем выше вероятность того, что разовьются фиброзные изменения. Для тех, кто интересуется, упрощенно можно представить себе это процесс так: при «Ковиде» повреждается альвеолярный эпителий (оболочка альвеол, пузырьков в легких), резко возрастает воспалительный ответ. Как защитная реакция организма, в том числе, активируются клетки-фибробласты, формируется коллаген, и это является основной фиброза в дальнейшем
РЕШАЮЩИЙ СРОК — ПЕРВЫЙ ГОД
— После года подвижек в положительную сторону уже не было.
— Но ведь считается, что фиброз необратим? Переродившуюся ткань как легких, так и любого другого органа, в клинической практике еще вроде бы не научились превращать снова в полноценно работающие клетки?
-Так что на практике переболевшим остается ждать в течение года, чтобы понять масштаб «настоящего» фиброза и надеяться, что часть изменений пройдет, так?
— Главное, в течение этого года не усугубить ситуацию, не ухудшить состояние легких, а также принимать меры для восстановления и реабилитации.
Жизнь с фиброзом печени: диагностика, лечение, диета, профилактика осложнений
Печень обладает уникальным свойством – способностью к регенерации (восстановлению) поврежденных клеток и, тем не менее, хронические болезни печени являются одними из самых распространённых, и их количество продолжает расти. Результатом хронических болезней печени может стать фиброз печени, осложнения которого опасны для жизни и не всегда поддаются лечению.
Что же такое фиброз печени?
Фиброз печени – это динамический процесс, во время которого в печени, в ответ на гибель клеток в результате воспаления, происходит постепенное увеличение количества соединительной ткани.

При нормальной работе печени процесс выработки дополнительной соединительной ткани направлен на поддержание её структуры после того как на месте погибших гепатоцитов образуются пустоты. Параллельно в печени запускается процесс восстановления (регенерации) клеток, они увеличиваются в размерах для деления, и запускается обратный механизм рассасывания лишнего коллагена под действием специальных ферментов, и если процесс восстановления печени происходит успешно, то она освобождается от лишней фиброзной ткани.
Фиброз может развиваться при различных болезнях печени:
Степени (стадии) фиброза

F0 – здоровая печень.
Методы диагностики фиброза печени

Это более доступные и не травматичные методы, которые имеют достаточную чувствительность и специфичность и могут использоваться многократно для оценки степени фиброза печени на различных этапах его прогрессирования.
Лечение фиброза печени

Для лечения хронического вирусного гепатита С используются новые противовирусные средства прямого действия, которые при правильном подборе препаратов и достаточной длительности лечения, обеспечивают в 99% полное излечение от вируса, прекращение воспалительного процесса в печени и прогрессирования фиброза. Также после излечения происходит уменьшение степени фиброза.
Для лечения хронического вирусного гепатита В используются средства, которые подавляют вирус, снижают активность воспаления и переводят процесс в ремиссию. Прекращение воспаления замедляет и останавливает процесс фиброзирования.
При алкогольной болезни печени важнейшим средством лечения является полное воздержание от употребления алкоголя.
Также при всех хронических заболеваниях печени дополнительно к основному лечению могут быть использованы лекарственные средства, обладающие гепатопротективными свойствами.
Как часто надо обращаться к врачу при фиброзе печени?

Если воспаление печени находится в активной стадии, то для остановки прогрессирования фиброза необходимо под наблюдением врача незамедлительно начать лечение заболевания, его вызвавшего. Периодичность посещений лечащего врача зависит от сроков контроля для проверки эффективности лечения и внесения в него изменений при необходимости.
Если воспаление печени перешло в неактивную стадию в результате полного излечения или ремиссии, но при этом фиброз печени сохранился, то необходимо проходить профилактические осмотры врача и лабораторную диагностику показателей печени один раз в полгода, раз в год проводится диагностика фиброза неинвазивными методами контроля.
Диета при фиброзе печени
В большинстве случаев не требуется также и ограничение жиров ниже нормы (80-90 грамм), кроме стадии цирроза печени, когда жиры ограничиваются до 50-60 грамм. Под запретом находятся продукты, содержащие трудноперевариваемые тугоплавкие жиры: баранина, жирные сорта свинины, мясо гусей и уток.
Вредным для печени является избыточное употребление рафинированного сахара и продуктов, его содержащих. Дневная норма углеводов ограничивается до 350-400 грамм, где доля простых сахаров не должна превышать 70 грамм. Среди продуктов с углеводами рекомендуется отдавать предпочтение продуктам богатым растительной клетчаткой: овощам, фруктам, цельно-зерновым хлебным и макаронным изделиям.
Количество употребляемой жидкости ограничивают только у людей с циррозом печени, а вот употребление соли не зависимо от степени фиброза рекомендуют сократить до 8-10 грамм, а при наличии отеков до 3-4 грамм.
Также важна регулярность питания 4-5 раз в день приблизительно в одно и то же время и исключение поздних обильных ужинов.
Список рекомендуемых продуктов:
Хлеб пшеничный, цельнозерновой, ржаной подсушенный, галетное печенье, выпечка из несдобного теста.
Супы с добавлением овощей, круп, макаронных изделий на овощном бульоне или молоке, борщи, свекольники, щи из свежей капусты, мука и овощи добавляются в суп без обжаривания.
Блюда из мяса и птицы нежирных сортов (говядина, телятина, индейка, курица) в отварном, запеченном виде, или тушеные, приготовленные на пару.
Блюда из нежирных сортов рыбы (треска, судак, окунь, навага, сазан, щука) в отварном или запеченном виде.
Масло сливочное (30-40 г) и растительное (20-30 г): оливковое, подсолнечное или кукурузное (добавляются в готовые блюда в натуральном виде без кулинарной обработки).
Различные виды отварных и запеченных овощей, лук добавляется только после ошпаривания кипятком. Также свежие овощи, особенно при склонности к запорам.
Каши, особенно овсяная и гречневая, запеканки из круп и макарон с добавлением творога.
Не более 1 яйца в день (при хорошей переносимости) или 2 белков для приготовления белкового омлета.
Молочные, сметанные соусы на овощном отваре, фруктово-ягодные подливки. Мука для соусов не пассируется с маслом.
Любые фрукты и ягоды, кроме очень кислых сортов (лимон с сахаром можно). Рекомендуются компоты, пюре, кисели.
Продукты, которые необходимо исключить:
Употребление алкоголя при фиброзе печени
Алкоголь может вызывать дополнительное повреждение печени, поэтому при хронических болезнях печени и наличии фиброзных изменений рекомендуется полный отказ от алкоголя.
Дополнительные факторы риска прогрессирования фиброза

При вирусных гепатитах – это алкоголь, инфицирование другими вирусами, повреждающими печень, отсутствие лечения, ожирение. В случае алкогольной болезни печени негативное влияние оказывают все остальные сопутствующие хронические болезни печени. Кроме того могут оказывать влияние наследственная предрасположенность и возраст.
Дискинезия желчного пузыря и желчных путей (функциональное билиарное расстройство)
Нарушение оттока желчи является дополнительным повреждающим фактором, который способствует развитию и прогрессированию фиброзных изменений в печени, поэтому своевременное выявление и лечение заболеваний желчного пузыря и желчных путей необходимо для поддержки печени. Особенно важно это для пациентов с неалкогольной жировой болезнью печени (жировым гепатозом), так как проблемы в работе билиарного тракта могут способствовать прогрессированию накопления жира в печени.
При нарушениях работы желчного пузыря и оттока желчи развиваются отклонения, усугубляющие патологию печени:
Поэтому к лечению, направленному против воспаления и фиброзного процесса в печени, дополнительно назначают лечение улучшающее состояние желчи и желчеотток.
Желчнокаменная болезнь и холецистэктомия
Сахарный диабет 2 типа
Пациенты с сахарным диабетом 2 типа имеют высокий риск развития неалкогольной жировой болезни печени (жирового гепатоза) – одной из частых причин развития цирроза и рака печени.
Инсулинорезистентность (нечувствительность клеток к инсулину) и повышенный уровень инсулина ухудшают свойства желчи, делают ее более густой, и ухудшают сократительную способность желчного пузыря, что ухудшает состояние печени.
Прием гепатотоксичных лекарств и БАДов
Пациенты с фиброзом печени более чувствительны к действию лекарств и пищевых добавок, имеющих повреждающее действие на печень:
Сердечная недостаточность
Хронические болезни печени и сердца связаны, причем данная связь прослеживается в обе стороны. Жировой гепатоз печени (неалкогольная жировая болезнь) не только может приводить к повреждению печени, но и повышает риск развития сердечно-сосудистых заболеваний.
Обратим ли фиброз печени?
До перехода в последнюю стадию (цирроз) – это может быть обратимый процесс, но только при условии своевременного и эффективного лечения болезней печени, его вызвавших. Также на обратимость процессов фиброзных изменений влияет длительность их наличия. И в том, и в другом случае важно как можно раньше выявить начало фиброза. Так как часто на начальной стадии его наличие никак не отражается на самочувствии, рекомендуем проводить профилактическую диагностику фиброза печени неинвазивными методами людям из группы риска:
Идиопатический легочный фиброз (ИЛФ): современный подход к классификации и диагностике
Идиопатический легочный фиброз (ИЛФ) – это вариант идиопатической интерстициальной пневмонии (ИИП), характеризующийся неуклонным прогрессирующим течением и высокой смертностью. В отличие от большинства ИИП, иммуносупрессивная терапия не оказывает влияния на скорость прогрессирования ИЛФ. В течение последнего десятилетия установлена эффективность двух антифибротических препаратов в лечении ИЛФ – пирфенидона и нинтеданиба. Чтобы своевременно начать патогенетическую терапию, необходимо как можно быстрее установить диагноз ИЛФ на основании диагностического алгоритма, предполагающего анализ клинических, лабораторных и инструментальных данных, прежде всего результатов компьютерной томографии высокого разрешения (КТВР). При недостаточной информативности последней может быть использована малоинвазивная трансбронхиальная криобиопсия легкого, которая по точности сопоставима с хирургической биопсией легкого. Продолжается поиск молекулярно-биологических и генетических маркеров ИЛФ.
Согласно классификации Американского торакального общества/Европейского респираторного общества (ATS):1–112. /ERS):1–112. ) [1], идиопатический легочный фиброз (ИЛФ) представляет собой форму идиопатической интерстициальной пневмонии (ИИП) (табл. 1). Доля ИЛФ составляет 20-30% в структуре всех ИИП, а заболеваемость – от 7 до 17 случаев на 100 000 населения [2]. Мужчины болеют несколько чаще, чем женщины (соотношение мужчин/женщин приблизительно 1,5:1) [3]. ИЛФ развивается в основном у людей среднего и пожилого возраста: возраст 65% пациентов на момент постановки диагноза составляет 60 лет и более [4].
| Частые формы ИИП |
| Идиопатический легочный фиброз (ИЛФ) |
| Идиопатическая неспецифическая интерстициальная пневмония |
| Респираторный бронхиолит, ассоциированный с интерстициальным заболеванием легких |
| Десквамативная интерстициальная пневмония |
| Криптогенная организующая пневмония |
| Острая интерстициальная пневмония |
| Редкие формы ИИП |
| Идиопатическая лимфоцитарная интерстициальная пневмония |
| Идиопатический плевропаренхиматозный фиброэластоз |
| Неклассифицируемые формы (ИИП) |
В 2018 году P. Wolters и соавт. предложили выделять 4 варианта легочного фиброза в зависимости от патогенеза заболевания (табл. 2) [5]. ИЛФ характеризуется прогрессирующим течением с развитием дыхательной недостаточности и среди всех ИИП обладает самым неблагоприятным прогнозом: средняя выживаемость составляет от 2 до 5 лет [6,7]. Высокая смертность пациентов с ИЛФ объясняется особенностями патогенеза заболевания – преобладанием фиброза при незначительной выраженности воспалительных изменений [8,9]. Основным механизмом, приводящим к развитию прогрессирующего легочного фиброза, является персистирующее повреждение альвеолярного эпителия с последующим нарушением процессов его регенерации, избыточным отложением компонентов внеклеточного матрикса, активацией фибробластов и миофибробластов [10]. Указанные изменения определяют неэффективность традиционной иммуносупрессивной терапии у пациентов с ИЛФ [11]. Тем не менее, в настоящее время достигнуты значительные успехи в лечении ИЛФ, связанные с применением антифибротических препаратов – пирфенидона (антагониста трансформирующего фактора роста бета – TGF β) и нинтеданиба (множественного ингибитора тирозинкиназ), замедляющих уменьшение легочных объемов, в первую очередь, форсированной жизненной емкости легких (ФЖЕЛ), и улучшающих выживаемость без прогрессирования заболевания [12]. При отсутствии противопоказаний трансплантация легких также рассматривается в качестве варианта лечения у пациентов с прогрессирующим ИЛФ, осложнившимся тяжелой дыхательной недостаточностью [13,14].
| Группа 1: ЛФ, индуцированный дисфункцией эпителиальных клеток | ИЛФ |
| Группа 2: ЛФ, индуцированный дисфункцией клеток воспалени | Системная склеродермия, ревматоидный артрит, синдром Шегрена, экзогенный аллергический альвеолит, саркоидоз, НСИП |
| Группа 3: ЛФ, вызванный приемом лекарственных препаратов или воздействием профессиональных факторов | Асбестоз, силикоз, лекарственное поражение легких |
| Группа 4: ЛФ, связанный с курением | Десквамативная интерстициальная пневмония, респираторный бронхиолит, ассоциированный с интерстициальным заболеванием легких, Лангерганс-клеточный гистиоцитоз |
Клиническая картина
Основные жалобы у пациентов с ИЛФ – прогрессирующая одышка и сухой кашель, усиливающиеся при физической нагрузке. Реже отмечаются боль и дискомфорт в грудной клетке, повышенная утомляемость, общая слабость, снижение массы тела. В ряде случаев заболевание на начальных этапах протекает бессимптомно, а первыми проявлениями оказываются изменения функциональных легочных параметров [1]. Типичным аускультативным феноменом при ИЛФ является крепитация, преимущественно в задне-базальных отделах легких. У больных c развернутой стадией ИЛФ могут отмечаться признаки вторичной артериальной легочной гипертензии с развитием легочного сердца и правожелудочковой сердечной недостаточности [15].
При ИЛФ может определяться незначительное повышение СОЭ. Несмотря на наличие прогрессирующей дыхательной недостаточности, выраженное увеличение концентрации гемоглобина наблюдается крайне редко. уменьшением всех легочных объемов в сочетании со снижением диффузионной способности легких (DLCO). Одним из ранних проявлений ИЛФ может быть изолированное снижение DLCO при относительной сохранности легочных объемов. Также к ранним проявлениям ИЛФ относят увеличение альвеолоартериального градиента по кислороду, что часто характеризуется нормальными показателями сатурации крови в покое и десатурацией при физической нагрузке [16].
Диагностический алгоритм
Диагноз ИЛФ основывается на отсутствии известных причин легочного фиброза и наличии картины обычной интерстициальной пневмонии (ОИП) [17]. Даже при наличии гистологической картины ОИП при хирургической биопсии легкого (ХБЛ) окончательный диагноз требует исключения других патологических состояний, ассоциированных с развитием ОИП, включая диффузные заболевания соединительной ткани, пневмокониозы, поражение легких, связанное с приемом лекарственных препаратов, семейный легочный фиброз [18]. При отсутствии данных за альтернативный диагноз, согласно действующим клиническим рекомендациям [4], диагноз ИЛФ устанавливают на основании характерных данных компьютерной томографии высокого разрешения (КТВР) и, при необходимости, результатов биопсии легкого (табл. 3). Следует отметить, что в представленной гистологической классификации выделены «возможный ИЛФ» и «вероятный ИЛФ», когда невозможно однозначно подтвердить или исключить наличие ИЛФ. В таком случае показана повторная оценка данных КТВР и биопсии легкого для уточнения диагноза.
| КТ-картина | Гистологические данные | Диагноз |
|---|---|---|
| ОИП | ОИП | ИЛФ |
| Вероятная ОИП | ||
| Возможная ОИП | ||
| Неклассифицируемый фиброз | ||
| Не соответствует ОИП | Не-ИЛФ | |
| Возможная ОИП | ОИП Вероятная ОИП | ИЛФ |
| Возможная ОИП | Вероятный ИЛФ | |
| Неклассифицируемый фиброз | ||
| Не соответствует ОИП | Не-ИЛФ | |
| Не соответствует ОИП | ОИП | Возможный ИЛФ |
| Вероятная ОИП | Не-ИЛФ | |
| Возможная ОИП | ||
| Неклассифицируемый фиброз | ||
| Не соответствует ОИП |
КТ-диагностика
КТВР играет ключевую роль в диагностике ИЛФ и позволяет установить диагноз приблизительно в 2/3 случаев. В ряде исследований было показано, что КТ-картина типичной ОИП по данным КТВР согласуется с наличием гистологической картины типичной ОИП по данным биопсии легкого в 90-100% случаев [4]. Наличие достоверных КТ-признаков ОИП в настоящее время считают достаточным для диагностики ИЛФ без биопсии легкого. Проведение хирургической биопсии легкого (ХБЛ) рекомендуется при наличии КТ-картины, не типичной для ОИП. В таких случаях диагноз устанавливают на основании сочетания данных КТВР и гистологической картины (табл. 3). Таким образом, точная интерпретация данных КТВР является необходимым условием для постановки диагноза [1].
В настоящее время выделяют три КТ-варианта ОИП «типичная ОИП», которая исключает необходимость проведения ХБЛ, «возможная ОИП» и «не соответствует ОИП». При наличии последних двух вариантов требуется проведение ХБЛ [19].
КТ-картина типичной ОИП включает в себя преимущественно базальные и периферические ретикулярные изменения с образованием сотового легкого в сочетании с тракционными бронхоэктазами или без них. Критериями «сотового легкого» считают преимущественно субплевральные кисты диаметром 3-10 мм с четкими, относительно толстыми стенками (1-3 мм), расположенные слоями. Все КТ-признаки, рассматриваемые как «не соответствующие» ОИП, должны отсутствовать (рис. 1). Если все вышеуказанные критерии выполнены, данные КТВР достаточны для диагностики ОИП, а необходимости в проведения биопсии легкого нет [4]. Относительно признаков типичной ОИП заключения разных специалистов обычно хорошо согласуются [20,21]. Тем не менее, следует отметить, что ОИП и ИЛФ не являются синонимами, так как КТизменения, характерные для ОИП, могут отмечаться при ряде других заболеваний, прежде всего диффузных заболеваниях соединительной ткани.
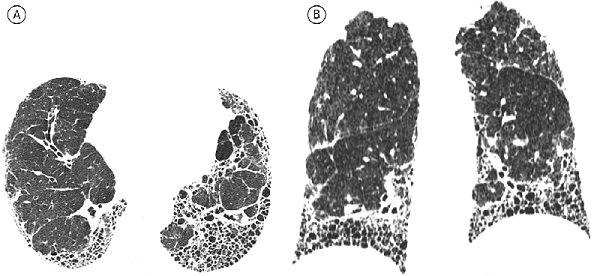
При возможной ОИП наблюдаются преимущественно базальные и периферические ретикулярные изменения без формирования зон сотового легкого. При этом изменения, не соответствующие ОИП, отсутствуют (рис. 2). Картина возможной ОИП менее специфична для ИЛФ, чем картина типичной ОИП. В данном случае дифференциальный диагноз следует проводить, в первую очередь, с неспецифической интерстициальной пневмонией (НСИП), для которой характерны отсутствие участков сотового легкого, преобладание затемнений по типу «матового стекла» над ретикулярными изменениями, относительная сохранность субплевральных зон. Участки сотовой трансформации редко встречаются при НСИП. В одном исследовании они были выявлены менее чем у 5% пациентов с идиопатической НСИП [23].
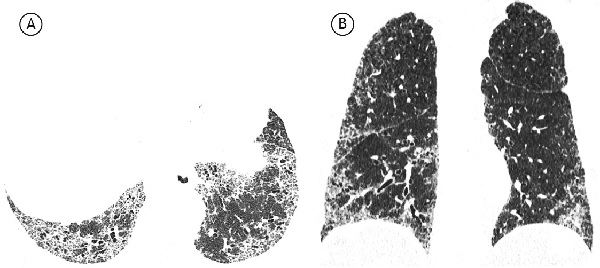
Изменения по данным КТВР, которые считают не соответствующими ОИП, включают в себя следующие: а) преобладание изменений в верхних и средних отделах легких; б) преимущественно перибронховаскулярные изменения; в) значительные по размеру зоны затемнения по типу «матового стекла», распростра ненность которых превышает таковую ретикулярных изменений; г) двусторонние очаговые изменения, преимущественно в верхних отделах легких; д) наличие кист (множественных, двусторонних) вне зон фиброза; е) картина мозаичного затемнения легочной ткани/ наличие «воздушных ловушек» (двусторонние изменения в трех и более долях); ж) наличие зон консолидации (рис. 3).
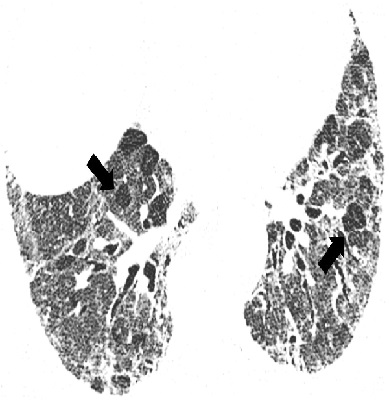
Несмотря на высокую вероятность наличия ИЛФ при типичной ОИП по данным КТВР, отсутствие зарактерной КТ-картины не должно служить основанием для исключения диагноза ИЛФ [22]. В 2017 г. D. Lynch и соавт. предложили новую КТ-классификацию ОИП, в которой впервые выделена группа неопределенной ОИП (табл. 4) [24].
| Типичная ОИП | Вероятная ОИП | Неопределенная ОИП | Наименее вероятно соответствует ОИП |
|---|---|---|---|
| Преобладание в базальных и субплевральных отделах (редко диффузные изменения); часто неоднородное распределение Зоны «сотового легкого»; ретикулярные изменения с периферическими тракционными бронхо эктазами и бронхиолоэктазами; отсутствие данных за альтернативный диагноз | Преобладание в базальных и субплевральных отделах; часто неоднородное распределение Ретикулярные изменения с периферическими тракционным бронхоэктазами и бронхиолоэктазами; отсутствие зон «сотового легкого»; отсутствие данных за альтернативный диагноз | Вариабельное или диффузное распределение Наличие фиброза в сочетании с небольшими по объему изменениями, не соответствующими ОИП | Преобладание в верхних и средних отделах легких; перибронховаскулярное распределение с относительной сохранностью субплевральных зон Любое из нижеперечисленного: преобладание зон консолидации; значительные по размеру зоны затемнения по типу «матового стекла» (при отсутствии обострения ИЛФ); диффузные очаговые или кистозные изменения; выраженное мозаичное затемнение легочной ткани с наличием «воздушных ловушек» |
Клиническое течение ИЛФ может быть различным. У большинства пациентов отмечается медленно прогрессирующее течение, однако у некоторых пациентов происходит стабилизация патологического процесса, тогда как у других отмечается довольно быстрое прогрессирование заболевания. Что касается выраженности легочных изменений по данным КТВР, то зоны затемнения по типу «матового стекла» чаще всего трансформируются в ретикулярные изменения, которые, в свою очередь, могут прогрессировать и формировать зоны «сотового легкого», размер которых со временем обычно увеличивается. Следует отметить, что общий паттерн легочных изменений также может изменяться: так, КТкартина возможной ОИП может трансформироваться в типичную ОИП [22].
Биопсия легкого
Если однозначные данные о наличии ИЛФ при КТВР отсутствуют, то для подтверждения диагноза показано выполнение хирургической биопсии легких, которую чаще проводят с помощью видеоторакоскопической методики. С целью повышение эффективности биопсия легких должна производиться из разных долей легких. Хотя ХБЛ является наиболее достоверным методом определения гистологической картины ИИП, ее проведение связано с риском возникновения ряда осложнений, наиболее тяжелым из которых является обострение ИЛФ, особенно у пациентов с тяжелой дыхательной и/или сердечной недостаточностью [25]. В связи с этим решение о ее проведении должно приниматься индивидуально с учетом клинической картины, возможных преимуществ для постановки точного диагноза, а также согласия пациента.
В течение последнего десятилетия для гистологического подтверждения диагноза ИЛФ и других вариантов ИИП разработана методика трансбронхиальной криобиопсии легкого (ТБКБЛ). Ее основными преимуществами являются малоинвазивность, отсутствие необходимости в проведении интубации и ингаляционного наркоза и, вследствие этого, низкая частота развития осложнений в сочетании с возможностью получения большого по объему биоптата легкого, достаточного, в абсолютном большинстве случаев, для гистологической верификации диагноза [26]. Так, у пациентов без типичной картины ОИП по данным КТВР проведение ТБКБЛ позволяло установить диагноз приблизительно в 2/3 случаев, что сопоставимо с эффективностью ХБЛ в сходной ситуации [27]. При этом для ТБКБЛ характерны более низкий риск периоперационных осложнений (чаще всего отмечают развитие пневмоторакса и не угрожающего жизни кровотечения в месте проведения биопсии) и смерти, более короткий период госпитализации, что позволяет проводить ТБКБЛ у пациентов с высоким уровнем анестезиологического риска и наличием противопоказаний к ХБЛ [28].Таким образом, внедрение ТБКБЛ в клиническую практику может расширить показания к биопсии легкого и повысить диагностическую точность алгоритма обследования пациентов с подозрением на ИЛФ.
При морфологическом исследовании у пациентов с подозрением на ИЛФ G. Raghu и соавт. выделяют пять возможных гистологических паттернов заболевания (табл. 5) [29,4]. В сочетании с рентгенологическими данными они используются для подтверждения/исключения диагноза ИЛФ (табл. 3) [4,30].
Дифференциальный диагноз
У пациентов с подозрением на ИЛФ должен проводиться тщательный дифференциальный диагноз. При выявлении КТ-картины, соответствующей вероятной или возможной ОИП, что происходит довольно часто, в круг дифференциального диагноза следует включать, в первую очередь, хронический экзогенный аллергический альвеолит и фибротический вариант НСИП. Тем не менее, у части пациентов рекомендованная в данном случае ХБЛ не проводится в связи с наличием противопоказаний (тяжелой дыхательной недостаточности, сопутствующих заболеваний, возрастных ограничений) или нежеланием пациента.
При проведении дифференциального диагноза важно также исключить поражение легких в рамках системного заболевания соединительной ткани, в частности, ревматоидного артрита, системной склеродермии, дерматомиозита, синдрома Шегрена [31], в том числе при наличии КТ-картины типичной ОИП. При наличии у пациента отдельных клинических проявлений или повышения уровня лабораторных аутоиммунных маркеров, не соответствующих конкретному системному заболеванию соединительной ткани, может быть установлен диагноз интерстициальной пневмонии с аутоиммунными чертами [32].
Генетические маркеры ИЛФ
В настоящее время выявлен ряд мутаций и полиморфизмов генов, участвующих в ремоделировании легочной ткани и регуляции врожденного и приобретенного иммунитета, ассоциированных с развитием ИЛФ [33]. К ним относятся, в частности, мутации в генах, кодирующих сурфактантные протеины А и D (S):1–112. P-A и S):1–112. PD), описанные при семейных формах ИЛФ [34]. В ряде исследований выявлена ассоциация генетических полиморфизмов с прогнозом заболевания: в частности, наличие отдельных однонуклеотидных полиморфизмов в гене TLR-3 (Toll-подобный рецептор 3-го типа) ассоциировано с более быстрым прогрессированием заболевания [35]. Также при ИЛФ описан ряд полиморфизмов в генах муцина 5B (MUC5B) и TOLLIP (протеин, взаимодействующий с Toll-подобным рецептором) [36]. Хотя исследование генетических полиморфизмов не является частью диагностического алгоритма при ИЛФ, продолжается поиск генетических маркеров, способных служить предикторами различных вариантов течения заболевания и ответа на терапию.
Обострение ИЛФ
Обострение ИЛФ – это тяжелое жизнеугрожающее состояние, проявляющееся в виде быстрого нарастания дыхательной недостаточности у пациентов с ранее установленным диагнозом ИЛФ [37]. Как правило, характеризуется крайне тяжелым течением; смертность в ряде исследований достигала 85% [38]. В отличие от стабильного или медленно прогрессирующего течения ИЛФ, критерии диагностики его обострения определены менее четко. Согласно данным Н. Collard и соавт. [39], критерии обострения ИЛФ включают в себя наличие предшествующего или впервые выявленного ИЛФ с резким нарастанием одышки, развитием дыхательной недостаточности за предшествующие 30 дней без установленной причины, а также появление новых зон затемнения легочной ткани по типу «матового стекла» и/или консолидации на фоне имевшихся ранее изменений, соответствующих ОИП – зон ретикулярных изменений и «сотового легкого» (рис. 4) [40]. Тем не менее, вышеуказанные критерии обладают низкой специфичностью, в связи с чем при подозрении на обострение ИЛФ должен проводиться дифференциальный диагноз с инфекционным процессом, тромбоэмболией легочной артерии и ее ветвей, пневмотораксом, а также острой левожелудочковой недостаточностью с развитием отека легких [41].
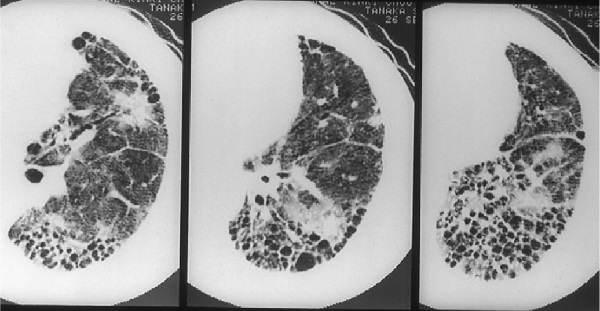
Заключение
Появление новых методов лечения, в частности, антифибротических препаратов, и неэффективность традиционной иммуносупрессивной терапии при ИЛФ подчеркивают важность как можно более ранней постановки диагноза и начала терапии. В течение последнего десятилетия был достигнут значительный прогресс в разработке диагностических алгоритмов для пациентов с ИЛФ. Этому способствовало повышение качества визуализационных методов, более полное понимание роли биопсии легких и разработка гистологических критериев ИЛФ. Все вышеперечисленные параметры должны исследоваться мультидисциплинарной командой специалистов, что в настоящий момент является стандартом диагностики ИЛФ. Несмотря на достигнутые успехи, в диагностике ИЛФ остаются нерешенные вопросы, в основном касающиеся применения инвазивных методов диагностики, в частности, хирургической биопсии легкого. Необходимо продолжать поиск молекулярно-биологических и генетических маркеров ИЛФ и разработку малоинвазивных биопсийных методов для максимально раннего установления диагноза, определения прогноза и разработки стратегии терапии ИЛФ.
