лимфоваскулярная и периневральная инвазия что это
Лимфоваскулярная и периневральная инвазия что это
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Патоморфологическая оценка простаты после радикальной простатэктомии
Т.О. Лаптева
ФГБУ «Ростовский научно-исследовательский онкологический институт» MЗ РФ; Ростов-на-Дону, Россия
Одним из самых важных вопросов, стоящих перед урологами и патоморфологами, является определение прогноза после радикальной простатэктомии (РПЭ). Наиболее ценной информацией для ответа на этот вопрос являются результаты патоморфологического исследования препарата после РПЭ. Так, по данным Stamey с соавт. [1] рецидив рака предстательной железы (РПЖ) после РПЭ может быть предсказан с высокой степенью точности на основании результатов патоморфологического исследования. Для того, чтобы правильно сориентировать и провести вырезку препарата «предстательная железа», нужно знать топографическую анатомию и гистологическое строение органа.
Зональная анатомия предстательной железы
Предстательная железа (ПЖ) – это непарный железисто-мышечный орган, который окружает простатическую часть мочеиспускательного канала и располагается между сфинктером мочевого пузыря и мочеполовой диафрагмой, по форме напоминающий каштан: длиной – 4–4,5 см, шириной 2,5–3 см, толщиной 1,2–2 см, объёмом 20–25 см3. Со всех сторон ПЖ окружена соединительнотканной капсулой, которая является продолжением прямокишечной перегородки.
МcNеаl предложил различать периферическую, центральную и переходную зоны, а также передний сегмент и зону сфинктера мочевого пузыря. В широкой урологической практике пользуются упрощённой схемой зональности ПЖ, где выделяют центральную, периферическую, переходную зоны и фибромускулярную строму: периферическая зона занимает до 70% железистой части простаты, её латеральной и задней части, протоки открываются в дистальном уретральном сегменте.
Происходит из мочеполового синуса. Срединная борозда делит её на правую и левую стороны; центральная зона занимает до 20-25% железистой части простаты, имеет конусовидную форму, включает все основание ПЖ, спускается от шейки мочевого пузыря к семенному бугорку, охватывая при этом семявыносящие протоки. Протоки центральной зоны открываются поблизости от семенного бугорка; переходная зона занимает до 5-10% железистой части ПЖ, располагается по бокам от простатической части уретры на уровне семенного бугорка.
Происходит из мочеполового синуса. Так же различают периуретральные железы и переднюю фибромускулярную строму («капсула») (рис. 1). Периферическая и центральная зоны имеют чёткие различия в строении стромы, протоков, что обусловлено различным эмбриогенезом и демонстрирует различия в их функциях. Переходная зона мало отличима от периферической, а с возрастом и при патологии различия вообще стираются.
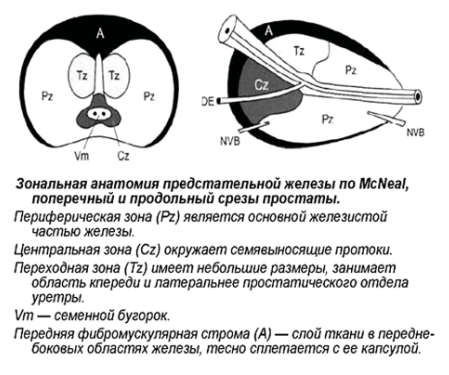
Рисунок 1. Соотношение доли позадилонной РПЭ к роботической РПЭ в США
Рак предстательной железы развивается с различной частотой в каждой зоне, и эта частота не пропорциональна массе железистой ткани в ней. Периферическая зона предстательной железы пальпируется через прямую кишку, она окружает центральную зону, в ней возникает около 70% аденокарцином ПЖ. Наиболее часто рак локализуется по задней и заднебоковой поверхностям ПЖ. Карциномы периферической зоны часто прорастают в перипростатические мягкие ткани по периневральным пространствам.
В центральной зоне возникаюттолько 5 – 10% от всех РПЖ. В переходной зоне самой частой патологией является доброкачественная гиперплазия предстательной железы (ДГПЖ), которая может приводить к значительному увеличению этой зоны, иногда превышающему по объёму остальные участки ПЖ. РПЖ в переходной зоне развивается реже, чем ДГПЖ, частота его составляет около 20%. В случае карцином переходной зоны экстрапростатическое распространение происходит по передней поверхности железы.
Опухоли из переходной зоны очень редко прорастают в периферическую зону. Периуретральные железы располагаются между простатической уретрой и проксимальным гладкомышечным сфинктером мочевого пузыря. Фибромускулярная строма занимает переднюю поверхность ПЖ и состоит преимущественно из мышечной ткани. Простатическая «капсула» не является истинной капсулой, а представляет собой периферическое уплотнение фибромускулярной стромы.
Правила вырезки препарата «предстательная железа» после РПЭ
Для оценки операционного материала после РПЭ необходима стандартная методика исследования макропрепарата, которая заключается в правильной ориентировке препарата – определения правой и левой долей, передней и задней поверхности, базальной и апикальной части железы. Для оценки краёв резекции и, возможных повреждений поверхности железы в ходе операции, рекомендуется окрашивание специальными чернилами поверхности макропрепарата ПЖ.
Препарат, фиксированный в 10% забуференном формалине в течение 24-36 часов, патолог разрезает по определенной схеме (рис. 2). Данная схема вырезки операционного материала позволяет более точно определить локализацию и объём опухолевых очагов. Макроскопически опухоль обычно представлена очагами неправильной формы диаметром около 5 мм, желтовато-белого цвета, плотной консистенции, что связано с диспластическими изменениями стромы.
Некоторые опухоли выглядят как желтоватые зернистые участки, что отличает их от нормальной губчатой ткани предстательной железы. РПЖ имеет тенденцию к мультилокулярному расположению и очень часто не выявляется макроскопически, что требует взятия большого количества материала для микроскопического исследования.
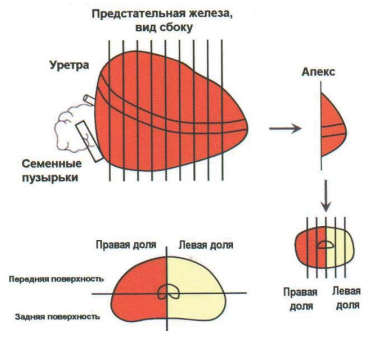
Рисунок 2. Схема вырезки предстательной железы [2]
РПЭ – гистологическое исследование
Патогистологический диагноз строится с учётом гистоархитектоники (структурно-тканевых) и цитологических признаков. Подавляющее большинство (до 95%) случаев РПЖ составляет обычная ацинарная аденокарцинома, и только небольшое количество представлено другими вариантами. Гистологическая картина обычной ацинарной карциномы вариабельна. Наиболее частый вариант – мелкие ацинарные структуры с признаками ядерной атипии.
В опухолевых ацинарных структурах отсутствует базальноклеточный слой, как правило, видны крупные чёткие ядрышки. Опухолевые ацинарные структуры могут быть разного размера, сливаться между собой, формировать криброзные структуры, тяжи и солидные поля. Подсчитано, что из 12 гистопатологических признаков, используемых при оценке степени аденокарциномы ПЖ, несомненную предсказательную ценность имеют 5 признаков: архитектоника расположения ацинусов, размеры клеточных ядер, форма ядра, наличие ядрышек, наличие фигур митоза.
Обычно для установления диагноза РПЖ бывает достаточно светооптического микроскопического исследования, прежде всего с определением гистологического варианта опухоли ПЖ. В 2016 году вышла в свет обновлённая классификация опухолей выделительной и мужской половой системы предстательной железы (WHO Classification of Tumors: Pathology and Genetics). В разделе новообразований предстательной железы наибольшие изменения коснулись группы эпителиальных опухолей.
В классификации Всемирной Организации Здравоохранения (ВОЗ) нашли отражение многие положения, принятые на консенсусе ISUP 2014 года. [3]. Согласно классификации ВОЗ (2016) варианты обычной аденокарциномы включают атрофический, псевдогиперпластический, микрокистозный, пенистоклеточный, муцинозный (коллоидный), перстневидно-клеточный, плеоморфный гигантоклеточный, саркоматоидный.
Неацинарный РПЖ составляет 5 – 10% случаев первичного РПЖ. В классификации ВОЗ (2016) выделены внутрипротоковая карцинома, протоковая карцинома, уротелиальная карцинома, плоскоклеточный и аденосквамозный рак, базальноклеточный рак, нейроэндокринные опухоли. В таблице 1 приведена актуальная гистологическая классификация опухолей предстательной железы (табл.1) [4].
Таблица 1. Классификация опухолей предстательной железы, ВОЗ (2016)
Нозологическая форма
ICD-O код
Эпителиальные опухоли
Из пенистых клеток
Простатическая интраэпителиальная неоплазия
Нейроэндокринные опухоли
Аденокарицнома с нейроэндокринной дифференцировкой
Высокодифференцированная нейроэндокринная опухоль
Мелкоклеточный нейроэндокринный рак
Крупноклеточный нейроэндокринный рак
Мезенхимальные опухоли
Стромальная опухоль с неопределенным потенциалом злокачественности
Воспалительная миофибробластическая опухоль
Недифференцированная плеоморфная саркома
Солитарная фиброзная опухоль
Злокачественная солитарная фиброзная опухоль
Гематолимфоидные опухоли
Опухоли неясного происхождения
Метастатические опухоли
Опухоли семенных пузырьков
В новой классификации пересмотрены подходы к определению степени дифференцировки и оценке индекса Глисона. По степени дифференцировки опухоли можно судить о месте возникновения аденокарциномы. Так, аденокарцинома, возникающая в переходной зоне ПЖ, обычно имеет низкую степень и клинически отличается меньшей агрессивностью, чем часто встречающаяся аденокарцинома периферической зоны ПЖ. Степень дифференцировки опухоли является одним из самых надёжных и полезных признаков определения стадии РПЖ.
Определение степени имеет прогностическую ценность, в частности, в отношении признаков распространения РПЖ за пределы ПЖ, инвазии семенных пузырьков, метастазов в лимфатические узлы или в кости. Фактически все временные показатели наступления рецидивов и выживаемости напрямую коррелируют со степенью, включая показатели выживаемости, продолжительность жизни без метастазов. Для оценки степени гистологической дифференцировки опухолевой ткани ПЖ используют систему Глисона (D.F. Gleason). Подсчёт по степени Gleason является прогностически наиболее точным относительно времени наступления рецидива после РПЭ.
Система градации по D.F. Gleason
В 1965 году Дональд Ф. Глисон предложил систему градирования РПЖ, основанную на гистологических критериях опухоли. Новым аспектом этой системы было определение степени дифференцировки рака не по наиболее злокачественному компоненту, а по сумме баллов распространённых структурных характеристик опухоли. В 1974 году система была несколько модифицирована. В 1993 году система градирования по Глисону была рекомендована конференцией ВОЗ и до сих пор остаётся одной из наиболее важных параметров для определения прогноза РПЖ. Система подвергалась минимальным изменениям, нашедшим отражение в 3 корректировках, принятых Международным Обществом Уропатологов в 2005, 2010 и 2014 годах (рис. 3).
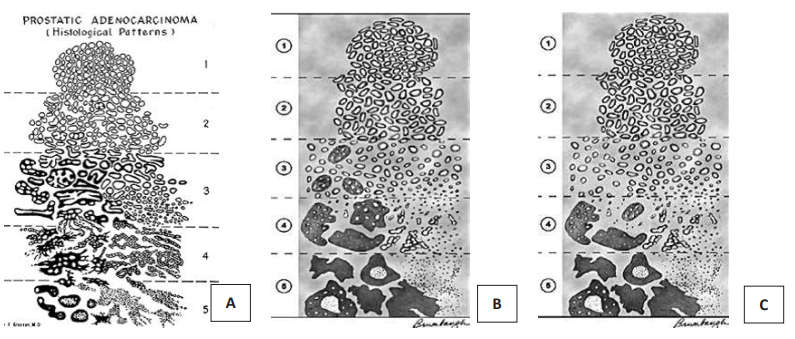
Рисунок 3. Схемы модификаций шкалы Глисона: А – оригинальная система Глисона;
В – схема градации с корректировкой в 2005 г. (ISUP); С – схема градации с корректировкой в 2010 г. (ISUP), утверждённая в 2012 г
Система градации по Глисону определяет пять степеней с уменьшающейся дифференцировкой: от максимально приближенной к строению нормальной железы простаты до недифференцируемых структур. В различных отделах опухоли степень дифференцировки железистых структур может быть различной. Сумма Глисон складывается из градаций 2-х преобладающих структурных компонентов [4].
Каждая степень дифференцировки, из пяти возможных, описывается цифрой от 1 до 5. Правила составления суммы Глисон: – по операционному материалу – самый распространённый компонент опухоли + второй по распространённости (занимающий более 5% объёма опухоли); – по биопсийному материалу – самый распространённый компонент + самый злокачественный компонент без учёта его % доли.
При этом не следует указывать в биопсии сумму Глисона менее 6 баллов [1], так как отмечена низкая воспроизводимость результатов при последующем исследовании материала РПЭ, в виде повышения индекса Глисона. В отличие от предыдущего издания классификации ВОЗ (2004), описание градации по Глисону начинается со структур, соответствующих 3 баллам. Например, сумма Глисон 6 (3+3), 7 (3+4) или 7 (4+3), 8 (4+4), 8 (3+5) и т. д.
На практике значения Глисона 1 и 2 балла используются лишь в исключительных случаях. Опухоль с суммой Глисона 3-4 определена как «встречающаяся иногда при трансуретральной резекции и при мультифокальных опухолях в материале радикальной простатэктомии» [6]. При оценке аденокарциномы в материале РПЭ градируется по системе Глисон больший опухолевый узел, а мелкие фокусы высокодифференцированного рака не подлежат оценке.
Исключением является случай, когда в мелком фокусе определяется низкодифференцированный рак [6]. Неацинарный РПЖ в материале РПЭ составляет 5 – 10% случаев первичного РПЖ. Впервые в классификации ВОЗ (2016) выделена:
Новая градирующая система аденокарциномы предстательной железы
Наряду с определением нозологического типа РПЖ и степени дифференцировки в классификации ВОЗ (2016) предусмотрены морфологические прогностические группы, принятые на согласительной конференции Международного общества уропатологов (ISUP), 2014 года [7] предусмотрено 5 прогностических градирующих групп (grading group), соответствующих определенной сумме по шкале Глисона (табл. 2).
ISUP рекомендует указывать прогностическую группу в гистологическом заключении после суммы баллов по Глисону, например, «7 баллов по Глисону (3+4), группа 2 (G2) или 7 баллов по Глисону (4+3), группа 3 (G3)». При этом в классификации сохранены прогностические группы ацинарной аденокарциномы, рассчитывающиеся на основании показателей TNM, уровня ПСА и индекса Глисон (табл. 3).
Таблица 2. Определение прогностической группы ацинарной аденокарицномы
| Прогностическая группа | Сумма баллов по Глисону |
| Группа 1, высокодифференцированные карциномы | Глисон ≤6 (только раздельно расположенные хорошо сформированные железы) |
| Группа 2, умереннодифференцированные карциномы | Глисон 7 (3 + 4) (преимущественно хорошо сформированные железы с небольшим компонентом плохо сформированных / рассыпающихся / крибриформных желез) |
| Группа 3, низко-умереннодифференцированные карциномы | Глисон 7 (4 + 3) (преимущественно плохо сформированные / рассыпающиеся/ крибриформные железы с небольшим компонентом хорошо сформированных желез) |
| Группа 4, низкодифференцированные карциномы | Глисон 8 (4+4), 8 (3+5), 8 (5+3) (только плохо сформированные/ рассыпающиеся/ крибриформные железы; тяжи опухоли, отдельные клетки, гнезда, трабекулы, структуры с очагами комедонекроза в сочетании с хорошо сформированными железами) |
| Группа 5, недифференцированные карциномы | Глисон 9-10 (плохо сформированные/ рассыпающиеся / крибриформные железы; тяжи опухоли, отдельные клетки, гнезда, трабекулы, структуры с очагами комедонекроза) |
Таблица 3. Клинические прогностические группы риска рака предстательной железы
Прогностическая группа
Категория Т
Категория N
Категория М
Уровень ПСА, нг/мл
Сумма Глисон, баллы
Классификация РПЖ по системе TNM (AjCC 8-е изд.)
Схема оценки первичной опухоли, согласно международной классификации РПЖ по системе TNM (AjCC 8-е изд.), которая была дополнена и пересмотрена в 2017 году:
Классификация РПЖ TNM (AjCC 8-е изд.) не претерпела существенных изменений по отношению к классификации РПЖ TNM (AjCC 7-е изд.). Изменения коснулись патоморфологической стадии (р TNM): осталась только категория рТ0, категория рТ1 – не указывается, а в категории первичной опухоли рТ2, упразднены подкатегории рТ2а, рТ2b, рТ2с, они объединены в одну – рТ2.
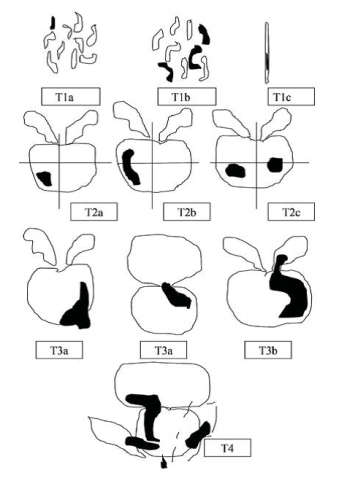
Рисунок 4. Схематическая классификация рака предстательной железы по системе TNM (2010)
Прогностические факторы при РПЭ
Ценным прогностическим фактором является наличие экстрапростатической инвазии с определением характера инвазии: фокальная или протяжённая. Опухолевые структуры могут определяться в парапростатической жировой клетчатке, вокруг структур сосудисто-нервного пучка, при выходе опухоли за пределы контура нормальной ткани простаты. Инвазия в семенные пузырьки диагностируется только в случае наличия опухолевого роста в мышечном слое свободной части семенных пузырьков и является плохим прогностическим признаком.
Инвазия в интрапростатическую часть семенных пузырьков не является истинной инвазией и имеет лучший прогноз [6]. Оценка статуса краёв резекции является обязательным критерием в оценке материала РПЭ. Положительным хирургическим краем резекции считается непосредственное наличие структур опухоли в маркированной красителем линии. В этом случае необходимо указать локализацию и протяжённость в мм положительного края, если позитивный край локализуется не в области верхушки и основания, указывается интра- или экстрапростаитческий край.
Это информация необходима для планирования тактики послеоперационного лечения [8]. Периневральная инвазия в ткани простаты после РПЭ не является значимым прогностическим фактором для ацинарной карциномы, несмотря на это рекомендуется указывать наличие периневральной инвазии в протоколе гистологического заключения. Периневральная инвазия в большинстве случаев обнаруживается вблизи капсулы железы, т. к. там располагается основная масса нервных стволиков.
Наличие периневральной инвазии в 50% случаев сопровождается капсулярной пенетрацией через инвазию и распространением по периневральному пространству. Риск прогрессирования после РПЭ у пациентов с наличием периневральной инвазии выше в 2 раза, чем у больных без неё [6]. Лимфоваскулярная инвазия — это стойкий прогностический фактор. Наличие лимфоваскулярная инвазии не влияет на стадию РПЖ, её рекомендовано подтверждать иммуногистохимическим методом.
При морфологической оценке ПЖ по материалу РПЭ после проведённой дооперационной терапии в гистологическом заключении отражаются изменения опухоли, объём опухолевой ткани, при возможности отображается сумма Глисона (она может повышаться). При выраженных изменениях после терапевтического и/или лучевого воздействия сумма Глисон не определяется [8].
Иммуногистохимическая диагностика РПЖ Раздел иммуногистохимической диагностики в материале ПЖ имеет достаточно ограниченный набор антител и включает в себя [6, 8]:
Применение иммуногистохимической диагностики ацинарной аденокарциномы при исследовании материала РПЭ имеет ограниченное значение, т. к. первичная диагностика опухоли была проведена в материале пункционной биопсии. Диагностическую значимость ИГХ исследование в материалах РПЭ имеет в случае:
Заключение
С учётом важности оценки значимых параметров в гистологическомзаключениипоматериалу РПЭ должны быть отображены: гистологический вариант опухоли, степень дифференцировки, сумма Глисона, прогностическая группа, распространённость опухоли по зонам (периферическая, центральная, переходная, апекс) и долям, объем (%) поражения опухолью, степень распространённости: врастает/прорастает псевдокапсулу железы, инвазия в семенные пузырьки, в простатический отдел уретры, в шейку мочевого пузыря, наличие периваскулярной, лимфоваскулярной инвазии, интра-, экстрапериневральной инвазии, состояние краёв резекции, оценка лимфатических узлов на наличие метастазов опухоли, стадия (рTNM), МКБ–О код (ICD-О code). Проводится оценка лечебного патоморфоза опухоли в случаях предоперационного лечения.
ЛИТЕРАТУРА
Рак прямой кишки. Послеоперационная профилактика расстройств
Уважаемые пациенты! Обратите внимание на следующие материалы сайта:
Профилактика послеоперационных колоректальных расстройств
при раке прямой кишки
Необходимость формирования толстокишечного резервуара возникает при низких резекциях прямой кишки. Правда понятие «низкая резекция» определяется по-разному и значение здесь имеет каждый сантиметр. Обычно речь идет о раке среднеампулярного отдела прямой кишки с определением нижней границы резекции. Т.С.Одарюк с соавт. (2000 г.) пишут, что это в среднем 1,5 см от аноректальной линии. Необходимость в резервуаре авторы обуславливали развитием «Синдрома низкой передней резекции» после прямых наданальных анастомозов.
Для оценки колоректальной функции у больных после резекций прямой кишки с формированием толстокишечного резервуара используется метод анкетирования (вопросник) и объективные исследования аноректальной функции в разные сроки после оперативного вмешательства.
Наряду с безусловно положительной оценкой резекции прямой кишки при раковом ее поражении с формированием толстокишечного резервуара, ряд авторов обращает внимание на недостатки такой операции. Справедливо замечают Г.И.Воробьев с соавт. (2000 г.), что «до настоящего времени сохраняется нестабильность и непредсказуемость функциональных результатов, особенно в отдаленные сроки после данного вмешательства (операции с резервуарами)». Так, у 15-20% больных не удается добиться нужной континенции.
Поиск лучших вариантов формирования толстокишечных резервуаров и оценка колоанальной функции в таких случаях продолжается. Совершенствование колопластических операций в этом плане, вероятно, займет определяющее место.
Склонностью к лимфотропизму при раке прямой кишки
В связи с тем, что рак прямой кишки, согласно исследованиям, обладает склонностью к лимфотропизму, именно лимфаденэктомии в хирургическом лечении рака прямой кишки придается весьма важное значение. Лимфогенное метастазирование рака прямой кишки является одной из вероятных причин развития локорегионального рецидива после операции. Поэтому наряду с удалением первичной опухоли целью хирургического лечения является радикальное удаление зон регионарного метастазирования опухоли.
Периневральная инвазия
Первичный рак прямой кишки характеризуется тем, что опухоль остается длительное время локализованной и относительно медленно растет по сравнению с другими опухолями пищеварительного тракта. Локализованный и медленный рост характерен так же и для метастазов в лимфоузлы. Исходя из этой биологической особенности рака прямой кишки, было сделано предположение, что, увеличив объем лимфаденэктомии, можно достичь снижения количества рецидивов.
Впервые расширенная лимфаденэктомия была описана Kuru в 1942 г. Однако, результаты исследований не показали статистически значимой разницы в 5-летней выживаемости между группами больных, которым проводились стандартная и расширенная лимфаденэктомия. Вновь интерес к расширенной лимфаденэктомии появился в 80-е годы, когда Heald и соавт. предложили выполнение тотальной мезоректумэктомии, т.е. удаление совокупности тканей и органов, находящихся в пределах фасциальной оболочки прямой кишки, включающей в себя параректальную клетчатку, кровеносные и лимфатические сосуды. Используя данную методику, этим авторам удалось снизить частоту местных рецидивов до 5%, что, однако не удалось воспроизвести другим исследователям, но вновь возник интерес к расширенной лимфаденэктомии.
Takahashi T. и соавт. предложили различать несколько вариантов лимфаденэктомии: ограниченную, стандартную и расширенную. Однако такое деление не является общепризнанным.
Данные о влиянии расширенной лимфаденэктомии на 5-летнюю выживаемость больных раком стадии В и С по Dukes весьма противоречивы. Необходимы дальнейшие многоцентровые исследования.
Недостатки лимфаденэктомии при раке прямой кишки
Казалось бы очевидным, что для получения лучших функциональных результатов после низкой резекции ПК необходимо позаботиться о сохранении вегетативной иннервации органов таза, однако специальных исследований в этом плане очень мало. Вероятно, правы Yasutomi Masayuki et all. (1995 г.), которые пишут, что в предыдущие годы все внимание было сосредоточено на повышение радикальности операций. К этому нужно добавить, что не существует, а мы специально интересовались, специфических методов идентификации нервных структур (окраска, свечение и т.д.).
Проблему составляет сохранение иннервации при резекциях ПК и ряд хирургов призывают бережно относиться к нервным структурам таза. В этом отношении нужно отметить определенную настойчивость и последовательность исследований японских хирургов.
Сохранение вегетативных нервов малого таза при операциях у больных РПК реально при начальных формах ракового поражения при стадиях по Dukes А и В. Окончательно неясным и спорным является вопрос о возможности и целесообразности сохранения гипогастральных нервов при более распространенных формах опухолевого поражения ПК, не пренебрегая онкологическими интересами.
Оригинальные исследования T.Kono et all. (1998 г.), которые провели исследование на крысах по трансплантации тазовых нервов после их предварительного иссечения. Через 6 недель они уже регистрировали ритмичные сокращения мочевого пузыря у всех подопытных. Авторы делают смелый вывод, что трансплантация нервов таза успешно восстанавливает функцию мочевого пузыря и поэтому такую операцию можно рекомендовать в практику.
Интересна работа хирургов из Нидерланд. Хирурги этой страны обратили внимание на то обстоятельство, что после операций по поводу рака на прямой кишке, возникает значительное число мочеполовых нарушений, что, безусловно, сказывается на КЖ этих пациентов. В связи с этим они пригласили японских хирургов и с их помощью оперировали 47 больных с низким раком ПК, которым сохраняли нервы таза. Мочевых расстройств не развилось ни у кого из больных. 19 из 30 мужчин были сексуально активны. Половое бессилие связано по их наблюдениям с повреждением гипогастрального сплетения. Для сохранения эякуляции необходимо сохранение верхнего гипогастрального сплетения. Авторы заключают, что операции с сохранением нервов таза должны стать хирургическим стандартом при оперативном лечении начальных форм рака прямой кишки.
О возможности сохранения нервов таза при резекциях прямой кишки сообщают и отечественные авторы: Г.И.Воробьев с соавт., П.В.Царьков с соавт. А.И.Темников и Ю.П.Дугин.
Мы провели собственное исследование с целью изучить некоторые особенности и варианты расположения верхнего подчревного сплетения, подчревных нервов и их ветвей, с целью возможного сохранения их при операциях по поводу низкого рака ПК.
Материалом для исследования послужили 12 бальзамированных и 5 нефиксированных трупов людей, умерших от причин не связанных с патологией органов малого таза. Методика исследования заключалась в проведении общей и специальной антропометрии, препарирования, зарисовки, протоколирования, фотографирования, видеозаписи.
Маловетвистая форма строения нервов характеризовалась наличием отдельных, немногочисленных, относительно толстых волокон с единичными анастомозами между ними. Волокна сплетения так же располагаются кзади от позадипрямокишечной клетчатки, верхних прямокишечных сосудов и не связаны с этими образованиями.
С учетом особенностей топографо-анатомического расположения автономных нервов таза, мы применили нерв-сберегающую технику оперирования при выполнении операций на прямой кишке по поводу рака ее различной локализации.
Показанием к операции у всех больных была аденокарцинома. Большинство новообразований соответствовало стадии Dukes B с высокой и умеренной степенью дифференцировки опухоли и локализацией ее в средне и нижнеампулярном отделах. Преобладающим типом операции была низкая передняя аппаратная резекция и брюшно-промежностная экстирпация прямой кишки. Обязательными этапами операции у всех больных были: высокая перевязка нижнебрыжеечной артерии и вены непосредственно у аорты, иссечение мезоректальной клетчатки, определение формы верхнего подчревного сплетения, выделение, взятие на «держалку» и мобилизация правого и левого подчревных нервов.
При дальнейшей мобилизации прямой кишки, мы старались выделить и визуализировать боковые связки ее (которые пересекаем на зажимах), с тем чтобы в инструмент, вместе со средними прямокишечными сосудами, попали только те веточки нижнего билатерального сплетения, которые направляются к стенке прямой кишки. Ветви идущие к другим органам малого таза, сохраняли с удалением окружающей их клетчатки. В тех случаях, когда раковая опухоль распространялась на окружающие ткани и вовлекала гипогастральный нерв с одной стороны, мы принебрегали им, соблюдая онкологические принципы оперирования и старались сохранить целостность подчревного нерва с другой стороны. Так мы оперировали трех больных.
В тех же случаях, когда опухоль распространяется на окружающие ткани с вовлечением вегетативных нервов таза с обеих сторон, ее следует удалять единым блоком совместно с нервами.