лимфоцеле после операции простатэктомии что это
Лимфоцеле после операции простатэктомии что это
а) Терминология:
1. Синонимы:
• Лимфатическая киста, псевдокиста, лимфокиста
2. Определение:
• Кистозные полости без эпителиальной выстилки, заполненные лимфой
1. Общие характеристики:
• Лучший диагностический критерий:
о Внебрюшинная киста с четкими границами у пациентов после операций в области малого таза
• Локализация:
о Внебрюшинно в малом тазу; парааортально в забрюшинном пространстве
• Морфология:
о Обычно однокамерная тонкостенная киста овоидной формы
2. КТ при послеоперационном лимфоцеле:
• Бесконтрастная КТ:
о Не осложненная киста имеет плотность, близкую к плотности воды
о Редко определяют небольшое количество внутреннего жира (хилюса)
о Редко (в случае хронизации) возможна кальцификация стенки
• КТ с контрастированием:
о Тонкие стенки; отсутствуют контрастное усиление стенки и пристеночный узел
3. МРТ при послеоперационном лимфоцеле:
• Однородный сигнал низкой интенсивности на Т1-ВИ; высокая ИС на Т2-ВИ:
о Т2-ВИ с подавлением сигнала от жировой ткани: отсутствует уменьшение ИС
о МРТ в DWI-режиме: низкая ИС
• Отсутствие усиления после введения внутривенного контраста
о МР-лимфангиография: позволяет установить точный диагноз
4. УЗИ при послеоперационном лимфоцеле:
• УЗИ в режиме серой шкалы:
о Анэхогенное образование с артефактом дистального усиления; иногда определяют перегородки
о В случае осложненной кисты: внутренние эхо-сигналы/уровень фрагментов ткани
• Цветовое допплеровское картирование:
о Отсутствие потока
5. Советы по визуализации:
• Советы по протоколу исследования:
о КТ с контрастным усилением или МРТ: экскреторная томография (более 10 мин.)
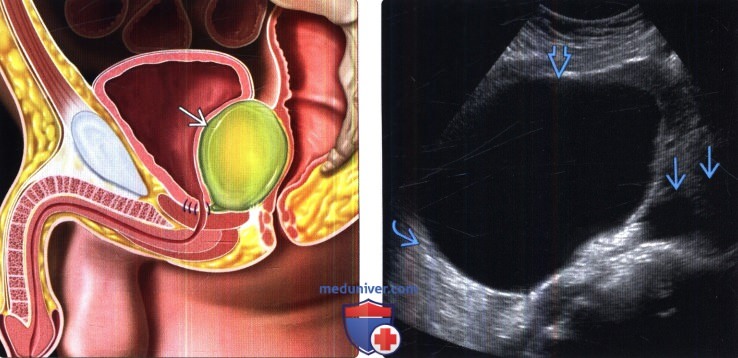
(Справа) УЗИ, трансвагинальный датчик, поперечная плоскость: у пациентки после гистерэктомии с лимфодиссекцией выявлена крупная анэхогенная киста, прилегающая к подвздошным сосудам, что соответствует картине послеоперационного лимфоцеле. Обратите внимание на тонкую стенку и артефакт дистального усиления.
в) Дифференциальная диагностика послеоперационного лимфоцеле:
1. Полостные образования малого таза:
• Уринома: может наполняться контрастом после экскреторной фазы
• Абсцесс: контрастная толстая неровная стенка
• Гематома/эндометриома: составная, компоненты крови
2. Дивертикул мочевого пузыря:
• Прилегает к мочевому пузырю; возможно наличие тонкой шейки к мочевому пузырю
• Помутнение после экскреторной фазы
3. Лимфангиома:
• Множественные образования стонкими перегородками; возможна кальцификация
• Часто вовлекает более одного отдела забрюшинного пространства
4. Псевдомиксома забрюшинного пространства:
• Поликистозное образование, толстые стенки, кальцификаты; правый нижний квадрант
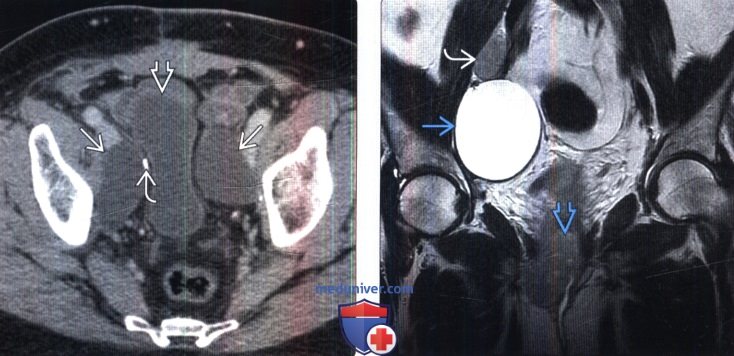
(Справа) МРТ, Т2-ВИ, SS FSE, коронарная проекция: после гистерэктомии и лимфодиссекции по поводу рака шейки матки выявлено ограниченное лимфоцеле с высокой ИС на Т2-ВИ. Обратите внимание на рецидив первичной опухоли и прилегающий к уретре и метастаз в лимфатическом узле.
2. Макроскопические и хирургические признаки:
• Киста с водянистой жидкостью от светло-желтого до желтовато-коричневого цвета
3. Микроскопия:
• Лимфоциты, единичные эритроциты; вариабельно-белок/жир
д) Клинические особенности:
1. Клиническая картина:
• Наиболее распространенные признаки/симптомы:
о Клинические проявления у небольшого числа (
Редактор: Искандер Милевски. Дата публикации: 21.9.2019
Симптоматические лимфатические кисты после онкоурологических операций на органах малого таза и влияние их анатомической локализации на клиническую картину
Полный текст:
Аннотация
Введение. Лимфатические кисты (ЛК) — это скопление свободной лимфатической жидкости в ограниченном пространстве (между тканями и органами), после выполнения лимфодиссекции. Они являются частыми осложнениями в онкоурологии малого таза. ЛК делятся на симптоматические и асимптоматические.
Цель исследования. Оценить влияние анатомической локализации симптоматических лимфатических кист (сЛК) на клиническую картину.
Материалы и методы. С января 2017 по март 2020 года выполнено 203 радикальных простатэктомий (РПЭ) с тазовой лимфодиссекцией (ТЛАЭ) и 42 радикальных цистэктомий (РЦЭ) с ТЛАЭ. Из 203 пациентов после РПЭ у 13 (6,4%) развились сЛК, а из 42 пациентов после РЦЭ — у 6 (14,3%). Всем пациентам в связи с развившимися осложнениями были проведены комплексное ультразвуковое исследование (УЗИ) и мультиспиральная компьютерная томография (МСКТ) органов забрюшинного пространства, брюшной полости и малого таза для оценки локализации и объёма ЛК.
Результаты. При анализе клинической картины и данных МСКТ у 19 пациентов с сЛК, нами выделены 4 анатомические локализации ЛК: паравазально-подвздошная, паравезикальная, превезикальная и тазово-забрюшинная. Частота паравазально-подвздошных сЛК была наивысшей — 13 (68,5%) пациентов, клиническая картина: боль в проекции малого таза, лимфедема нижней конечности, температура тела ≥ 39,0 о С, признаки компрессии подвздошных сосудов. Паравезикальные сЛК развились у 2 (10,5%) пациентов вследствие несостоятельности уретровезикального анастомоза. Превезикальные сЛК были выявлены у 2 (10,5%) пациентов, больные отмечали прогрессирующее недержание мочи и боль над лонным сочленением. Тазово-забрюшинные сЛК наблюдали у 2 (10,5%) пациентов: тянущая боль в поясничной области, температура тела ≥ 38,0 о С вследствие сдавления мочеточника и развития обструктивного пиелонефрита, а также имелась компрессия нижней полой вены лимфатической кистой. В 18 случаях выполнили оперативное вмешательство: чрескожное дренирование ЛК под ультразвуковым контролем у 12 (63,2%) пациентов, лапароскопическую марсупиализацию ЛК у 3 (15,7%) пациентов, открытую методику у 3 (15,7%) и в 1 (5,4%) случае лечение было консервативным.
Заключение. Симптоматические ЛК могут быть классифицированы по 4 анатомическим локализациям, которые определяют их клиническую симптоматику. Большинство сЛК нуждаются в оперативном вмешательстве.
Ключевые слова
Для цитирования:
Котов С.В., Простомолотов А.О. Симптоматические лимфатические кисты после онкоурологических операций на органах малого таза и влияние их анатомической локализации на клиническую картину. Вестник урологии. 2020;8(4):72-79. https://doi.org/10.21886/2308-6424-2020-8-4-72-79
For citation:
Kotov S.V., Prostomolotov A.О. Symptomatic lymphatic cysts after oncourological operations on the pelvic organs and influence of their anatomical localization on the clinical appearance. Vestnik Urologii. 2020;8(4):72-79. (In Russ.) https://doi.org/10.21886/2308-6424-2020-8-4-72-79
Введение
Лимфатические кисты (лимфоцеле) представляют собой скопление лимфатической жидкости в ограниченном пространстве после выполнения тазовой лимфаденэктомии (ТЛАЭ): вдоль подвздошных кровеносных сосудов, в обтураторной ямке, в пара- и предпузырном пространствах, забрюшинно. Лимфатические сосуды в меньшей степени, чем кровеносные, содержат гладкую мускулатуру, они неспособны к полноценной вазоконстрикции. Из этого следует, что при выполнении лимфаденэктомии, при которой происходит обширное повреждение жировой ткани вдоль границ лимфодиссекции, афферентные лимфатические сосуды остаются открытыми на длительный срок (до 48 часов), что ведёт к развитию лимфатических осложнений, таких как длительная лимфорея, лимфостаз и формирование лимфатических кист (ЛК) [1].
Зарубежные и отечественные авторы в своих исследованиях сообщают о разной частоте возникновения лимфоцеле после радикальной простатэктомии (РПЭ) и радикальной цистэктомии (РЦЭ). В исследовании W.Y. Khoder et al. частота образования ЛК составила 26% (304 пациента из 1163, которым выполнили позадилонную РПЭ с тазовой лимфодиссекцией). Лимфатические кисты выявляли ультразвуковым исследованием органов брюшной полости и малого таза. Из 304 пациентов лишь у 28 (9%) кисты имели клиническую симптоматику и потребовали выполнения оперативного вмешательства [2].
В работе V. Novotny et al. продемонстрировано 516 случаев выполнения РЦЭ с тазовой лимфаденэктомией, частота лимфатических кист составила 8,1% (42 пациента). Из 42 пациентов 14 (2,7%) подверглись хирургическому вмешательству в связи с развитием симптоматических ЛК [3].
В отечественном ретроспективном исследовании К.М. Нюшко и соавт. сообщено о выполнении позадилонной РПЭ с расширенной ТЛАЭ 59 пациентам, у 9 (15,3%) из них развились симптоматические ЛК [4].
Описано множество факторов риска развития симптоматических ЛК, такие как возраст и индекс массы тела пациента, антикоагулянтная профилактика, хирургический доступ, тип тазовой лимфодиссекции, количество удалённых лимфатических узлов и наличие их метастатического поражения. Изучались способы профилактики симптоматических лимфоцеле: применение различных методов лигирования лимфатических сосудов и лимфостатических средств, установка страховых дренажей, формирование брюшинного лоскута или выполнение перитонеальной фенестрации. Несмотря на это, частота развития симптоматических ЛК остаётся на высоком уровне. Клиническая симптоматика связана с давлением лимфоцеле на различные соседние органы и сосуды. ЛК могут клинически проявляться болевым синдромом в брюшной полости и приводить к серьёзным последствиям, таким как тромбоз глубоких вен нижних конечностей, развитие кишечной непроходимости, отеки мягких тканей, абсцедирование ЛК, формирование уретерогидронефроза, развитие сепсиса и тромбоэмболии лёгочной артерии [5][6].
Целью нашего ретроспективного исследования является анализ клинических проявлений симптоматических ЛК в зависимости от их анатомической локализации после РПЭ с тазовой лимфодиссекцией и РЦЭ с тазовой лимфодиссекцией и собственного опыта лечения симптоматических ЛК.
Материалы и методы
Радикальную простатэктомию осуществляли различными доступами: экстраперитонеальным — позадилонная простатэктомия без формирования брюшинного лоскута у 7 пациентов (53,8%) из 13, позадилонная простатэктомия с формированием брюшинного лоскута у 5 (38,5%), трансперитонеальным — лапароскопическая радикальная простатэктомия (ЛРПЭ) у 1 пациента (7,7%).
Радикальную цистэктомию в большинстве случаев выполняли лапароскопически у 4 пациентов (66,7%) из 6, открыто — у 2 пациентов (33,3%). Среди методик деривации мочи преобладала операция Брикера (у 5 пациентов). Одному пациент была произведена операция Штудера.
Всем пациентам помимо стандартного компрессионного трикотажа проводили периоперационную тромбопрофилактику инъекциями низкомолекулярных гепаринов в подкожно-жировую клетчатку живота, начинавшуюся за 12 часов до операции и продолжавшуюся амбулаторно в течение 30 дней.
Результаты
Таблица 1. Результаты патогистологического исследования биоматериала 13 пациентов после радикальной простатэктомии с тазовой лимфодиссекцией
Table 1. The results of histopathological examination of 13 patients` biomaterial after radical prostatectomy with pelvic lymph node dissection
Таблица 2. Результаты патогистологического исследования биоматериала 6 пациентов после радикальной цистэктомии с тазовой лимфодиссекцией
Table 2. The results of histopathological examination of 6 patients` biomaterial after radical cystectomy with pelvic lymph node dissection
В связи с развившимися у амбулаторных пациентов жалоб они были регоспитализированы, где им проводили комплексное ультразвуковое исследование (УЗИ), ультразвуковую допплерографию сосудов нижних конечностей (УЗДГ) и мультиспиральную компьютерную томографию (МСКТ) органов забрюшинного пространства, брюшной полости и малого таза для оценки локализации и объёма ЛК. Клинические проявления лимфатических кист представлены в таблице 3.
Таблица 3. Клинические проявления у 19 пациентов лимфатическими кистами
Table 3. Clinical manifestations in 19 patients with lymphatic cysts
Обсуждение
По данным МСКТ, симптоматические ЛК классифицированы по 4 анатомическим локализациям: паравазально-подвздошные, паравезикальные, превезикальные, тазово-забрюшинные. Анатомическое расположение симптоматических ЛК влияет на клиническую картину и выбор метода оперативного вмешательства. Мы использовали чрескожное дренирование лимфатической кисты под ультразвуковым контролем с установкой дренажа в полости кисты для её опорожнения с последующим введением склерозирующих веществ, лапароскопическую марсупиализацию ЛК и открытую методику.
Паравазально-подвздошные симптоматические ЛК являлись наиболее распространенными кистами и наблюдались у 13 пациентов из 19 (68,5%). Все симптоматические ЛК после РЦЭ с ТЛАЭ развились в данной зоне. Эти кисты имели хорошо сформированную плотную соединительнотканную оболочку, которая образовалась из свернувшихся фибриновых сгустков. Лимфа, вытекающая из повреждённых афферентных лимфатических сосудов, собиралась в ограниченном пространстве вокруг и латеральнее подвздошных сосудов, иногда распространяясь на запирательную ямку, а также на мышцы тазового дна (рис. 1). Объём кист был относительно небольшим, и клиническая симптоматика была связана либо с инфицированием и формированием абсцесса в малом тазу (боль и тяжесть в проекции малого таза; температура тела > 39,0 0 С), либо с давлением кисты на подвздошные сосуды (боль и тяжесть в нижней конечности, лимфостаз половых органов и нижней конечности). Чрескожное дренирование лимфатической кисты под ультразвуковым контролем с установкой дренажа при такой локализации является трудновыполнимым пособием. Впрочем, при большом объёме лимфоцеле и наличии опыта у хирурга, данный вид оперативного вмешательства может быть успешным. Если произошло инфицирование кисты с формированием абсцесса в малом тазу, то рекомендуется выполнение внебрюшинной лапароскопической марсупиализации или использование открытой хирургии.
Паравезикальные симптоматические ЛК были выявлены у 2 пациентов из 19 (10,5%). Лимфа скапливалась и заполняла промежутки между боковой стенкой малого таза и мочевым пузырём, ЛК формировались с одной или обеих сторон от мочевого пузыря (рис. 2). Две кисты могут сообщаться друг с другом спереди от мочевого пузыря, образуя одну большую полость. Данный тип кисты содержит большие объёмы лимфы (более 1 литра) и формируется достаточно быстро после радикальной простатэктомии с ТЛАЭ. Клиническая симптоматика связана с болью и тяжестью в проекции малого таза, а в некоторых случаях с компрессией мочевого пузыря. По данным ретроградной цистографии и ретроградной уретроцистоскопии у пациентов отмечали несостоятельность уретро-везикального анастомоза. Дифференциальная диагностика данного вида кист проводится между уриномой, гематомой и абсцессом в малом тазу. Чрескожное дренирование лимфатической кисты под ультразвуковым контролем с установкой дренажа, внебрюшинная лапароскопическая марсупиализации кисты или открытая хирургия при таком типе не вызывают трудностей.
Превезикальные симптоматические ЛК наблюдали у 2 пациентов из 19 (10,5%). Лимфатическая жидкость скапливалась, формируя ЛК между передней поверхностью мочевого пузыря и стенкой брюшной полости (рис. 3). Клиническая картина связана с тяжестью над лонным сочленением и прогрессирующим недержанием мочи. При таком типе кисты выполнение чрескожного дренирования под ультразвуковым контролем с установкой дренажа является оптимальным выбором, однако частота рецидивирования таких кист остаётся высокой.
Тазово-забрюшинные симптоматические ЛК были выявлены у 2 пациентов из 19 (10,5%). Вначале лимфатическая жидкость поступает в малый таз и далее распространяется вдоль подвздошных сосудов в забрюшинное пространство, скапливаясь позади почки и формируя забрюшинную часть ЛК (рис. 4). Данный вид кисты может содержать большие объёмы лимфы. Клиническая картина связана со сдавлением мочеточника и развитием обструктивного пиелонефрита (тянущая боль в поясничной области, температура тела > 38,0 0 С). Также развивается компрессия нижней полой вены (рис. 4). В литературе описан ряд других симптомов, связанных с данным типом кист: динамическая кишечная непроходимость и кишечные колики, однако мы не нашли этому подтверждения [7]. Метод оперативного вмешательства при таком типе кисты выбирает хирург, однако первым этапом необходимо восстановить пассаж мочи по верхним мочевыводящим путям.
В исследовании W.Y. Khoder et al. продемонстрировано преимущество лапароскопической марсупиализации в лечении симптоматических ЛК, которые не были восприимчивы к консервативной тактике или к чрескожному дренированию ЛК под ультразвуковым контролем. Из 105 пациентов, которым выполнили лапароскопическую марсупиализацию, лишь у 3 (2,9%) данная техника была неэффективна. Авторы связывают это с недостаточным формированием перитонеального окна в ЛК. Двум пациентам была выполнена повторная лапароскопическая марсупиализация, одному потребовалось открытое вмешательство [7].
В нашем исследовании чрескожное дренирование ЛК под ультразвуковым контролем с установкой дренажа в полость кисты было выполнено 12 пациентам (63,2%), лапароскопическая марсупиализации ЛК в 3 случаях (15,7%), открытая хирургия 3 пациентам (15,7%). У 1 больного (5,4%) лечение было консервативным. Из 12 пациентов, которым было выполнено чрескожное дренирование ЛК под ультразвуковым контролем с установкой дренажа в полость кисты, у 2 (16,7%) развились повторные симптоматические ЛК. В этих двух случаях мы применили лапароскопическую марсупиализацию, которая оказалась успешной (рис. 5). В послеоперационном периоде выполняли регулярное комплексное УЗИ органов забрюшинного пространства, брюшной полости и малого таза. Среднее время наблюдения за пациентами составило 3 месяца от повторного оперативного вмешательства по поводу симптоматических ЛК.
Заключение
Анатомическая локализация симптоматических ЛК, безусловно, влияет на клинические проявления заболевания и определяет дальнейшую тактику хирургического лечения. Симптоматические ЛК могут быть классифицированы по 4 анатомическим локализациям: паравазальноподвздошные, паравезикальные, превезикальные и тазово-забрюшинные. Методом выбора при больших, неинфицированных, симптоматических и рецидивирующих ЛК является лапароскопическая марсупиализация. Осложнения при данном виде оперативного вмешательства редки, а процент рецидивирования ЛК крайне низок.
Список литературы
1. White M, Mueller PR, Ferrucci JT Jr, Butch RJ, Simeone JF, Neff CC, Yoder I, Papanicolaou N, Pfister RC. Percutaneous drainage of postoperative abdominal and pelvic lymphoceles. AJR Am J Roentgenol. 1985;145(5):1065-9. DOI: 10.2214/ajr.145.5.1065
2. Khoder WY, Trottmann M, Buchner A, Stuber A, Hoffmann S, Stief CG, Becker AJ. Risk factors for pelvic lymphoceles postradical prostatectomy. Int J Urol. 2011;18(9):638-43. DOI: 10.1111/j.1442-2042.2011.02797.x
3. Novotny V, Hakenberg OW, Wiessner D, Heberling U, Litz RJ, Oehlschlaeger S, Wirth MP. Perioperative complications of radical cystectomy in a contemporary series. Eur Urol. 2007;51(2):397-401; discussion 401-2. DOI: 10.1016/j.euru-ro.2006.06.014
4. Патент на изобретение RU 2674976 C2/13.12.2018. Заявка № 2018111102 от 28.03.2018. Нюшко К.М., Крашенинников А.А., Темиргереев М.З., Алексеев Б.Я., Воробьев Н.В., Каприн А.Д. Способ профилактики лимфореи и лимфо-кист у больных раком предстательной железы после хирургического лечения. Доступно по: https://patentscope.wipo.int/search/ru/detail.jsf?docId=RU219320048 Ссылка активна на 19.10.2020.
5. Naselli A, Andreatta R, Introini C, Fontana V, Puppo P. Predictors of symptomatic lymphocele after lymph node excision and radical prostatectomy. Urology. 2010;75(3):630-5. DOI: 10.1016/j.urology.2009.03.011
6. Capitanio U, Pellucchi F, Gallina A, Briganti A, Suardi N, Sa-lonia A, Abdollah F, Di Trapani E, Jeldres C, Cestari A, Kara-kiewicz PI, Montorsi F. How can we predict lymphorrhoea and clinically significant lymphocoeles after radical prostatectomy and pelvic lymphadenectomy? Clinical implications. BJU Int. 2011;107(7):1095-101. DOI: 10.1111/j.1464-410X.2010.09580.x
7. Khoder WY, Gratzke C, Haseke N, Herlemann A, Stief CG, Becker AJ. Laparoscopic marsupialisation of pelvic lymphoceles in different anatomic locations following radical prostatectomy. Eur Urol. 2012;62(4):640-8. DOI: 10.1016/j.eururo.2012.05.060
Об авторах
Котов Сергей Владиславович — доктор медицинских наук, профессор; заведующий кафедрой урологии и андрологии РНИМУ им. Н.И. Пирогова Минздрва России.
117997, Москва, ул. Островитянова, д. 1.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Простомолотов Артём Олегович — аспирант кафедры урологии и андрологии РНИМУ им. Н.И. Пирогова Минздрава России.
117997, Москва, ул. Островитянова, д. 1.
тел.: +7 (925) 124-36-79
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Для цитирования:
Котов С.В., Простомолотов А.О. Симптоматические лимфатические кисты после онкоурологических операций на органах малого таза и влияние их анатомической локализации на клиническую картину. Вестник урологии. 2020;8(4):72-79. https://doi.org/10.21886/2308-6424-2020-8-4-72-79
For citation:
Kotov S.V., Prostomolotov A.О. Symptomatic lymphatic cysts after oncourological operations on the pelvic organs and influence of their anatomical localization on the clinical appearance. Vestnik Urologii. 2020;8(4):72-79. (In Russ.) https://doi.org/10.21886/2308-6424-2020-8-4-72-79
Лимфорея и лимфоцеле
Лечение в Инновационном сосудистом центре
В нашей клинике разработаны эффективные хирургические методы лечения лимфореи. Если лимфа продолжает скапливаться дольше месяца после операции, то мы предпринимаем открытую операцию под микроскопом. Выявляются и коагулируются все поврежденные лимфатические сосуды и узлы, полость обрабатывается крепким йодовым раствором и дренируется через отдельный дренаж. Как правило, этого вмешательства достаточно, для ликвидации лимфореи. В сложных случаях мы проводим трансплантацию сальника в паховую область, чтобы он всасывал лимфатическую жидкость.
Осложнения лимфореи
Есть два серьезных осложнения, которые возникают при лимфорее.
Лимфатическая жидкость-это естественная «пища» для бактерий. Открытая дренажная рана входными воротами для инфекции. Это приводит к флегмонам, лимфангитам или рожистому воспалению.
Лимфорея при контакте с кожей может разъедать ее и вызывать воспаление (дерматит). Раны могут прогрессивно увеличиваться и даже потребовать в последующем реконструктивно-пластических операций для их закрытия.
Прогноз при лимфорее
В большинстве случаев послеоперационная лимфорея прекращается со временем при применении консервативных мероприятий. Если истечение лимфы обильное и продолжается больше месяца, то необходимо планировать хирургическое лечение, направленное на перекрытие источника лимфоистечения.
Хирургическое лечение требуется примерно в 10% случаев лимфореи.
Ранние и поздние осложнения радикальной простатэктомии
© С. Х. Аль-Шукри, Е. С. Невирович, И. В. Кузьмин, А. Г. Борискин
Кафедра урологии Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова
Проведен анализ результатов радикальной простатэктомии (РПЭ) у 128 больных, проходивших лечение в клинике урологии СПбГМУ им. акад. И.П.Павлова с 2005 по 2012 годы. Возраст больных от 52 до 81 года (в среднем — 66,0 лет). Интраоперационная летальность отсутствовала. Интраоперационные осложнения включали травму прямой кишки у 4 пациентов (2,3%) и повреждение мочеточника у 1 пациента (0,7%). К поздним осложнениям относились стриктура пузырноуретрального анастомоза — у 5 больных (3,9%), недержание мочи более 12 месяцев после операции — у 5 больных (3,9%). Проведенный статистический анализ не выявил факторов, достоверно влияющих на развитие стриктуры анастомоза. Отмечено, что уровень интраоперационной кровопотери и продолжительность операции достоверно коррелировали с длительностью восстановления удержания мочи после радикальной простатэктомии.
Ключевые слова: радикальная простатэктомия, осложнения; кровотечение; стриктура анастомоза; недержание мочи.
Введение
Радикальная простатэктомия (РПЭ) является одним из ведущих методов лечения локализованных форм рака предстательной железы. Достигнутые в последнее время успехи в развитии урологии позволили значительно улучшить результаты операции. Так, десятилетняя общая выживаемость больных после операции превышает 90% [4]. В этой связи возрастает значимость проблемы улучшения качества жизни больных, перенесших РПЭ [1; 2]. На качество жизни пациентов в большой мере влияют последствия интраоперационных осложнений. Именно этой проблеме уделяется повышенное внимание многих исследователей [3; 8]. Известно, что одним из самых частых интраоперационных осложнений РПЭ многие годы являлось кровотечение [11]. Однако улучшение хирургической техники, особенно при манипуляциях в области дорзального венозного комплекса, методов его лигирования и прошивания, применение современных методов гемостаза («Liga Sure», «Garmonic») позволило значительно снизить объем кровопотери и соответственно время проведения оперативного пособия. При этом такие последствия РПЭ, как стриктура пузырно-уретрального анастомоза и недержание мочи, встречаются еще достаточно часто, а механизмы их возникновения до конца не ясны [5].
Задачей настоящего исследования явилось выявление интраоперационных факторов, влияющих на развитие ранних и поздних осложнений РПЭ.
Пациенты и методы обследования
Проведен анализ результатов 128 РПЭ, выполненных в клинике урологии СПбГМУ им. акад. И. П. Павлова с 2005 по 2011 годы по поводу локализованного рака предстательной железы. Средний возраст больных составил 66 лет и находился в диапазоне от 52 до 81 года. Средний период наблюдения за пациентами в послеоперационном периоде составил 48 месяцев (от 8 до 88 месяцев).
Всем пациентам РПЭ проводили по стандартной методике, описанной P. Walsh [13]. В первые годы выполнения РПЭ анастомоз уретры с мочевым пузырем ушивали отдельными швами рассасывающейся мононитью (монокрил 3/0) с установкой по уретре катетера Foley 20 Fr, который удаляли на 12–14-е сутки после операции. Начиная с 2008 года для этой цели использовали непрерывный шов по методу Veldhoven (нить 3/0), а катетер удаляли на 7–8-е сутки после операции. Большинству больных (78 из 128, 60,9%) выполняли нервосберегающую РПЭ. 5 больных (3,9%) до РПЭ перенесли трансуретральную резекцию предстательной железы по поводу ДГПЖ.
Общая характеристика наблюдавших больных с раком предстательной железы, перенесших РПЭ, представлена в таблице 1. Большинство больных (76,6%) были оперированы в период с 2008 по 2011 годы. Разделение на два периода выполнения РПЭ связано с тем, что вследствие улучшения хирургической техники, накопления хирургического опыта, внедрения современных технологий гемостаза удалось значительно снизить объем интраоперационной кровопотери и время проведения оперативного вмешательства.
Таблица 1. Общая характеристика больных с раком предстательной железы, перенесших РПЭ (n = 128)
| Показатель | Количество больных | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| n | % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период выполнения РПЭ | Всего | ||
| 2005– 2008 | 2008– 2011 | ||
| n = 30 | n = 98 | n = 128 | |
| Повреждения прямой кишки | 3 (10%) | 1 (1%) | 4 (3,1%) |
| Повреждение мочеточника | 1 (3,3%) | 0 | 1 (0,8%) |
| Несостоятельность анастомоза | 3 (10%) | 1 (1%) | 4 (3,1%) |
| Лимфорея | 6 (20%) | 2 (2%) | 8 (6,3%) |
| Лимфоцеле | 0 | 1 (1%) | 1 (0,8%) |
| Стриктуры анастомоза | 3 (10%) | 2 (2%) | 5 (3,9%) |
| — ранее 6 месяцев после РПЭ | 1 (3,3%) | 0 (0%) | 1 (0,8%) |
| — позднее 6 месяцев после РПЭ | 2 (6,7%) | 2 (2%) | 4 (3,1%) |
| Стриктуры наружного отверстия уретры | 1 (3,3%) | 0 (0%) | 1 (0,8%) |
| Недержание мочи | 3 (10%) | 2 (2%) | 5 (3,9%) |
Результаты статистического анализа не выявили достоверной корреляционной связи между развитием пузырно-уретрального анастомоза и возрастом больного, объемом кровопотери, длительностью операции, назначением неоадьювантной терапии, предшествовавшей трансуретальной резекцией предстательной железы, сохранением сосудисто-нервных пучков и стадией рака предстательной железы.
Для анализа качества удержания мочи больными после перенесенной РПЭ мы использовали такой критерий, как количество урологических прокладок, используемых больным в сутки. Только у 5 (3,9%) из 128 пациентов через 12 месяцев после РПЭ имели место симптомы стрессового недержания мочи. При этом у 90 (70,3%) пациентов удержание мочи восстановилось в течение 3 месяцев после операции, у 18 (14,1%) — в течение 6 месяцев после операции, а у 11 (8,6%) — в течение 12 месяцев после операции. У 4 (3%) больных было выявлено ургентное недержание мочи, связанное с гиперактивностью мочевого пузыря. После проведенной антихолинергической терапии удержание мочи восстановилось у всех пациентов. Пациентам, у которых стрессовое недержание мочи сохранялось более 12 месяцев после РПЭ (5 человек), выполняли слинговую операцию. У всех из них был отмечен положительный эффект от данной операции. При этом у 4 пациентов недержание мочи было устранено полностью, а у 1 пациента существенно уменьшилось (2 урологические прокладки в сутки). Проведенный корреляционный анализ показал зависимость между вероятностью развития недержания мочи в послеоперационном периоде, с одной стороны, и величиной интраоперационной кровопотери и длительностью операции, с другой.
Обсуждение
В настоящей работе исследована частота и ранних, и поздних осложнений РПЭ, а также сделана попытка выявить факторы, спосбствующие развитию этих осложнений.
Интраоперационные осложнения встречаются, по различным оценкам, в 0,8–3,7% случаев [9]. Наиболее частым осложнением во время РПЭ является кровотечение. При том, что уровень интраоперационной кровопотери в нашем исследовании оказался в общем невысоким, отмечено, что во время операции 2008–2011 годов объем кровопотери был почти в два раза ниже, чем в во время операций 2005–2008 годов. Накопление опыта выполнения РПЭ, знание особенностей дорзального венозного комплекса, методов лигирования и прошивания последнего, а также внедрение и использование современных методов лигирования и коагуляции сосудов позволяют получить более детальную визуализацию операционного поля, сократить продолжительность операции и величину интраоперационной кровопотери. Все эти факторы могут стать ключевыми моментами для предотвращения возможных ранних и поздних осложнений РПЭ. Использование непрерывного шва при формировании пузырно-уретрального анастомоза позволило снизить процент развития послеоперационной несостоятельности анастомоза и уменьшить время дренирования мочевого пузыря по уретре до 7 суток.
Поздние осложнения, такие как стриктура анастомоза и недержание мочи, существенно снижают качество жизни больных, перенесших РПЭ [8]. Частота стриктуры пузырно-уретрального анастомоза в позднем послеоперационном периоде, по данным разных исследователей, различна — от 0,48% до 32% [7; 10]. Среди наблюдаемых нами больных частота стриктур пузырно-уретральных анастомозов составила 3,9%. Мы не выявили факторов, влияющих на развитие этого осложнения, хотя у больных перенесших до РПЭ трансуретральную резекцию предстательной железы, во время операции после удаления простаты мы нередко обнаруживали рубцовые изменения шейки мочевого пузыря, которые потенциально могли бы способствовать развитию стриктуры анастомоза. Частота другого осложнения РПЭ, недержания мочи, по данным литературы, варьирует в пределах от 5,0% до 19,9% через 12 месяцев после операции [7; 10]. В нашем исследовании мы обнаружили недержание мочи в этот период только у 3,9% пациентов. В качестве факторов, способствующих развитию послеоперационного недержания мочи, отмечены длительность оперативного вмешательства и величина интраоперационной кровопотери. В этой связи представляется очевидным, что по мере накопления хирургического опыта и навыков выполнения РПЭ риск возникновения послеоперационного недержания мочи будет снижаться.
Заключение
Таким образом, результаты проведенного исследования показали низкую частоту ранних и поздних осложнений РПЭ, выполнявшихся в клинике урологии СПбГМУ им. акад. И. П. Павлова. Полученные данные свидетельствуют о том, что частота осложнений оперативного вмешательства снижается по мере накопления опыта оперирующих хирургов.
Список литературы
1.Arai Y., Egawa S., Tobisu K. et al. Radical retropubic prostatectomy: time trends, morbidity and mortality in Japan // BJU Int. 2000. Vol. 85. P. 287–294.
2. Benoit R. M., Naslund M. J., Cohen J. K. Complications after radical retropubic prostatectomy in the Medicare population // Urology. 2000. Vol. 56. P. 116–120.
3. Catalona W. J., Carvalhal G. F., Mager D. E., Smith D. S. Potency, continence and complication rates in 1,870 consecutive radical retropubic prostatectomies // J Urol. 1999. Vol. 162. P. 433–438.
4. Davidson P. J., van den Ouden D., Schroeder F. H. Radical prostatectomy: prospective assessment of mortality and morbidity // Eur Urol. 1996. Vol. 29. P. 168–173.
5. Dillioglugil O., Leibman B.D, Leibman N. S. et al. Risk factors for complications and morbidity after radical retropubic prostatectomy // J. Urol. 1997. Vol. 157. P. 1760–1767.
6. Han M., Partin A. W., Pound C. R. et al. Long-term biochemical disease-free and cancer-specific survival following anatomic radical retropubic prostatectomy. The 15-year Johns Hopkins experience // Urol. Clin. North. Am. 2001. Vol. 28. P. 555–565.
7. Lepor H., Nieder A. M., Ferrandino M. N. Intraoperative and postoperative complications of radical retropubic prostatectomy in a consecutive series of 1,000 cases // J. Urol. 2001. Vol. 166. P. 1729–1733.
8. Leandri P., Rossignol G., Gautier J. R., Ramon J. Radical retropubic prostatectomy: morbidity and quality of life. Experience with 620 consecutive cases // J. Urol. 1992. Vol. 147. P. 883–887.
9. Mangram A. J., Horan T. C., Pearson M.L. et al. Guideline for prevention of surgical site infection, 1999. Hospital Infection Control Practices Advisory Committee // Infect Control Hosp Epidemiol. 1999. Vol. 20. P. 250–280.
10. Murai M. Summary and characteristics of ‘General rule for clinical and pathological studies on prostate cancer.’ 3rd edition // Nippon Rinsho. 2002. Vol. 60 (Suppl. 11). P. 39–43.
11. Myers R. P. Improving the exposure of the prostate in radical retropubic prostatectomy: longitudinal bunching of the deep venous plexus // J. Urol. 1989. Vol. 142. P. 1282–1284.
12. Tienforti D., Sacco E., Marangi F. et al. Efficacy of an assisted low-intensity programme of perioperative pelvic floor muscle training in improving the recovery of continence after radical prostatectomy: a randomized controlled trial // BJU Int. 2012. Feb 14. doi: 10.1111/j.1464–410X.2012.10948.x. [Epub ahead of print].
13. Walsh P. C. Radical prostatectomy for the treatment of localized prostatic carcinoma // Urol. Clin. North. Am. 1980. Vol. 7. P. 583–591.
Early and late complications of radical Prostatectomy
Al-Shukri S.Kh., Nevirovich E. S., Kuzmin I. V., Boriskin A. G.
Summary. The analysis of radical prostatektomiya (RPE) results at 128 patients taking place of treatment in the clinic of urology of SPbGMU named after academician I. P. Pavlov since 2005 till 2012 is carried out. Age of patients was from 52 to 81 year (averagely — 66.0 years). The intraoperative mortality was absent. The intraoperative complications included the injury of rectum at four patients (2.3%) and damage of the ureter at one patient (0.7%). The late complications included a stricture of vesicourethral anastomosis — at five patients (3.9%), an urine incontinence later than 12 months after the operation — at five patients (3.9%). The carried-out statistical analysis didn’t reveal any factors which are statistically influenced to the anastomosis stricture development. It is noted that the level of intraoperative hemorrhage and the operation’s duration authentically correlated with the duration of urinary retention recovery after radical prostatektomy.
Key words: radical prostatektomy; complica tions; bleeding; anastomosis stricture; urine incontinence.


