лечебные дозы нмг что это
Применение низкомолекулярных гепаринов в акушерской практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
Д о настоящего времени тромбозы и тромбоэмболические осложнения остаются основной причиной смерти в большинстве развитых стран. Только в США от артериальных и венозных тромбозов ежегодно погибает около 2 млн человек и приблизительно такому же числу больных ежегодно удается пережить эпизоды глубоких венозных тромбозов, тромбоэмболий, цереброваскулярных тромбозов, транзиторных ишемических атак, коронарных тромбозов, тромбозов сетчатки и т.д. Даже от злокачественных новообразований погибает приблизительно в четыре раза меньше больных. Это свидетельствует о том, что тромбозы являются экстраординарной причиной заболеваемости и смертности населения, в том числе и материнской. По обобщенным данным мировой литературы, на 1000 родов приходится 2-5 тромботических осложнений. 50% всех венозных тробмоэмболических осложнений возникают у женщин в возрасте до 40 лет и, как правило, они связаны с беременностью.
| На 1000 родов приходится 2-5 случаев тромботических осложнений. |
Таким образом, тенденция к стазу крови в сочетании с гиперкоагуляцией создает условия, благоприятствующие повышенному риску тромбообразования.
Дополнительными факторами риска по тромботическим осложнениям могут служить возраст (старше 35 лет), сердечно-сосудистая патология, эндокринные нарушения, гестоз, заболевания почек, гнойно-септические заболевания, а также ряд острых состояний (отслойка плаценты, эмболия околоплодными водами, длительная задержка мертвого плода в матке и др.). Гиперкоагуляция сменяется внутрисосудистым свертыванием крови, проявляющимся различными формами синдрома диссеминированного внутрисосудистого свертывания (ДВС).
Следует отметить, что расширение показаний к кесареву сечению также сопряжено с повышенным риском тромбоза вследствие хирургического вмешательства, значительного изменения метаболизма, травмы, попадания тромбопластических субстанций в кровоток, иммобилизации, замедления венозного кровотока и пр.
Особое место среди факторов риска по тромбоэмболическим осложнениям занимают гнойно-септические процессы в области малого таза, так как в патологический процесс вовлекаются подвздошные, яичниковые, маточные вены, что может осложниться бактериальной легочной эмболией. При этом повышенная концентрация высокодисперсных белков плазмы (в частности, фибриногена) дополнительно опосредует повышенную структурную гиперкоагуляцию.
За последнее десятилетие клиническая картина обогатилась возможностями выяснения ряда ранее не известных патогенетических форм тромбоза: иммунных, а также генетических или так называемых наследственных дефектов гемостаза, предрасполагающих к тромбозу.
К иммунным формам относят тромбоз, обусловленный гепарин-индуцированной тромбоцитопенией (ГИТ), тромбоз, связанный с циркуляцией антифосфолипидных антител при антифосфолипидном синдроме, а также сравнительно недавно открытую новую форму иммунного тромбоза, обусловленного аутоантителами к фактору Виллебранда. При всех иммунных тромбозах независимо от генеза происходит внутрисосудистая агрегация тромбоцитов.
В последние годы значительно изменился взгляд на патогенез иммунных тромбозов. Если предыдущие концепции сводились к ингибиции патофизиологически важных естественных антитромботических агентов (антигенов) антителами, то в настоящее время основную роль отводят связыванию антител через различные протеины с клетками крови (тромбоциты и др.) или мембраной эндотелиальных клеток с последующей активацией протромботических механизмов этими клетками через их FcgRII-рецепторы или через комплементарный каскад.
Наиболее изученными на сегодняшний день считаются механизмы возникновения гепарининдуцированной тромбоцитопении и тромбоза, обусловленного ГИТ.
Различают 2 типа ГИТ: наиболее частый I тип имеет раннее начало, сопровождается легкой тромбоцитопенией, возможно, связанной со способностью фракций гепарина (в основном нефракционированного), не обладающих антикоагулянтной активностью, усиливать небольшую активность тромбоцитов; тип II обусловливает спорадические, изолированные случаи тяжелой тромбоцитопении с поздним началом, иммуноспровоцированные и часто ассоциирующиеся с катастрофическим тромбозом.
В основе лечения тромбофилических состояний и ДВС-синдрома лежит устранение непосредственной причины их возникновения (например, антибиотикотерапия при гнойно-септических процессах), а также воздействие на основные звенья патогенеза. Целый ряд состояний в акушерстве диктует необходимость проведения профилактических мер.
Показания к профилактике тромбоэмболических осложнений во время беременности и в послеродовом периоде:
• беременные в возрасте старше 35–40 лет
• беременные с экстрагенитальной патологией, особенно с заболеваниями сердечно-сосудистой системы и почек
• повторнобеременные с отягощенным акушерским анамнезом (гнойно-септические заболевания, антенатальная гибель плода, задержка развития плода, нефропатия, преждевременная отслойка нормально расположенной плаценты)
• наличие в анамнезе тромбозов и тромбоэмболий
• беременные, которым показана операция при беременности
• осложненное течение беременности, родов и послеродового периода: (нефропатия, преждевременная отслойка нормально расположенной плаценты, эмболия околоплодными водами, гнойно-септические заболевания, массивные гемотрансфузии)
• острые тромбозы и тромбоэмболии
• генетические формы тромбофилии.
Критериями противотромботической терапии в акушерской практике являются ее эффективность и безопасность для матери и плода. Из всего арсенала противотромботических средств (непрямые и прямые антикоагулянты, антиагреганты, тромболитики) препаратами выбора были и остаются гепарин натрий и его производные. В акушерской практике гепарин натрий занимает особое место в связи с немедленным антикоагулянтным эффектом, существованием антидота, легкостью управления дозой, отсутствием тератогенного и эмбриотоксического эффектов. Непрямые антикоагулянты проходят через плаценту и обладают тератогенным и эмбриотоксическим эффектами. В исключительных случаях их применение ограничено II триместром беременности, когда органогенез завершен.
Однако, несмотря на множество преимуществ, обычный нефракционированный или высокомолекулярный гепарин обладает рядом нежелательных побочных свойств, которые в основном предопределены его структурой. Нефракционированный гепарин (НГ) представляет собой смесь кислых макромолекулярных цепей сульфатированных анионов мукополисахаридов с высоковариабельной молекулярной массой от 4000 до 40 000 Д.
Вследствие гетерогенности структуры НГ имеет биодоступность лишь 30%, так как связывается с множеством белков, клеток (макрофаги, клетки эндотелия и т.д.). Кроме того, НГ подвержен влиянию антигепаринового фактора тромбоцитов (фактор IV), образуя комплекс гепарин-фактор. Это чревато возникновением гепариновой иммунной тромбоцитопении в результате образования антител к этому комплексу (наиболее опасная форма тромбоза).
Одним из нежелательных эффектов гепарина натрия является истощение АТ III при длительном его применении в больших дозах, что также может вызвать состояние гиперкоагуляции и стать причиной тромбоза. Понятно, что увеличение дозы гепарина натрия в такой ситуации не приводит к антикоагулянтному эффекту.
Последние 5-7 лет в клиническую медицину активно внедряются низкомолекулярные гепарины (НМГ), зарекомендовавшие себя с лучшей стороны, так как в большинстве случаев проявляют большую противотромботическую активность и достоверно гораздо более низкую выраженность геморрагических осложнений и других побочных эффектов.
НМГ получают путем деполимеризации НГ, их молекулярная масса колеблется в пределах от 4 до 8 кД. Деполимеризацию можно осуществить химическим, ферментным и физическим методом (g-излучение).
Изменение структуры молекулы гепарина, т.е. уменьшение молекулярной массы почти в 3 раза, повлекло за собой и изменения фармакодинамики и фармакокинетики. НМГ имеют более высокую биодоступность, чем НГ (около 98%), больший период полужизни. НМГ меньше связываются с различными белками, клетками. В отличие от НГ их почечный клиренс значительно преобладает над клеточным (что важно учитывать у больных с почечной недостаточностью). Кроме того, НМГ в гораздо меньшей степени, чем НГ, связываются с клетками эндотелия, что также обеспечивает длительную циркуляцию в плазме (в 2-4 раза дольше).
НМГ не обладают антитромбиновым свойством и, следовательно, не вызывают гипокоагуляции. Противотромботический эффект НМГ в основном зависит от его влияния на фактор Ха.
Однако если в состав НМГ входят фракции с молекулярной массой более 5400 Д, что эквивалентно более чем 18 дисахаридным остаткам, то также проявляется анти-IIa-активность. Так, у одного из наиболее ранних НМГ, надропарина кальция, молекулярная масса которого в среднем 4500 Д, благодаря фракциям с молекулярной массой больше 5400 Д соотношение анти-IIa- и анти-Ха-активности равно 1:4.
НМГ способствуют также активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена t-PA; кроме того, они меньше подвержены действию антигепаринового фактора IV тромбоцитов и, соответственно, реже вызывают гепариновую иммунную тромбоцитопению.
Прогресс в области гемостазиологии показал, что в генезе большинства тромботических явлений огромную роль играют активация внешнего пути свертывания и выделение в кровь тканевого фактора (ТФ). Этот механизм преобладает во время беременности, в перинатальном, послеоперационном периодах, при гнойно-септических заболеваниях, антифосфолипидном синдроме (АФС), ожирении, онкологических и множестве сердечно-сосудистых заболеваний, а также при ряде связанных с ними состояний: пороках сердца, кава-фильтре, чрескожной транслюминальной коронарной ангиопластике, тромбоэмболии легочной артерии, дистресс-синдроме легких, отслойке плаценты, эмболии околоплодными водами и др.
TFPI-фактор, или липопротеин-ассоциированный ингибитор коагуляции (LACI-фактор), является мощным естественным ингибитором внешнего пути свертывания. НМГ способны значительно повышать его уровень в крови. TFPI-фактор контролирует обусловленный фактором Ха механизм отрицательной обратной связи и ингибирует ряд комплексов, которые через образование протромбиназы ведут к генерации тромбина и затем фибрина.
TFPI имеет и другие фармакологические свойства, как потенциальное антитромботическое средство: это ингибитор образования протеаз, прямой ингибитор фактора Ха и эластазы, ингибитор, обусловленный ТФ активации тромбоцитов и макрофагов; он взаимодействует с липопротеинами низкой плотности с изменением их патогенетической роли (особенно при атеросклерозе), взаимодействует с эндотелием сосудов, обеспечивает модуляцию эндогенных гликозаминогликанов, нейтрализует эндогенно образующийся ТФ.
В нормальных физиологических условиях TFPI синтезируется в микроваскулярном эндотелии и в небольших количествах мегакариоцитами и макрофагами и не синтезируется нормальными гепатоцитами или эндотелием крупных сосудов. Незначительные количества TFPI исходят из фибробластов, но при активации этих клеток уровнь TFPI повышается в 6-8 раз.
Возвращаясь к эффектам НМГ, следует отметить, что независимо от патогенетического механизма тромбозов общим для них является активация тромбинового пути, и преимуществом НМГ является их способность препятствовать образованию тромбина. Если учесть меньшую зависимость противотромботического эффекта НМГ от уровня АТ III, чем у НГ, то можно думать о применении НМГ у больных с дефицитом АТ III.
В отличие от НГ, благодаря меньшей молекулярной массе и большей биодоступности, НМГ дольше циркулируют в крови и обеспечивают продолжительный противотромботический эффект в значительно меньших суточных дозах. Возможно однократное подкожное введение препарата в сутки: препараты не вызывают образования гематом в области инъекций.
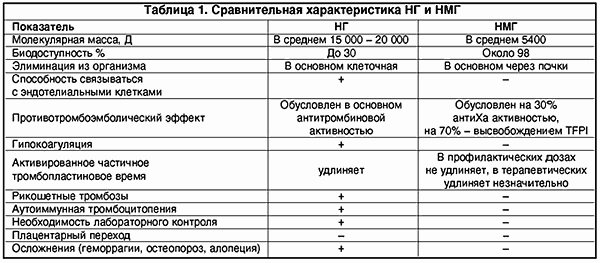
НМГ не вызывают гипокоагуляции, поскольку противотромботический эффект направлен на ингибцию Ха-фактора и внешнего пути свертывания крови; в гораздо меньшей мере подвержены влиянию антигепаринового фактора 4 тромбоцитов, соответственно крайне редко вызывают тромбоцитопению и не обусловливают иммунных тромбозов (табл. 1).
Учитывая механизм действия НМГ и результаты их применения в широкой клинической практике, большинство исследователей считают, что нет необходимости в лабораторном контроле при использовании НМГ в профилактических целях. Тем не менее оценку их антикоагулянтного эффекта можно проводить по анти-Ха-активности. Биологические методы контроля терапии НГ и НМГ с учетом их действия на различные компоненты системы гемостаза представлены в таблице 2.
До появления НМГ контроль терапии преследовал цель обеспечения адекватной дозы НГ во избежание опасных геморрагических осложнений. При применении НМГ практически не существует проблемы гипокоагуляционных эффектов. Однако, весьма актуален контроль эффективности препарата. Для этой цели можно использовать такие маркеры тромбофилии, как комплекс тромбин-антитробмин, фрагмены F1+2 протромбина и особенно продукты деградации фибрина-фибриногена. Маркеры внутрисосудистого свертывания крови и тромбофилии представлены в таблице 3.
Установление отсутствия трансплацентарного перехода НМГ открыло большие возможности широкого применения его в акушерской практике, особенно у беременных с заболеваниями сердечно-сосудистой системы, с АФС и при ряде состояний, сопровождающихся тромбофилией и внутрисосудистым свертыванием крови. Преимущественное воздействие НМГ на внешний путь свертывания крови открывает заманчивую перспективу лечения эндотелиальных изменений при гестозах.
Положительным свойством НМГ (в частности, надропарина кальция) является купирование в течение 2-3 дней ДВС-синдрома у беременных с гестозами. Как правило, это сопровождается и регрессом заболевания. Однако если основные проявления гестоза не исчезают, то терапия НМГ более 1 нед нецелесообразна. Возможно, наблюдаемый положительный эффект НМГ у беременных с начальными формами гестоза обусловлен воздействием на эндотелий. Помимо стабилизирующего влияния антиагрегантов и антикоагулянтов, НМГ препятствуют экспрессии фактора Виллебранда на эндотелии.
Раствор Фраксипарина выпускается в одноразовых шприцах по 0,3, 0,4, 0,6, 1 мл. Это удобно в применении, инъекции безболезненны и не оставляют гематом. Препарат вводят под кожу брюшной стенки, что делает возможным его применение в амбулаторных условиях.
Таким образом, применение НМГ в акушерской практике открывает новые перспективы для эффективной профилактики и лечения тромбоэмболических осложнений, заболеваний, протекающих с ДВС-синдромом, а также шока и шокоподобных состояний.
Низкомолекулярные гепарины в профилактике и лечении тромбозов у пациентов с хронической болезнью почек
Более 40 лет в практике врачей-нефрологов широко используется гепарин. Нефракционированный гепарин (НФГ) обеспечивает возможность проведения заместительной почечной терапии гемодиализом у больных с терминальной почечной недостаточностью, необходим в лечении тромботических осложнений нефротического синдрома, входит в состав так называемой четырехкомпонентной терапии некоторых активных форм гломерулонефрита в сочетании со стероидами и цитостатиками. Возможность применения гепарина у нефрологических больных определяют не только его антитромботические свойства и способность подавлять процессы внутрисосудистой, в том числе внутригломерулярной, коагуляции, являющейся неотъемлемым компонентом иммунного воспаления в клубочках почки, но и другие эффекты. Так, установлено, что препарат оказывает натрийуретическое действие. Подавление гепарином продукции альдостерона объясняет диуретический эффект препарата [1, 2]. Гипотензивное действие гепарина, с одной стороны, вызвано подавлением продукции альдостерона, а с другой – его участием в регуляции сосудистого тонуса, связанным, как было показано в последнее время, со стимуляцией высвобождения оксида азота (NO) и снижением продукции эндотелина эндотелиальными клетками [3]. Антипротеинурическое действие гепарина обусловлено его способностью стимулировать синтез отрицательно заряженного гепарансульфата, что приводит к восстанoвлению утраченного гломерулярной базальной мембраной отрицательного заряда и уменьшению ее проницаемости для молекул белка [4]. Кроме того, гепарин обладает антикомплементарным, противовоспалительным, анальгезирующим и липолитическим эффектом. В последние годы в экспериментальных и клинических исследованиях продемонстрирована его способность подавлять пролиферацию мезангиальных клеток, предотвращая склерозирование почечной ткани [5, 6]. Однако, несмотря на многочисленные эффекты НФГ, позволяющие применять его в нефрологической практике, использование препарата ограничено в связи с высокой частотой побочных явлений, наиболее серьезным из которых является кровоточивость. Появление низкомолекулярных гепаринов (НМГ), сочетающих высокую антитромботическую активность с низкой частотой возникновения геморрагических осложнений, обусловило закономерный интерес нефрологов к этой группе препаратов.
Механизмы антитромботического действия гепаринов
В настоящее время НМГ – это важный класс антитромботических успешно использующихся препаратов, которые конкурируют с НФГ, а в последнее время и все чаще заменяют их в лечении тромбозов. Как и обычный гепарин, НМГ представляют собой отрицательно заряженные высокосульфатированные гликозаминогликаны, состоящие из цепей связанных между собой остатков d-гликозамина и глюкуроновой или идуроновой кислот. НФГ имеет молекулярную массу от 3000 до 30 000 дальтон, средняя молекулярная масса НМГ, полученных при контролируемой ферментативной или химической деполимеризации гепарина, составляет около 5000 дальтон. Антитромботическое действие НМГ, подобно НФГ, обусловлено инактивацией тромбина в результате образования комплекса с антитромбином. Взаимодействие последнего с гепаринами опосредовано уникальной последовательностью пентасахаридов, произвольно распределенных в цепях гепарина. Такую последовательность содержат 30% цепей обычного гепарина и лишь 15–25% цепей НМГ.
Уменьшение размеров молекулы в результате деполимеризации приводит к изменению антикоагулянтных свойств: если действие НФГ направлено против тромбина (IIa-фактор) и активированного Х фактора свертывания (Ха), то действие НМГ – преимущественно против Ха, в чем и состоит основное отличие НМГ от обычного гепарина. Связывание пентасахаридов с антитромбином вызывает конформационные изменения в его молекуле, ускоряя взаимодействие с тромбином и Ха-фактором почти в 1000 раз. Любые пентасахаридсодержащие цепи гепаринов могут ингибировать действие Ха, вызывая конформационные изменения антитромбина, тогда как для инактивации тромбина гепарин должен связать и тромбин, и антитромбин, формируя, таким образом, трехкомпонентный комплекс «гепарин – антитромбин – тромбин». Образование этого комплекса возможно при наличии в пентасахаридсодержащей цепи препарата, по крайней мере, 18 сахаридных единиц. Большинство НФГ содержит ≥ 18 сахаридных единиц, однако достаточную длину для формирования такого комплекса имеют > 50% цепей НМГ, что объясняет меньший, по сравнению с обычным гепарином, ингибиторный эффект НМГ в отношении тромбина.
Кроме прямого ингибирующего воздействия на тромбин и Ха-фактор, НФГ и НМГ стимулируют высвобождение из эндотелиальных клеток в кровоток ингибитора тканевого фактора (он же – ингибитор внешнего пути свертывания – tissue factor pathway inhibitor, TFPI) [7]. Тканевой фактор (TF) активирует внешний механизм свертывания крови, приводя к образованию Ха, ингибитор тканевого фактора нейтрализует последний, а также блокирует комплекс активированного фактора VII c тканевым фактором (VIIа/TF) [8]. На долю опосредованного TFPI действия приходится не менее трети общего антикоагулянтного эффекта гепарина [9] и, по-видимому, еще большая часть эффекта НМГ. У пациентов с острым коронарным синдромом была описана способность как НФГ, так и НМГ предотвращать рост уровня тканевого фактора в кровотоке [10, 11]. Полагают, что этот новый антикоагулянтный эффект гепаринов может быть результатом как снижения активности TF, так и уменьшения его экспрессии эндотелиальными клетками и моноцитами [12, 13]. Таким образом, как НФГ, так и НМГ оказывают комплексное антикоагулянтное действие, обусловленное сочетанием нескольких разных механизмов – ингибированием тромбина, Ха- и тканевого фактора, а также блокадой TFPI.
По сравнению с обычным гепарином, НМГ обладают лучшей биодоступностью, имеют большее время полувыведения и независимый от дозы клиренс, что обеспечивает более предсказуемый антикоагулянтный эффект. В свою очередь, эти особенности фармакокинетики НМГ обусловлены более низкой способностью последних связываться с белками плазмы, эндотелием и макрофагами. Период полувыведения НМГ в 2–4 раза больше, чем у обычного гепарина, и составляет 2–4 ч после внутривенного введения и 3–6 ч – после подкожного. Это объясняется большей длительностью ингибиторного эффекта НМГ в отношении Ха-фактора по сравнению с таковым в отношении тромбина, что отражает более высокий клиренс более длинных цепей гепарина [14]. Описанные особенности НМГ делают необязательным постоянный лабораторный контроль в процессе лечения, за исключением случаев использования у больных с ХПН [15], поскольку, в отличие от обычного гепарина, выведение их из организма осуществляется почками, а также позволяет вводить препараты дважды или даже однократно в течение суток.
Важным преимуществом НМГ является сравнительно малый риск развития геморрагических осложнений при равной с НФГ антитромботической активности. Это обусловлено их менее выраженной способностью связываться с тромбоцитами и, следовательно, ингибировать их функцию, а также отсутствием влияния на сосудистую проницаемость. Группа НМГ в настоящее время включает около 10 препаратов, отличающихся по способу получения, физико-химическим и фармакокинетическим свойствам, а также соотношению активности анти-Ха/анти-IIa. Чем оно ниже, тем ближе препарат к НФГ. Большая величина отношения, указывающая на преимущественную инактивацию Ха-фактора, свидетельствует о преобладании в действии препарата ингибирования образования тромбина над его инактивацией. В России наиболее распространенными препаратами группы НМГ являются эноксапарин, надропарин и далтепарин, у которых соотношение анти-Ха/анти-IIa-активности составляет 3,8:1; 3,6:1 и 2,7:1 соответственно.
Применение НМГ для профилактики тромбозов у больных хронической почечной недостаточностью
До недавнего времени отсутствовали исследования по предупреждению тромбозов у больных терапевтического профиля, имеющих факторы риска их развития (возраст > 75 лет, рак, тромбоэмболические эпизоды в анамнезе, ожирение, лечение эстрогенами или антиандрогенами, хроническая сердечная или дыхательная недостаточность, острые сердечно-сосудистые и воспалительные заболевания). Несмотря на то что частота тромботических осложнений у таких пациентов точно не установлена, она, по-видимому, не ниже, чем у оперированных больных, особенно в острых ситуациях [16]. Оказалось, что госпитализация по поводу острого терапевтического заболевания сама по себе сопряжена с восьмикратным увеличением риска тромбозов; отражением этого факта служит высокая частота тромбозов глубоких вен голеней, развивающихся у 20–40% пациентов отделений интенсивной терапии без профилактического применения антикоагулянтов, и чрезвычайно высокий риск летальных исходов (70–80%) при тромбоэмболии легочной артерии, приходящиеся на долю терапевтических больных [17–19]. Назначение таким пациентам антикоагулянтов в период госпитализации полностью оправдано, что подтвердили выполненные в последние годы исследования по применению НМГ у этой категории больных [20, 21]. Так, по данным рандомизированного плацебоконтролируемого исследования PREVENT (Prospective Evaluation of Dalteparin Efficacy for Prevention of Venous Thromboembolism in Immobilised Patients), частота тромбоэмболических осложнений у пациентов с острым терапевтическим заболеванием при использовании профилактической дозы далтепарина 5000 МЕ в сутки в течение 14 дней оказалась на 45% ниже, чем при применении плацебо, при практически одинаковом риске кровотечений, что свидетельствует об эффективности препарата в предупреждении тромбозов у больных с факторами риска их развития [21]. Особенно уязвимы в плане развития тромботических осложнений пациенты старшей возрастной группы, составляющие большинство больных, госпитализированных в терапевтические отделения. Именно у этой категории больных наиболее часто развиваются периферические венозные тромбозы и тромбоэмболия легочной артерии [22, 23], а также острый коронарный синдром, риск смерти при котором у пациентов старше 75 лет почти в 4 раза выше, чем у лиц более молодого возраста [24]. Следует также отметить, что старческий возраст ассоциирован не только с высокой частотой тромбозов, но и с риском развития хронической болезни почек (ХБП) [25, 26]. При этом нарушение функции почек может вносить свой вклад в повышение риска развития «больших» кровотечений при лечении антикоагулянтами, и без того высокого у этой группы больных [27, 28].
Несмотря на то что значительная часть больных, госпитализированных в отделения интенсивной терапии, имеет нарушение почечных функций, соответствующее 3–5-й стадии ХБП, этих пациентов, как правило, не включали в исследования по изучению эффективности НМГ для профилактики тромбозов. Причиной этого было сложившееся на протяжении многих лет мнение о крайней редкости венозных тромбозов и тромбоэмболий и преобладании геморрагических осложнений у пациентов с терминальной ХПН, с одной стороны, и опасность развития кровотечений, связанных с биоаккумуляцией НМГ вследствие снижения их почечного клиренса, – с другой. Лишь совсем недавно были получены данные о высокой частоте тромбоэмболических осложнений у больных с поздними стадиями ХБП, в том числе терминальной ХПН, риск которых оказался почти вдвое выше, чем у лиц с сохранной функцией почек [29–32]. Факторы, обусловливающие развитие тромбозов при терминальной ХПН, многочисленны и включают в себя артериальную гипертонию, сахарный диабет, ускоренное развитие атеросклероза, гипергомоцистеинемию, признаки синдрома воспалительного ответа (высокий уровень С-реактивного белка, интерлейкина-6), нарушения гемокоагуляции, эндотелиальную и тромбоцитарную дисфункции, применение эритропоэтина [33–37]. Это объясняет необходимость проведения превентивной антикоагулянтной терапии у больных из группы риска.
Результаты многочисленных исследований обосновывают применение НМГ у пациентов с ХПН не только с лечебной, но и с профилактической целью. Однако на определенном этапе без достаточной доказательной базы утвердилась точка зрения о нецелесообразности назначения НМГ и преимущественном использовании НФГ у этой категории больных. Результаты последующих исследований по применению НМГ в терапевтических дозах у больных с почечной недостаточностью подтвердили это положение. Так, по данным метаанализа, включавшего 12 исследований (всего 4971 пациент) по применению НМГ у больных с выраженной почечной недостаточностью, было установлено, что использование терапевтических доз эноксапарина у больных с клиренсом креатинина менее 30 мл/мин по сравнению с больными с более высокими значениями скорости клубочковой фильтрации (СКФ) сопровождается значимым увеличением пикового уровня анти-Ха и повышенным риском «больших» кровотечений (8,3% vs 2,4%, ОШ 3,88; 95% доверительный интервал 1,78–8,45; р = 0,01) [38]. Аналогичные данные были получены при применении НМГ у больных с почечной недостаточностью, включенных в крупные рандомизированные исследования по изучению венозных тромбозов, тромбоэмболии легочной артерии и острого коронарного синдрома. Из 18 251 больных, включенных в регистр RIETE – действующий в настоящее время проспективный регистр пациентов с венозными тромбоэмболиями, – 1037 (5,7%) имели расчетную СКФ менее 30 мл/мин. Использование НМГ в качестве первоначальной терапии у этой группы пациентов сопровождалось развитием «больших» кровотечений в 7,3% случаев по сравнению с 2,1% в группе больных с клиренсом креатинина более 30 мл/мин [39]. Сходная частота «больших» кровотечений установлена и по данным регистра GRACE – проспективного регистра пациентов с острым коронарным синдромом – при лечении НМГ: 8,1% у пациентов с клиренсом креатинина менее 30 мл/мин и 2,3% – у пациентов с более высокими значениями СКФ (p