латентная вирусная инфекция что это
Латентная вирусная инфекция что это
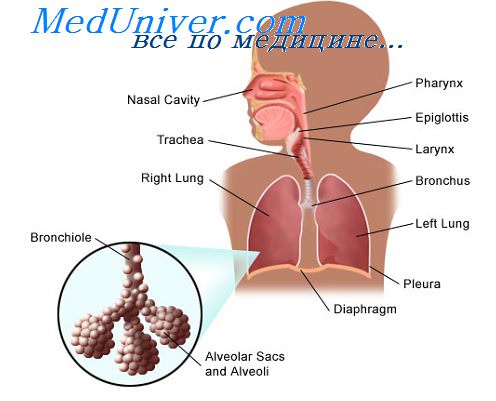
Персистентными называют инфекции, при которых вирус либо его антигены в течение продолжительного времени обнаруживаются в организме человека. Указанное пребывание сопровождается определенными специфическими иммунологическими сдвигами. Клинические проявления заболевания могут быть выраженными, слабыми либо маскироваться симптомами общего хронического заболевания (кашель, слабость, субфебрилитет, одышка и т.д.), что нередко наблюдается у больных с хронической обструктивной болезнью легких и бронхиолите с облитерацией при нерсистенции респираторно-синцитиального вируса.
Наиболее типичным примером хронической инфекции является инфекция, вызываемая аденовирусами. Для нее характерна частая смена клинических ремиссий и обострений, но относительно благоприятный прогноз при своевременном и правильном лечении.
Классификация вирусной персистенции весьма условна. При наличии отличительных свойств многие ее формы имеют общие черты: при всех вариантах весьма распространено формирование дефектных форм вируса, их тесное взаимодействие с геномом клетки-хозяина, чередование фаз обострения и клинической ремиссии. Вероятны переходы одной разновидности персистенция в другую, например персистентной инфекции в латентную или хроническую.
Как показали исследования, проведенные в Государственном научном центре пульмонологии (МЗ РФ), персистенция достаточно широко распространена не только при хронической, но и острой бронхолегочной патологии. При тяжелых полисегментарных пневмониях и острых абсцессах нередко отмечается замедленная элиминация респираторных вирусов и их компонентов из организма больного, что подтверждается и более длительными сроками образования специфических противовирусных иммуноглобулинов класса М и G. Персистенция сопровождается низкими показателями клеточного иммунитета (прежде всего Т-активные клетки), натуральной киллерной активности, всех видов интерферона. Иммуносупрессия, обусловленная вирусами, способствует более выраженной активации бактериальной флоры как аэробного, так и анаэробного плана.
При затяжных и рецидивирующих бронхитах, особенно с явлениями бронхоспазма, вирусы и вирусные компоненты удается обнаружить до 1,5-2 месяцев от начала заболевания. Их элиминация прямо коррелирует с исчезновением признаков воспаления бронхов.
При хронической обструктивной болезни легких и бронхиолите с явлениями облитерации у детей респираторно-синцитиальный вирус чрезвычайно часто выявляется как в период обострения, так и относительной клинической ремиссии.
У больных с ЛОР-патологией: аденоидитами, хроническими тонзиллитами и отитами основным персистирующим агентом является аденовирус. При одновременном наличии аденоидитов и шейных лимфоденитов чаще всего наблюдается ассоциация хронических аденовирусных и микоплазменных инфекций.
Особенности воспалительных реакций организма при вирусной персистенции чрезвычайно разнообразны, весьма вариабельны и зависят от громадного количества факторов, определяемых как макро-, так и микроорганизмами.
Вирусная инфекция
Содержание статьи:
Вирус – это крошечный агент, который живет внутри живых клеток или клеток-хозяев. Вирусы нуждаются в живых клетках, чтобы иметь возможность воспроизводиться. Существуют тысячи вирусных инфекций человека, некоторые из которых встречаются чаще, чем другие. Например, простуда и грипп – это вирусы, но встречаются они чаще, чем Эбола и ВИЧ. Обычно инфекции вирусного характера у взрослых протекают нетяжело у относительно здоровых людей, но могут быть довольно тяжелыми для людей с ослабленной иммунной системой. Практически любой вирус может привести к осложнениям, присоединению микробной инфекции.
Основные вирусные инфекции
Вирусной инфекцией является заболевание, которое возникает при проникновении в тело патогенных вирусных частиц. Вирусы «захватывают» нормальные живые клетки тела. Они используют эти клетки для репликации и размножения, в конечном итоге разрушая клетку-хозяина – это то, что вызывает признаки заболевания вирусной инфекцией. Важно понимать различия вирусной и бактериальной инфекции. В отличие от бактериальных инфекций, которые поддаются лечению антибиотиками, вирусные инфекции не так просто лечить. Многие, такие как ОРВИ, проходят своим чередом, и тело восстанавливается самостоятельно, а другие, например ВИЧ, – нет.
Вирусные заболевания – это чрезвычайно распространенные инфекции. Есть много типов возбудителей, вызывающих самые разные вирусные заболевания. Самый распространенный тип вирусного заболевания – простуда, вызванная вирусной инфекцией верхних дыхательных путей (носа и горла). Другие распространенные вирусные заболевания:
Для вирусных инфекций характерна высокая заразность, они передаются от человека к человеку, когда вирус проникает в организм и начинает размножаться. Источником является больной человек (животное) или носители. Распространенные пути и механизмы передачи вирусов от человека к человеку включают:
Вирусные заболевания в своем развитии и течении имеют определенные отличия, вызывают широкий спектр симптомов, которые различаются по характеру и степени тяжести в зависимости от конкретной причины вирусной инфекции и других факторов, включая возраст человека и общее состояние здоровья.
Вирусная инфекция: основные симптомы заболевания
Симптомы вирусных заболеваний различаются в зависимости от конкретного типа, характеристики вируса, вызывающего инфекцию, пораженной области тела, возраста, истории болезни пациента и других факторов, изначального состояния при вирусной инфекции. Симптомы вирусных заболеваний могут затронуть практически любую область тела или систему организма. Они могут включать:
У младенцев картина вирусной инфекции также может включать:
Серьезные признаки, которые могут указывать на опасные для жизни осложнения
В некоторых случаях нужно строго контролировать то, как проявляется инфекция. Немедленно нужно обратиться за медицинской помощью, если наблюдаются какие-либо из следующих симптомов:
Методы диагностики
Большинство ОРВИ и грипп в эпидемический сезон диагностируют клинически, учитывая особенности симптомов, тяжесть заболевания и сроки развития болезни (инкубационный период). В зависимости от того, сколько длится период инкубации – от момента контакта с больным, до первых признаков болезни, можно уточнить тип ОРВИ.
Лечение вирусной инфекции у взрослых
Терапия вирусных инфекций зависит от конкретного вируса и других факторов. Общие лечебные меры направлены на облегчение симптомов, чтобы человек мог отдохнуть, поддержать свои силы и выздороветь без развития осложнений. Чем лечить инфекции, определяет врач.
Общие препараты для лечения и немедикаментозные методы вирусных инфекций включают:
Важно знать, что антибиотики при вирусной инфекции не показаны, они применимы только при развитии или угрозе присоединения микробных осложнений.
В зависимости от типа вирусной инфекции и наличия осложнений может потребоваться широкий спектр других методов лечения. Например, инфекцию, вызванную вирусом папилломы человека (ВПЧ), которая приводит к дисплазии шейки матки, можно лечить путем хирургического удаления аномальных клеток на шейке матки женщины.
В некоторых случаях для лечения вирусных заболеваний могут быть назначены определенные лекарства:
Возможные осложнения после вирусных инфекций
Меры профилактики и защиты
Вирусы распространяются по-разному, в зависимости от их классификации и особенностей. Гепатит С, заболевание печени, передается через биологические жидкости. С другой стороны, грипп может передаваться при контакте с вирусом, оставленным на каком-либо объекте, например телефоне, или через капли в воздухе, если больной гриппом чихает или кашляет перед вами. Не все вирусные инфекции можно предотвратить, но можно снизить риск заражения вирусом несколькими способами:
Источники статьи:
Что такое инфекция цитомегаловирусная? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
Цитомегаловирусная болезнь (ЦМВИ, цитомегалия, вирусная болезнь слюнных желёз, болезнь с включениями) — это общее системное инфекционное заболевание, вызываемое вирусом семейства герпесов V типа — цитомегаловирусом, который специфически поражает лейкоциты и клетки различных органов (слюнных желёз, почек, лёгких, печени, головного мозга и другие).
Клинически характеризуется многообразием проявлений — от бессимптомного течения до генерализованных (распространённых) форм с поражением внутренних органов и центральной нервной системы, а также пожизненного пребывания в организме.
Этиология
Вид — Cytomegalovirus hominis (открыт в 1956 году)
Является древним человеческим вирусом (предположительно с Кембрийского периода), который в ассоциации с другими герпесвирусами оказал значительное влияние на формирование иммунитета современного человека.
Внутривидовая структура неоднородна. Известно о трёх штаммах вируса: Davis, АД 169, Kerr и Towne. Они могут иметь различия в тропизме к тканям человека, различаться по степени вирулентности и патогенности.
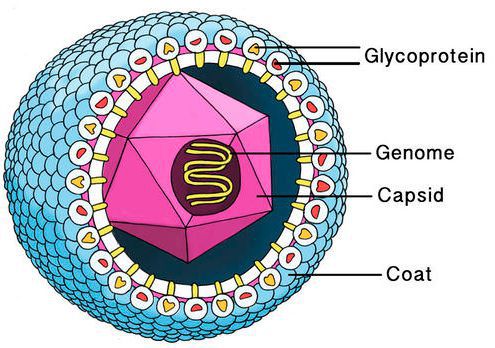
Цитомегаловирус имеет внешнюю гликопротеиновую оболочку, в составе которой есть B и H звенья — к ним формируются антитела. Представляет собой двухцепочечный ДНК-содержащий крупный вирус с диаметром нуклеокпсида до 180 нм.
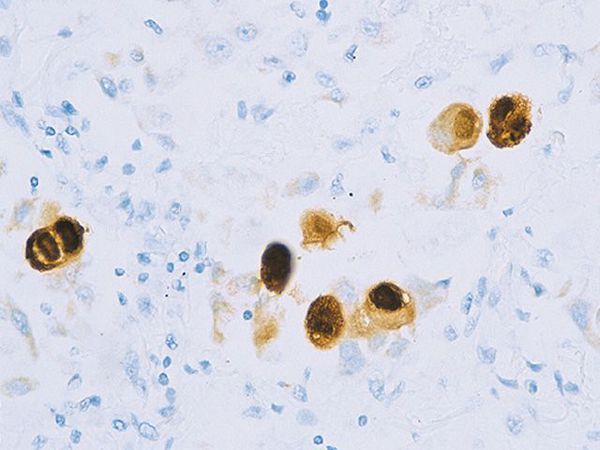
Вирус способен поражать практически любую ткань человеческого организма, т.е. обладает политропностью. При развитии в ядрах инфицированных клеток образует включения (незрелые вирионы), описываемые как «глаз совы».
Вызывает цитомегалию (увеличение) клеток, не приводя к их гибели. Способен при активном течении значительно снижать иммунитет. Возможна трансплацентарная передача вируса с развитием врождённой инфекции.
Культивируется на культуре фибробластов (клеток соединительной ткани) человека. Изменения хромосомного набора клеток не вызывает. Очень чувствительны к ЦМВ клетки плода и новорождённого.
Малоустойчив в окружающей среде, быстро погибает при повышении температуры до 56°С и действии дезинфицирующих средств, теряет заражающие свойства при замораживании. В условиях комнатной температуры способен сохраняться в течение нескольких дней. [1] [3] [4] [8]
Эпидемиология
Антропоноз. Источник инфекции — только человек (больной различными формами и носитель), причём выделение вируса возможно в течение всей жизни человека и зависит от его индивидуальных иммунологических особенностей. Возможно заражение различными штаммами ЦМВ, роль этого в изменении патологии и клинической картине пока не выяснена.
Как передаётся цитомегаловирус
Механизмы передачи вируса:
Факторами передачи вируса выступают слюна (преимущественно), моча, кровь, вагинальный секрет, слёзы, сперма, фекалии, грудное молоко.
Восприимчивость среди населения высокая, наибольшее количество заражённых выявляется в детском и подростковом возрасте, когда происходит повышение контактных взаимодействий между людьми. Во взрослом состоянии ЦМВ инфицировано до 95% населения планеты, которые являются пожизненными носителями вируса. [1] [2] [3] [8]
Симптомы цитомегаловирусной инфекции
Инкубационный период — от 15 дней до трёх месяцев (при манифестной, т. е. явно выраженной форме).
Врождённая форма цитомегаловирусной инфекции
Цитомегаловирусную инфекцию выявляют примерно у одного из 200 рождённых детей, каждый пятый из них имеет или будет иметь проблемы со здоровьем. Сразу после рождения выявляются низкая масса тела, увеличение печени и селезёнки, желтуха, увеличение всех групп лимфоузлов, высыпания геморрагического характера, различные органные поражения, резкие изменения гемограммы и функциональных тестов. В крови, слюне и моче выявляется вирусная ДНК (в ряде случаев выделение вируса продолжается на протяжении нескольких лет).
Прогноз серьёзен и зависит от тяжести поражения и объёма проводимых лечебных мероприятий. В более поздние сроки инфицирования беременной вероятность тяжёлых проявлений заболевания существенно ниже, и новорождённые, как правило, не имеют симптомов врождённой ЦМВ-инфекции на начальных этапах после родов, однако это не говорит о полном клиническом благополучии в будущем — возможно поражение нервной системы различной степени выраженности и нейросенсорная тугоухость. Поэтому такие дети нуждаются в обследовании и наблюдении профильных специалистов, а при необходимости — в лечении. [1] [2] [3] [5] [8] [10]
Приобретённая форма цитомегаловирусной инфекции
При приобретённых формах заболевание чаще всего протекает в детском или подростковом возрастах. В эти периоды отмечается наибольшая лабильность иммунной системы (имеет значение при группе «детских инфекций»).
Чаще всего первичное инфицирование протекает или бессимптомно, или по типу ОРЗ нетяжёлого течения. Наблюдаются лёгкая слабость, субфебрилитет (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение лимфатических узлов шеи, увеличение и болезненность слюнных желёз.
Зачастую такие проявления не вызывают настороженности в плане ЦМВ и самостоятельно купируются в течение 1-2 недель — болезнь переходит в стадию латентного течения (носительство).
При инфицировании в более позднем возрасте (взрослые люди), а также у некоторых детей (с нарушением иммунитета) и ослабленных больных заболевание, как правило, протекает с явными морфофункциональными нарушениями и гораздо тяжелее, чем у первой группы лиц. Наблюдается:
Синдром тонзиллита не характерен. Увеличивается печень и селезёнка, значимо изменяются показатели гемограммы и функциональных печёночных проб.
В зависимости от состояния иммунной системы и возможностей её коррекции клинически значимая первичная инфекция у данной группы людей продолжается в течение 1-3 месяцев и, как правило, завершается победой организма над вирусной экспансией с последующим формированием вирусоносительства без каких-либо явных клинических проявлений.
В некоторых случаях (ВИЧ-инфекция, онкологические заболевания, длительный приём цитостатических препаратов, генетические дефекты иммунной системы) может наблюдаться длительное волнообразное течение первичной инфекции или реактивация (обострение) имеющегося носительства вируса (латентной формы). В этом случае отмечается:
Мононуклеозоподобный синдром
При выраженной форме болезни может развиться мононуклеозоподобный синдром — слабость, субфебрильная температура (37,1—38,0 °C), увеличение и чувствительность лимфоузлов, увеличение печени и селезёнки, изменения крови вирусного характера.
Симптомы цитомегаловируса у мужчин и женщин
Цитомегаловирусная инфекция поражает людей всех возрастов и полов. Принципиальных отличий в симптомах у мужчин и женщин нет, за исключением поражения половых органов.
Цитомегаловирусная инфекция у беременных
У беременных первичная инфекция может протекать бессимптомно или с ограниченными клиническими проявлениями (чаще всего). При заражении ребёнка (плода) до родов в зависимости от сроков первичного инфицирования женщины (иногда истинной реактивации ЦМВ при СПИДе) возможно развитие врождённой цитомегаловирусной инфекции.
Риск внутриутробной передачи — до 90% от всех случаев инфицирования на любом сроке беременности.
При заражении в ранние сроки беременности высок риск самопроизвольного выкидыша, мертворождения или рождения детей с явными пороками развития (патологии лёгких, головного мозга, почек, сердца, сосудов, органа слуха, психоневрологическими нарушениями).
Интересной особенностью является влияние возраста беременной, на котором произошло первичное инфицирование, на частоту передачи инфекции: у женщин до 20 лет риск передачи в три раза выше и не зависит от сроков беременности, а после 20 лет риск внутриутробного инфицирования существенно ниже
Симптомы хронической цитомегаловирусной инфекции
Болезнь становится хронической, если вирус долго находится в организме и иммунная система не может ему противостоять. Характерны длительная субфебрильная температура (37,1—38,0 °C) и слабость. Может увеличиться печень, лимфоузлы (чаще нескольких разных групп), иногда селезёнка, возникает поражение глаз и миокардит.
Цитомегаловирусная инфекция у людей с нормальным иммунитетом
Заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека, т.е. иммунная система среднестатистического жителя планеты способна самостоятельно найти достойный выход из ситуации.
Цитомегаловирусная инфекция при СПИДе
При СПИДе болезнь протекает крайне тяжело — может развиться генерализованная форма инфекции, т. е. поражаются различные органы:
Прогноз часто неблагоприятен. Генерализованная форма цитомегаловирусной инфекции может также развиваться у пациентов с ослабленным иммунитетом и младенцев.
Патогенез цитомегаловирусной инфекции
Входные ворота — слизистая оболочка различных органов, преимущественно ротоглотки и верхних дыхательных путей (также желудочно-кишечного тракта, мочеполовой системы и других органов).
В месте внедрения никаких структурных и воспалительных изменений не наблюдается. После проникновения вируса в организм он атакует свои главные мишени — лимфо- и моноциты, эпителиальные клетки слюнных желёз, лёгких, почек и других органов.
Поражённые клетки увеличиваются в размерах в 3-4 раза (цитомегалия), в ядре клетки формируются включения (незрелые вирионы), в результате чего клетка приобретает вид «совиного глаза». При активном течении болезни развивается депрессия большинства звеньев иммунитета, в том чичле и белка ИНФ-α.
В дальнейшем в ответ на проникновение ЦМВ развивается защитная реакция в виде образования специфических антител различных классов, активации Т-киллеров и развития реакций гиперчувствительности замедленного типа, проявляющейся в поражённых органах образованием узелковых лимфомоноцитарных инфильтратов.
Однако инфицированные клетки не погибают, а продолжают функционировать и выделяют специальный слизисто-белковый секрет, который, обволакивая вирионы, обеспечивает маскировку вируса от иммунной системы человека. Это выражается в слабом иммунном ответе и переходу острого заболевания в длительный латентный процесс (носительство).
При слабой репликации и равновесных отношениях с иммунитетом вирус может длительно (пожизненно) сохранятся в организме в состоянии относительной стабильности, не вызывать никаких органных поражений и не причинять никаких неудобств человеку. Вирусную ДНК при таком состоянии в крови выявить не удаётся, однако в эпителии слюнных желёз и моче вирус можно обнаружить (обычно в незначительном количестве).
При значительном снижении иммунитета (ВИЧ, онкологические заболевания, пересадка органов, длительный приём цитостатиков) происходит активизация вирусной репликации, вирус попадает в кровь и вновь атакует различные органы. [1] [3] [10]
Классификация и стадии развития цитомегаловирусной инфекции
Общепринятой классификации не существует, она разнится в зависимости от особенностей медицинского подхода к проблематике заболевания.
Классификация по клинической форме:
1. Приобретённая ЦМВ:
○ генерализованная (мононуклеозоподобная, лёгочная, церебральная и почечная, печёночный гепатит, с поражением ЖКТ, комбинированного вида);
Отдельно выделяют цитомегаловирусную болезнь у ВИЧ-инфицированных.
Классификация по МКБ-10:
Классификация по степени тяжести:
Осложнения цитомегаловирусной инфекции
Осложнения при цитомегалии бывают специфическими неспецифическими.
Специфические осложнения:
Неспецифические осложнения обусловлены наслоением вторичной бактериальной флоры. Это гнойные осложнения — повышение температуры тела до 41°С, соответствующие симптомы поражения определенных органов, нейтрофильный лейкоцитоз. [1] [3] [9] [10]
Диагностика цитомегаловирусной инфекции
Лабораторная диагностика:
Также проводится инструментальная диагностика:
Дифференциальная диагностика:
Лечение цитомегаловирусной инфекции
Лечение бессимптомной цитомегаловирусной инфекции
Бессимптомные носители цитомегаловирусной инфекции, как правило, не нуждаются в лечении. Исключением могут быть пациенты, которые получают сильную терапию, выраженно угнетающую иммунную систему. В таком случае может возникнуть опасное обострение инфекции, т. е. лечение проводится для профилактики.
Лечение цитомегаловирусной инфекции лёгкой степени тяжести
Лечения проводится в амбулаторных условиях. Важно отметить, что заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека. Это определяет основную лечебно-диагностическую тактику при выявлении активной (острой) ЦМВ-инфекции (при отсутствии тяжёлого течения и осложнений) — это здоровое питание, полноценный отдых и динамическое наблюдение. Лишь в случаях упорного течения и выраженных отклонений клинико-лабораторного характера следует подключать средства медикаментозного лечения.
Лечение средней и тяжёлой формы цитомегаловирусной инфекции
Больные средней тяжести, тяжёлые пациенты и дети неонатального возраста подлежат стационарному обследованию, наблюдению и лечению.
Принципы лечения цитомегаловируса должны отвечать следующим требованиям:
Медикаментозное лечение
С учётом индивидуальных особенностей проводится этиотропная терапия, направленная на ослабление вируса, прекращение его генерализованной циркуляции (персистенции) и патогенного потенциала.
В зависимости от условий могут применяться специфические цитомегаловирусные иммуноглобулины, специфические противовирусные препараты прямого противоцитомегаловирусного действия (в основном в условиях реанимации и интенсивной терапии).
В целях повышения сопротивляемости организма показано назначение средств иммунокоррекции и иммунотерапии, патогенетическое и симптоматическое лекарственное обеспечение.
Диета
Питание больных осуществляется согласно тяжести заболевания, проявлениям и возрастному фону. В общем показана диета №5 по Певзнеру с отказом от жирной, жареной, острой и раздражающей пищи, механически и химически щадящие питание.
Диспансерное наблюдение
После выписки за переболевшими устанавливается диспансерное наблюдение в течении 6-12 месяцев с периодическими осмотрами профильных специалистов и обследованием, объём и кратность которого определяется лечащим врачом. [1] [2] [5] [8] [10]
Прогноз. Профилактика
Прогноз, как правило, благоприятный (переход в неактивное носительство).
Специальной профилактики заражения не существует.
В очаге заболевания противоэпидемические мероприятия не проводятся, карантина нет.
После клинического выздоровления дети допускаются в коллективы без ограничительных мероприятий.
В целях выявления источников повышенной опасности ЦМВ проводятся обследования донорам крови, органов и тканей, а также беременным женщинам. Если беременная не имеет специфических антител IgG к ЦМВ, за ней следует установить более тщательное наблюдение с трёхкратным обследованием на ЦМВ за время беременности. В это время ей следует по возможности минимизировать общение с детьми, не пользоваться чужой посудой и не целоваться с новыми людьми.
Рекомендовано назначение профилактического лечения больным СПИДом и после трансплантации органов препаратами прямого противовирусного действия.
Вакцина для предотвращения врождённого ЦМВ находится в стадии разработки. [1] [2] [9]
Международный эндокринологический журнал 4(16) 2008
Вернуться к номеру
Латентная вирусная инфекция и аутоиммунный тиреоидит
Авторы: О.А. Гончарова, Харьковская медицинская академия последипломного образования
Версия для печати
В последние годы наблюдается активизация исследований, касающихся роли внутриклеточных патогенов в развитии аутоиммунных заболеваний (АИЗ). В значительной степени это связано с бурным развитием иммунологии. Актуальность таких исследований не вызывает сомнений, ибо углубление представлений о механизмах взаимосвязи инфекции с АИЗ важно для разработки подходов, разрывающих такую связь, т.е. для предотвращения развития аутоиммунного процесса [1].
В структуре эндокринной патологии значительный удельный вес принадлежит аутоиммунной тиреопатологии, одним из основных представителей которой является аутоиммунный тиреоидит (АИТ). Это заболевание в определенной степени противоречивое. С одной стороны, по данным статистики, оно является наиболее частым из всех тиреопатий (табл. 1.).
С другой стороны, высказано мнение (В.В. Фадеев и соавт.) [7], что АИТ как самостоятельное заболевание не существует. Обсуждается только такой его исход, как гипотиреоз. Такой подход, как считают Э.П. Касаткина и М.И. Балаболкин [8], ведет только к созерцательной позиции относительно ранних форм АИТ и является неприемлемым.
Сегодня мы являемся свидетелями прогрессивного развития иммунологии, и это, несомненно, внесло немало существенных прорывов в понимание механизмов развития аутоиммунных заболеваний (рис. 1), в осознание возможностей их профилактики.
Характеристике иммунного ответа посвящена обширная литература, касающаяся аутоиммунных процессов, но все еще существуют противоречия относительно ряда важных моментов их этиопатогенеза. Одним из них является понимание роли микроорганизмов в развитии этой патологии [2].
Теоретически предполагается, что развитие органо- или антигенспецифического АИЗ могло бы иметь ряд причин. Л.И. Брамерван приводит 5 причин тиреоидной аутоиммунной патологии. В качестве первой предлагается следующая — антигенный стимул (инициированный какими-то внешними факторами, в т.ч. и молекулярной мимикрией) провоцирует и/или поддерживает заболевание.
Такой стимул может быть обусловлен либо инфицированием самих клеток-мишеней, либо инфицированием нетиреоидных тканей микроорганизмами со свойствами суперантигенов или антигенов, гомологичных антигенам клеток-мишеней [10].
В то же время очень важным моментом считается то, что развитие АИТ невозможно без нарушений в иммунной системе. Этот постулат можно продемонстрировать на примере подострого тиреоидита де Кервена. Хорошо известны иммунологические и серологические сдвиги, возникающие в ходе этого заболевания и постепенно исчезающие по мере затухания воспалительного процесса. К ним относятся появление тиреоидных антител (АТ) (включая АТ к рецепторам тиреотропного гормона (ТТГ)) и экспрессия HLA-DR тиреоцитами по крайней мере у части больных [11, 12]. Однако АИЗ щитовидной железы (АИЗЩЖ) при этом развиваются лишь в очень редких случаях. Чем это объясняют?
1. В лимфоцитах здоровых людей присутствуют гены, определяющие способность этих клеток продуцировать тиреоидные аутоантитела (включая АТ к рТТГ) в ответ на усиленный выход тиреоидных антигенов из воспаленных и поврежденных тиреоцитов.
2. Такая усиленная презентация аутоантигенов иммунной системе сама по себе не приводит к развитию АИЗЩЖ. Для того чтобы это произошло, необходимы нарушения в самой иммунной системе. Изменения клеток-мишеней или количества и качества аутоантигенов для этого совсем не обязательны.
Всем известно, что при АИТ выявляются АТ к ТГ (коллоидному антигену) и к ТПО (микросомальному антигену) [13–16]. Однако доказано, что одного лишь наличия антитиреоидных АТ еще недостаточно для повреждения структуры ЩЖ. Для проявления цитотоксических свойств эти АТ должны кооперироваться с Т-лимфоцитами. Поэтому патогенез АИТ невозможно объяснить только механизмами гуморального иммунитета. Имеются многочисленные данные, подтверждающие участие механизмов клеточного иммунитета в патогенезе заболевания [17–19].
Исходно все клетки организма имеют иммунологическую толерантность, которая приобретается в перинатальный период при контакте незрелых лимфоцитов с собственными антигенами. Различные отклонения таких процессов в этом периоде и образование отдельных клонов Т-лимфоцитов (дефект Т-супрессоров), способных взаимодействовать с собственными антигенами (антигены ЩЖ), могут быть причиной нарушения такой толерантности и в дальнейшем приводить к развитию АИЗ.
Предполагается, что внутренний фактор наследования АИЗ связан с наличием таких клонов Т-лимфоцитов. Для реализации наследственной предрасположенности к развитию АИЗЩЖ дополнительно необходимы внешние факторы, активирующие Т-хелперы, которые вовлекают в своеобразную цепную реакцию другие компоненты. К таким факторам относят вирусы, различные инфекции, лекарственные агенты.
Инициация аутоиммунного ответа, по современным представлениям, начинается с презентации антигена Т-лимфоцитам, рецептор которых взаимодействует с молекулами антигенов HLA II класса. Такая презентация антигена происходит и в ЩЖ. Доказательство: тиреоциты, полученные от больных с АИТ и диффузным токсическим зобом, экспрессируют антигены II класса HLA и могут в связи с этим вызывать пролиферацию Т-лимфоцитов [20, 21].
Основываясь на проведенных исследованиях, считают, что роль антигенпрезентирующих клеток, инициирующих иммунный ответ в ЩЖ, играют дендритные клетки (ДК), которые являются тканевыми макрофагами — производными моноцитов. Моноциты периферической крови и тканевые макрофаги происходят из полипотентной стволовой клетки. Попав в кровяное русло, моноциты в течение 2–3 суток расселяются в ткани, где превращаются в тканевые макрофаги [22].
Тканевые макрофаги — производные моноцитов:
1. Плевральные и перитонеальные макрофаги.
2. Звездчатые ретикулоэндотелиоциты (купферовские клетки) печени.
3. Альвеолярные макрофаги.
4. Интердигитарные клетки лимфатических узлов.
5. Макрофаги вилочковой железы (тимические).
6. Костномозговые макрофаги.
8. Синовиальные клетки (тип А).
9. Глиальные макрофаги (микроглиоциты) мозга.
10. Мезангиальные клетки почек.
11. Поддерживающие клетки (клетки Sertoli) яичка.
12. Дендритные клетки лимфатических узлов и селезенки.
13. Клетки Лангерганса кожи и слизистых оболочек.
Схема развития аутоиммунного процесса в ЩЖ (F.G.A. Delemarre и соавт., 1996) [23]:
1. Антиген (АГ) захватывается дендритными клетками ЩЖ и затем перемещается в близлежащий лимфоузел, где происходит презентация АГ Т-клеткам, приводя к последующей активации В-лимфоцитов и дифференцировке их в плазматические клетки.
2. Т-клетки активно вторгаются в ЩЖ, инициируя иммунную атаку с вовлечением различных эффекторных механизмов, в частности, антителозависимую клеточно-опосредованную цитотоксичность и другие формы цитотоксичности, приводя к развитию тиреоидита и деструкции железы.
Остается еще много необъяснимых моментов в патогенезе и развитии АИЗ. Неясно, какие причины или механизмы заставляют дендритные клетки передвигаться в ЩЖ. Есть предположение, что такой причиной может быть вирусная инфекция или избыток поступления йода в организм. В последние годы, судя по научным публикациям, исследование роли вирусной инфекции в развитии АИЗ активизировалось. Происходит пересмотр традиционного отношения к вирусам как к инфекционным агентам. Доказана их роль в этиопатогенезе ряда АИЗ. К настоящему времени вирусологами изучено более 500 вирусов, способных вызвать различные заболевания у людей. В табл. 2 приведены семейства и роды вирусов, вызывающих заболевания у людей.
Если судить по сегодняшним публикациям, касающимся роли инфекции в активизации аутоиммунных процессов, то можно сделать вывод, что основная их направленность связана с исследованием внутриклеточных патогенов, а это вирусы, микоплазма, уреаплазма, хламидии и т.д. [25–27]. Целью этих исследований является выяснение механизмов, связующих внутриклеточную инфекцию с аутоиммунитетом, для уточнения групп высокого риска аутоиммунной патологии (при этом возможно как расширение, так и сужение этих групп) и совершенствование методов первичной и вторичной профилактики.
В публикациях, связанных с развитием аутоиммунной патологии ЩЖ, в качестве объекта исследования как инфекционный патоген используются герпесвирусы, к которым относятся вирус Эпштейна — Барр, цитомегаловирус (ЦМВ), вирус герпеса, а также вирус гепатита С, который относится к флавивирусам [28–37].
Установленные на сегодняшний день факты и гипотетические взгляды на роль вирусов в развитии АИЗ, в том числе на АИТ, рассмотрим на примере цитомегаловируса.
Человеческий ЦМВ — широко распространенный патоген. На сегодняшний день считают, что им инфицировано 70–100 % мировой популяции. У иммунокомпетентных лиц эта инфекция обычно протекает субклинически. Инфицирование у 30–40 % популяции происходит в детстве, через грудное молоко, при контактах в детских коллективах. У лиц с нарушениями в иммунной системе инфицирование сопровождается острым подъемом температуры, лейкопенией, гепатитом, интерстициальной пневмонией, желудочно-кишечной симптоматикой, ретинитом. У 50–90 % реципиентов органных или костных трансплантантов наблюдается активация ЦМВ-инфекции. ЦМВ — причина врожденных дефектов, в том числе потерь слуха и задержки умственного развития [38].
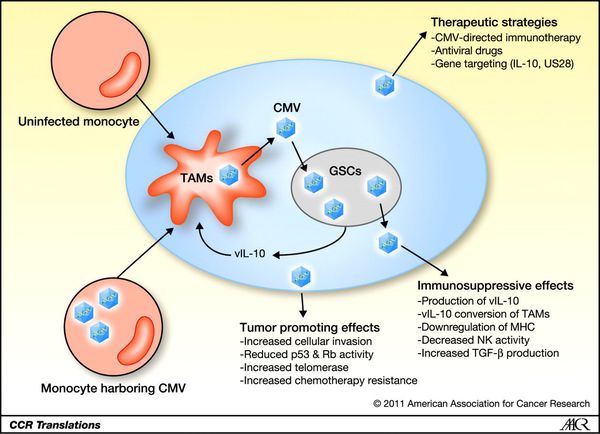
«Жизненный путь» ЦМВ в организме человека схематически представлен на рис. 2.
1. В латентном состоянии ЦМВ-инфекция локализуется в клетках миелоидного происхождения и обеспечивает свое продолжительное существование. К клеткам миелоидной линии относят моноциты и их производные (монобласты, промоноциты и макрофаги). Они обеспечивают идеальную среду для латентных вирусов.
2. Для реактивации и репликации вируса необходима иммунная активация и дифференцировка этих клеток в макрофаги, которая может происходить под влиянием воспаления, стресса, физической нагрузки или гиперактивности вегетативной нервной системы.
3. Установлено, что для активации латентной ЦМВ-инфекции в моноцитах периферической крови необходим активный иммунный процесс, в ходе которого для дифференцировки моноцита в макрофаг важную роль играют лимфоциты CD4+, CD8+, цитокины, особенно ИЛ-2, ИНФ-γ, ФНО-α.
4. Реактивация латентной ЦМВ-инфекции может проходить бессимптомно, но в ряде случаев результатом взаимодействия между вирусом и иммунной системой хозяина могут стать такие серьезные заболевания, как атеросклероз, аутоиммунная либо опухолевая патология [37].
Постоянное распространение инфекции по клеткам в этом микроокружении позволяет вирусу оказывать влияние и на клеточные, и на иммунологические функции, что может вносить вклад в патогенез различных болезней. ЦМВ может вовлекаться в развитие многих болезней, но пока не совсем понятно, каким образом. Понимание этого углу-бит представления об этиологии мультифакториальных болезней и откроет пути к новым стратегиям профилактики и терапии.
Механизмы, помогающие ЦМВ избегать узнавания иммунной системой хозяина
ЦМВ считают преобладающим антигеном, с которым сталкивается иммунная система в течение жизни большинства людей. Находясь в клетках-макрофагах, которые играют центральную роль в антигенпрезентации, т.е. будучи вовлечен в ключевой этап иммунного ответа хозяина, этот вирус развил механизмы, которые обеспечивают возможность избегать узнавания и элиминации иммунной системой (рис. 3).
— уклоняется от выявления и элиминации натуральными киллерами (NK), которые играют важную роль в ранней защите против вирусной инфекции;
— нарушает функцию антигенпродуцирующих клеток (АПК), влияя на макрофаги, в т.ч. дендритные клетки, тем, что снижает уровень экспрессии молекул HLA-классов I и II на их поверхности, изменяет алгоритм цитокиновой секреции на них, снижает способность ДК стимулировать Т-клеточный цитотоксический эффект и нарушает миграцию зрелых и незрелых ДК;
— предотвращает активацию CD4 Т-клеток и выполнение ими своей функции по узнаванию антигена;
— супрессирует прямой Т-клеточный ответ;
— нарушает гуморальный ответ, уклоняясь от специфических антител путем образования защитного покрытия инфицированной клетки, тем самым защищая ее от антителоопосредованной клеточной цитотоксичности;
— стимулирует цитокиновый и хемокиновый ответ;
— углубляет иммуносупрессию в инфицированном организме, что повышает риск бактериальной инвазии и грибковой инфекции;
— ингибирует апоптоз и тем самым обеспечивает выживание инфекции в клетках [37].
Этот вирус, вероятно, достигает многих генов, включенных в этот процесс, путем инкорпорации генетического материала хозяина в свой собственный вирусный геном. Таким образом, вирус обладает способностью к модуляции клеточного и гуморального иммунного ответа хозяина, что способствует его выживанию.
Современные взгляды на роль вируса в патогенезе аутоиммунных заболеваний
Как мы уже отметили выше, решающими вехами в развитии аутоиммунитета являются:
— потеря невосприимчивости и толерантности к аутоантигенам;
— генетическая предрасположенность к развитию аутоиммунной патологии;
— наличие факторов внешней среды, запускающих аутоиммунный процесс.
Вирусной инфекции сегодня отводится ведущая роль как кофактору в этих мультифакториальных заболеваниях [8, 39]. Более того, развитие некоторых АИЗ связываются с определенными вирусами. Тем не менее не все механизмы этого процесса на сегодня определены, и поэтому мы остановимся на существующих гипотезах.
Наиболее привлекательным механизмом считается следующий: под влиянием любой инфекции происходит дифференцировка моноцита, в котором вирус находится в латентном состоянии, в макрофаг, а это является условием для реактивации вируса в пораженных тканях. Иммунная система не может элиминировать вирус, который в инфицированной клетке продуцирует ряд провоспалительных цитокинов (ИЛ-1β, ИНФ-γ и ФНО-α), а также способствует росту клонов активированных Т-лимфоцитов. Все это утяжеляет и пролонгирует воспалительный процесс. Очень важным моментом является то, что эти активированные клетки становятся способными к перекрестной реакции не только с вирусными белками, но и с собственными, тем самым приводя к аутореактивности. Этот процесс описан как молекулярная мимикрия [40].
Предполагают также, что вирусы могут непосредственно обладать цитотоксичностью и вызывать лизис тиреоцитов, способствуя высвобождению свободных аутоантигенов, индуцируя срыв естественной толерантности и развития антитиреоидного иммунитета у лиц с генетической предрасположенностью к АИТ [41].
Существует также предположение, что ЦМВ может вызывать иммуносупрессию, которая усиливается при аутоиммунном заболевании.
Следующая гипотеза: при активации ЦМВ появляются специфические аутореактивные аутоантитела. Их выявляют в сыворотке крови больных одновременно с выявлением инфекции. В то же время их не определили ни у одного больного без признаков цитомегаловирусной инфекции. Установлено, что эти антитела (CD13), которые являются N-аминопептидазой, служат рецептором молекул, обеспечивающих проникновение ЦМВ внутрь клеток. Этот белок хозяина присутствует во всех клетках, чувствительных к цитомегаловирусной инфекции [42].
Некоторые исследователи связывают развитие АИТ с действием латентной инфекции, вызванной внутриклеточными патогенами, на процессы Fas-опосредованного апоптоза. В общих чертах этот процесс выглядит следующим образом. АИТ — хроническое аутоиммунное заболевание, характеризующееся деструкцией тиреоидного эпителия и снижением продукции тиреоидных гормонов. В ЩЖ определяется выраженная Т- и В-клеточная лимфоидная инфильтрация с замещением паренхимы фиброзной тканью [43, 44]. В нормальной ЩЖ наблюдается крайне низкий уровень апоптоза, который уравновешивается медленной физиологической пролиферацией тиреоцитов, обеспечивая тканевой гомеостаз [45, 46]. При АИТ апоптотическая гибель этих клеток возрастает, приводя к гипофункции ЩЖ [47].
В то же время существуют и такие данные: хронические инфекции, вызванные лимфотропными вирусами, могут усилить активацию процесса путем индукции антиапоптотического сигнала, что ведет к удлинению жизненного цикла В-клеток, а с учетом появления новых В-клеток — к клональной В-клеточной экспансии, сначала доброкачественной, а затем — злокачественной.
Установлено, что сбои в В-клеточной активации различны при различной аутоиммунной патологии. Поэтому понимание механизмов активации В-клеток и В-клеточных рецепторов при различных АИЗ имеет краеугольное значение в аутоиммунной и онкологической патологии [48].
Таким образом, на сегодняшний день вирусная теория инициации АИТ является популярной, актуальной и перспективной, так как может открыть пути к новым стратегиям профилактики и терапии этой патологии.
1. Barzilai O., Ram M., Shoenfeld Y. Viral infection can induce the production of autoantibodies // Curr. Opin. Rheumatol. — 2007. — Vol. 19 (6). — P. 636-643.
2. Болезни щитовидной железы. Пер. с англ / Под ред. Л.И. Бравермана. — М.: Медицина, 2000. — 432 с.
3. Валдина Е.А. Заболевания щитовидной железы (2-е изд.). — СПб.: Питер, 2001. — 416 с.
4. Петунина Н.А. Клиника, диагностика и лечение аутоиммунного тиреоидита // Проблемы эндокринологии. — 2002. — Т. 48, № 6. — С. 16-21.
5. Караченцев Ю.И., Гончарова О.А., Герасименко В.Л. Частота и структура госпитальной тиреоидной патологии в возрастно-половом аспекте // Проблеми ендокринної патології. — 2004. — № 2. — С. 60-63.
6. Уроки тиреоидологии: пособие для врачей / Под ред. акад. РАЕН М.М. Велдановой. — Петрозаводск: ИнтелТек, 2005. — 542 с.
7. Фадеев В.В., Мельниченко Г.А., Герасимов Г.А. Аутоиммунный тиреоидит, первый шаг к консенсусу // Проблемы эндокринологии. — 2001. — Т. 47, № 4. — С. 7-14.
8. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Фундаментальная и клиническая тиреоидология: Учеб. пособие. — М.: Медицина, 2007. — 816 с.
9. Никулин Б.А. Оценка и коррекция иммунного статуса. — М.: ГЭОТАР-Медиа, 2007. — С. 307.
10. Tomer Y., Davies T.F. Infection, thyroid disease and autoimmunity // Endocr. Rev. — 1993. — Vol.14. — P. 107-120.
11. Volpe R. Autoimmune disease of the endocrine system. — CRC, Boca Raton, 1990. — 364 p.
12. Volpe R. A perspective on human autoimmune thyroid disease: is there an abnormality of the target cell which predisposes to the disorder? // Autoimmunity. — 1992. — Vol. 12. — P. 3-9.
13. Паньків В.І. Захворювання щитовидної залози: Навчальний посібник. — Чернівці: БДМА, 2003. — 258 с.
14. Олійник В.А. Хронічний лімфоцитарний тиреоїдит (тиреоїдит Хашимото): сучасний стан проблеми // Ендокринологія. — 2006. — Т. 11, № 1. — С. 71-79.
15. Jaume J.C., Guo J., Wang J., Rapoport B., McLachlan S.M. Cellular thyroid peroxidase (TPO) unike purified TPO and adjuvant, induces antibodies in mice that resemble autoantibodies in human autoimmune thyroid disease // J. Clin. Endocrinol. Metab. — 1999. — Vol. 84. — P. 1651-1657.
16. Гончарова О.А. Гуморальний імунітет за умов автоімунної тиреоїдної патології у статево-віковому аспек-ті // Буковинський медичний вісник — 2003. — Т. 7, № 3. — С. 28-30.
17. Кузьменюк О.И., Романовский А.А., Данилова Л.И. и др. Нарушения Т-клеточного звена иммунитета у больных аутоиммунными заболеваниями щитовидной железы // Иммунология. — 2000. — № 2. — С. 44-48.
18. Martin A., Davies T.F. T cells and human autoimmune thyroid disease: emerging data show lack of need to invoke suppressor T cell problems // Thyroid. — 1992. — Vol. 2. — P. 247-261.
19. Гончарова О.А. Возрастные особенности Т-клеточного иммунного ответа у женщин с аутоиммунным тиреоидитом // Фундаментальні питання експериментальної та клінічної ендокринології (Четверті Данилевські читання). — Харків, 2005. — С. 45-46.
20. Einarsdottir E., Soderstrom I., Lofgren-Burstrom A. et all. The CTLA4 region as a general autoimmunity factor: an extended pedigree provides evidence for synergy with the HLA Locus in the etiology of type 1 diabetes mellitus, Hashimoto’s thyroiditis and Graves’ disease // Eur. J. Hum. Genet. — 2003. — Vol. 11. — P. 81-84.
21. Гончарова О.А., Караченцев Ю.И. Иммуногенетика аутоиммунной тиреоидной патологии // Проблеми ендокринної патології. — 2003. — № 3. — С. 26-35.
22. Дранник Г.Н. Клиническая иммунология и аллергология — М.: ООО «Медицинское информационное агенство», 2003. — 604 с.
23. Delemare F.G.A., Simons P.J., Drexhage H.A. Histomorpholological aspects of the development of thyroid autoimmune disease consequences for our understanding of endocrine ophthalmopathy // Thyroid. — 1996. — Vol. 6. — P. 369-377.
24. Дубоссарская З.М. Герпетическая инфекция у женщин: сложности в решении проблемы // Медицинские аспекты здоровья женщины. — 2007. — № 5(8). — С. 38-40.
25. Hоllsberg P., Hansen H.L., Haahr S. Altered CD8+ T cell responses to selected Epstein-Barr virus immunodominant epitopes in patients with multiple sclerosis // Clin. Exp. Immunol. — 2003. — Vol. 132(1). — P. 137-143.
26. Борхсениус С.Н., Чернова О.А., Чернов В.М. Взаимодействие микоплазм с иммунной системой животных и человека // Цитология. — 2001. — Т. 43, № 3. — С. 219-242.
27. Молочков В.А. Урогенитальный хламидиоз. — М.: «Издательство БИНОМ», 2006. — 208 с.
28. Arkwright P.D., Rieux-Laucat F., Le Deist F. et al. Cytomegalovirus infection in infants with autoimmune lymphoproliferative syndrome (ALPS) // Clin. Exp. Immunol. — 2000. — Vol. 121 (2). — P. 353-357.
29. Zhang Zhen-lin, Lin Bo, Yu lu-yang et al. CMV-hFasL transgenic mice prevent from experimental autoimmune thyroiditis // Chin. Med. J. — 2005. — Vol. 118(13). — P. 1087-1092.
30. Sоderlin M., Blomkvist C., Dahl P. et al. Increased risk of infection with biological immunomodifying antirheumatic agents. Clear guidelines are necessary as shown by case reports // Lakartidningen. — 2005. — Vol. 102(49). — P. 3794-3796.
31. Недосекова Ю.В., Кравец Е.Б., Уразова О.И. и др. Связь герпевирусной инфекции с развитием аутоиммунного тиреоидита // Материалы IV Всероссийского тиреоидилогического конгресса. — Москва, 2007. — С. 111.
32. Субхангулов З.М., Давлетшин Р.А. Роль вирусов в патогенезе аутоиммунного тиреоидита // Материалы IV Всероссийского тиреоидилогического конгресса. — Москва, 2007. — С. 163.
33. Поздняк А.О., Пачкориня Т.Н., Фазылов В.Х. Тиреоидный статус у больных хроническим вирусным гепатитом С на фоне лечения a-интерферонами // Материалы IV Всероссийского тиреоидилогического конгресса. — Москва, 2007. — С.138.
34. Shindo A., Li Y., Sasaki R. et al. Non-herpetic acute limbic encephalitis-like manifestation in a case of Hashimoto’s encephalopathy with positive auttoantibodies against ionotropic glutamate receptor epsilon2 // Rinsho Shinkeigaku. — 2007. — Vol. 47(10). — P. 629-634.
35. Гречаник О.І., Руденко А.В., Абдуллаєв Р.Я. Структура уражень щитоподібної залози за даними ультразвукової діагностики у хворих з латентними інфекціями // Мат. наук-практ. конф з міжнародною участю «Фундаментальна та клінічна ендокринологія: проблеми, здобутки, перспективи» (Сьомі Данилевські читання). — Харків, 2008. — С. 45-46.
36. Thomas D., Liakos V., Michou V. et al. Detection of Herpes virus DNA in post-operative thyroid tissue specimens of patients with autoimmune thyroid disease // Exp. Clin. Endocrinol. Diabetes. — 2008. — Vol. 116 (1). — P. 35-39.
37. Sоderberg-Naucler C. Does cytomegalovirus play a causative role in the development of various inflammatory diseases and cancer? // J. of Internal Medicine. — 2006. — Vol. 259. — P. 219-246.
38. Numazaki K., Chiba S. Current aspects of diagnosis and treatment of cytomegalovirus infections in infants // Clin. Diagn. Virol. — 1997. — Vol. 8. — P. 169-181.
39. Davidson A., Diamond B. Autoimmune disease // N. Engl. J. Med. — 2001. — Vol. 345. — P. 340-350.
40. Purcell A.W., Todd A., Kinoshita G. et al. Association of stress proteins with autoantigens: a possible mechanism for triggering autoimmunity? // Clin. Experim. Immunol. — 2003. — Vol. 132. — P. 193-200.
41. Troselj-Vukic B., Milotic I., Milotic F. et al. Cytomegalovirus reactivation after low-dose steroid treatment for hemolytic anemia in a patient with primary Epstein-Barr virus infection // Wien. Klin. Wochenschr. — 2007. — 119 (13–14). — P. 435-437.
42. Papadakis K.A., Tung J.K., Binder S.W. et al. Outcome of cytomegalovirus infections in patients with inflammatory bowel disease // Am. J. Gastroenterol. — 2001. — Vol. 96. — P. 2137-2142.
43. Dayan C.M., Daniels G.H. Chronic autoimmune thyroiditis // N. Engl. J. Med. — 1996. — Vol. 335. — P. 99-107.
44. Stassi G., Zeuner A., Di liberto D., et al. Fas-Fasl in Hashimoto’s thyroiditis // J. Clin. Immunol. — 2001. — Vol. 21. — P. 19-23.
45. Dong Z., Takakuwa T., Takayama H. et al. Fas and Fas Ligand gene mutations in Hashimoto’s thyroiditis // Lab. Invest. — 2002. — Vol. 82. — P. 1611-1616.
46. Mitsiades N., Poulaki V., Mitsiades C.S. et al. Apoptosis induced by FasL and Trail/Apo2L in the pathogenesis of thyroid disease // Trends Endocrinol. Metab. — 2001. — Vol. 12. — P. 384-390.
47. Giordano C., Stassi G., De Maria R. et al. Potential involvement of Fas and its ligand in the pathogenesis of Hashimoto’s thyroiditis // Science. — 1997. — Vol. 275. — P. 384-390.
48. Ferracciolli G., Tolusso B. Infections, B cell recepror activation and and autoimmunity: different check-point impairments lead to autoimmunity, clonal B cell expansion and fibrosis in different immunological settings // Autoimmun. Rev. — 2007. — Vol. 7(2). — P. 109-113.

/110/2.png)
/110/1.png)
/110/3.png)
/110/4.png)
/110/5.png)