культура клеток линии vero чем опасна для человека
Культура клеток линии vero чем опасна для человека
В настоящее время производство многих биотехнологических продуктов (вакцины, факторы роста, гормоны, ферменты, интерфероны и др.), получаемых с помощью перевиваемых клеточных линий, все еще основано на питательных средах, содержащих сыворотку крови (СК) животных. Сыворотка крови содержит комплекс разнообразных компонентов, влияющих на рост клеток: питательные вещества, факторы роста, факторы прикрепления (способствующие прикреплению субстратзависимых клеток), белки, связывающие тяжелые металлы, ингибиторы протеаз и др. Однако использование СК для процесса клеточной пролиферации имеет и некоторые недостатки, такие как вариация качества и высокая цена сыворотки, постоянная потенциальная возможность ее контаминации вирусами, микоплазмами, бактериями и т.д. Существует реальная опасность инфицирования препаратов, полученных на тест-культурах с использованием СК животных, прионами. Поэтому конструирование эффективных бессывороточных питательных сред является на сегодняшний день одной из актуальных проблем клеточной биотехнологии.
Использование бессывороточной питательных сред для культивирования клеток позволяет существенно уменьшить риск контаминации, а также сделать биопроцесс более контролируемым. При этом повышается воспроизводимость результатов на пассируемых культурах вследствие большей стабильности состава среды (свойства сыворотки могут меняться от партии к партии), снижается стоимость среды (особенно в случае эмбриональной сыворотки КРС), отсутствуют специфические антитела и цитотоксичность, которую иногда проявляет СК.
Состав используемой культуральной питательной среды является фактором, оказывающим огромное влияние на клеточный метаболизм. Обычно рецепты бессывороточных сред являются предметом интеллектуальной собственности компаний и недоступны для широкого использования. Однако требования чистоты и безопасности, предъявляемые в настоящее время к медицинским иммунобиологическим препаратам, могут быть эффективно достигнуты только при использовании бессывороточных технологий. Поэтому в последние два десятилетия ведутся интенсивные исследования по разработке бессывороточных питательных сред, при этом все более широкое применение в качестве аминокислотно-пептидной основы вирусологических сред находят ферментативные белковые гидролизаты.
Учитывая тот факт, что в состав ферментативных гидролизатов входят низкомолекулярные пептиды, микроэлементы и другие биологически активные соединения, усиливающие обменные процессы в клетках, нами была совершенствована технология получения гидролизатов растений и оптимизирован состав питательной среды для культур клеток млекопитающих. Для культивирования клеток предложена питательная среда на основе сбалансированного солевого раствора Хенкса, содержащая ферментативный гидролизат обезжиренной соевой муки (5,0 г/л) и ростовые белки (3,0 г/л), выделенные из сыворотки крови КРС. Кроме этого в состав среды дополнительно были включены витамины (тиамин, пиридоксаль, мезо-инозит, пантотенат кальция, никотинамид, фолиевая кислота, рибофлавин), а также некоторые микроэлементы (ионы железа, цинка, селена, кобальта и молибдена). Проведенные исследования показали пригодность питательной среды на основе ферментативного гидролизата сои для культивирования клеток Vero. Индексы пролиферации клеточной культуры Vero в бессывороточной питательной среде на основе гидролизата сои и в контрольной среде, содержащей 5 % сыворотки КРС, были сопоставимы (4,7±0,2) и (4,9±0,3) соответственно.
Культура клеток линии vero чем опасна для человека
Подводя итоги своей многолетней научно-практической деятельности, а также работы сотрудников лаборатории культур ткани, которую я возглавляла в течение 50 лет, четко можно выделить основные результаты. Это прежде всего успешное крупномасштабное изготовление живой полиовакцины трех типов на первичных культурах клеток почек обезьян. В процессе массового выпуска препарата были разработаны новые модификации метода трипсинизации почек, что позволило в 10-15 раз увеличить количество получаемых вакцинных культур с каждой пары почек по сравнению со стартовыми результатами [1, 2].
Особое место занимает работа по установлению новых линий перевиваемых клеток. Она потребовала много лет кропотливого труда, но результаты ее используются еще недостаточно [3]. Создан криобанк культур, в нем после вынужденной ревизии оставлено 12 линий диплоидных клеток человека, 6 линий диплоидных клеток обезьян, 6 гетероплоидных линий обезьян и по одной теленка и овцы. Приготовлены банки посевных и рабочих клеток с полным контролем на безопасность [4]. Линия диплоидных клеток кожи и мышц эмбриона человека М-22 и линия гетероплоидных клеток почек взрослой зеленой мартышки 4647 прошли национальное лицензирование в качестве вакцинных субстратов [5, 6].
Кроме этого, тот же автор изучил вопрос репродукции вакцинных штаммов вируса кори Л-16 и эпидемического паротита Л-3 на клетках линии М-22, и теперь может идти речь о создании отечественной тривакцины. Это будет значительный шаг вперед, так как до сих пор вакцины против кори и эпидемического паротита в РФ производятся на первичных культурах клеток эмбрионов перепелов, а вакцину против краснухи закупают за границей.
Клетки линии 4647 хорошо размножаются при использовании практически всех известных питательных сред с добавлением 5-10% сыворотки крупного рогатого скота, а в последнее время претендуют на 5-7% эмбриональной сыворотки. При внесении среды Игла МЕМ клетки формируют плотный слой на 2-4 сутки культивирования при кратности рассева 1:3-1:4. Урожай из однолитрового роллера составляет 80-90 млн. клеток.
В процессе работы с клетками линии 4647 они многократно подвергались замораживанию в жидком азоте. Без нарушения режима хранения материала более 80% клеток сохраняли свою жизнеспособность. Удалось, например, восстановить клетки ранних уровней пассажей через 25 лет после криоконсервирования. Также следует отметить, что после восстановления, независимо от длительности нахождения в жидком азоте, клетки не изменяли своих морфобиологических свойств. Созданы крупные банки посевных и рабочих клеток. Клетки линии 4647 проверены на безопасность и полностью удовлетворяют всем требованиям ВОЗ и национальных органов контроля к вакцинным субстратам. Важным положительным качеством линии 4647 является широкий спектр чувствительности к вирусам практически всех таксономических групп. Нами были приготовлены экспериментальные серии вакцин против полиомиелита при разных способах культивирования клеток. В качестве посевных вирусов применяли аттенуированные штаммы Сэбина I-III типов. Соответствующая документация передана в ВОЗ, где получила одобрение, но дело дальше не пошло.
Седьмой вакциной, созданной в нашем институте на клетках линии 4647, была первая в отечественной практике вакцина против гепатита А. Линия 4647 оказалась пермиссивной клеточной системой для размножения вируса гепатита А, что позволило получить значительное количество культурального вируса, достаточного для производства инактивированной вакцины в промышленных условиях. Последнее осуществлено на фирме «Вектор».
Таким образом, ИПВЭ им. М.П. Чумакова РАМН располагает перспективными отечественными клеточными системами, пригодными для производства многих диагностических, а также лечебно-профилактических препаратов, и ждет серьезных предложений для реализации имеющегося банка линий перевиваемых клеток с заключением соответствующих договоров на поставку требуемого количества культур.
2. Авторское свидетельство № 914624, 1981. Способ дезагрегации парехиматозного органа / Миронова Л.Л., Хапчаев Ю.Х., Завальный М.А., Кашликова В.И.
5. Авторское свидетельство №1317021, 1987. Штамм диплоидных клеток кожи и мышц эмбриона человека, используемый для культивирования вирусов / Миронова Л.Л., Преображенская Н.К., Грачев В.П. и др. / Патент РФ №13137021, 1993.
6. Авторское свид-во №770195, 1980. Способ культивирования вирусов / Миронова Л.Л., Грачев В.П., Кузнецова Н.В., Попова В.Д. / Патент РФ №770195, 1993.
ПРИМЕНЕНИЕ КУЛЬТУР КЛЕТОК ДЛЯ ВИРУСОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Р.Я. Подчерняева, М.В. Мезенцева, И.А. Суетина, О.А. Лопатина. Г.Р. Михайлова,
А.Д. Петрачев, Л.А. Потапова, О.В. Бакланова, Е.Л. Фирсова, О.М. Гринкевич,
Т.Н. Притчина, М.Н. Щетвин, Л.И. Руссу
ФГБУ «НИИ вирусологии им. Д.И. Ивановского» Минздрава России, Москва, cells@rambler.ru
Оптимизированный состав этих сред представляет собой определенные концентрации ферментативных гидролизатов, растворенных в сбалансированных растворах Эрла или Хенкса, в которые дополнительно добавлены витамины, микроэлементы и отдельные аминокислоты. Показано, что для пролиферации клеток МДСК (клетки почки собаки) при культивировании с соевой средой достаточно добавление только 2% эмбриональной бычьей сыворотки (FBS), а для пролиферации клеток Vero (клетки почки африканской зеленой мартышки) требуется добавление 5% FBS. Таким образом, использование соевой среды позволяет снизить количество сыворотки, необходимой для успешного культивирования этих клеток с 10% до 2—5%. Надо отметить, что морфология и кариология клеток МДСК и Vero не менялась при использовании соевой среды (6—8). Для проведения биотехнологических исследований на современном уровне желательно для культивирования клеток применять полностью бессывороточные среды. Список таких сред, как правило, широко представлен во многих каталогах, но, к сожалению, их цена слишком высока. Поэтому мы провели работу с применением отечественной бессывороточной среды «Гибрис-2» производства ООО «ПанЭко».
Адаптация клеток к этой среде проводилась поэтапно. Так, для получения адаптированной линии клеток МДСК к среде «Гибрис-2» было проведено 4 пассажа с 3% FBS, 3 пассажа с 2% FBS, 5 пассажей с 1% FBS и 6 пассажей без сыворотки. Показано, что индекс пролиферации (ИП), идентичный контрольным значениям, был отмечен только в присутствии 1—2% FBS, а культивирование без сыворотки не приводило к контрольным показателям. Возможно, требуется большее количество пассажей для полной адаптации клеток к бессывороточной среде (9,10). С целью оптимизации работы с нативными сыворотками было исследовано влияние сывороток северных оленей, суягных овец, свиней и морских котиков на пролиферативную активность 2-х клеточных линий — ЛЭЧ (клетки легких эмбриона человека) и Vero. Контролем служили эксперименты с использованием сыворотки FBS.
Было показано, что сыворотки из крови северных оленей можно успешно использовать для культивирования клеток Vero, которые наиболее часто применяются для биотехнологических целей. Однако вопрос стандартизации условий культивирования клеток в зависимости от наличия доброкачественных сывороток или их заменителей не утрачивает своего значения. Поэтому, были проведены исследования по получению и применению так называемых ростстимулирующих белков (РБ), выделенных из сывороток северных оленей, суягных овец и свиней с помощью водного раствора полиэтиленгликоля с M.м. 4000—8000 Д, который способствует также удалению ряда контаминирующих агентов. РБ представлены главным образом альбуминовой и α-глобулиновой фракциями, которые являются белковыми факторами роста, влияющими на пролиферацию клеток.
Изучена пролиферативная активность 7 клеточных линий после 5-ти последовательных пассажей в среде с РБ из сывороток свиней, суягных овец и оленей без добавления сыворотки FBS и с 2% FBS. Показано, что для получения показателей индекса пролиферации (ИП), равнозначных с контролем, все же необходимо добавление 2% сыворотки FBS. Показатели ИП разных клеточных линий различались незначительно. Лучшие показатели ИП наблюдались в экспериментах с РБ из сывороток оленей и свиней (11,12). При работе с культурами клеток не менее важным является применение ферментов для диспергирирования или отделения клеток от субстрата при их пересевах. Для этих целей, как известно, можно применять трипсин или химопсин.
Недостатком этих ферментов является то, что сырье для их получения не стандартизовано и не исключает наличия в них патогенных примесей. Поэтому, совместно с сотрудниками НПО «Вектор», мы провели изучение полученного ими препарата «Коллаза», который представляет собой комплекс протеолитических ферментов с коллагенолитической активностью, выделенных из экологически чистого гепатопанкреаса Камчатского краба с помощью хроматографической очистки и ультрафильтрации. При применении этого фермента по сравнению с трипсином количество жизнеспособных клеток было в 2—2,5 раза больше и требовалось более короткое время воздействия. При этом морфология культивируемых клеток 10 изученных линий оставалась без изменения. Таким образом, использование «Коллазы» при культивировании оказалось более эффективным, чем использование трипсина. Существенной проблемой при работе с клеточными культурами является микробная контаминация клеток, т.к. она влияет на метаболизм клеток, вызывает хромосомные аберрации и изменяет клеточные функции.
Частым контаминантом клеточных культур оказывается вирус бычьей диареи (ВД), относящийся к роду Pestivirus семейства Flaviviridae и являющийся возбудителем вирусной диареи — болезни слизистых крупного рогатого скота. Этот вирус может проникать в клетки из нативных сывороток крупного рогатого скота и даже FBS, добавленных в ростовую среду (13). Так, с помощью метода ПЦР было выявлено наличие ВД в коммерческих FBS, полученных из различных фирм (ПАНЭКО, ООО Биолот, Gibco, Biowest, HyClone, Amimed, Sigma). В сыворотках FBS фирмы ПАНЭКО ВД обнаруживается как до, так и после прогревания в водяной бане при 56°С в течение 30 и даже 60 минут (14). Мы проводили определение ВД с помощью метода ПЦР в клеточных линиях из нашей коллекции.
Иследовались диплоидные клетки легкого и фибробласты эмбриона человека, клетки онкогенных и лимфобластоидных линий человека, перевиваемые клетки обезьян, крупного рогатого скота, собаки, свиньи, крыс, мышей, хомячка, кролика, кошки, овцы, хорька и кур. Клетки хранились в жидком азоте в течение различного периода. Было показано, что диплоидные клетки человека и ряд перевиваемых клеток барана, свиньи, хомячка, обезьян и человека не были контаминированы ВД. Однако в 30% клеточных линий из 83-х изученных был выявлен ВД, причем чаще всего в более поздних закладках. Очевидно, при культивировании этих клеток использовались сыворотки, содержащие этот вирус (15). Одним из пунктов паспорта клеточной линии является чувствительность к репродукции вирусов. Изучение чувствительности разных клеточных линий к определенным вирусам крайне важно для приготовления противовирусных вакцин.
Вирусам свойственен определенный круг хозяев, узкий для одних видов и очень широкий для других. Генетический аппарат вирусов представлен как ДНК, так и РНК в одно- или двунитевой, линейной или циркулярной, моно- или фрагментарной формах. К РНК- содержащим вирусам позвоночных относятся 20 видов вирусов (арена, артери, астро, бирна, борна, бунья, геле, дельта, калици, корона, нода, ортомиксо, парамикса, рабдо, рео, ретро, тога, фило и флави вирусы), включая субвирусные агенты вероиды, сателлиты и прионы. К ДНК-содержащим вирусам позвоночных относятся 11 видов вирусов (адено, анелмо, асфар, гепадна, герпес, иридо, паппилома, парво, покс, полиома и цирко вирусы). Название этих видов вирусов связано либо с их морфологией, либо с местом их изоляции. Интерес к проблеме поиска клеточных линий, чувствительных к различным ДНК- и РНК-содержащим вирусам, позволил нам суммировать различные данные и представить их в виде таблиц 1—4 (16,17).
Культура клеток линии vero чем опасна для человека
В 1974 году Всемирная Организация Здравоохранения (ВОЗ) предложила использовать для производства медицинских биологических препаратов (МИБП) линии диплоидных клеток (1), а позднее и линии гетероплоидных клеток (2). К сожалению, в России до настоящего времени большая часть требуемых препаратов выпускается по-прежнему на первичных культурах клеток.
В лаборатории культур ткани Института было установлено более 100 линий перевиваемых клеток человека, обезьян, крупного рогатого скота, овец, свиней, хомяков, тхорзофреток, морской свинки, кролика. Наиболее перспективные из них сохраняются в жидком азоте.
При обследовании М-22 на стерильность (наличие грибов, бактерий, микоплазм, вирусов) получены отрицательные результаты на уровнях 10, 20, 24, 30, 33, 40 и 42 пассажей. При исследовании культуральных жидкостей и самих клеток на уровнях 10, 20, 30 и 40 пассажей в чувствительных клеточных системах, а также в реакциях гемадсорбции вирусы-контаминанты не обнаруживались. При обследовании клеток М-22 на тех же уровнях пассажей в опытах на взрослых и сосунках белых мышей, кроликах, морских свинках, куриных эмбрионах, иммунодепрессированных мышах линии СВА посторонних агентов также не установлено. Онкогенная активность клеток линии М-22 не выявлена и в опытах in vitro в органной культуре кожи куриного эмбриона.
На линии М-22 приготовлены экспериментальные серии живой коревой вакцины с вакцинным штаммом ЭШЧ. На клетках линии М-22 активно размножается отечественный вакцинный штамм краснухи «Орлов-Д», вакцинные штаммы Сэбина вируса полиомиелита, клещевого энцефалита. Линия М-22 успешно применяется для лечения ожоговых ран в НИИ Скорой помощи им. Н.В. Склифосовского (Патент на изобретение № 2373944 от 27.11.09).
Таким образом, созданный банк линии 4647 полностью удовлетворяет рекомендациям ВОЗ. Отмечено, что все изученные характеристики клеток оставались стабильными в течение срока наблюдений (40 пассажей). Показано, что линия 4647 свободна от посторонних агентов, не обладает онкогенной активностью, чувствительна к заражению различными вирусами, в том числе к ряду вакцинных штаммов. С использованием клеток 4647 выпущены производственные серии вакцины против чумы плотоядных. Созданы экспериментальные серии вакцин против полиомиелита, клещевого энцефалита, диагностикумы клещевого и японского энцефалитов, лимфоцитарного хориоменингита.
В ГНЦ ВБ «Вектор» приготовлена вакцина против гепатита А «Геп-А-инВАК». Здесь же запланировано производство рекомбинантной бивакцины против натуральной оспы и гепатита В. Группа авторов (12 человек) сообщила о создании посевного и рабочего банков культуры клеток 4647. Показано, что культура клеток в составе этих банков имеет высокую пролиферативную активность, типичную для линии 4647 морфологию, биологические свойства и характерные для клеток африканской зеленой мартышки кариотип и энзимограмму. Линия не контаминирована бактериями, грибами, микоплазмами, вирусами, в том числе и онкогенными. Планируется использование рекомбинантного штамма вируса вакцины в 7, 5S2-S и гепатита В перорального применения (в таблетированной форме) (4).
Таким образом, мы владеем потентным криобанком культур клеток человека и животных, которые могут быть успешно применены в широкой вирусологической практике. Неудовлетворительное использование имеющихся линий клеток наносит, на наш взгляд, необъяснимый ущерб национальному здравоохранению и замедляет прогресс в деле разработки методов диагностики и средств для профилактики вирусных инфекций.
Культура клеток линии vero чем опасна для человека
Геморрагическая лихорадка с почечным синдромом, вызываемая хантавирусами, занимает в Российской Федерации ведущее место среди зоонозных вирусных инфекций и одно из первых мест среди всех природно-очаговых болезней человека [3]. В связи с отсутствием лабораторной модели экспериментальных животных, чувствительных к размножению большинства хантавирусов, для выделения и культивирования этих вирусов активно используются клеточные культуры. Вместе с тем, хантавирусы, относящиеся к семейству Bunyaviridae, имеют характерные для большинства представителей этого семейства закономерности, связанные с трудностями их адаптирования к размножению в культурах клеток [2], прочной внутриклеточной ассоциацией и низким выходом вируса в культуральную жидкость. В обычных условиях культивирования хантавирусы не оказывают видимого цитопатического действия (ЦПД) на культуру клеток, в то время как в условиях искусственного закисления среды наблюдалось ЦПД в виде синцития [7].
Целью настоящего исследования явилось исследование морфологических характеристик вируса Пуумала, а также внутриклеточных структур клеток Vero E6, в процессе репликации в них вируса.
Материалы и методы
Исследования выполнены на модели хантавируса Пуумала, штамм K-27/Уфа-85. Вирус размножали в монослое клеток почки зеленой мартышки VeroE6 ( ATCC No. CRL-1586). Для роста клеток использовалась среда Игла MEM с добавлением 5% телячьей сыворотки и 200 мкг/мл канамицина. Титр вируса определяли методом индикации инфекционных фокусов в культуре Vero E6 [1].
Для морфологического исследования монослой клеток (зараженных, а также не зараженных) покрывали слоем фиксатора (глютеральдегид 2,5 % и параформальдегид 2,0% на буфере Хенкса) толщиной 1,5-2 мм и выдерживали в течение 30 минут. После ополаскивания буфером 3 раза по 5 минут стерильным шпателем клетки переносили в центрифужные пробирки и ресуспензировали в 1% растворе четырёхокиси осмия (OsO4) на буфере Хенкса для фиксации в течение часа. Клетки отмывали от фиксатора в трёх сменах буфера в течение 10 минут и обезвоживали в ацетоне восходящей концентрации (50%, 70%, 100%). Осадок клеток, полученный путём центрифугирования при 4000 об/мин в течение 10 минут, пропитывали в смеси эпоксидных смол эпон-аралдит с окисью пропилена, заключали в чистую смолу и полимеризовали при 55оС в течение 48 часов. С полученных блоков на ультрамикротоме изготавливали полутонкие срезы для светооптического изучения и ультратонкие срезы для исследования в электронном микроскопе JEM-100C. Полутонкие срезы окрашивали толуидиновым синим, а ультратонкие 1% раствором уранилацетата и цитратом свинца.
Результаты
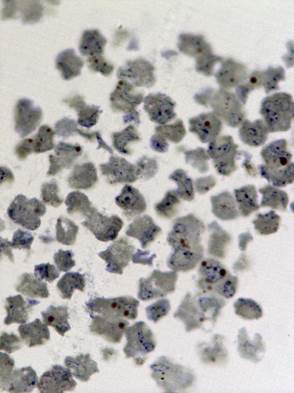
Изучению патологических изменений культуры клеток при её заражении хантавирусом предшествовали исследования незаражённой культуры. При светооптическом исследовании полутонких срезов был выявлен клеточный полиморфизм, отражающий процессы созревания, инволюции и разрушения клеток (Рис. 1а).
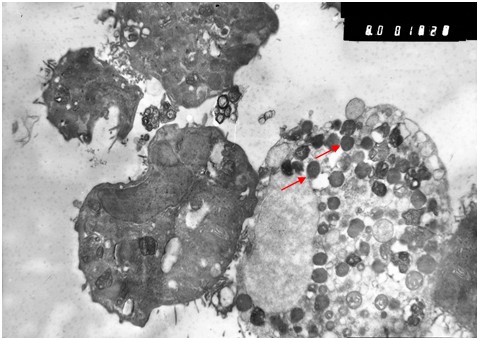
Исследование зараженной культуры клеток в световом микроскопе на ранних сроках (3 суток) после инфекции, показало, что и в этом случае наблюдаются естественные процессы клеточной инволюции, практически не отличимые от таковых в незараженной культуре (Рис. 1б). При электронно-микроскопическом исследовании незараженных культур был обнаружен широкий спектр клеток, находящихся на разных стадиях жизненного цикла. Встречаются молодые небольшого размера клетки без признаков каких-либо нарушений и клетки на различных этапах деградации (деградация внутриклеточных структур, появление множественных вторичных лизосом (цитосегресом), набухание и изменение цитоплазмы, внутриклеточная гидратация в виде многочисленных вакуолей) (Рис. 2). Наряду с этим можно наблюдать клетки с полным разрушением цитоплазмы и клеточной оболочки.
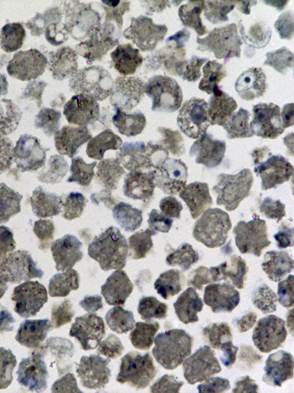
Рис. 1. Светооптическое исследование полутонких срезов культуры VeroE6.
а) нативная культура б) культура, зараженная вирусом Пуумала. Увеличение 20х60
Таким образом, в незаражённой культуре клеток Vero E6 наблюдаются естественно протекающие процессы инволюции, которые при изучении заражённой культуры можно было бы принять за патологические изменения, вызванные хантавирусом.
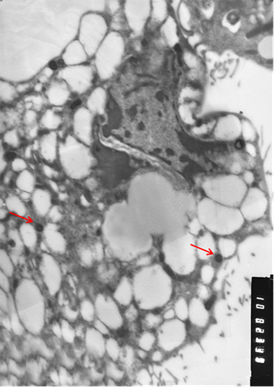
При электронно-микроскопическом исследовании зараженной культуры, была получена картина, аналогичная картине при микроскопии незараженной культуры. Было отмечено, что на ранних сроках заражения встречаются молодые клетки, клетки в состоянии частичного распада и полной деградации у которых отмечается вакуолизация цитоплазмы, распад внутренней мембраны митохондрий, резкое просветление цитоплазматического матрикса и отсутствие рибосомального аппарата (Рис. 3).
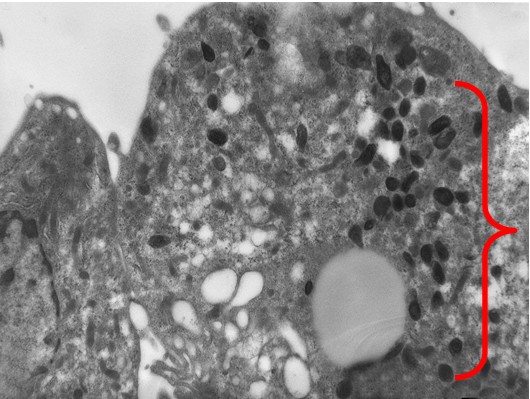
При более длительном культивировании (7 суток) состояние заражённых клеток мало отличалось от 3-х суточной культуры. Вместе с тем, в этот период появлялись клетки с гораздо большим содержанием вирионов в цитоплазме (Рис. 4). Для сравнения следует указать, что титр вируса на 3 сутки составлял 3,6±0,4 lgФОЕ/мл, а на 7 сутки достигал максимальных показателей: 5,7±0,4 lgФОЕ/мл. В эти сроки наряду с вирионами в цитоплазме молодых и высокодифференцированных клеток обнаруживались вторичные лизосомы, состоящие преимущественно из миелиноподобных ламелл небольшого размера (150-200 нМ).
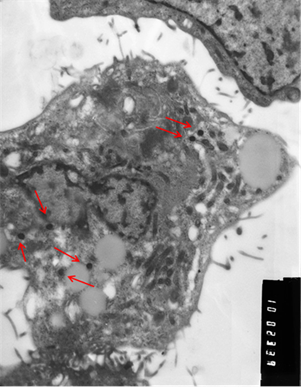
Рис. 3. Клетки, зараженные вирусом Пуумала. а) молодая клетка; б) разрушающаяся клетка. Вирионы хантавируса обозначены стрелкой. Увеличение х 10 тыс.
Визуально вирионы имели не только округлую, но и эллипсовидную форму размером около 90 нм в поперечнике и до 300 нм в длину. По абсолютно нормальной (без признаков патологии) картине клетки, представленной на иллюстрации, и большому количеству вирионов можно предположить, что в её цитоплазме вирус активно размножается. Следует отметить, что и при длительной инкубации заражённой культуры клеток инволютивные процессы протекают в культуре независимо от количества вирионов в цитоплазме и, скорее всего, не связаны с процессами вирусной репликации.
Рис. 4. Культура клеток Vero E6 на 7-е сутки после заражения. Большое количество вирионов хантавируса в цитоплазме (скобка). Увеличение х 10 тыс.
Обсуждение
Морфология хантавирусов впервые была описана для вируса Хантаан в 1982 году при негативном контрастировании вирусных частиц из вируссодержащей жидкости и лизата зараженных клеток, очищенных и сконцентрированных в градиенте плотности сахарозы [8, 10]. Применение этой методики позволило авторам представить описание вирионов, включая наличие шипиков на внешней оболочке и размеры вирионов от 90 до 120 нм, ставшие таксономическими характеристиками нового рода, получившего одноименное название. В последующих работах с применением электронной микроскопии основное внимание было уделено исследованиям, направленным на изучение морфологии вновь выделенных хантавирусов Нового света, включая механизмы созревания вирионов на клеточных мембранах [5, 9]. Позднее методом крио-электронной микроскопии вируса Хантаан было подтверждено, что вирионы имеют сферическую форму, однако средний диаметр их был определен в диапазоне от 120 до 154 нм (в среднем 130 нм) [4].
Результаты наших исследований выявили определенные отличия морфологии хантавируса Пуумала, вызывающего около 98 % случаев ГЛПС в России, от аналогичных характеристик, других патогенных хантавирусов, включая вирус Хантаан. Так, особенностью вирионов, наблюдаемых на ультратонких срезах зараженной культуры, является гетерогенность их формы (округлые и эллипсовидные) и размера (от 90 до 300 нм). Вариации в размере вирусных частиц могут объясняться особенностями методического подхода – диаметр вируса существенно больше толщины среза, поэтому размер вирусной частицы зависит от плоскости среза. Однако впервые были обнаружены вирионы хантавируса Пуумала вытянутой эллипсовидной формы с максимальным размером около 300 нм. Похожие результаты были получены ранее при электронной криотомографии вируса Тула, непатогенного хантавируса наиболее близкородственного вирусу Пуумала [6]. Было показано, что размер и форма вирионов вируса Тула значительно варьировали, наблюдались сферические частицы размером 120-160 нм и продолговатые вытянутые частицы с диаметром 80 нм в поперечнике и максимальной длиной около 350 нм. Можно предположить, что наличие вирионов вытянутой формы, длина которых почти вдвое превышает ранее описанный средний диаметр хантавирусных вирионов [4, 5, 8, 9, 10], является уникальной особенностью, присущей, по крайней мере, двум близкородственным хантавирусам – Пуумала и Тула, адаптированным к размножению в культуре Vero E6.
Впервые предпринята попытка охарактеризовать состояние клеточной культуры в процессе репликации в ней хантавирусов. Ранее было отмечено отсутствие цитопатических изменений, наблюдаемых in vitro в световом микроскопе при репликации вируса Пуумала в культуре Vero E6, на протяжении 57 дней культивирования с периодической сменой питательной среды. Количество накапливаемого в среде вируса после достижения пиковых значений на 7-9 сутки снижалось и поддерживалось до конца эксперимента на уровне 3,5±0,5 lg ФОЕ/мл (неопубликованные данные). При исследовании ультратонких срезов как незаражённой, так и зараженной культуры клеток Vero E6 наблюдаются естественно протекающие процессы инволюции, которые при изучении заражённой культуры можно принять за патологические изменения, вызванные хантавирусом.
Таким образом, методом электронной микроскопии ультратонких срезов культуры клеток Vero E6, инфицированной вирусом Пуумала показано, что проникновение в клетку и репликация в ней хантавируса не вызывают патологических изменений.
Рецензенты:
Ожерелков С.В., д.б.н., заведующий лабораторией вирусных препаратов и иммуномодуляторов, ФГБНУ «Институт полиомиелита и вирусных энцефалитов им.М.П. Чумакова», г. Москва;
Хапчаев Ю.Х., д.б.н., начальник отделения полиомиелитной вакцины ФГУП «ПИПВЭ им. М.П. Чумакова», г. Москва.