кровь на мутацию при онкологии что показывает
Что показывают онкомаркеры
Онкомаркеры – это органические вещества (белки), количество которых увеличивается при развитии раковых клеток в организме человека. Что показывают онкомаркеры? Количество данных веществ помогает выявить наличие злокачественных опухолей и провести контроль эффективности лечения. Онкомаркеры позволяют диагностировать рак на ранних сроках и примерно определить нахождение опухолевого образования.
Что показывают онкомаркеры и как правильно сдавать анализ

• узнать входит ли пациент в зону риска;
• примерно выявить пораженный орган;
• заподозрить рецидив онкологии;
При получении результатов анализа на онкомаркеры особое внимание стоит обратить:
• на повышенные показатели;
• на вид повышенного онкомаркера.
Изменения в показателях говорят, что в организме человека присутствуют отклонения от нормы, в том числе это могут быть прогрессирующие раковые клетки. Основным преимуществом анализа является то, что онкомаркеры показывают наличие онкологического заболевания на ранних сроках, что очень важно для эффективности лечения.
Правила сдачи анализа:
— кровь сдают из вены натощак, исключая прием пищи за 8 часов до процедуры;
— анализ проводится до 11 часов утра;
— за три дня до сдачи анализа прекращают прием алкоголя и вредной пищи, снижают физические нагрузки;
— в день анализа запрещено курить и принимать лекарственные средства;
— сдавая анализ на ПСА, воздерживаются от половой связи в течение семи дней.
Онкомаркеры обнаруживают в крови, моче детей, молодых, взрослых и пожилых пациентов. В большинстве случаев такой анализ показывает наличие раковых клеток на полгода раньше, чем другие методы диагностики.
Важно, что онкомаркеры показывают даже малейшие изменения и помогают решить следующие задачи:
1. Прослеживание эффективности терапии, что позволяет в некоторых случаях сменить схему лечения или поменять препараты.
2. Отслеживание рецидивов новообразования, слежение за появлением новых метастаз. Это поможет начать вовремя повторное лечение и не упустить болезнь.
3. Анализ поможет решить, какие методы терапии стоит использовать.
4. Онкомаркер помогает оценить, насколько орган поражен раковыми клетками, степень прогрессирования, что способствует подбору более адекватной схемы лечения.
5. Анализ помогает оценить, как проходит ремиссия и сделать прогноз продолжительности жизни пациента.
Кому и когда необходим анализ

• после сильных нервных перенапряжений;
• при проживании в неблагоприятных экологических условиях;
• при других обстоятельствах, которые могут стать причиной заболевания онкологией.
Чаще делать скрининговые тесты рекомендуют людям:
• с поставленным диагнозом;
• с пролеченной злокачественной опухолью;
• при первичном обнаружении новообразования;
• перед и после операции;
• во время проведения курса терапии.
Вылечившимся рекомендуют проверять уровень онкомаркеров в течение 3-х лет после того, как лечение окончено:
1. Первый год – каждый месяц.
2. Второй год – 1 раз в два месяца.
3. Третий год – 1 раз в три месяца.
Последующие годы сдают анализ каждые полгода. Перед скрининговыми действиями пациент должен посетить врача- онколога, который выяснит, на какие маркеры надо сдавать анализ.
Норма: до 10 нг/мл. Что показывают онкомаркеры АФП? Патологические результаты анализа могут указывать на онкологические заболевания:
— печени;
— желудочно-кишечного тракта;
— яичников;
— яичек;
— почек.
На точность теста могут оказать влияния заболевания:
• сахарный диабет;
• многоплодная беременность;
• гепатит;
• почечная недостаточность.
Низкие показатели у беременной женщины могут говорить о риске патологии плода.

Норма: до 6,3 нг/мл. Небольшое увеличение норм РЭА определяется у курильщиков. При высоких показателях маркера есть риск новообразований в следующих органах:
— пищеварительный тракт;
— молочная железа;
— простате;
— печени;
— легких.
Анализ РЭА рекомендуют проводить, если были замечены:
• одышка, беспричинный кашель;
• появление видимой опухоли;
• хроническая усталость;
• необоснованный упадок сил;
• потливость;
• длительное повышение температуры тела;
• снижение веса;
• появление новых родинок;
• понижения аппетита или полное нежелание есть с приступами тошноты и рвоты;
• нарушения в работе пищеварительного тракта.
CA 125
Этот онкомаркер является показателем рака яичника.
Норма: от 0 до 30 МЕ/мл. Показания вне нормы говорят об онкологии:
— женских половых органов;
— дыхательных органов;
— ЖКТ.
CA 15-3
Маркер новообразований в молочной железе.
Норма: от 9,2 до 38 Ед/л. Что показывают онкомаркеры если показатель завышен? Как правило, это подозрение на рак:
• молочной железы;
• пищеварительного тракта;
• печени;
• органов дыхания.
Также это может указывать на воспалительную патологию в районе желчевыводящих органов и развитие аутоиммунных нарушений.
CA 19-9
Маркер характерен для патологии ЖКТ.
Нормой является: от 0 до 37 Ед/мл. Превышение нормы в большинстве случаев указывает на новообразования в:
• желчном пузыре;
• поджелудочной железе;
• печени;
• органах, пищеварительного тракта.
CA 72-4
Дает исчерпывающую информацию при саркоме желудка, яичников, легких.
Норма: до 6,7 Ед/мл. Высокие значения указывают на то, что развиваются раковые клетки в:
• матке;
• желудке;
• молочных железах;
• яичниках;
• поджелудочной железе;
• печени.
CYFRA 21-1
Показывает на рак мочевого пузыря, легких. Анализ на CYFRA 21-1 в большинстве случаев назначается совместно с РЭА.
• мочеполовой системе;
• органах дыхания.
Повышенный онкомаркер (ПСА)
ПСА является белком, который выделяет предстательная железа. Онкомаркер поможет определить опухоль простаты, аденому. Анализ применяют для контроля проводимой терапии.
Норма: до 4,1 нг/л. Если норма превышена, то онкомаркеры показывают наличие злокачественной патологии в простате. Специалисты рекомендуют представителям мужского пола после 50 лет сдавать анализ на простат-специфический антиген ежегодно. Это поможет выявить заболевания предстательной железы на ранних сроках, что упростит терапию и сделает ее максимально эффективной.
Чтобы правильно подготовиться к анализу, необходимо:
• за 10 часов отказаться от употребления питания, рекомендуют чистую, негазированную воду, остальные напитки исключают;
• два дня надо придерживаться диеты;
• не стоит заниматься спортом и максимально нагружать себя несколько дней.
• семь дней не проявлять половую активность.
Диагностика на ПСА необходима:
• при диагностировании аденомы простаты;
• при контроле эффективности назначенной терапии;
• при выявлении рака на первой стадии.
Повышенный онкомаркер ПСА может быть не только при онкозаболеваниях, но и в других случаях:
— наличие аденомы простаты;
— проблемы с потенцией;
— если есть нарушения в процессе мочеиспускания;
— во время долгой езды на велосипеде по плохой дороге.
Очень важно знать, что небольшие отклонения показателей онкомаркеров могут говорить о доброкачественных процессах в организме человека, например, о воспалении. Повышенный онкомаркер не может говорить о 100% наличии онкологии, а дает информативный повод продолжить углубленное обследование больного. Проводить скрининговый тест на все виды маркеров не стоит, просто надо обратиться к специалисту и он уже решит, какие анализы необходимы.
Для подбора эффективного метода лечения вы можете обратиться за
— методы инновационной терапии;
— возможности участия в экспериментальной терапии;
— как получить квоту на бесплатное лечение в онкоцентр;
— организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
BRCA1 и BRCA2: что делать, если обнаружена мутация в этих генах?
Несмотря на множество теорий развития злокачественных опухолей специалисты и сегодня нередко затрудняются ответить на вопрос, почему развивается рак того или иного органа. Однако уже не вызывает сомнений тот факт, что некоторые его разновидности могут быть связаны с наследственной предрасположенностью, выявить которую позволяет специальное генетическое исследование.
Анализ BRCA1 и BRCA2. В каких случаях и для чего его проводят? Об этом и многом другом мы беседуем с врачом-акушером-гинекологом «Клиника Эксперт» Курск Татьяной Ивановной Еремеевой.
— Татьяна Ивановна, среди названий исследований, проводимых при подозрении на онкологическое заболевание, упоминаются такие аббревиатуры, как BRCA1 и BRCA2. Что они означают?
— Так называются гены, которые выступают в роли опухолевых супрессоров. Это значит, что они являются своеобразными «контролёрами», препятствующими неконтролируемому и нарушенному процессу деления клетки. Если в этих генах появляются мутации, то гены утрачивают способность отслеживать изменения в геноме клетки, а это, в свою очередь, может привести к атипичным трансформациям в клетках и развитию злокачественных опухолей.
— То есть получается, что можно унаследовать эти гены с такими мутациями и, соответственно, иметь повышенный риск развития опухоли?
— Да, это возможно. Если дети получают повреждённые гены BRCA1 и BRCA2 от родителей, то у них возрастает риск возникновения рака молочной железы, рака яичников и ряда других разновидностей злокачественных новообразований. Однако следует помнить, что ребёнок получает половину генома от матери, а вторую часть от отца, поэтому вероятность передачи генов с дефектами равна 50 % и она не зависит от пола ребёнка (то есть мутировавший ген может получить как девочка, так и мальчик).
— Может ли мутация встречаться лишь в одном из этих генов?
— Да, может. На сегодняшний день изучено более двух тысяч разновидностей мутаций в генах BRCA1 и BRCA2. На практике можно встретить как сочетанные дефекты обоих генов, так и изолированные повреждения одного из них. Среди населения нашей страны превалируют мутации в гене BRCA1 – они составляют около 80 % от общего количества повреждений в обоих генах. Причём здесь гораздо чаще встречаются повторяющиеся мутации, тогда как большинство дефектов гена BRCA2 уникальны.
— Кому и в каких случаях необходимо сдать анализ на мутации BRCA1 и BRCA2? Судя по тому, что вы сказали ранее, это не всегда только женщины?
— Да, верно. Такую диагностику проводят и мужчинам. Связано это с тем, что повреждение генов BRCA1 и BRCA2 указывает на высокую вероятность развития не только рака молочных желез или яичников, но и злокачественных новообразований других органов, в частности, рака поджелудочной железы, желудка, кишечника и других.
К примеру, если у мужчины обнаружена мутация гена BRCA1, это может говорить о высоком риске развития рака простаты. Согласно зарубежным исследованиям любые BRCA-мутации повышают вероятность развития нескольких разновидностей опухолей у мужчин в 8 раз. Поэтому такой вид диагностики для них также актуален.
Необходимость в определении мутации генов BRCA1 и BRCA2 возникает тогда, когда пациент (независимо от того, мужчина это или женщина) принадлежит к группе риска. Вероятность наследственной предрасположенности высока, если:
— Татьяна Ивановна, расскажите, пожалуйста, о процедуре проведения исследования на мутации в генах BRCA1 и BRCA2
— Начну с того, что прежде, чем сдать анализ на выявление повреждений в BRCA1 и BRCA2, проводится консультация с врачом-генетиком. Доктор информирует пациента о содержании проводимого исследования, а также о значении положительного и отрицательного результатов. Это делают с целью психологической подготовки пациента к возможному результату.
В качестве материала для генетического анализа служит кровь. Специальной подготовки перед сдачей анализа не предусмотрено. В нашей стране это исследование проводят методом ПЦР (полимеразной цепной реакции).
Подробнее о методе ПЦР читайте в нашей статье: Диагностика инфекций методом ПЦР: что это такое?
— Предположим, что анализ выявил мутацию. Что человеку делать дальше?
— Следует вновь обратиться к врачу-генетику. Если обнаружены мутации в BRCA1 и/или BRCA2, специалист даст пациенту необходимые рекомендации по дальнейшей профилактике онкологических заболеваний.
Важно помнить, что выявление подобных генетических дефектов – это не диагноз. Наличие повреждений в этих генах указывает только на возможность развития онкологической патологии в молочных железах или других органах. Хочу также заметить, что положительный анализ не позволяет утверждать, что мутация генов непременно обнаружится у всех близких родственников (мамы, дочери, тёти).
С другой стороны, отрицательный результат не означает, что у пациента никогда не разовьётся опухолевый процесс. В таком случае нет лишь повышенного риска развития злокачественного новообразования вышеуказанных органов.
Подчеркну, что независимо от результатов диагностики на наличие повреждений в генах BRCA1 и BRCA2 не отменяются, в частности, регулярные скрининговые меры профилактики рака молочной железы у женщин – это консультация врача-маммолога и проведение маммографии.
Беседовала Севиля Ибраимова
Редакция рекомендует:
Для справки:
Еремеева Татьяна Ивановна
Анализ генов BRCA1 и BRCA2 для выявления синдрома наследственного рака молочной железы и яичника
Одним из самых частых видов семейных опухолей является наследственный рак молочной железы (РМЖ), он составляет 5-10% от всех случаев злокачественного поражения молочных желез. Часто наследственный РМЖ связан с высоким риском развития рака яичника (РЯ). Как правило, в научной и медицинской литературе используют единый термин «синдром РМЖ/РЯ» (breast-ovarian cancer syndrome). Причем, при опухолевых заболеваниях яичника доля наследственного рака даже выше, чем при РМЖ: 10-20% случаев РЯ обусловлены присутствием наследственного генетического дефекта.
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Гены BRCA1 и BRCA2 играют ключевую роль в поддержании целостности генома, в частности в процессах репарации (восстановления) ДНК. Мутации, затрагивающие эти гены, как правило приводят к синтезу укороченного, неправильного белка. Такой белок не может правильно выполнять свои функции – «следить» за стабильностью всего генетического материала клетки.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
 |  |
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
Однако для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»). Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG. Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
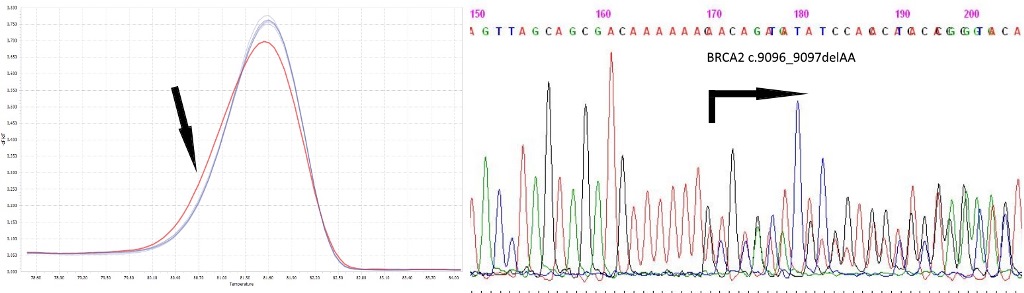
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации BRCA1 и BRCA2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
 |  |
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
Как предрасположенность к РМЖ и РЯ передается по наследству.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.
Учеными было доказано, что для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»). Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG. Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
И, в заключение, наглядная инфографика «Синдром наследственного рака молочной железы и яичников». Автор — Кулигина Екатерина Шотовна, к.б.н., старший научный сотрудник Научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Авторская публикация:
АЛЕКСАХИНА СВЕТЛАНА НИКОЛАЕВНА,
лаборант-исследователь научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Молекулярно-генетическое исследование опухоли для подбора терапии
Молекулярно-генетические исследования опухоли помогают получить диагностические, предиктивные и прогностические данные для выбора эффективной терапии путем геномного профилирования опухоли. Онкогенотесты позволяют врачу подбирать индивидуальное лечение, диагностировать сложные случаи и предсказать возникновение наследственного рака.
Что определяет метод молекулярно-генетического тестирования опухоли?
Рост клетки контролируется как скорость автомобиля. Ряд генов кодирует молекулы, которые “давят на газ”. При мутации они не прекращают работу, заставляя клетку делиться без остановки. Другие гены кодирует молекулы-“тормоза”, и при их поломке деление клеток, становится неконтролируемым. Молекулярно-генетическое исследование опухоли позволяет обнаруживать такие мутации.
Мутации всегда наследуемы?
Большинство случаев рака вызывается приобретенными в течении жизни мутациями. Их вызывает контакт с, например, сигаретным дымом, радиацией, некоторыми химикатами. Некоторые мутации не имеют чёткой причины и происходят случайно, при делении клеток. Поэтому, даже если человек родился со здоровыми генами, некоторые из них могут измениться в течение жизни. Молекулярно-генетические методы позволяют выявить опухоль на ранней стадии благодаря обнаружению “поломок”.
Почему существует семейная предрасположенность к опухолям?
По современным представлениям, одной единственной мутации в клетке недостаточно. Однако, если пациент уже унаследовал мутацию от родителей, то это ускоряет накопление достаточного количества мутаций для появления злокачественного процесса. Благодаря онкогенотесту возможно узнать о наличии мутации до появления опухоли.
Какие виды исследований ткани опухоли существуют?
Исследования позволяют определить генетический и молекулярный профиль опухоли. Иммуногистохимический тест и флуоресцентная гибридизация in situ (FISH) помогают обнаружить “мутированные” клетки. Генетические тестирования опухоли (ПЦР, секвенирование) применяются для детального анализа последовательности ДНК и выявления мутации.
Какой материал опухоли исследуют?
Для проведения молекулярно-генетического исследования опухоли принимают фиксированный в формальдегиде материал после биопсии опухоли или её метастазов, а также готовые стекла и парафиновые блоки. О деталях процедуры уточнит специалист.
Как исследуют ткань опухоли?
Для чего применяется FISH-метод?
Флуоресцентная гибридизация in situ (FISH) по особому свечению помогает определить хромосомные аномалии в опухолевых клетках. Данное молекулярно-генетическое исследование применяется для обнаружения мельчайших генетических изменений, недоступных для нахождения иными способами.
Что представляет собой геномное профилирование опухоли?
Геномное профилирование опухоли заключается в “разложении на буквы” (секвенировании) ключевых онкогенов. Технология основана на выявлении генетических мутаций злокачественных клеток. В ходе комплексного профилирования выявляются все нарушения, которые могут быть связаны с онкологическими патологиями, оценивается их значимость.
Что такое таргетная терапия?
Это новое поколение противоопухолевых препаратов, которые атакуют конкретные “мишени”, запускающие опухолевый процесс. Лекарства действуют на пораженные клетки, не трогая здоровые. Для подбора терапии необходимо генетическое тестирование опухоли.
Можно ли назначать таргетное лечение без генетического тестирования опухоли?
Применение «таргетных» препаратов, действующих непосредственно на молекулярную мишень в опухолевой клетке, требует обязательного генетического тестирования, определяющих эффективность терапии. Как правило, доступные для атаки “мишени” несут не все опухоли, а лишь часть случаев. Поэтому нужно сначала обнаружить наличие “мишени” в опухоли, и только затем назначать препарат.
Каким пациентам показано исследование опухолевой ткани?
Исследование показано большинству пациентов для качественной диагностики и лечения, а также выбора терапии из нескольких вариантов; В сложных случаях (при затруднении диагностики или без выявленного первичного очага); Пациентам, которым перестало помогать лечение, назначенное ранее; Пациентам с диагностированным раком, для которого нет клинических стандартов лечения.
Если в образце ткани выявлена мутация, что делать далее?
После проведения комплексного молекулярно-генетического исследования, сбора и анализа всей информации и оформления заключения, пациент получит информацию, которая необходима врачу-онкологу для назначения или коррекции терапии с учетом информации о молекулярном и геномном профиле опухоли. Иногда значимых мутаций выявить не удается. Тем не менее, эта информация также будет полезна лечащему врачу при выборе тактики лечения и назначения дополнительных методов диагностики.
Что получает пациент после прохождения молекулярно-генетического исследования опухоли?
Пациент получает врачебное заключение с по генетическим нарушениям и молекулярным биомаркерам его опухоли, рекомендации по потенциально эффективным/неэффективным или токсичным препаратам.
Какую информацию получает врач по результату исследования?
Геномное профилирование опухоли позволяет врачу персонализировать лечение и получить результат лучше, чем стандартное лечение. Онкогенотест также помогает снизить риск осложнений при лечении и исключить неэффективные в конкретном случае препараты.
Помогают ли методы для прогноза текущего лечения и вероятности рецидива?
Конечно. Генетическое тестирование опухоли помогает выявить персональные риски и скорректировать текущее лечение в случае его неэффективности. После тестирования пациент узнает, повышен ли у него риск повторного заболевания, в каком органе, какие меры профилактики необходимо предпринять.
В чем преимущества геномного тестирования опухоли?
Геномное тестирование позволяет врачу-онкологу назначать эффективную терапию индивидуально для каждого пациента. Классическое назначение лекарств не уточняет персональный «вид» опухоли, а назначается или эмпирически, или «атакует» все клетки организма разом. Тестирование позволяет врачу опираться не на чаще назначаемые при данной патологии препараты, а выбирать препараты, которые при наличии мутации дадут положительный эффект.
Есть ли необходимость в сдаче крови?
Исследования на основе периферической крови возможны в том случае, если тканевая биопсия невозможна, количество опухолевой ткани является недостаточным для анализа или есть подозрения на метастазирование и прогрессирование. В таком случае производится геномное профилирование опухоли на основе образца крови. Также на основе крови осуществляется поиск наследственных и приобретенных мутаций для предупреждения заболевания.
Кому показан онкогенотест без наличия обнаруженной опухоли?
Онкогенотест важен для раннего выявления наследственных форм рака. Также тест будет важен лицам, перенесшим заболевание раннее или имеющим пороки развития. Не стоит забывать, что мутации могут возникать спонтанно в течении жизни, поэтому их раннее обнаружение позволяет не пропустить начало заболевания.
При генетическом тестировании целиком разбирается весь ген?
При генетическом тестировании исследуют только определенные участки генов, которые чаще всего «замечены» в наличии значимых мутаций. Нет необходимости «разбирать» ген целиком, так как цена исследования будет значительно выше, скорость выполнения дольше, а клиническая ценность остается сомнительной.
Существует ли возможность узнать свою предрасположенность к развитию опухолей?
Часть случаев рака имеют наследственную природу. Это значит, что человек унаследовал сломанный ген, повышающий риск заболевания. Геномное профилирование опухоли определяет наличие онкологической предрасположенности и заблаговременно проводит профилактические мероприятия по раннему выявлению опухоли здоровым людям с неблагоприятной наследственностью в генах, вовлеченных в канцерогенез.
Как генетическое тестирование выявляет предрасположенность к наследственным формам рака?
Тест проверяет известные гены, защищающие нас от рака, на наличие мутаций, и определяет риск появления заболевания. Часть случаев рака имеют наследственную природу.
Чем поможет раннее выявление предрасположенности к наследственным формам рака?
Стоит ли родственникам проходить генетическое тестирование при обнаружении у пациента опухоли?
Какой рак чаще всего является наследуемым?
Всего известно около девяти распространенных и множество редких онкологических заболеваний, вероятность развития которых увеличена у носителей наследственных мутации. К самым распространенным наследуемым формам относятся рак желудка, яичников, молочной, поджелудочной, щитовидной и предстательной желез, колоректальный рак, меланома.
Что позволяет заподозрить наследственную форму рака?
Можно задуматься о наследственной форме рака при возникновении нескольких случаев одного типа рака в семье. Также насторожить может возникновение рака в каждом из парных органов, или рак, нехарактерный для данного пола. Опухоль появляется чаще всего в более раннем возрасте, чем при «спонтанной» мутации. Несколько типов рака у родственника также могут помочь заподозрить наследственную форму.
Если у родителей нет онкологии, значит и у ребенка не будет наследуемого рака?
Список литературы
Wishart DS. Is Cancer a Genetic Disease or a Metabolic Disease?. EBioMedicine. 2015;2(6):478 479. Published 2015 May 23. doi:10.1016/j.ebiom.2015.05.022
K.V. Shelekhova, A.S. Konstantinov.Morphological methods of malignant tumors investigation. Практическая онкология. Т. 18, No4 – 2017
Vnencak-Jones, C., M. Berger, W. Pao. 2016. Types of Molecular Tumor Testing. My Cancer Genome
Sokolenko AP, Imyanitov EN. Molecular Diagnostics in Clinical Oncology. Front Mol Biosci. 2018;5:76. Published 2018 Aug 27. doi:10.3389/fmolb.2018.00076