краниокаудальный размер печени что это
Краниокаудальный размер печени что это
Большое разнообразие анатомических вариантов положения и формы печени приводит к довольно значительной вариабельности ее линейных размеров, что может привести к ложной информации относительно размеров органа в целом и отдельных сегментов в частности [11].
Различают следующие три основных положения печени в брюшной полости: вентропетальное (anteflexio), дорсопетальное (retroflexio) и промежуточное. При вентропетальном положении передний край печени опущен книзу, при дорсопетальном ‒ печень приближается к задней брюшной стенке и нижняя поверхность ее открыта кпереди так, что хорошо видны все доли, а также желчный пузырь; промежуточное положение является средним между вентро- и дорсопетальным [3, 4].
Наблюдаются также смещения печени во фронтальной плоскости. При смещении печени вправо (декстропетальное положение) правая доля ее по средней подмышечной линии выступает из-под правого подреберья и иногда достигает гребня подвздошной кости. При смещении печени влево (синистропетальное положение) левая доля ее распространяется на несколько сантиметров кнаружи от левой среднеключичной линии.
Однако, несмотря на то, что в доступной литературе широко применяется вышеизложенная классификация [3, 4, 11], нами не найдено данных, характеризующих линейные параметры печени в целом, её правой и левой долей в частности в зависимости от анатомического варианта расположения органа. Некоторые авторы считают размеры правой доли печени очень вариабельными и приводят только одно нормативное значение [1, 2, 7, 13]. Рекомендуемые параметры для измерения левой доли печени также сильно варьируют в зависимости от используемых руководств [6, 8, 12]. В настоящее время отсутствуют анатомические стандарты, позволяющие оценить положение печени, основываясь на биометрических показателях морфометрии печени обследуемых. Определение одного или нескольких линейных параметров печени без учета положения органа в брюшной полости не позволяет делать безошибочные выводы об истинных размерах органа.
В связи с вышеизложенным актуально определение линейных параметров печени и их соотношений, позволяющих сделать суждение о положении органа в брюшной полости. Необходимо сформировать нормативную базу линейных параметров органа с учетом положения органа в брюшной полости.
Цель работы – охарактеризовать линейные параметры печени в зависимости от положения органа в брюшной полости.
Материалы и методы исследования
В ходе проведения исследования было обследовано 92 человека обоего пола юношеского и первого периода зрелого возраста, не имевших на момент обследования патологии печени и сердечно-сосудистой системы. Средний возраст обследованных составил 31,92 ± 2,93, при этом средний возраст лиц мужского пола – 32,04 ± 2,69, а лиц женского пола – 31,54 ± 3,62. Всем обследованным была выполнена СКТ (спиральная компьютерная томография) органов брюшной полости на 64-срезовом компьютерном томографе Aquilion (Toshiba). После определения положения печени в соответствии с вышеописанной классификацией исследуемый контингент был разбит на шесть групп в зависимости от анатомического варианта положения органа в брюшной полости. В первую группу вошли лица с нормальным положением печени, во вторую лица с декстропетальным (dextropositio), в третью ‒ с синистропетальным (sinistropositio) положением печени, в четвертую и пятую группу были отнесены исследуемые с вентро- и дорсопетальным положением печени соответственно. В шестую группу вошли обследуемые с сочетанным смещением печени относительно сагиттальной и фронтальной плоскостей. Распределение обследованных по группам (табл. 1).
Измерялся латеролатеральный размер печени в целом, краниокаудальный (высота), переднезадний (толщина) и косовертикальный размер правой доли органа (измерения проводились по среднеключичной линии) и краниокаудальный и переднезадний размер левой доли органа. Обработка статистического материала проводилась на IBM PC\AT AMD Atlon 3200+ в среде Microsoft Windows XP Professional 2000 c использованием пакета прикладных программ «Statistica 6,0», «Microsoft Excel», «MedСalc», рекомендованных для статистического анализа медико-биологических данных [9, 10].
Распределение обследованных лиц в зависимости от положения печени
Краниокаудальный размер печени что это
Печень выполняет в организме ряд важных функций, является главным метаболическим центром для поддержания гомеостаза. Около 300 биллионов гепатоцитов здоровой печени функционируют как железы смешанной секреции, в них происходят тысячи биохимических реакций. Основными функциями печени являются: пищеварительная, белково-синтетическая, обменная (участие в обмене углеводов, липидов, витаминов, пигментов, белков), регуляция гемокоагуляции, иммунитета, барьерная функция, метаболизм гормонов [1].
По данным Всемирной организации здравоохранения (ВОЗ), в последние годы отмечается увеличение числа заболеваний печени в общей структуре хронических заболеваний, среди которых первые позиции занимает неалкогольная жировая болезнь печени (НАЖБП). Анализ литературных источников показал, что ее распространенность может составлять от 20 % до 40 %. В Российской Федерации частота выявления НАЖБП выросла в 1,5–2,0 раза [2]. НАЖБП включает в себя следующие клинико-морфологические формы: стеатоз, неалкогольный стеатогепатит и цирроз печени. Важным отличительным признаком неалкогольного поражения печени является отсутствие употребления пациентом алкоголя в гепатотоксической дозе: для мужчин это более 40 г/сут. чистого этанола, для женщин более 20 г/сут. [2].
Учитывая клиническую значимость НАЖБП, малосимптомность начальных стадий, важность своевременного лечения, необходимо сказать о современных методах диагностики заболеваний печени и правильной интерпретации данных. Среди прочих прижизненных методов диагностики патологии печени одно из главных мест занимает ультразвуковое исследование (УЗИ) как наиболее доступный, неинвазивный скрининговый метод.
Все вышесказанное определило цель данного обзора – описание современных возможностей ультразвукового метода и сонографических критериев диагноза НАЖБП, так как на фоне возросшей частоты фиброзно-цирротических поражений печени актуализируются вопросы своевременного выявления и лечения НАЖБП.
Все известные методы диагностики и верификации стеатоза печени, играющего значимую роль в патогенезе цирроза, можно разделить на инвазивные (биопсия печени), малоинвазивные (биохимические, серологические) и неинвазивные (ультразвуковая и компьютерная диагностика).
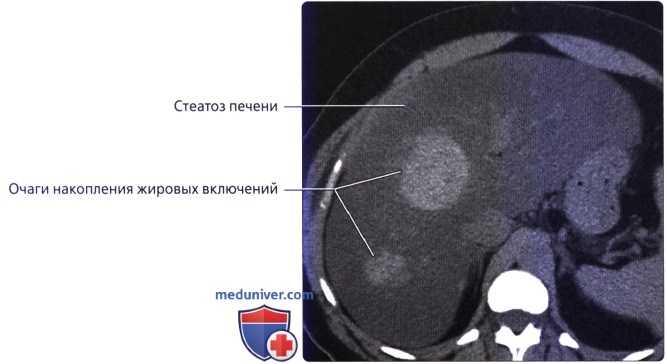
Стеатоз печени характеризуется повышенным накоплением жира в гепатоцитах, отличается от стеатогепатита отсутствием некроза гепатоцитов и воспалительной инфильтрации в строме. Анализ литературы позволил нам выделить несколько групп патогенных факторов, имеющих первостепенное значение в развитии патологии печени и влияющих на состояние ее паренхимы:
1) токсические факторы;
2) алиментарные факторы;
3) метаболические нарушения;
4) хроническая гипоксия [4].
При этом повреждение может проявляться в форме неалкогольного стеатоза или стеатогепатита.
По мнению ряда авторов, стеатоз развивается постепенно и в своем развитии проходит несколько стадий:
1) первоначальное накопление жиров в цитоплазме гепатоцита, которое не приводит к деструкции клетки, сохраняется ее внутренняя дифференциация;
2) развитие некробиоза клеток печени;
3) перестройка архитектоники печени и нарушение ее дольковой структуры [2, 4].
По данным морфологических исследований, возможно развитие мелкокапельной и крупнокапельной жировой дистрофии гепатоцитов. Более тяжелой формой является мелкокапельное повреждение, когда в цитоплазме клетки накапливаются включения фосфолипидов. Ядро клетки не смещается к периферии. При этом цитоплазма имеет пенистый вид. Такая перестройка клетки приводит к нарушению процессов окисления в митохондриях, дефициту энергии, некрозу клетки [5].
Наиболее частой формой повреждения гепатоцитов при стеатозе является крупнокапельная дистрофия, когда в цитоплазме появляются одна или две крупные капли нейтрального жира, смещающие ядро клетки к периферии. Такая морфологическая картина при отсутствии других признаков является основанием для постановки диагноза стеатоза. Морфологическая градация степени тяжести стеатоза осуществляется полуколичественным методом по количеству пораженных гепатоцитов в биоптате: 0 – менее 5 %; 1 – от 5 % до 33 %; 2 – от 33 % до 66 %; 3 – более 66 % [5, 6].
Применение биопсии печени целесообразно только в том случае, когда риск проведения данной манипуляции не превышает ее пользу для пациента. Безусловной альтернативой в данном случае являются неинвазивные методики.
Ультразвуковое исследование, выполненное на современном аппарате и включающее допплерографию сосудов печени с использованием цветового допплеровского картирования, импульсноволнового допплера, тканевой гармоники, может быть эффективным диагностическим методом в 70 % случаев [7].
Нужно отметить, что по данным УЗИ дифференцировать стеатоз и стеатогепатит нельзя, как и стеатогепатит алкогольный и неалкогольный [7].
В специальной литературе существует традиционное описание сонографической картины здоровой печени, когда неизмененная паренхима представляет собой мелкозернистое однородное изображение, по всей поверхности визуализируемого среза лоцируются мелкие трубчатые структуры, являющиеся протоками и сосудами печени. Крупная зернистость паренхимы печени может рассматриваться как вариант нормы при условии сохранения ее однородности.
Известным эталоном нормальной эхогенности паренхимы печени является таковая в корковом слое почки. В некоторых случаях изменение данной эхографической характеристики может рассматриваться как норма (например, гиперэхогенность в области ворот печени или гипоэхогенность хвостатой доли) [8]. Важным критерием сонографического заключения является также звукопроводимость, которая в норме позволяет визуализировать глубокие слои печени и диафрагму. При наличии стеатоза это становится невозможным, возникает эффект затухания эхосигнала к периферии [7, 8].
Основными ультразвуковыми показателями при исследовании печени являются следующие нормальные характеристики: косой вертикальный размер (КВР) правой доли печени, по данным разных авторов, в норме до 15 см (заключение о наличии гепатомегалии делают при увеличении данного показателя более 17 см), КВР левой доли печени в норме до 6–8 см; диаметр воротной вены в норме 0,8–1,2 см, до 1,3 см; диаметр нижней полой вены до 1,8 см; диаметр холедоха до 0,3–0,5 см. Признаком портальной гипертензии является диаметр воротной вены более 1,4 см. Диаметр селезеночной вены в норме 0,6–0,8 см, диаметр верхней брыжеечной вены в норме до 0,8–1,1 см, на выдохе 0,4–0,6 см, если на выдохе диаметр верхней брыжеечной вены уменьшается вдвое и более, то портальная гипертензия отсутствует [8].
При описании структуры печени для диагностики жировой дистрофии учитывают следующие сонографические характеристики: наличие гепатомегалии, округлый контур нижнего края печени, однородность структуры, гиперэхогенность, сглаженность зернистости при уменьшении звукопроводимости, обеднение и сглаженность сосудистого рисунка [8, 9].
Общими ультразвуковыми признаками стеатоза при проведении рутинного исследования с применением серошкальной шкалы являются следующие:
1) гепатомегалия, форма печени не нарушена, контур четкий, ровный, закругленный;
2) диффузное уплотнение паренхимы печени с повышением ее эхогенности и снижением звукопроводимости, что пропорционально степени выраженности стеатоза;
3) обеднение и сглаженность сосудистого рисунка, что связано с повышением эхогенности паренхимы печени; сначала затруднена визуализация мелких сосудов, а затем и более крупных;
4) появление эффекта дистального ослабления эхосигнала [9].
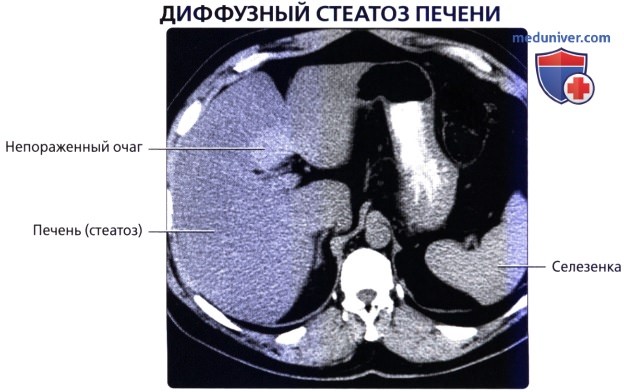
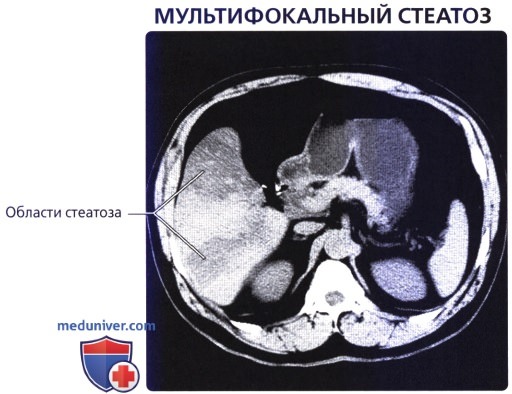
Анализ литературы по теме исследования показывает, что изменения, характерные для стеатоза, могут диффузно распространяться по всей поверхности печени или же образовывать изолированные участки жировой инфильтрации (очаговая форма).
На основании вышесказанного выделяют сонографические степени выраженности стеатоза:
I степень – незначительное диффузное увеличение эхо-сигналов в паренхиме печени, нормальная визуализация границ диафрагмы и внутрипеченочных сосудов;
II степень – уплотнение паренхимы печени с повышением ее эхогенности, выраженное обеднение сосудистого рисунка; визуализация крупных сосудов, границ диафрагмы; эффект дорсального затухания эхосигнала;
III степень – структура печени значительно уплотнена; выраженное обеднение сосудистого рисунка, при котором даже крупные сосуды печени просматриваются очень плохо; диафрагма не визуализируется; выраженный эффект дорсального затухания эхосигнала, при котором нижний край печени практически не визуализируется [9, 10].
По данным литературы, метод УЗИ является высокочувствительным в диагностике тяжелой степени стеатоза и имеет наименьшую эффективность при выявлении легкой степени стеатоза.
Ультразвуковыми признаками цирроза являются следующие:
1) увеличение краниокаудального размера печени более 15 см;
2) косо-вертикальный размер больше 17 см;
3) толщина левой доли более 8 см;
4) толщина хвостатой доли более 2 мм, ее краниокаудальный размер более 8 см;
5) заостренный нижний край печени;
6) бугристость контура за счет узловой регенерации паренхимы (специфичность этого признака при крупноузловом циррозе составляет 98 %);
7) гиперэхогенность паренхимы, неоднородность зернистости печени и отсутствие мелкососудистого рисунка по периферии;
8) четкое прослеживание контура диа- фрагмы;
9) отсутствие эффекта дистального затухания эхосигнала [10].
При допплерографии отмечаются замедление кровотока, обратный ток крови в воротной вене, увеличение скорости и объема кровотока в печеночной артерии.
В последние годы возрастает потребность в неинвазивных методах диагностики заболеваний печени, патогенез которых составляют прогрессирующий склероз и фиброз паренхимы. Определение эластичности ткани возможно с применением ультразвуковых систем с функцией различных видов эластографии:
1) статической или компрессионной;
2) динамической с оценкой показателей распределения сдвиговых волн.
Статическая эластография позволяет провести оценку эластичности ткани при помощи компрессии ультразвуковым датчиком, которую осуществляет врач-оператор с частотой 2 раза в секунду. Этот метод не дает возможности получить числовые показатели модуля упругости в килопаскалях (кПа) и числовые показатели эластичности печени.
Цветное картирование зоны интереса в данном случае может показать различную плотность паренхимы и является удобным при скрининге локальных образований в печени. Для оценки диффузных поражений при фиброзе данный метод неэффективен. Оценить эластичность печени можно при помощи динамической (транзиентной) эластографии, которую проводят с использованием аппарата Fibroscan (Echosens, Франция) [11]. Методика описана в специальной литературе, поэтому в рамках данной статьи мы не будем подробно останавливаться на вопросах проведения процедуры. Основой метода является механическая вибрация, которая генерирует упругие поперечные волны, скорость их распространения выражается в килопаскалях, при этом она прямо коррелирует с упругостью ткани: чем больше плотность ткани, тем быстрее распространяется поперечная волна.
Согласно отчетам Европейской федерации обществ ультразвука в медицине и биологии (EFSUMB), референсные значения выше 1,5–5,8 кПа говорят об отсутствии фиброза; 5,9–7,2 кПа соответствуют 1-й степени фиброза; 7,3–9,5 кПа – 2-й степени фиброза; 9,6–12,5 кПа – 3-й степени; более 12,5 кПа – 4-й степени, имеется цирротическое поражение [11]. Ограничениями к применению данной методики являются тяжелые степени ожирения пациента и асцит.
Необходимость доступной количественной оценки жесткости ткани, выраженной как модуль Юнга (кПа) или скорость сдвиговой волны (м/с), привела к созданию современных ультразвуковых систем, применение которых позволяет получить значение эластичности ткани печени в режиме реального времени. Значение скорости сдвиговой волны можно переводить в значения модуля Юнга по следующей формуле: E ≈ 3ρcs 2 (Па) где E – модуль Юнга (Па), ρ – плотность ткани (≈1000 кг/м3), сs – скорость сдвиговой волны (м/с). Повышение значений модуля Юнга или скорости сдвиговой волны говорит о высокой жесткости ткани [12].
Эластометрия с применением форсированного импульса акустической радиации (ARFI) с помощью системы Acuson S2000™ (Siemens, Германия) – это метод эластографии, интегрированный в стандартные ультразвуковые аппараты. Для получения результата требуется 10 валидных измерений, из которых рассчитывается среднее значение скорости сдвиговой волны (см/сек). Эластометрия с применением ARFI имеет более низкую частоту ошибок измерений, чем транзиентная эластография [11, 12].
В мировой и отечественной практике существуют современные аппаратные ультразвуковые системы, которые, помимо традиционного сканирования в В-режиме, обладают функцией эластометрии и двухмерной сдвиговолновой эластографии для определения степени фиброза печени, оценки коэффициента затухания для количественного анализа степени выраженности стеатоза [12, 13]. Измерение степени выраженности стеатоза проводится в соответствии с морфологической шкалой и выражается в дБ/см.
Значение до 2,2 дБ/см – стеатоз отсут- ствует;
1-я степень – от 2,2 до 2,32 дБ/см;
2-я степень – от 2,33 до 2,9 дБ/см;
3-я степень – более 2,91 дБ/см [13].
Таким образом, применение неинвазивных методик оценки эластичности паренхимы печени в сочетании со сканированием в В-режиме и допплерографией становится частью стандартного обследования пациентов с НАЖБП, так как инвазивные диагностические методики при помощи биопсии не всегда применимы. Возросшая потребность в скрининге и мониторировании пациентов с болезнями печени актуализирует вопросы разработки и внедрения новых информативных и доступных методов неинвазивной диагностики стеатоза и фиброза печени. В настоящее время идет активное изучение сразу нескольких методик визуализации печени: магнитно-резонансной и транзиентной эластографии, УЗИ с контрастным усилением и др. Это расширяет возможности своевременной прижизненной диагностики болезней печени с определением показателей клинического прогноза. Указанные методики могут занять полноправное место в ряду многочисленных диагностических мероприятий.
Краниокаудальный размер печени что это
а) Обзор анатомии печени:
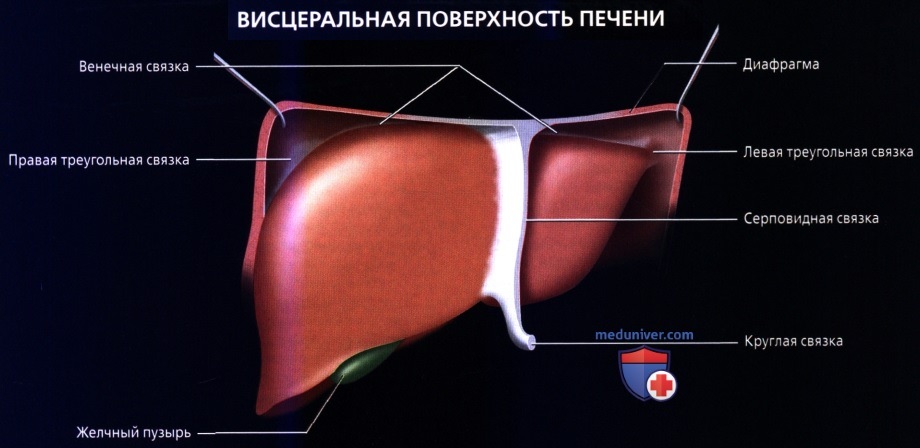
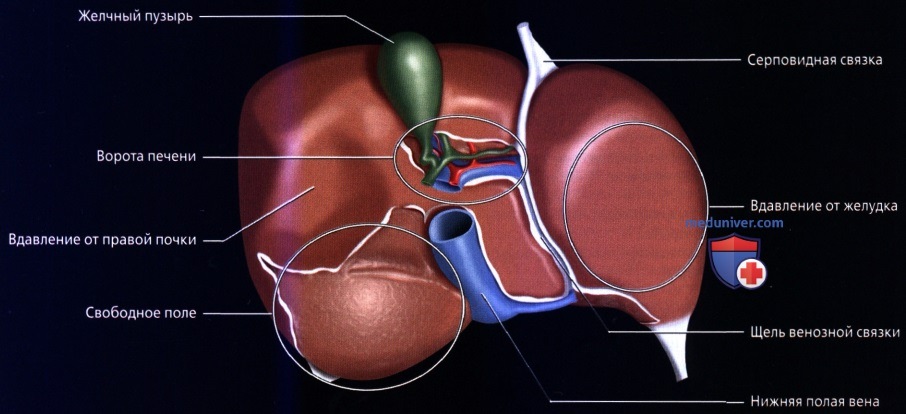
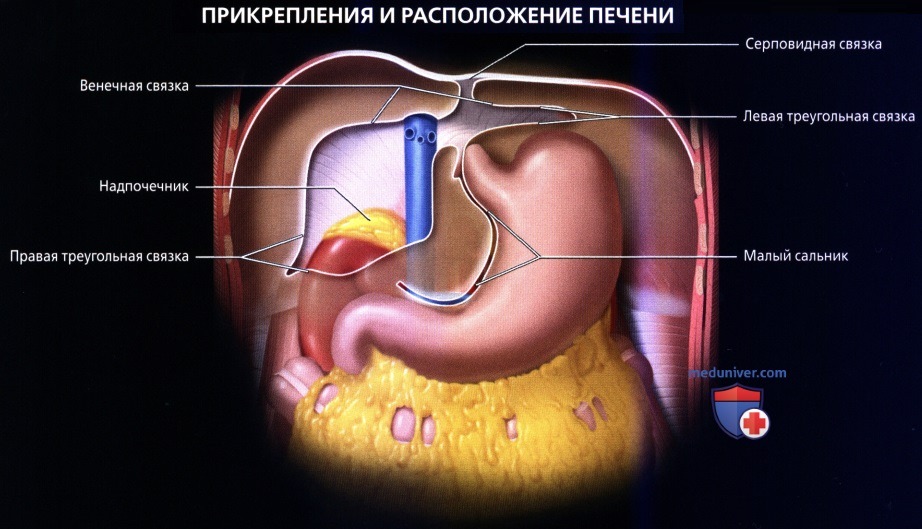
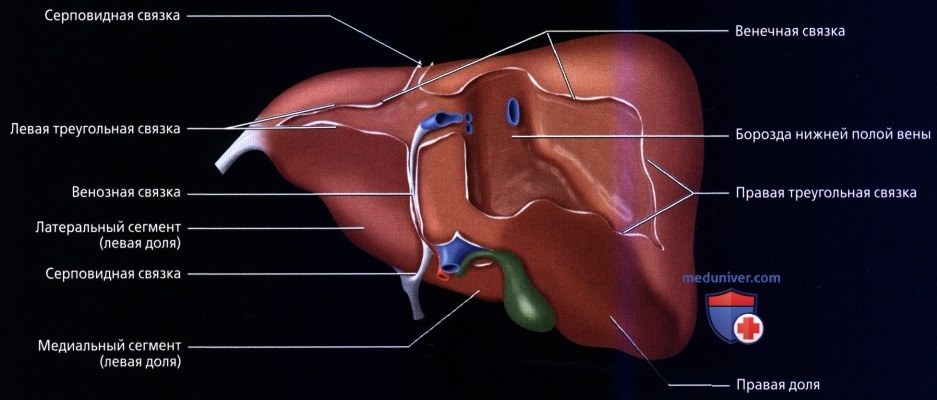
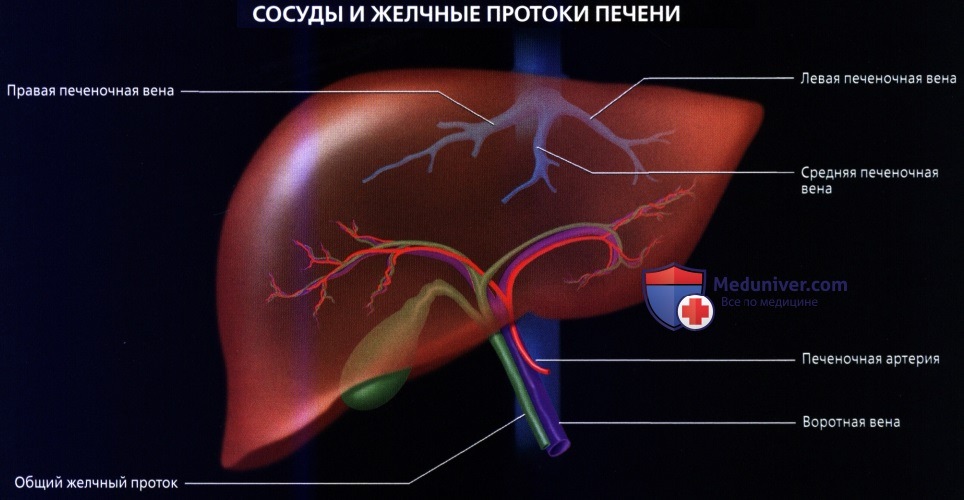
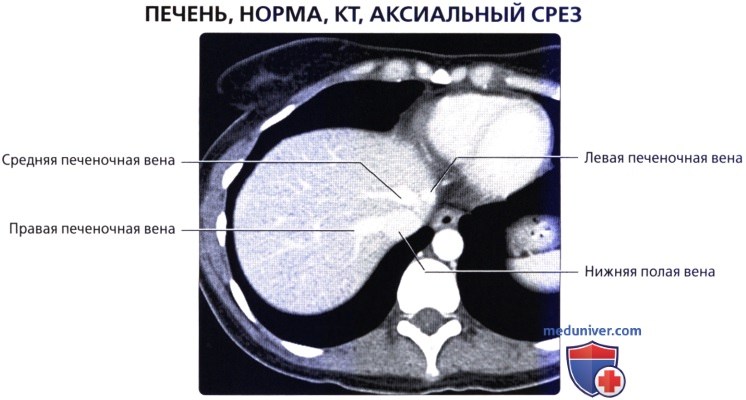
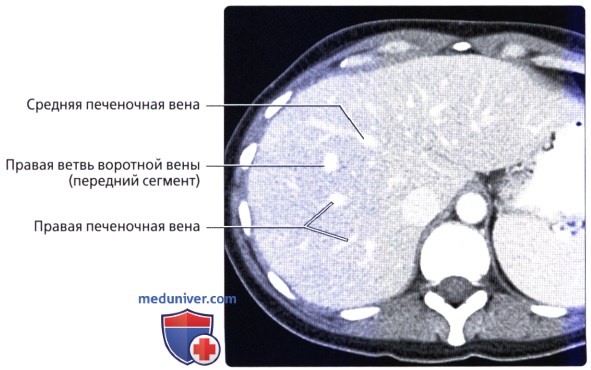
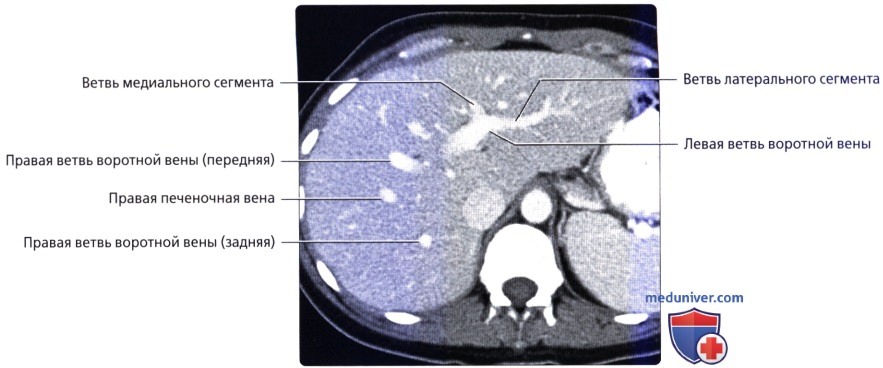
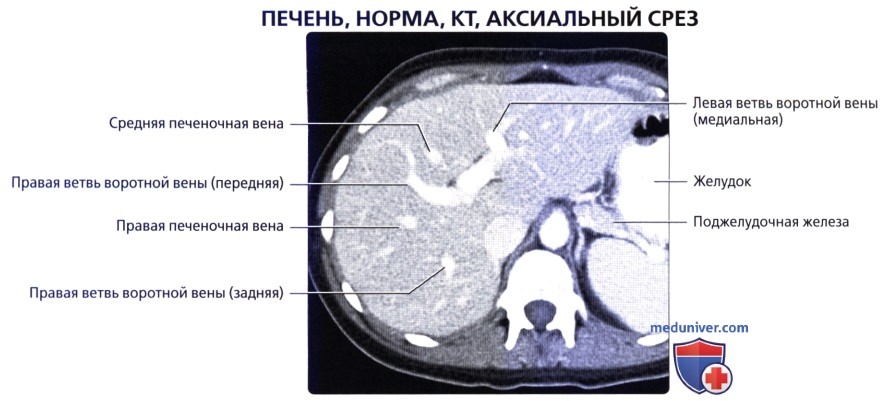
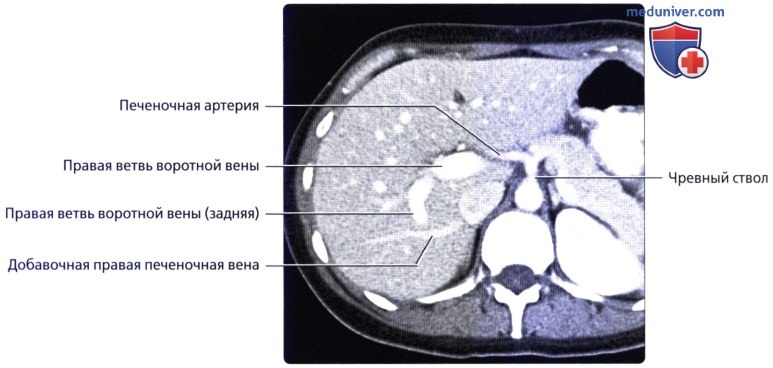
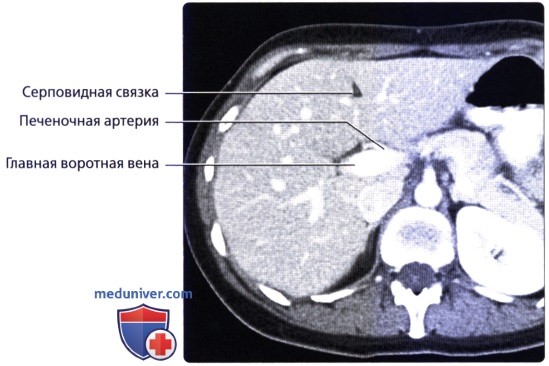
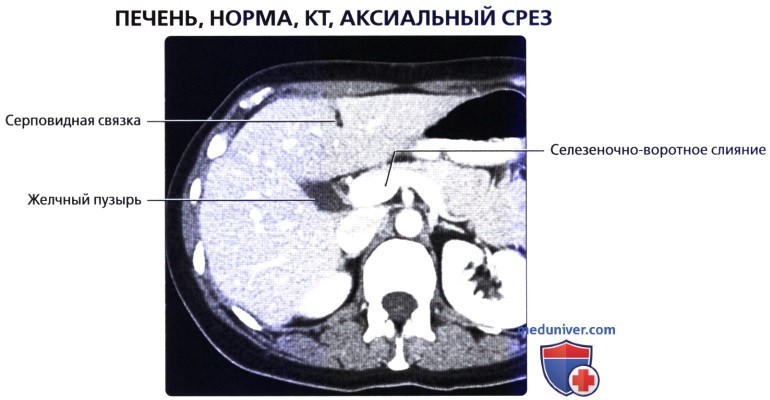
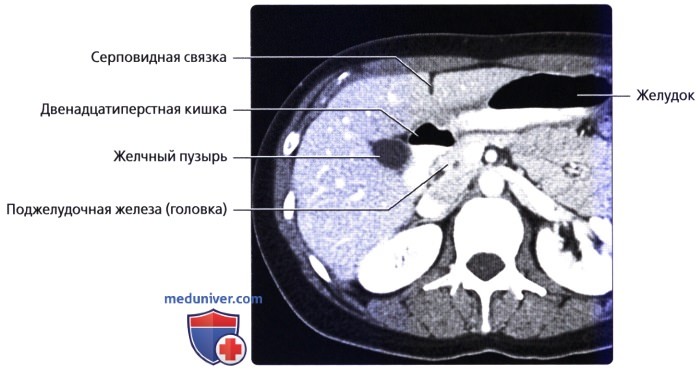
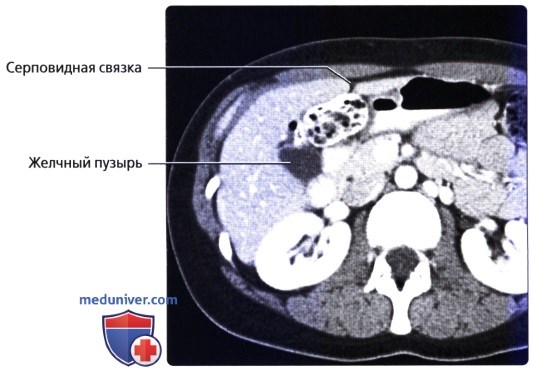
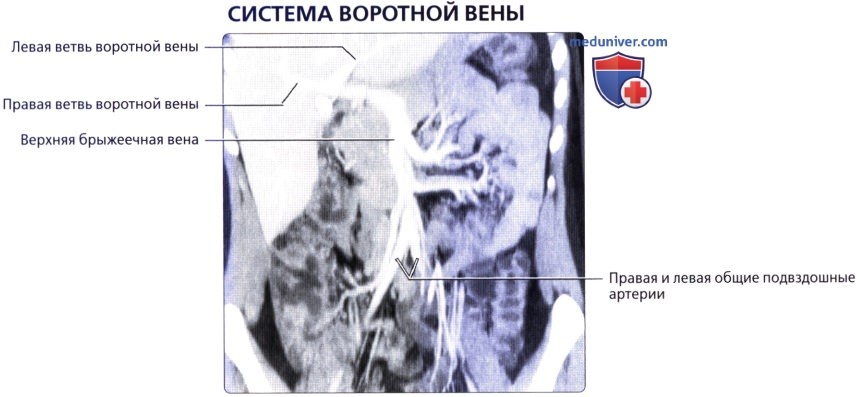
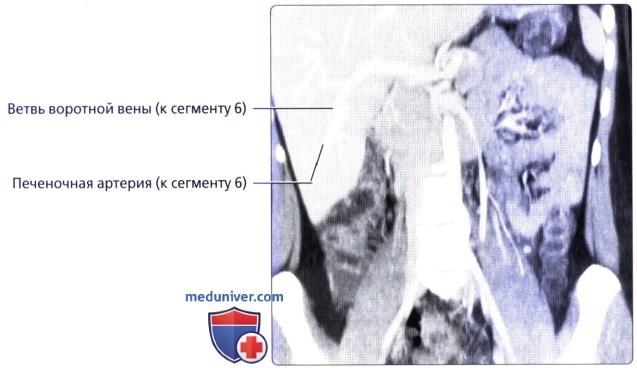
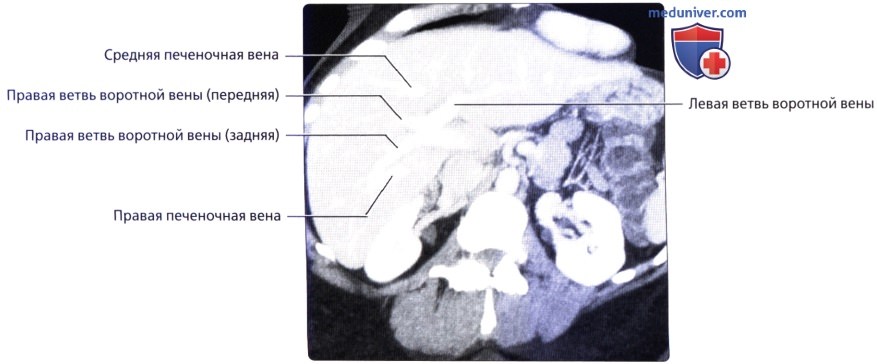
• Кровоснабжение: печень обладает уникальной двойной системой кровоснабжения через воротную вену и печеночные артерии:
о Воротная вена:
— Осуществляет 75-80% притока крови к печени
— Кровь несет питательные вещества из кишечника, гепатотропные гормоны поджелудочной железы и кислород (содержит на 40% больше кислорода, чем венозная кровь системной венозной сети, но значительно меньше кислорода, чем кровь печеночной артерии)
о Печеночная артерия:
— Осуществляет 20-25% притока крови к печени
— Кровь более богата кислородом, чем кровь в воротной вене, но не несет тех же питательных веществ, что переносятся в системе воротной вены
— Печень менее зависима от печеночного кровоснабжения, чем желчевыводящие протоки
— Обычно берет начало от чревного ствола, но часто встречаются различные варианты начала печеночной артерии, например замещенная артерия, берущая начало от верхней брыжеечной артерии или левой желудочной артерии
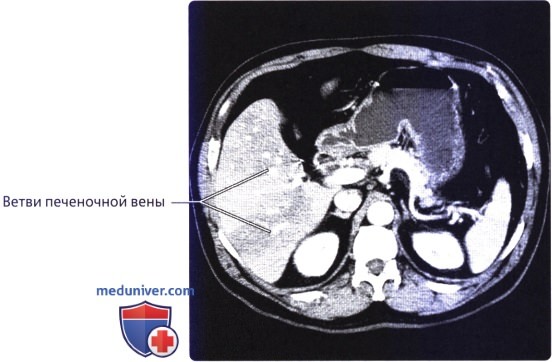
о Печеночные вены:
— Обычно три (правая, средняя и левая), возможно наличие одного из множества вариантов развития и часто наблюдаются добавочные вены
— Возвращают кровь в НПВ в точке слияния печеночных вен чуть ниже диафрагмы и входа НПВ в сердце
о Воротная триада:
— При любом размере и разделении ветви печеночной артерии, воротной вены и желчевыводящих протоков проходят вместе
— Кровь течет в печеночные синусы из междольковых ветвей печеночной артерии и воротной вены → клетки печени (детоксикация крови и продукция желчи) → желчь входит в желчевыводящие протоки и кровь входит в центральные вены → печеночные вены
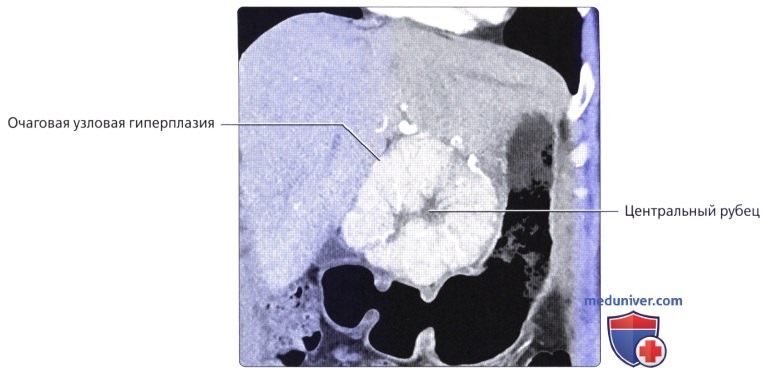
• Сегментарная анатомия печени:
о Старое классическое разделение печени на четыре сегмента (правая передняя и задняя, левая медиальная и латеральная) уступило место классификации Куино, в которой печень подразделяется на восемь сегментов
— Клинически и хирургически обоснованная классификация, поскольку каждый отдельный сегмент получает вторичную или третичную ветвь печеночной артерии и воротной вены и дренируется собственным желчевыводящим протоком (внутрипеченочным) и ветвью печеночной вены
— Каждый сегмент функционально независим и может быть обособленно удален
— Сегментарные ветви печеночной артерии, воротной вены и желчевыводящих протоков входят в центр каждого сегмента, в то время как печеночные вены расположены на периферии (и разделяют сегменты)
— Печень делится в вертикальной плоскости тремя печеночными венами (плоскости печеночных вен), а бифуркация воротной вены разделяет печень в горизонтальной плоскости (плоскость воротной вены):
Средняя печеночная вена разделяет правую и левую доли печени (линия Кантли), а правая печеночная вена разделяет правую долю на передний и задний отделы, левая печеночная вена разделяет левую долю на медиальный и латеральный отделы
— Сегменты пронумерованы по часовой стрелке при взгляде на переднюю поверхность печени
— Из-за вариативности хода ветвей сосудов и желчевыводящих протоков часто невозможно определить точные границы сегментов печени при визуализации
— Правая доля обычно чуть крупнее левой (около 60% всего объема печени)
о Сегмент 1: хвостатая доля:
— Особенный сегмент, расположенный вокруг внутрипеченочного отдела НПВ и имеющий независимую воротную триаду и прямой венозный отток крови в НПВ (через вены мелкого калибра)
о Левая доля:
— Верхний латеральный = сегмент 2 (расположен слева от левой печеночной вены и выше плоскости воротной вены)
— Нижний латеральный = сегмент 3 (расположен слева от левой печеночной вены и ниже плоскости воротной вены)
— Медиальный верхний = сегмент 4А (расположен справа от левой печеночной вены и выше плоскости воротной вены)
— Медиальный нижний = сегмент 4Б (расположен справа от левой печеночной вены и ниже плоскости воротной вены)
о Правая доля:
— Передний нижний = сегмент 5 (расположен справа от средней печеночной вены и ниже плоскости воротной вены)
— Задний нижний = сегмент 6 (расположен справа от правой печеночной вены и ниже плоскости воротной вены)
— Задний верхний = сегмент 7 (расположен справа от правой печеночной вены и выше плоскости воротной вены)
— Передний верхний = сегмент 8 (расположен справа от средней печеночной вены и выше плоскости воротной вены)
• Околопеченочные углубления (пространства, окружающие печень и собирающие жидкость)
о Карман Моррисона (печеночно-почечное углубление): наиболее низко расположенное пространство брюшины у человека в положении лежа на спине между правой печеночной долей и почкой
о Поддиафрагмальное пространство: пространство между печенью и диафрагмой, разделенное на правое и левое поддиафрагмальные пространства серповидной связкой
о Подпеченочное пространство: пространство между нижней поверхностью печени и прилегающим отделом поперечноободочной кишки
• Иннервация:
о Симпатическая и парасимпатическая из печеночного нервного сплетения (проходит в воротных триадах):
— Симпатическая из чревного сплетения и парасимпатическая из переднего и заднего блуждающих нервов
• Нормальная картина при различных методах визуализации:
о КТ:
— Нормальная ткань печени на КТ приблизительно на 10 ЕХ плотнее ткани селезенки (важное соотношение в диагностике стеатоза печени)
— Ткань печени на КТ с контрастированием характеризуется большей вариабельностью, что делает различение «нормы» и стеатоза значительно более трудным
— Нет абсолютной границы повышения плотности печени (например, при гемохроматозе или влиянии амиодарона и т.д.), но печень часто на 80 ЕХ плотнее или значительно сильнее накапливает контраст по сравнению с селезенкой
о УЗИ:
— Нормальная печень должна обладать одинаковой или слегка большей эхогенностью по отношению к прилегающей правой почке
— Измерение расстояния от купола печени до верхушки правой доли печени часто используется для определения гепатомегалии, граница гепатомегалии составляет 15,5 см (достоверность вызывает сомнения)
— Поверхность/капсула печени должна быть гладкой и однородной при исследовании с использованием высокочастотного датчика, узлы на поверхности печени говорято наличии цирроза/фиброза печени
— Воротные вены имеют толстые, эхогенные стенки в отличие от тонких стенок печеночных вен
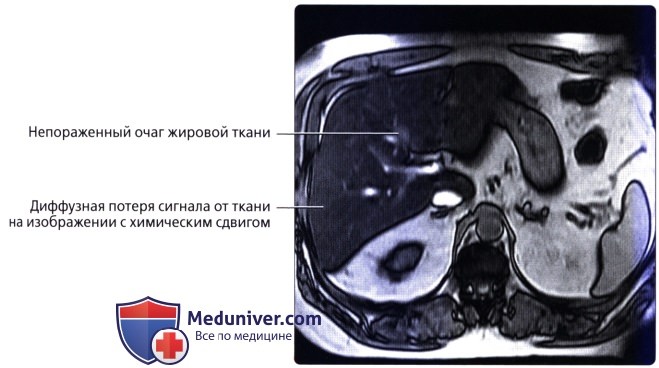
о Магнитно-резонансная томография:
— Нормальная печеньелегка гиперинтенсивна наТ1-ВИ по отношению к мышцам и почкам
— Нормальная печень гипоинтенсивна по отношению к селезенке, почкам и поджелудочной железе на Т2-ВИ и ДВИ
• Эмбриология:
о Печень развивается в виде вентрального дивертикула в точке соединения передней и средней кишок:
— Желчевыводящая система и желчный пузырь также развиваются из вентрального дивертикула
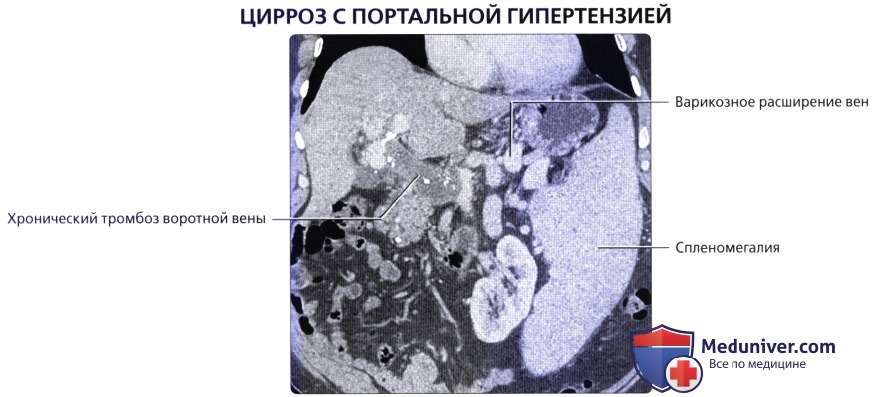
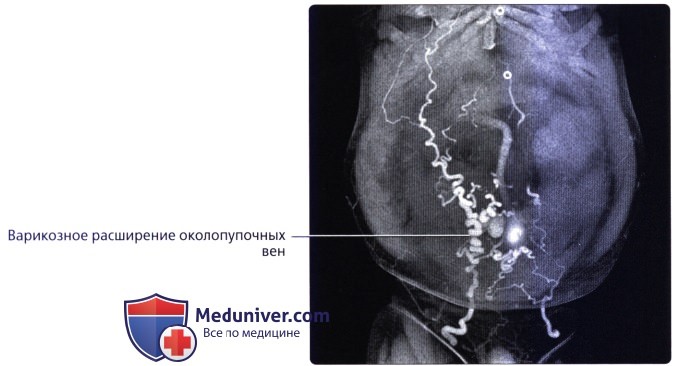
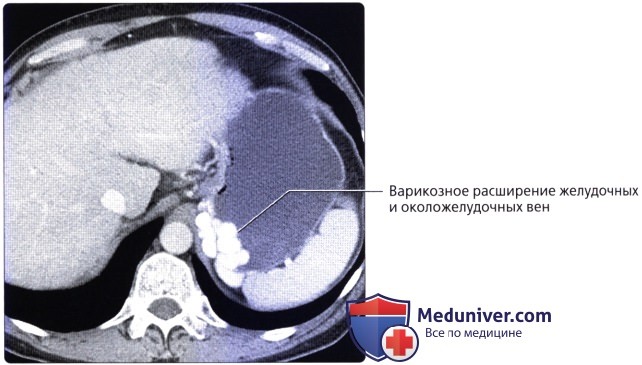
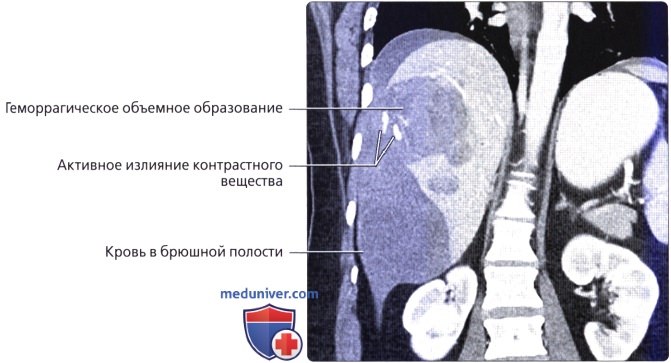
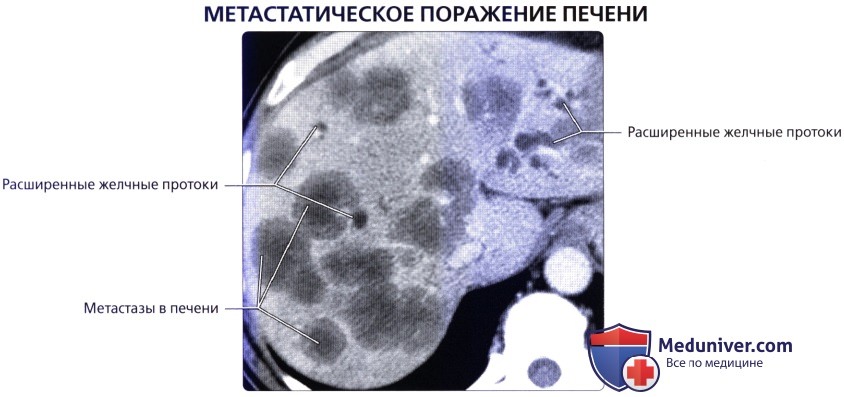
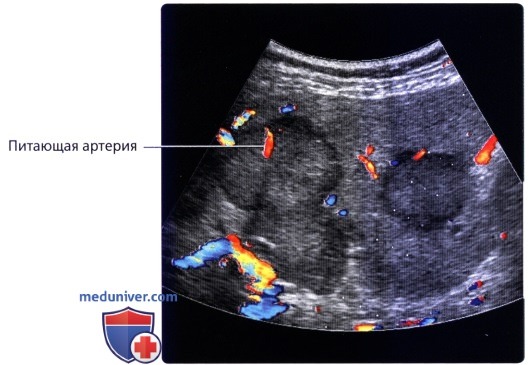
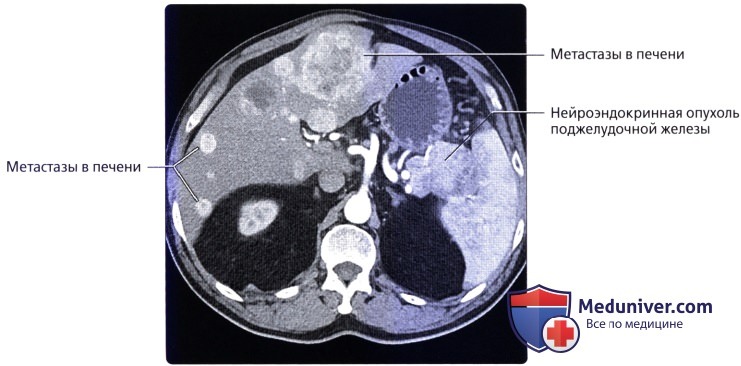
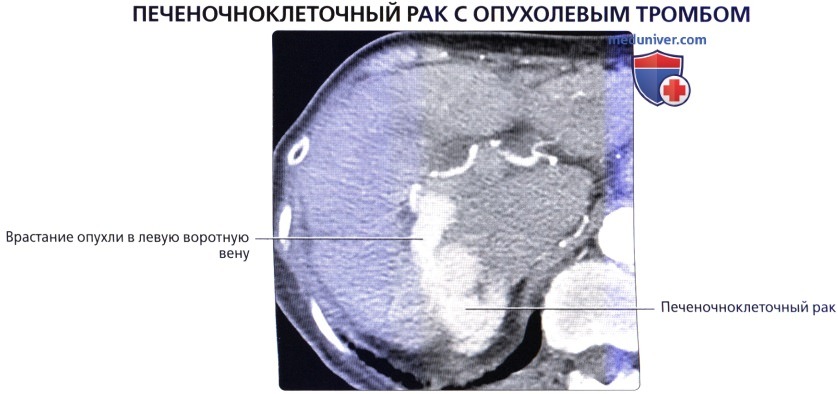
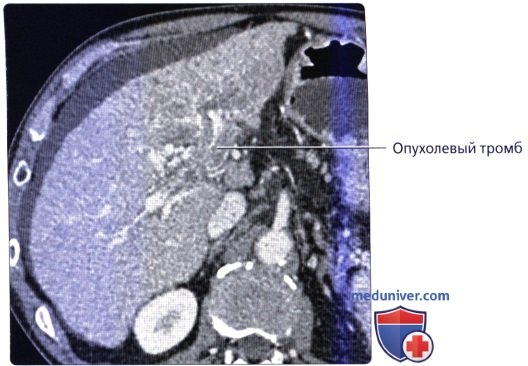
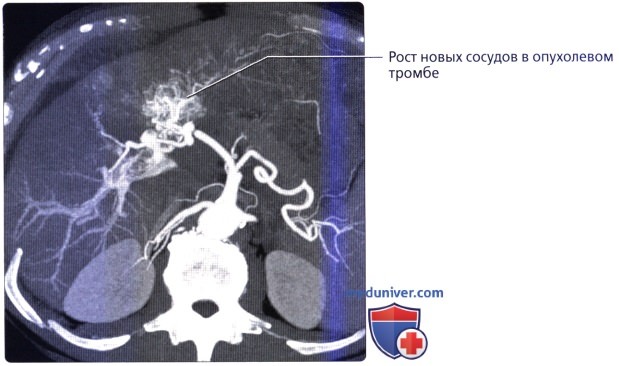
б) Клинические особенности анатомии печени:
• Достижения в хирургии печени (удаление опухоли, пересадка) требуют предельно точной визуализации анатомической структуры долей и сегментов, объема, кровоснабжения и оттока желчи:
о Сочетание стандартной многоплоскостной визуализации и трехмерной реконструкции (КТ, МРТ, УЗИ) может быть необходимо для оптимального планирования операции
о Сейчас обычно нет необходимости в «инвазивных» методах визуализации (катетерная ангиография и чрескожная печеночная или эндоскопическая холангиография) из-за высокого качества изображений, получаемых при КТ и МРТ/МРХПГ
о Анатомическая классификация Куино играет роль важнейшего ориентира в хирургическом лечении печени, так как многие операции (удаление сегмента, удаление двух сегментов, удаление печени, расширенное правое/левое удаление печени) основаны на анатомии сегментов
— Неанатомическое удаление печени, не придерживающееся анатомии сегментов, обозначается как«клиновидная резекция»
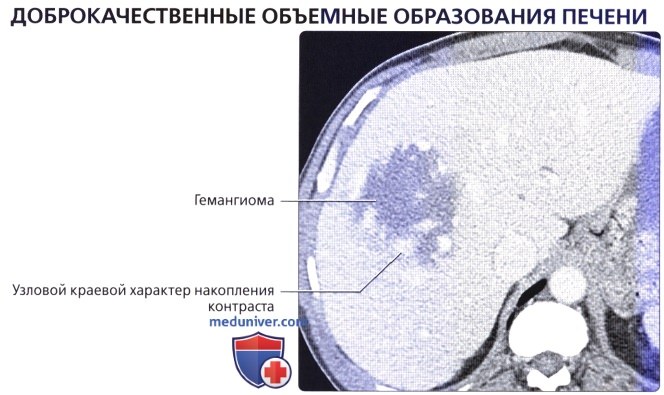
• Метастатическое поражение печени встречается намного чаще первичных злокачественных новообразований печени:
о Первичные карциномы желудочно-кишечного тракта, такие как злокачественные образования толстой кишки, поджелудочной железы и желудка, встречаются наиболее часто
о Отток крови в воротную вену обычно приводит к тому, что печень становится первым органом, пораженным метастазами опухолей этих органов
о Визуализация в артериальную фазу очень важна для оценки наличия возможных метастазов богатых сосудами опухолей (например, нейроэндокринная опухоль поджелудочной железы, карциноид, почечноклеточный рак) в печени, поскольку мелкие метастазы могут быть практически невидимы в фазу контрастирования воротной вены
— Вернуться в оглавление раздела «Лучевая медицина»
Редактор: Искандер Милевски. Дата публикации: 22.4.2020

