коронавирус sars cov 2 ген n что это
Генетическая характеристика вируса SARS-CoV-2
Eng. Genetic characteristics of the SARS-CoV-2
Novikova Irina Alekseevna 1
1 Southern Federal University, Rostov-on-Don, Russia
This review describes the genetic characteristics of the virus, the main ways to diagnose COVID-19 infection. The SARS-CoV-2 virus is a single-stranded RNA molecule, the length of the virus genome varies from 29.8 kbp. up to 29.9 kb Comparative genomic analysis showed that SARS-CoV-2 belongs to the group of beta-coronaviruses and is very close to SARS-CoV. Initial comparative genomic analysis showed that SARS-CoV-2 is almost 79% identical to SARS-CoV and 50% identical to the MERS-CoV virus. Based on homologous modeling studies, SARS-CoV-2 has been shown to be 96.2% homologous to BatCoV RaTG13, a bat coronavirus of the genus Rhinolophus affinis. Studies to establish the origin of SARS-CoV-2 have shown that random mutation and recombination are two main sources of the genetic diversity of this virus. Recently published works show that the frequency of SARS-CoV-2 mutations is approximately the same as in the SARS-CoV genome (0.80-2.38 × 10-3 nucleotide substitutions per site per year). The most common types of mutations in the SARS-CoV-2 genome are synonymous and missense mutations. Mutations of other types were also found in the SARS-CoV-2 genome: nonsense mutations, insertions, deletions, mutations of non-coding DNA.
At least seven genetically independent clones have been found that have acquired a mutation at one specific site Q677H or Q677P of the Spike virus spike protein gene.
Возникающие и возобновляющиеся эпидемии – это проблема здравоохранения глобального масштаба. Первые случаи болезни, вызванной коронавирусной инфекцией COVID-2019 были обнаружены еще в 2019 году, но и по сей день это заболевание отнимает тысячи жизней. По данным Worldometer на 15 апреля: 2021 г. в мире выявлено 133 717 735 случаев заражения COVID-19 [14]. До сих пор инфицированными остаются 18415472 человек, 107555 из которых находятся в тяжелом состоянии. Россия входит в десятку стран лидирующими по заражению COVID-2019. По данным сайта стопкоронавирус.рф на 15 апреля 21 года за все время в России было инфицировано 4 675 153 человек, из них скончалось 105 928 человек [2]. Изучение структуры SARS-CoV-2 позволило приступить к созданию вакцин, которые уже активно применяются с целью профилактики COVID-2019.
Генетическая характеристика вируса SARS-CoV-2
Понимание генетики SARS-CoV-2 может открыть новые возможности для разработки более эффективных и безопасных методов лечения новых поколений вакцин.
SARS-CoV-2 относится к РНК-вирусам, для которых характерна высокая частота мутаций. Он представляет собой одноцепочечную молекулу РНК, длина генома SARS-CoV-2 варьирует от 29,8 т.п.н. до 29,9 т.п.н. По данным Супотницкого [1] это самый большой вирусный РНК-геном из известных на сегодняшний день. Геном вируса состоит из шести основных открытых рамок считывания (ORF), общих для коронавирусов, и ряда других дополнительных генов.
Сравнительный геномный анализ показал, что SARS-CoV-2 относится к группе бета-коронавирусов и очень близок к SARS-CoV, ответственному за эпидемию атипичной пневмонии, начавшейся в ноябре 2002 года в китайской провинции Гуандун и затем распространившейся на 29 стран в 2003 году.
Впервые последовательность генома SARS-CoV-2 была опубликована в GenBank 11 января 2020 г. (инвентарный номер MN908947.3) [8].
На основании выравнивания последовательностей и анализа эволюционного древа SARS-CoV-2 теперь считается новейшим представителем линии B рода Betacoronavirus (β-CoV) в семействе Coronaviridae порядка Nidovirales. Первоначальный сравнительный геномный анализ показал, что SARS-CoV-2 почти на 79% идентичен SARS-CoV и на 50% идентичен вирусу MERS-CoV, ответственному за развитие ближневосточного респираторного синдрома [18].
Согласно филогенетическому анализу, SARS-CoV-2 больше похож на SARS-CoV, чем на MERS-CoV. Стоит отметить, что на основе исследований гомологического моделирования было показано, что SARS-CoV-2 на 96,2% гомологичен BatCoV RaTG13, коронавирусу летучих мышей рода Rhinolophus affinis [15].
Рис.1 – Геномы коронавирусов типовых видов различных родов (по: М.В. Супотницкий, 2020 [1])
В настоящее время проводится большое количество исследований по обнаружению различных геномных вариантов SARS-CoV-2. Как сообщают Chan и Laamarti [5], наиболее частыми типами мутаций в геноме SARS-CoV-2 являются синонимичные и миссенс-мутации. Также в геноме SARS-CoV-2 были обнаружены мутации и других типов, а именно: нонсенс-мутации, вставки, делеции, а также мутации некодирующей ДНК.
Геномный анализ SARS-CoV-2 в нескольких исследованиях выявил мутации в генах: ORF1ab, ORF3a, ORF6, ORF7, ORF8, ORF10, S, M, E и N [5]. Как сообщается, гены nsp1 nsp2 nsp3, nsp12 и nsp15, ORF1ab, S и ORF8 имеют значительно больше число мутаций, чем другие [15]. Кроме того, в гене ORF1ab были обнаружены две вставки с неизвестными эффектами [16].
По результатам нескольких исследований в различных частях генома SARS-CoV-2 были обнаружены делеции различного типа (в рамке считывания или сдвиг рамки считывания), однако о мутациях в гене M до сих пор ничего не сообщалось. Эти делеции предположительно могут играть определенную роль в вирулентности и патогенезе вируса посредством влияния на третичную структуру и функции вирусных белков, а также на врожденный иммунитет.
Рис.2 – генетическая структура SARS-CoV-2 (по: Alanagreh, Foad Alzoughool, Manar Atoum, 2020[3])
Из-за роли более мутабельных регионов в вирусной репликации, передаче и, соответственно, индуцированных иммунных ответах, необходимы дальнейшие исследования для определения эффектов этих мутаций в патогенезе SARS-CoV-2.
Благодаря исследованию ученых из Великобритании, включающему в себя анализ геномов SARS-CoV-2 от 7500 пациентов по всему миру, удалось установить, что вирус был распространен не «нулевым пациентом». В результате анализа обнаружено 198 мутаций, каждая из которых встречалась более одного раза. Это указывает на то, что SARS-CoV-2 подвергается селективному давлению при адаптации к организму хозяина [7].
В. Куппер в своем недавнем исследовании [9] сообщает, что обнаружено по крайней мере семь генетически независимых клонов, которые приобрели мутацию в одном конкретном месте Q677H или Q677P гена S шипового белка вируса Spike. «Эти вирусные адаптации уже переписывают наши учебники биологии по конвергентной эволюции» —пишет Купер.
Заключение. Исходя из сообщений о патологии и патогенезе новой коронавирусной инфекции COVID-19, полученных из разных стран, развитие заболевания представляет собой сложную картину взаимодействия различных факторов. Необходимы дальнейшие исследования для определения эффектов мутабельных регионов в патогенезе SARS-CoV-2. Более полное понимание генетической структуры SARS-CoV-2 имеет решающее значение для выработки протоколов диагностики, прогнозирования тяжелого течения инфекции, создания профилактических вакцин, разработки протоколов терапии заболеваний, вызванных SARS-CoV-2, а также другими вновь появляющимися инфекциями.
Новые ущербы от инфекции SARS-CoV-2 за пределами дыхательной системы
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все мы помним, как с начала декабря 2019 года в китайском городе Ухань был выявлен ряд случаев пневмонии, связанных с коронавирусной инфекцией COVID-19 c серьезными симптомами, такими как респираторные проблемы (кашель, одышка, поражение легких) и лихорадка. Но вы когда-нибудь задумывались о том, что же происходит с остальными органами нашего тела? Так давайте разберём, как крошечный вирус может поражать не только дыхательную систему, но и вызвать повреждение других систем человеческого организма.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Партнеры номинации — медико-биологическая школа «Вита» и «Новая школа».
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
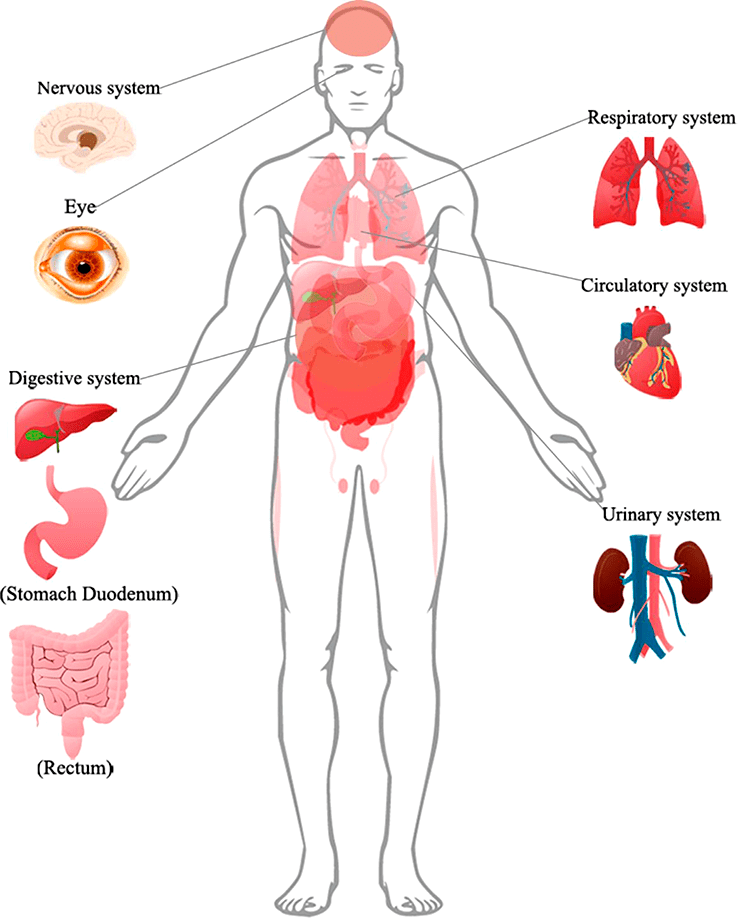
Согласно исследованиям немецких ученых, SARS-CoV-2 проникает внутрь организма с помощью клеточного рецептора — ангиотензинпревращающего фермента 2 (АПФ2; ACE2 — англ.), который специфически синтезируется в определенных органах и тканях. Соответственно, ACE2 играет важную роль в регуляции сердечно-сосудистой, кишечной, почечной и репродуктивной функций [1]. Попав в систему кровообращения, коронавирус, вероятнее всего, распространяется через кровоток [2]. Следуя этим данным, мы можем понять, как SARS-CoV-2 заражает не только дыхательную систему, но и представляет потенциальную угрозу для пищеварительной и мочеполовой систем, ЦНС и системы кровообращения.
Рисунок 1. Поражения органов, подтвержденные клиническими признаками или биопсией, у пациентов с COVID-19
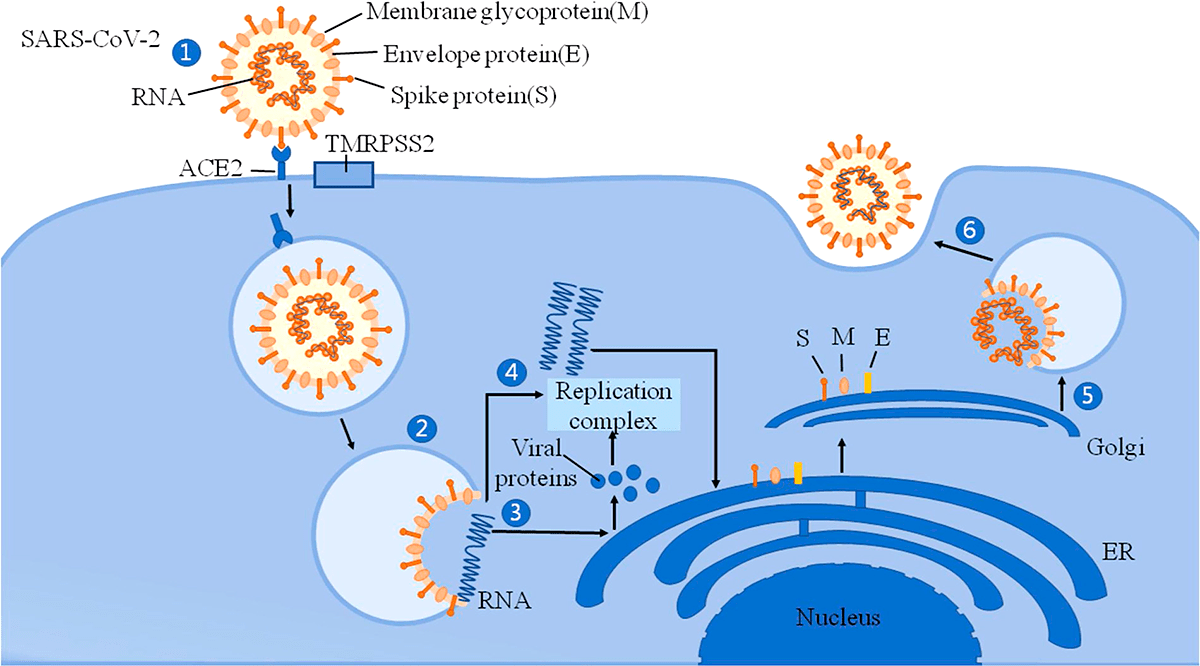
Рисунок 2. Механизм вторжения SARS-CoV-2 в клетку
SARS-CoV-2 и пищеварительная система
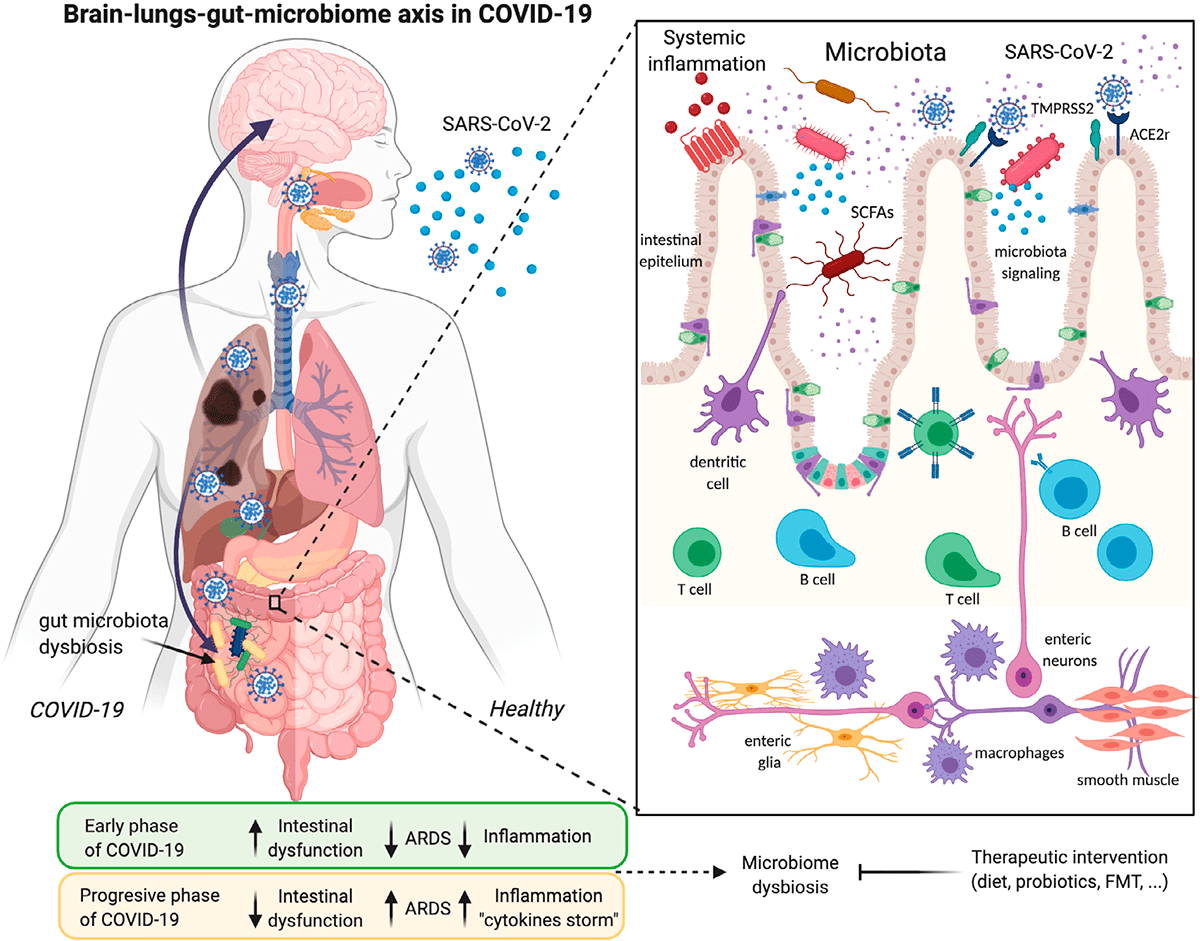
Помимо главного рецептора ACE2, SARS-CoV-2 использует трансмембранную сериновую протеазу 2 (TMRPSS2), фермент, который также экспонируется на эпителиальных клетках тонкой кишки. Он способствует проникновению вируса в клетки [3]. Активность SARS-CoV-2 может вызывать модификации ACE2 в кишечнике, которые повышают восприимчивость к воспалению кишечника и диарее. ACE2 оказывает значительное влияние на состав кишечной микробиоты [4]. Первичные воспалительные стимулы вызывают высвобождение в систему кровообращения микробных продуктов и цитокинов, которые могут вызвать микробный дисбиоз и воспалительную реакцию.
Изменения микробиоты кишечника могут быть связаны с изменениями в иммунной системе и предрасположенностью к более серьезным последствиям COVID-19. Наш микробиом меняется с возрастом: в первые несколько лет жизни микробиота малоразнообразна и нестабильна [5], [6]; во взрослом возрасте стабильна и разнообразна, а к пожилому возрасту разнообразие микробиоты уменьшается, а дисбиоз увеличивается, что связывают с когнитивным дефицитом, депрессией и воспалением [7]. Сниженное разнообразие микробиоты — еще один фактор риска заражения COVID-19 для пожилых людей.
Рисунок 3. Инфекция SARS-CoV-2 и ее связи с осью легких—кишечника—мозга и дисбиозом микробиома
Изменение кишечной флоры также связано с ожирением, еще одним фактором риска для тяжелого течения COVID-19 [8], [9]. Жировая ткань может служить резервуаром для распространения SARS-CoV-2 и активации системного иммунитета [10]. Коронавирусная инфекция вызывает изменения в кишечной бактериальной флоре, которые могут повлиять на ось «кишечник—мозг». Таким образом, кишечная флора играет решающую роль в регуляции неврологических функций, таких как депрессия или тревога [11].
Следовательно, режим питания играет значительную роль во время заражения вирусом SARS-CoV-2. Из-за вирусной инфекции иногда начинается дисбиоз, который может быть скомпенсирован компонентами диеты и пробиотиками [12]. Несколько исследований показывают, что оптимальный иммунный ответ зависит от правильного питания [13], [14]. Недоедание может поставить под угрозу иммунитет, тем самым влияя на уязвимость ответа на COVID-19. Потребление достаточного количества белка имеет решающее значение для выработки антител, поддержания ворсинчатой морфологии кишечника и уровня кишечного иммуноглобулина, что улучшает кишечный барьер [15–17]. Таким образом, высококачественные белки являются важным компонентом противовоспалительной диеты, которая включает омега-3 жирные кислоты, витамины С и Е, фитохимические вещества, которые широко присутствуют в продуктах растительного происхождения (фруктах, овощах, орехах, злаках и т.д.) [18–21]. Правильная диета укрепляет иммунную систему и способствует защите организма от тяжелого течения COVID-19.
SARS-CoV-2 и центральная нервная система (ЦНС)
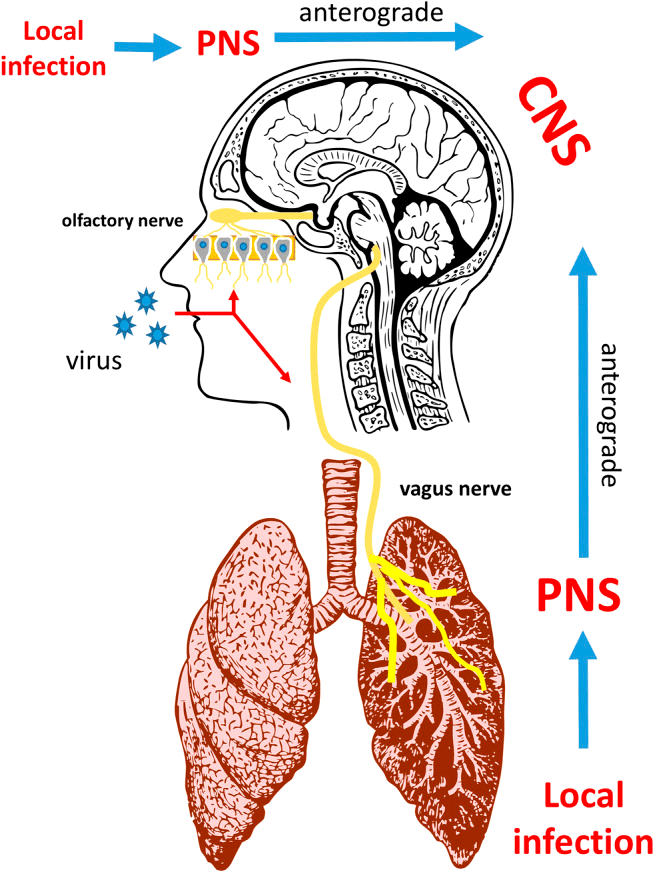
Кроме пищеварительной системы, коронавирусная инфекция (COVID-19) также затрагивает центральную и периферическую нервную систему. Неврологические проявления могут возникать по разным причинам, включая прямое вирусное поражение центральной нервной системы (ЦНС) и иммунноопосредованные процессы. Примеры заболеваний ЦНС при COVID-19 могут включать энцефалит (воспаление головного мозга), менингит и инсульт. В периферической нервной системе COVID-19 ассоциируется с дисфункцией обоняния и вкуса, повреждением мышц и синдромом Гийена—Барре, при котором иммунная система человека поражает собственные периферические нервы.
Рисунок 4. Коронавирусная инфекция и нервная система
Ученые Университета Гонконга отметили, что механизмы инфекции SARS-CoV-2 могут быть аналогичны механизмам инфекции SARS-CoV из-за 79,5% сходства последовательностей РНК этих двух коронавирусов [22]. Однако SARS-CoV-2 обладает более мощной способностью к распространению, чем SARS-CoV и MERS-CoV. Причина в том, что SARS-CoV-2 и ACE2 обладают более сильной связывающей способностью [23]. S-белок (спайк-белок) на поверхности коронавируса связывается с ACE2 и прикрепляется к поверхности клетки; затем сериновая протеаза (TMPRSS2) активирует S-белок, что помогает вирусу проникать в нейрон [1]. Так как клетки кровеносных сосудов экспонируют ACE2 в большом количестве, SARS-CoV-2 может атаковать эндотелиальные клетки в кровеносных сосудах головного мозга через этот рецептор и нарушить гематоэнцефалический барьер (ГЭБ — барьер между кровеносной системой и центральной нервной системой). Нарушенный ГЭБ может способствовать вторжению вируса в ткани мозга и нейроны и привести к серьезным неврологическим осложнениям [24].
SARS-CoV-2 и система кровообращения
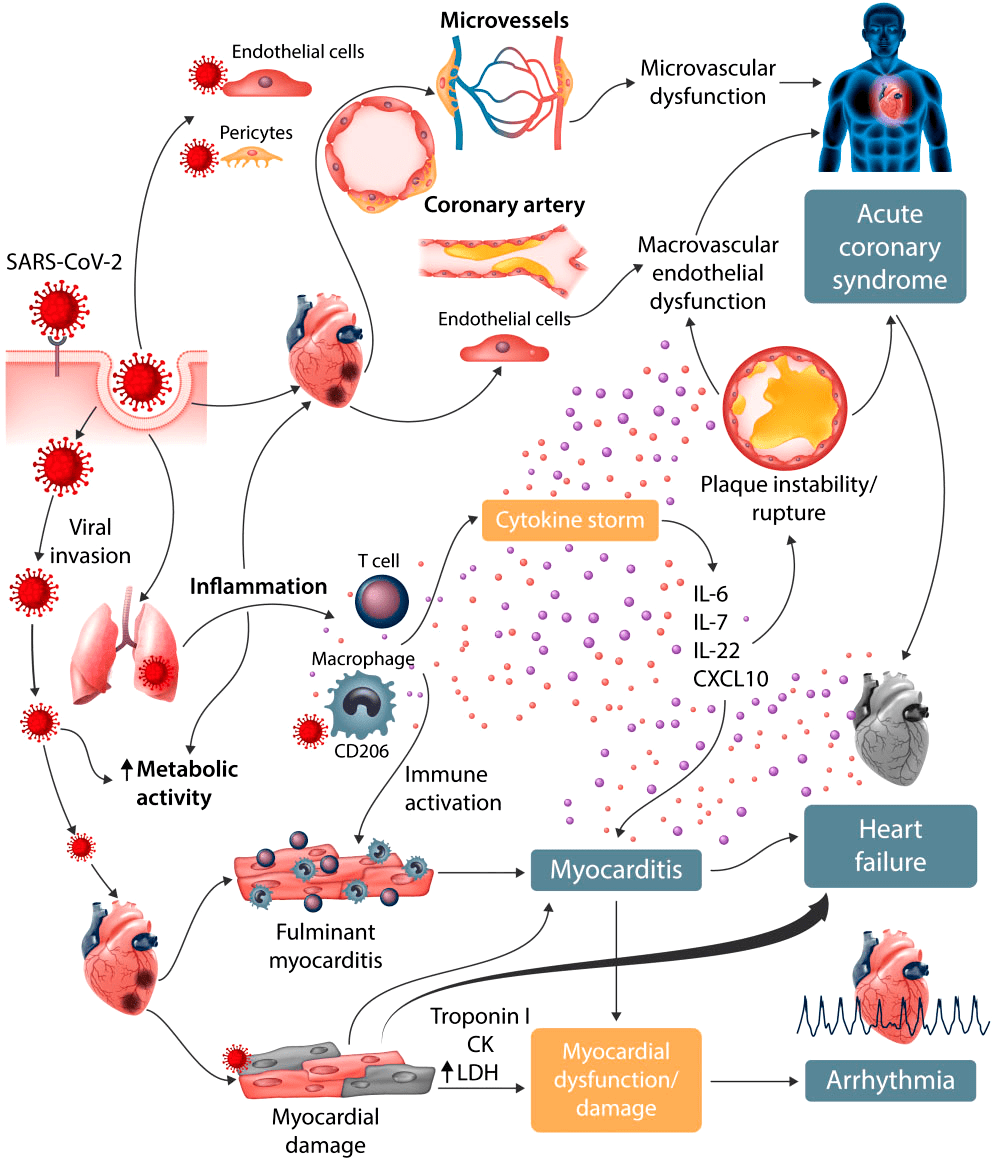
Помимо дыхательных путей, SARS-CoV-2 поражает сердечно-сосудистую систему. Это приводит к высвобождению высокочувствительных сердечных тропонинов (hs-cTnl) — белков, содержащихся в сердце и скелетных мышцах человека. В процессе заражения мембраносвязанный белок ACE2 может расщепляться трансмембранным дезинтегрином ADAM17, высвобождая ACE2 в кровоток. Таким образом, вирус циркулирует в крови зараженного организма. Воспаление сосудистой системы и миокарда может привести к миокардиту, сердечной недостаточности и быстрому ухудшению состояния больного [25].
Рисунок 5. Сердечно-сосудистое поражение при COVID-19
SARS-CoV-2 и мочеполовая система
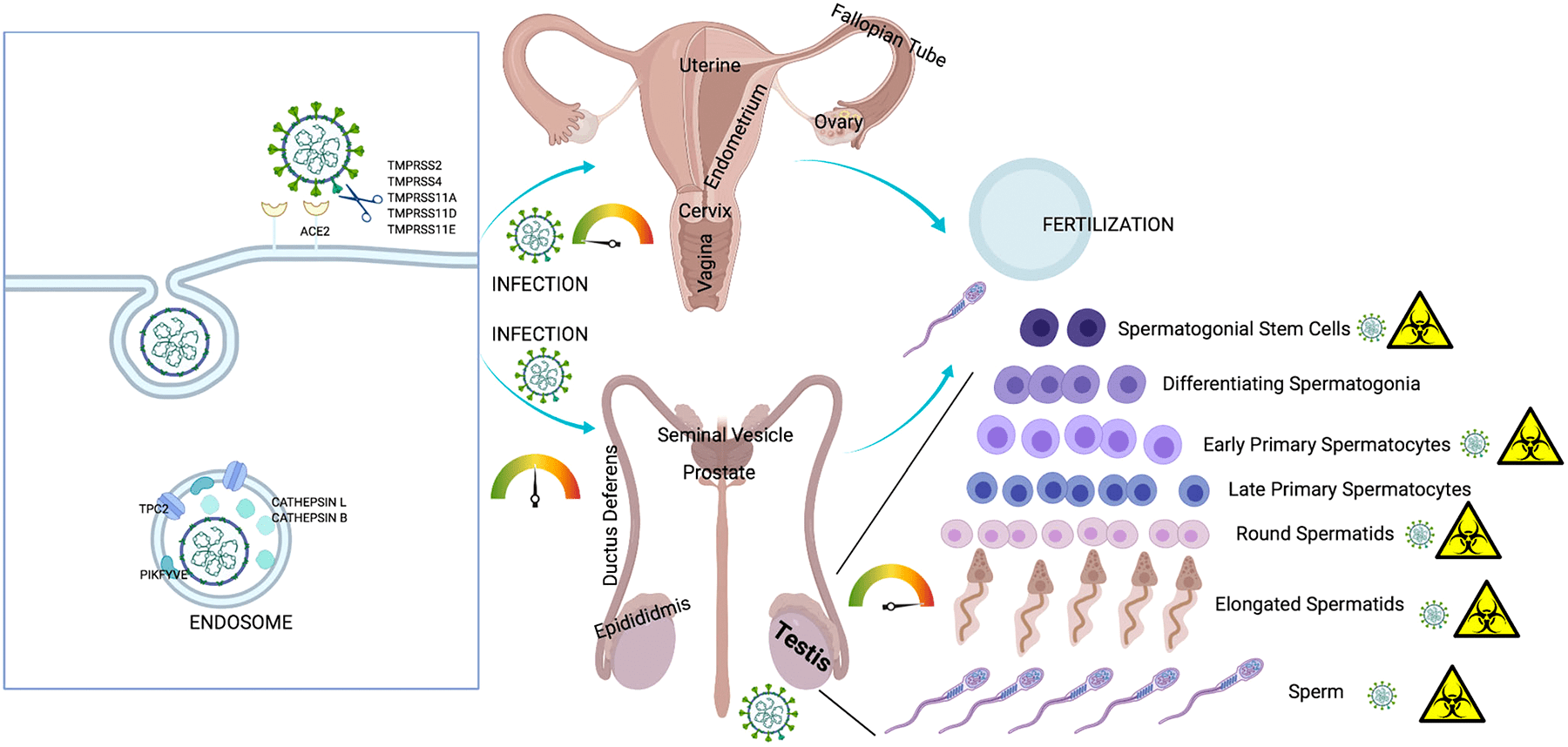
Инфекция репродуктивной системы требует большего внимания, потому что она не только влияет на нынешнее поколение, но также может распространяться на потомство через поврежденные гаметы. На сегодняшний день несколько исследований подтвердили влияние SARS-CoV-2 как на мужскую, так и на женскую репродуктивную систему [26], [27]. В настоящее время хорошо известен факт, что мужчины более восприимчивы к инфекции SARS-CoV-2 и у них выше уровень смертности, чем у женщин. Это объясняется тем, что клетки семенного протока и сперматогонии синтезируют много ACE2 [28–30].
По мнению ученых, SARS-CoV-2 нарушает репродуктивные функции мужчин через несколько механизмов, таких как воспалительные реакции, окислительный стресс и апоптоз [31–33]. Инфекция SARS-CoV-2 приводит к перепроизводству активных форм кислорода, которые могут усиливать внутриклеточные сигнальные пути (NF-κB-TLR). Это приводит к высвобождению цитокинов, что еще больше усиливает воспалительный ответ. К примеру, орхит, вызванный инфекцией SARS-CoV-2, может привести к окислительному стрессу в тканях яичка. Окислительный стресс может вызвать внутриклеточное окислительное повреждение сперматозоидов, что приводит к ухудшению их качества и мужскому бесплодию.
Рисунок 6. Инфекция SARS-CoV-2 и репродуктивная система
Рецепторы ACE2 были также обнаружены в женских яичниках [34], [35]. Можно предположить, что SARS-CoV-2 поражает ткань яичников и клетки гранулезы и таким образом ухудшает функцию яичников и жизнеспособность ооцитов, что может привести к бесплодию или невынашиванию [33]. Недавно ученые (Виванти и др.) сообщили о трансплацентарной передаче вируса от матери, инфицированной COVID-19, новорожденному. Мать была инфицирована в последнем триместре беременности, и гены SARS-CoV-2 были обнаружены в ткани плаценты. Согласно этому отчету, трансплацентарная передача может привести к воспалению плаценты [36]. Однако стоит отметить, что плацента имеет плацентарный барьер, который не смешивает кровь матери и плода, тем самым защищая плод от всех видов материнской инфекции. Невосприимчивые клетки плаценты обладают противовирусными свойствами, которые дополнительно предотвращают проникновение SARS-CoV-2 в клетки ребенка [37].
Вывод
Прочитав эту статью, мы с вами узнали, как вирус поражает не только дыхательную систему, но и другие системы человека. Это осложняет потенциальные клинические проявления и затрудняет лечение случаев COVID-19. Однако биомедицинские исследования могут помочь нам больше узнать о способностях нового коронавируса и о том, как с ним бороться, чтобы определить важные ориентиры для дальнейших исследований, диагностики и лечения. Также стоит всегда помнить, что соблюдая правильную диету и карантинные меры, мы снижаем риски заражения и ухудшения состояния здоровья во время COVID-19. Ведь вирус не всегда может вызвать вышеуказанные осложнения, если мы будем правильно заботиться о своем здоровье.
Ваш гид по мутациям SARS-CoV-2 Биологи рассказывают о том, как меняется коронавирус
Этот материал впервые был опубликован в казахстанском издании «Vласть». «Новая газета» перепечатывает его на условиях партнерства.

Что такое мутации? Из школьного курса биологии вы помните, что эволюция — по сути накопление адаптаций к окружающей среде. Так вот, мутации — это и есть способ адаптироваться. Вирусы — не что иное, как генетическая информация в упаковке из белка (и иногда липидов). Из-за своей простоты (и хитрости, конечно) мутируют они постоянно (в среднем до 1 млн раз быстрее человека), это их способ существования. Коронавирус SARS-CoV-2 в этом году совершил огромный рывок в развитии, он перепрыгнул на нового хозяина, — на человека. Этот выход из зоны комфорта дался ему нелегко, и он до сих пор к нам привыкает. Поэтому в мутациях нет ничего удивительного. Другое дело, что за обычными простудными коронавирусами, с которыми мы встречаемся каждый сезон, мы так тщательно не следим. Сравниваем мы SARS-CoV-2, как правило, с вирусом атипичной пневмонии 2003-2004 годов. А уж за тем, как развивается сам SARS-CoV-2, сейчас происходит беспрецедентно тщательный контроль. По вирусным меркам коронавирус не так изменчив. Было подсчитано, что в одном ВИЧ-инфицированном пациенте разница между двумя вирусами ВИЧ будет больше, чем между Уханьским и британским штаммом коронавируса! Собственно, это одна из причин, по которой до сих пор не удалось создать вакцину против постоянно «убегающего» от иммунной системы и мутирующего ВИЧ.
Как можно следить за мутациями?
Эволюционные биологи любят рисовать деревья, но не обычные, а филогенетические. Каждый листик — генетическая последовательность (например, ДНК какого-то вида животных или растений, РНК или ДНК вируса или даже аминокислотная цепочка белка). Самый удобный сайт, содержащий информацию о РНК коронавируса по всему миру — Neхtstrain.org. Информация на нем обновляется в реальном времени. Сайт был создан задолго до пандемии, и содержит информацию о распространении и эволюции многих инфекций, таких как вирус Зика, корь и туберкулез. Во время пандемии этот ресурс стал одним из важнейших инструментов борьбы с дезинформацией и фейками, так как это прекрасный пример открытости данных. Он позволяет в реальном времени понять, как быстро могут меняться вирусы и как вирус смог перепрыгнуть на нового хозяина. В этом материале мы расскажем о том, как пользоваться этим ресурсом и что мы на данный момент знаем о мутациях SARS-CoV-2.
Kакие бывают мутации и что значат все эти буквы и цифры в громких заголовках?
Генетический код, состоящий из четырех букв — это, пожалуй, самый красивый механизм в природе. Четыре буквы (А, Т, Г, Ц в ДНК и А, У, Г, Ц в РНК) обозначают четыре азотистых основания, последовательность которых и является генетическим кодом. В случае SARS-CoV-2 генетическая информация представляет собой молекулу РНК, в которой около 30 000 азотистых оснований. Сбором данных, которые используются для анализа сайтом Neхtstrain, занимается организация GISAID (первые буквы от global initiative on sharing avian influenza data). Эта организация появилась в 2006 году, чтобы объединить усилия во время эпидемии птичьего гриппа, и стала успешным примером открытости и борьбы с сокрытием данных о вспышках инфекционных заболеваний. На данный момент в открытом доступе можно найти почти 300 000 последовательностей геномов SARS-CoV-2 (геном=набор генов), которые расставлены в филогенетическом дереве с 5 января 2020 года по сегодняшний день.
Теперь о том, как вирус «решает», какие мутации ему нужны. Селективное давление —термин, который описывает степень воздействия естественного отбора, которая влияет на скорость появления генетических изменений. Еще в начале эпидемии высказывалось мнение, что коронавирус будет мутировать, а значит, «слабеть», чтобы не убивать хозяина. Но на самом деле,
SARS-СoV-2 не меняется в сторону снижения или повышения летальности, так как особого эволюционного давления для этого не наблюдается — смертность и так не слишком высока.
Важно повторить, что большинство мутаций проходят незамеченными и не сохраняются в популяции. Если мутация очень сильно мешает вирусу (например, полностью отключая очень важный ген), то, скорее всего, она не сохранится попросту потому, что вирусу от нее будет слишком плохо. А выигрышной для вируса будет мутация (или группа мутаций), которая поможет закрепиться в хозяине как можно дольше, не убивая его слишком быстро, чтобы успеть распространиться. Это и увеличение «заразности» (то есть, более эффективное проникновение в клетку и длительное асимптоматическое течение), и мутации, помогающие «спрятаться» от иммунной системы (а именно, от иммунных клеток памяти и антител).
Мухтар Садыков и его коллеги в своей недавней публикации отметили важность изучения как позитивного (то есть, когда мутации необходимы вирусу для адаптации), так и негативного селекционного давления (когда участки генома важны для функционирования вируса, то частота мутаций там ниже среднего).
Наибольшее количество изменений, — уже более 4000 мутаций, — происходит в знаменитом белке-шипе. Шипы на поверхности, из-за которых вирус и получил свое название (сходство с короной солнца), важны для того, чтобы прикрепиться к рецептору на поверхности клетки хозяина и заразить ее. Этот процесс можно себе представить так: вы — вирус, а ваша ладонь — белок-шип. Чтобы открыть дверь (рецептор на поверхности клеток АСЕ2) и зайти в комнату (в клетку), вы, вирус, держитесь ладошкой (белком-шипом) за ручку (участок на АСЕ2, который связывается с шипом). На этом видео вы можете посмотреть как именно происходит эта встреча.
Коротко о четырех главных мутациях
Теперь давайте проследим, как менялся коронавирус. Начать, пожалуй, следует с его происхождения. И хотя точного ответа у нас до сих пор нет, филогенетический анализ подсказывает нам, что SARS-СoV-2 ближе к коронавирусам летучих мышей и панголинов (или яванских ящеров), чем к вирусу атипичной пневмонии 2003-2004 годов SARS-СoV. Основная разница между двумя человеческими вирусами в том, что SARS-СoV-2 намного эффективнее «открывает дверь» в клетку, изменив тот самый белок-шип. И если в геноме коронавирусов летучих мышей этого «апдейта» пока не было обнаружено, то в коронавирусах панголинов схожее преимущество уже присутствует. Существуют две главные гипотезы происхождения SARS-СoV-2: он или мутировал в организме животного (летучей мыши или панголина), или же изменился до неузнаваемости уже в организме человека. Анализируя имеющиеся данные, ученые приходят к выводу о том, что искусственное создание коронавируса в лаборатории — версия хоть и интересная, но на данный момент беспочвенная. Доктор Мухтар Садыков на примере коронавируса также напоминает о важности контроля за вирусами животных:
«Согласно исследованиям, вирус, очень похожий с SARS-СoV-2, начал циркулировать в летучих мышах уже несколько десятков лет назад. Это важное напоминание о необходимости мониторинга за различными вирусами животных, чтобы предупредить возникновение эпидемий».
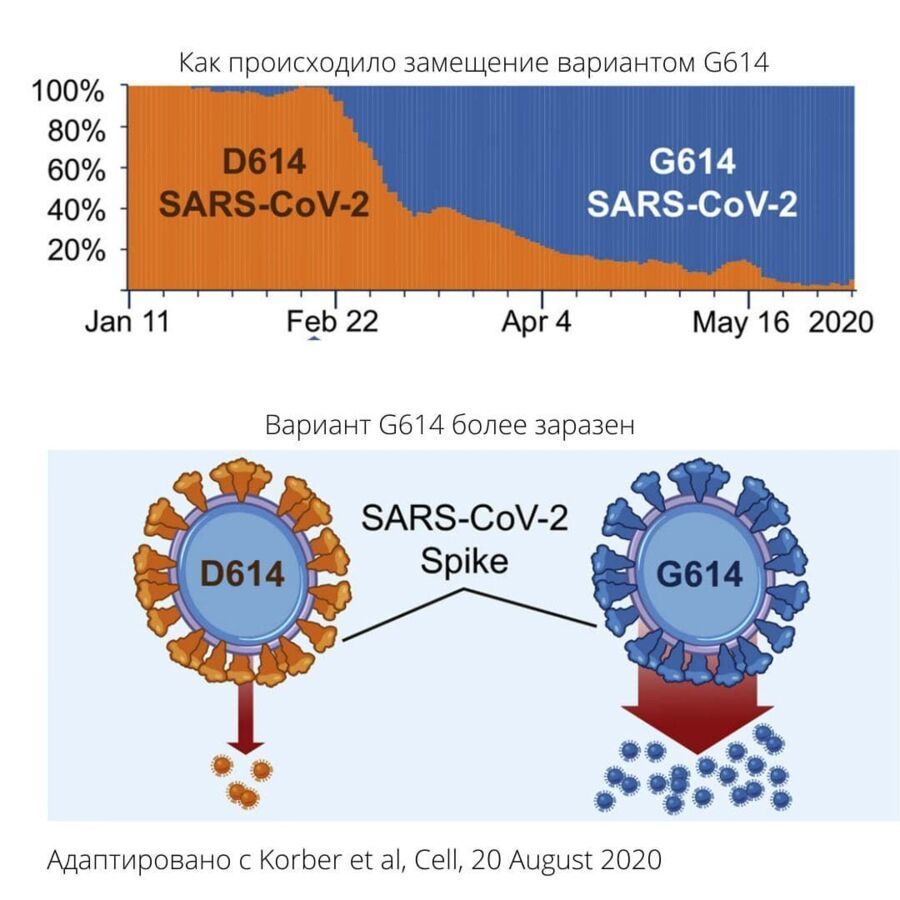
Итак, год назад появился новый коронавирус. Генетическая последовательность, которая используется в качестве начального образца генома коронавируса, была взята у пациента из Уханя в декабре 2019 года. Вирус тут же начал мутировать, а ученые сразу начали тщательно за этим следить. Уже в январе была замечена, пожалуй, главная мутация — D614G — замена аспартата на глицин на позиции 614 в белке-шипе. Мутация стала настолько важной и удобной для вируса, что уже к июню стала доминировать во всем мире. Эти две аминокислоты сильно различаются по своим свойствам и было ожидаемо, что такое изменение может значительно повлиять на поведение вируса. Как именно? Исходя из исследований на клетках, на лабораторных животных, а также согласно эпидемиологическим данным, мы можем сделать вывод о том, что этот вариант вируса заражает эффективнее, а также лучше размножается (Hou et al Science, 18 Dec 2020) в верхних дыхательных путях. Но также было предварительно показано, что эта мутация не влияет на тяжесть заболевания, на чувствительность к нейтрализующим антителам и на эффективность вакцин.
Следующий нашумевший вариант вируса называется «Cluster 5», он был обнаружен в июне 2020 в Дании у людей, работающих с норками. Тут важно отметить, что норки — важный и давно известный резервуар для инфекций, они способствуют ускоренному изменению вируса и поэтому контроль за ними очень важен. Этот вариант вируса содержит комбинацию мутаций всё там же, в белке-шипе: делеция (потеря) аминокислот на позициях 69-70; замена Y453F внутри участка, который связывается с ACE2; замена I692V and M1229I. Датские власти, а с ними и все мы, испугались не на шутку. Чтобы ограничить дальнейшее распространение этого варианта вируса, были уничтожены около 14 млн норок. А некоторые страны, например, Нидерланды, и вовсе запретят норковые хозяйства к 2024 году. Но по предварительным данным, эта мутация не влияет на тяжесть и степень передачи инфекции. Однако, у этого варианта слегка снижена чувствительность к нейтрализующим антителам, что вызывает некоторые опасения в связи с повторным заражением. Но Дания показала пример максимально быстрого реагирования, поэтому этот вариант удается держать под контролем.
Третья важная мутация, которая стала поводом для написания этого материала, является частью так называемого британского варианта коронавируса — VOC 202012/01 (он же VUI – 202012/01, он же B.1.1.7). Обнаружен он был в октябре 2020 года, на начало января он присутствует уже в более чем 30 странах. Он содержит 23 мутации, большинство из них находится в белке-шипе. Одна из мутаций схожа с датскими норками, это делеция на позициях 69-70. А главная мутация — N501Y — является заменой аминокислоты в маленьком участке белка-шипа, который связывается с АСЕ2. Комбинация этих двух мутаций, вероятно, и объясняет повышенную контагиозность данного варианта вируса. Как мы об этом узнали? Дело в том, что один из самых популярных ПЦР тестов в Великобритании — TaqPathCOVID-19 компании Thermo Fisher. Он определяет наличие 3 участков РНК вируса. Один из них, что находится в белке-шипе в аккурат на месте делеции 69-70, вдруг перестал выявляться, тогда как другие два были на месте. Это побудило британцев на всякий случай определить полную последовательность генома и обнаружить новый вариант вируса! Этот ПЦР тест дал нам много информации о распространении этого штамма за короткий срок (следить было проще простого — двa участка вместо трех), а реакция властей и возможность проведения массового секвенирования быстро позволила нам определить точные генетические изменения. Но это также говорит о том, что, возможно, в других странах мы попросту не заметили появление этого варианта, что еще раз подчеркивает значимость секвенирования.
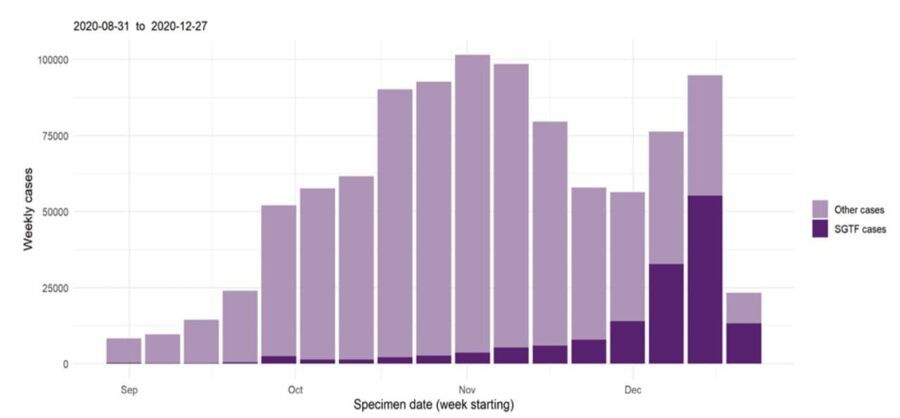
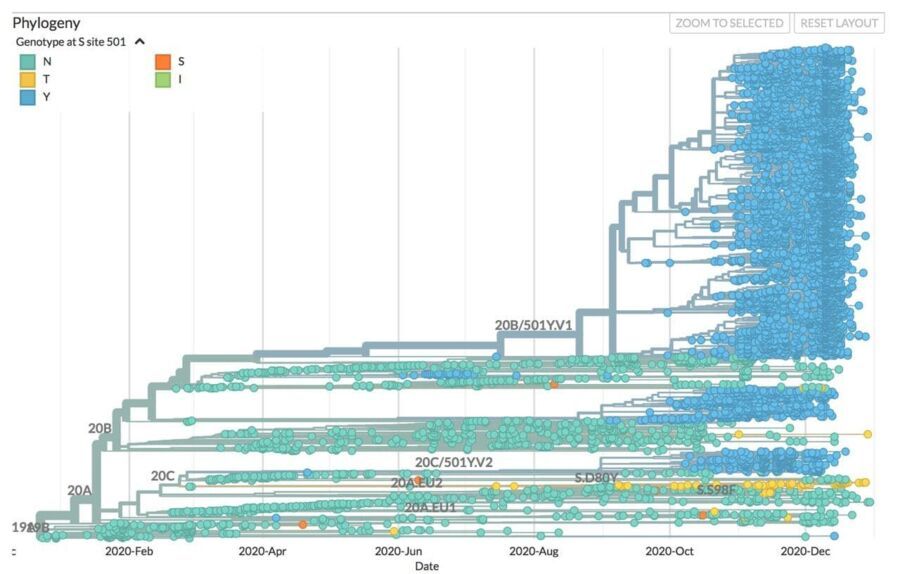
На что влияет это изменение вируса? Ключевым фактором здесь является, видимо, комбинация мутаций, что, возможно, изменяет не только состав, но и форму шипа и других белков, что является своеобразной попыткой сбежать от «наручников» нейтрализующих (умелых, качественных) антител, которые должны в идеале сформироваться у нас по результату знакомства с вирусом или (внимание!) с вакциной. У нас есть некоторые данные о том, как эти мутации могут по отдельности влиять на поведение вируса. Так, потеря двух аминокислот на позициях 69-70 не только снижает эффективность некоторых диагностических тестов, как было описано выше, но также она, возможно, возникла в результате использования терапии плазмой переболевших пациентов.
То есть, возможно, использование антител в качестве терапии в некоторых пациентах может создавать среду для селективного давления и подобного изменения структуры вируса.
Следовательно, эта мутация может привести к тому, что вирус сможет избежать иммунного ответа антителами. Также в этом варианте присутствуют 6 мутаций в гене ORF1ab, но они пока мало изучены. Другой интересной мутацией является P681H, которая влияет на слияние мембраны клетки и оболочки вируса, что, возможно, помогает вирусу проникать в клетки респираторного эпителия, а также облегчает передачу вируса на животных моделях. Еще одно важное изменение: белок ORF8, который очень изменчив и значительно различается с аналогичным белком SARS-CoV (вируса атипичной пневмонии). Мутация, которая поменяла код 27 аминокислоты на знак «стоп» делает его последовательность в четыре раза меньше (26 аминокислот вместо 121). На что это влияет? Пока не ясно, но мы знаем, что этот белок сбивает с толку нашу иммунную систему, отключая интерферон, и имеет непосредственное отношение к цитокиновому шторму. Возможно, потеря функции этого белка повлияет на течение болезни, но это еще необходимо установить экспериментально. Ну и самая известная мутация N501Y (замена аминокислоты на позиции 501) находится в ключевом контактном участке белка-шипа, состоящем из 6 аминокислот. Предполагается, что это изменение может значительно повлиять на степень связывания с рецептором АСЕ2.
Какая у нас есть информация о распространении этого варианта? Качество данных зависит от страны (ресурсы для секвенирования и организация тестирования). Примером здесь, пожалуй, является Дания, которая секвенирует до 2000 геномов в неделю. 86 случаев VOC 202012/01 уже было зарегистрировано (11% всех новых случаев), и они развиваются в отдельной ветке, что означает, что имело место локальное распространение варианта. Ситуация же в Великобритании очень беспокоит, стране пришлось объявить новые строгие карантинные меры. Но дело здесь, скорее всего, не только в новом варианте вируса, а также в эпидемиологической ситуации по возвращению с каникул. Вообще относительно новых версий коронавируса важно не делать поспешных решений. Панику порождают высказанные вслух предположения. Так, некоторые британские специалисты высказались о том, что новый вариант опаснее для детей, но по факту, скорее всего, это связано с открытием школ.
Предварительно по эпидемиологическим данным из-за очевидного экспоненциального роста мы видим, что этот вариант возможно более заразен. Но так ли он опасен в плане тяжести болезни? На прошлой неделе британская правительственная комиссия опубликовала результаты исследования, которое говорит о том, что вариант VOC 202012/01 не является более опасным по тяжести заболевания. В этом когортном исследовании участвовали 1769 пациентов, зараженных новым вариантом коронавируса, и их данные сравнили с таким же числом пациентов, зараженных старым вариантом.
Итак, было показано, что нет статистической разницы в продолжительности и тяжести заболевания, в показателях смертности и в вероятности повторного заражения.
Поэтому основной вывод: без паники, новый вариант не так опасен, как его представляет Борис Джонсон!
И четвертый вариант вируса, который следует упомянуть — из Южной Африки под кодовым названием 501Y.V2. Он похож на британский, так как содержит ключевую мутацию N501Y, но появился он независимо от него. Этот вариант доминирует в южно-африканском регионе с ноября 2020 года, на сегодня обнаружен в четырех странах. Было показано, что такое изменение вируса повышает вирусную нагрузку, следовательно, возможно, более эффективно заражает клетки. А в остальном нужно больше данных. Кстати, количество данных напрямую зависит от доходов страны, ведь секвенирование в таком количестве, как в Европе, африканским странам не доступно. А нехорошо от этого нам всем, так как в случае с мутациями «Предупрежден — значит вооружен»! Будем надеяться, что пандемия заставит пересмотреть взгляд на технологическое неравенство.
Будут ли работать вакцины?
Пожалуй, самый обсуждаемый и сложный на сегодня вопрос. Мутации коронавируса обнажают недостатки и преимущества разных подходов к разработке вакцин. Традиционные цельновирионные (содержащие живой или убитый вирус) вакцины, возможно, менее подвержены кардинальному изменению эффективности из-за мутаций. Тогда как новые подходы, использующие часть вируса (белок или РНК), рискуют не сработать, так как изменения в вирусе могут быть слишком значимы. Безусловно, настораживает тот факт, что мутации, укрепившиеся в белке-шипе, могут сделать его неузнаваемым для антител, сформировавшихся после вакцинации. Мутации затронули участки, которые входят в состав самых успешных РНК вакцин от Pfizer/Biontech и Moderna. Основатель компании Biontech Угур Шахин успокаивает: «Да, мы знаем, что некоторые участки мутировали. Но там еще много участков, которые остались нетронутыми и пока нет оснований считать, что вакцина не сработает». К слову, компания Biontech уже проверила более 20 установившихся вариантов вируса, и сейчас проверяет «британский» вариант. Также ученый отметил, что в случае необходимости поменять РНК последовательность, они готовы это сделать за две недели, в короткий срок обеспечив миллионы новых доз. В этом главное преимущество РНК вакцин.
У Мухтара Садыкова есть интересные предположения относительно мутаций на белке-шипе:
«На данный момент есть уже с десяток установившихся мутаций на белке-шипе, которые отличаются от первого Уханьского вируса. А также есть множество других мутаций, которые помогают вирусу избежать распознавания иммунной системой. Сейчас, после массовой вакцинации, у вируса может появиться сильное эволюционное давление, особенно на белок-шип. Это может привести еще ко многим мутациям, что в итоге заставит нас пойти по сценарию ежегодной вакцинации, как с вирусом гриппа».
Доктор Болат Султанкулов, работающий над проектом по использованию нанотел для диагностики коронавирусной инфекции, чуть более оптимистичен: «Я предполагаю, что существующие вакцины все-таки будут работать против нового штамма. Дело в том, в ответ на вакцину формируются поликлональные антитела, а это значит, что если нет кардинальных изменений в форме белка-шипа, антитела, вырабатывающиеся на вакцину, должны физически перекрывать доступ к участку, который связывается с АСЕ2. Однако, это лишь мое предположение и нам нужны экспериментальные данные от производителей вакцин. Единственное, чего мы еще не получили, так это данных о том что вирус слабеет, становится менее агрессивным по симптоматике, переходит в разряд «простудных», так как снижение смертности в основном связано с тем, что мир чуть-чуть научился лечить Ковид-19. После массовой вакцинации мы увидим насколько вирус приспосабливается, так как в популяции есть пул генотипа супер-распространителей, они, в свою очередь, и являются генераторами новых мутаций. Дело в том, что иммунная система супер-распространителей работает по-другому, они своего «летучие мыши». Будет очень интересно, как именно они реагируют на вакцинацию, так как предположительно они вырабатывают меньше антител и дают вирусу возможность мутировать, чтобы избежать иммунного ответа.
А как мы знаем из эпидемиологии, всегда есть «пациент 0» и одного человека достаточно, чтобы все началось заново. Возможно, это будет не в этом году, а через полгода или 10 лет.
Вирус, скорее всего никуда не исчезнет, нам остается лишь наблюдать и быть готовыми к быстрому реагированию. А предположение о том, что он никуда не уйдет и после вакцинации связано с его родичами, вызывающими обычную простуду. Остается надеяться на то, чтобы вирус пошел по их пути и просто ослаб».
Есть некоторые опасения по тому, как происходит сейчас вакцинация от Ковид-19. Дело в том, что она происходит двумя инъекциями. Первая — знакомство с антигеном и появление специфического иммунитета, а вторая — закрепление иммунитета в адекватной для защиты дозе. Существуют опасения, что вакцинация в низкой дозе (например, проведение первой инъекции и задержка второй) будет создавать селективное давление на вирус и даст рост еще большим изменениям. А поэтому не совсем уместно изменение графика вакцинации или вакцинация мизерной доли населения. По словам одного из создателей сайта Neхtstrain.org Эммы Ходкрофт, кампании по вакцинации должны быть быстрыми, масштабными и четко организованными. Если добавить к этому сложности с хранением и транспортировкой РНК вакцин, то задача не из легких.
Какие мы можем сделать выводы сейчас?
Сами по себе мутации — нормальный и постоянный для вирусов процесс. Большинство главных мутаций коронавируса не делают его опаснее в плане тяжести заболевания, ведь вирусу не нужно, чтобы мы умирали быстрее. Однако, возможно, они делают его заразнее, и для этого уже есть некоторые данные. Мутаций у коронавируса много (в одном только белке-шипе их более 4000), и мы за ними тщательно следим. Влияние этих мутаций на эффективность вакцин пока не было доказано, мы ждем данных от производителей вакцин и независимых лабораторий, которые сейчас проверяют это на новых вариантах.
Что делать нам всем? Дистанцируйтесь и надевайте маски, пока ученые получают больше данных. А мы будем держать вас в курсе новостей.
Асель Мусабекова — биолог и вирусолог, специально для Vласти