Хроническое гранулематозное воспаление что это
Хроническая гранулематозная болезнь
Хроническая гранулематозная болезнь — это редкая форма первичного иммунодефицита, при которой нарушается бактерицидная функция фагоцитов. Является наследственным заболеванием, в основном передается по Х-сцепленному рецессивному типу. Патология проявляется рецидивирующими инфекциями легких, ЖКТ, кожи и других органов. Для диагностики используется проточная цитометрия, генетическое тестирование, микробиологические исследования. Лечение включает антибиотикотерапию, противогрибковые препараты, иммуномодуляторы, в отдельных случаях рекомендована трансплантация костного мозга.
МКБ-10
Общие сведения
Заболевание известно с 1954 г. благодаря ученому C.A. Джейнвею и его коллегам, а генетические причины патологии начали изучаться только в 1980-х гг. Хроническая гранулематозная болезнь (ХГБ) встречается редко, в США ее регистрируют у 1 ребенка на 200-250 тысяч новорожденных. Данные по распространенности в России отсутствуют. Редкость проблемы, недостаточная осведомленность педиатров и терапевтов, сложности в подборе адекватной поддерживающей терапии — все это обуславливает большую актуальность этой хронической наследственной болезни в медицине.
Причины
Болезнь вызвана генетическими мутациями, которые передаются по наследству. Самым частым вариантом является Х-сцепленная мутация в гене gp91-фокс (60-70%). Болеют мужчины, а женщины являются носителями дефектного гена. Оставшиеся случаи приходятся на аутосомно-рецессивный тип наследования, связанный с генными мутациями p22-фокс, p47-фокс, p67-фокс. Этот подтипом заболевания могут страдать больные обоего пола.
Патогенез
В основе хронической гранулематозной болезни лежит дефицит НАДФН-оксидазного комплекса, который образуется при участии цитозольных и мембраносвязывающих белковых единиц. Вследствие мутации генов образование этих протеинов нарушается, в организме пациента не синтезируются ферменты, способные превращать молекулярный кислород в активные формы — супероксидный анион, перекись водорода, синглетный кислород.
Эти окислители в норме вырабатываются гранулоцитами (фагоцитами), составляют основу кислородозависимого этапа фагоцитоза. Он необходим для переваривания отдельных видов бактерий и грибков, продуцирующих фермент каталазу (например, Klebsiella sp, Candida albicans, Aspergillus niger). Остальные звенья клеточного иммунитета не нарушены, поэтому вирусные и паразитарные инфекции встречаются не чаще, чем в среднем в популяции.
Симптомы
Дети с ХГБ рождаются здоровыми, клинические признаки заболевания у них появляются в первые 2 года жизни. В атипичных случаях симптомы Х-сцепленного варианта хронической патологии манифестируют к 5 годам, а при аутосомно-рецессивном наследовании — к 9 годам. Основным признаком болезни являются инфекции, вызванные каталазоположительными Грам+ (Staphylococcus aureus) или Грам- бактериями (E. coli, Serratia liquefaciens, Klebsiella sp., P. aeruginosa, Proteus sp.).
Первичный иммунодефицит в 70-80% случаев манифестирует с рецидивирующих бактериальных инфекций дыхательных путей: тонзиллитов, бронхитов, пневмоний. Инфекционные заболевания отличаются тяжелым течением, умеренным ответом на стандартную антибиотикотерапию, частым переходом в нагноительные процессы. При этом образуются буллы, абсцессы, гангрена легкого.
В дальнейшем у 75-100% пациентов развиваются хронические гнойные лимфадениты, которые проявляются покраснением, припухлостью, болезненностью лимфоузлов. При поражении подмышечных или паховых узлов беспокоит резкая боль при движениях конечностями. В 24-41% случаев формируются гнойные воспаления печени, у 20-30% больных наблюдаются рецидивирующие желудочно-кишечные инфекции, бактериальные и грибковые поражения костей.
Характерным признаком гранулематозной болезни является генерализованный «бецежит», возникающий как осложнение после проведения первой прививки БЦЖ, проявляющийся спустя 1-2 месяца после иммунизации. Патология связана с недостаточностью клеточного иммунитета при введении ослабленных микобактерий Коха. Также после вакцинации есть вероятность начала остеита — формы костного туберкулеза.
Осложнения
Опасное последствие хронической гранулематозной болезни — аспергиллез легких, который провоцирует до 25% случаев смерти среди пациентов. Абсцессы печени чреваты развитием тяжелого гепатолиенального синдрома. Поражение костной ткани грибковым процессом, особенно в области позвоночника и ребер, сопряжено с массивной диссеминацией возбудителя, отличается крайне неблагоприятным прогнозом.
Типичным осложнением иммунодефицита у страдающих гранулематозной болезнью являются неконтролируемые микробные инфекции, которые распространяются по организму с возникновением сепсиса, септицемии, септического шока. При критическом снижении иммунитета, отсутствии своевременной помощи эти заболевания заканчиваются смертью больного. Также при гранулематозной болезни у детей отмечаются задержка роста, отставание в физическом развитии.
Диагностика
При первичной диагностике устанавливаются общие признаки иммунодефицита, выясняется семейный анамнез, степень риска генетической патологии. При физикальном осмотре патогномоничные проявления хронической гранулематозной болезни не определяются. Для постановки диагноза требуется комплексное лабораторно-инструментальное обследование:
Лечение хронической гранулематозной болезни
Консервативная терапия
При острых эпизодах микробных инфекций, возникших у пациентов с ХГБ, назначаются стандартные антибиотики из класса макролидов, цефалоспоринов, фторхинолонов. Для терапии грибкового поражения наиболее эффективен амфотерицин В, который принимается длительными курсами. Поддерживающее лечение, которые направлено на снижение риска инфекционных осложнений, включает следующие лекарства:
Экспериментальное лечение
Наиболее перспективным методом терапии больных хронической гранулематозной болезнью считается трансплантация гемопоэтических стволовых клеток, чтобы полностью восстановить нормальную иммунную защиту. Однако пересадка сопряжена с высоким риском осложнений, поэтому проводится ограничено в рамках исследовательских программ. На стадии разработки находятся различные методы генной терапии.
Прогноз и профилактика
Несмотря на применяемые методы лечения, нередко развиваются системные грибковые и бактериальные инфекции с летальным исходом. Прогноз относительно неблагоприятный, наблюдается ухудшение качества и снижение продолжительности жизни больных. Профилактика осложнений предполагает обеспечение постоянной поддерживающей терапии, проведение вакцинации в полном объеме (за исключением БЦЖ), максимальное ограждение пациента от инфекций.
Орофациальный гранулематоз
Орофациальный гранулематоз (ОФГ) характеризуется гранулематозным воспалением тканей лица и полости рта, при этом системное заболевание, вызывающее гранулемы, отсутствует.
Гранулематозное воспаление — это локальное воспаление, характеризующееся образованием гранулем (папул или узелков), вызванных несостоятельностью деятельности (трансформацией, пролиферацией) клеток, способных к фагоцитозу, играющих важную роль в иммунных реакциях и защите организма от инфекций.
Известны две клинические формы орофациального гранулематоза: гранулематозный хейлит Мишера (для него характерен стойкий или рецидивирующий отек нижней губы/губ) и синдром Мелькерссона — Розенталя (у него три клинических признака: рецидивирующий паралич лицевого нерва, складчатый или скротальный язык и стойкие отеки губ и периорбитальной области).
В некоторых случаях орофациальный гранулематоз может быть связан с такими заболеваниями, как саркоидоз, болезнь Крона и инфекционными заболеваниями (туберкулез).
ОФГ, возникающий сам по себе (не на фоне сопутствующих заболеваний) называют идиопатическим. До 40% пациентов с ОФГ имеют положительную реакцию при аллергопробах.
Распространенность орофациального гранулематоза неизвестна. По некоторым данным, она составляет всего 0,08% от общей популяции.
Причины
Причины возникновения орофациального гранулематоза точно неизвестны, однако предполагается, что заболевание связано с аномальным иммунным ответом у человека с предрасполагающими генетическими факторами. Считается также, что ОФГ может развиваться вследствие аллергических реакций — воздействия пищевых, контактных, лекарственных и других антигенов (бензоаты, ментол, глутамат натрия, коричный альдегид, додецилгаллат, золото, кобальт, ртуть).
Заболевание наблюдается и у мужчин, и у женщин, обычно развивается в молодом возрасте. Средний возраст манифестации ОФГ составляет 32 года, однако зарегистрированы случаи заболевания как возрасте 3 лет, так и в возрасте 78 лет.
Симптомы
Диагностика
Диагноз орофациальный гранулематоз устанавливается на основании физикального осмотра и симптомов (рецидивирующего отека ротовой полости или лица). И местные, и системные состояния, характеризующиеся гранулематозным воспалением, должны быть исключены соответствующими клиническими и лабораторными исследованиями. Подтверждает диагноз биопсия мягких тканей (губы или орофациальной области) с микроскопическим исследованием биоптата на неказеозные гранулемы.
Дифференциальный диагноз: приобретенный отек, связанный с дефицитом ингибитора C1-эстеразы, острые осложнения саркоидоза, болезнь Крона, абсцесс зуба, дерматологические проявления гранулематоза с полиангиитом или саркоидоза, гранулематоз с полиангиитом (гранулематоз Вегенера), гистоплазмоз, лепра, риноспоридиоз, эндокринная офтальмопатия, туберкулез.
Лабораторные исследования могут включать анализы на фолиевую кислоту, железо, витамин B12, ангиотензинпревращающий фермент, квантифероновый тест или кожную пробу на туберкулез. Для исключения саркоидоза врач может назначить анализ на определение антител к Saccharomyces IgA/IgG. Аллергопробы используются для исключения реакций на металлы, пищевые добавки и другие антигены.
Для исключения болезни Крона может быть назначена гастродуоденоскопия с прицельной биопсией и гистологическим исследованием, рентгенография/рентгеноскопия пищевода и желудка. Рентгенография органов грудной клетки или позитронно-эмиссионная томография могут назначаться, чтобы исключить саркоидоз и туберкулез.
Лечение орофациального гранулематоза
Орофациальный гранулематоз трудно поддается лечению. Оно сложное, растянуто во времени и направлено на устранение симптомов. Его эффективность окончательно не подтверждена. Лечение может включать глюкокортикоидную терапию (системную или введение препаратов непосредственно в очаг поражения) и нестероидные противовоспалительные препараты (для устранения отеков); антибиотики, иммуносупрессоры и хирургические методы (при стойких отеках, мешающих говорить и принимать пищу, а также для уменьшения давления на лицевой нерв). В случаях выявленной аллергии следует избегать контакта с антигеном. Соблюдение диеты (исключение корицы и бензоатов) может улучшить состояние пациента.
У пациентов с поражениями полости рта впоследствии может развиться болезнь Крона, поэтому необходима консультация гастроэнтеролога, иммунолога, диетолога. Чтобы исключить вероятное развитие болезни Крона и язвенного колита необходимо дальнейшее наблюдение.
Особенности и преимущества лечения орофациального гранулематоза в клинике Рассвет
Диагностика и лечение редких синдромов и болезней требует от врача глубоких и специфических знаний, помогающих правильно распознать орфанную патологию и назначить эффективное лечение.
Клиника Рассвет располагает современным и высокоточным оборудованием, позволяющим нашим врачам быстро и эффективно проводить диагностику и лечение любых состояний, в том числе таких редких заболеваний, как орофациальный гранулематоз. В нашей работе мы придерживаемся мультидисциплинарного подхода, поэтому при необходимости быстро подключаем к проблеме специалистов разных направлений: стоматологов, гастроэнтерологов, иммунологов, диетологов.
Рассвет — это доказательная медицина, лечение, основанное на международных протоколах, правильная коммуникация и поддержка пациентов.
Хроническое гранулематозное воспаление что это
Кафедра патологической анатомии ГБОУ «Первый МГМУ им. И.М. Сеченова»
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
Иммунное гранулематозное воспаление как приспособительная реакция организма
Журнал: Архив патологии. 2014;76(4): 39-44
Пауков В. С., Коган Е. А. Иммунное гранулематозное воспаление как приспособительная реакция организма. Архив патологии. 2014;76(4):39-44.
Paukov V S, Kogan E A. Immune granulomatous inflammation as the body’s adaptive response. Arkhiv Patologii. 2014;76(4):39-44.
Кафедра патологической анатомии ГБОУ «Первый МГМУ им. И.М. Сеченова»
На основании собственных исследований и анализа литературы авторы выдвигают гипотезу о приспособительном характере хронического иммунного гранулематозного воспаления, возникающего при инфекционных заболеваниях, характеризующихся развитием нестерильного иммунитета. Предлагаемая гипотеза позволяет утверждать, что не всякое хроническое воспаление является выражением несостоятельности защитных сил организма при взаимодействии с повреждающим фактором. На примере туберкулеза и лепры показана несостоятельность ряда существующих представлений о пато- и морфогенезе эпителиоидно-клеточной и лепрозной гранулем. Авторы считают, что при туберкулезе резидентные макрофаги сохраняют функцию уничтожения микобактерий, благодаря чему иммунная система получает информацию об антигенных детерминантах возбудителей. Израсходовав все гидролазы на уничтожение микобактерий, макрофаги не образуют новые лизосомы из-за способности возбудителей препятствовать их образованию. В результате макрофаг, лишенный лизосом, трансформируется в эпителиоидную клетку, которая, сохраняя функцию фагоцитоза, теряет способность убивать возбудителей. Именно в ней протекает эндоцитобиоз. Периодически эти микроорганизмы разрушают эпителиоидную клетку и выпадают в зону творожистого некроза гранулемы. Часть из них вновь фагоцитирует эпителиоидные клетки для поддержания нестерильного иммунитета, а остальные уничтожаются воспалительными макрофагами. Принципиально аналогично протекает пато- и морфогенез лепрозной гранулемы, особенно ее туберкулоидного типа. Таким образом поддерживается нестерильный иммунитет, характерный для туберкулеза, лепры и, возможно, для других микобактериозов.
Кафедра патологической анатомии ГБОУ «Первый МГМУ им. И.М. Сеченова»
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
Настоящая работа является анализом как собственных многолетних разнообразных исследований воспаления, так и известных фактов и представлений о нем на основе закономерностей общей патологии в соответствии с взглядами И.В. Давыдовского [1, 2] о причинности в медицине и А.И. Струкова [5] о единстве структуры и функции.
Воспаление определяют как реакцию организма, направленную на уничтожение повреждающего фактора, его элиминацию и репарацию возникших повреждений. Сейчас уже не возникают дискуссии по поводу приспособительного характера острого воспаления. Вместе с тем хроническое воспаление рассматривается как выражение несостоятельности защитных сил организма при взаимодействии с повреждающим фактором, в том числе и с инфекционным возбудителем, и поэтому оно не может иметь адаптивного значения [2, 3, 7, 17].
Это в первую очередь относится к хроническому гранулематозному воспалению, которое характерно для инфекций, сопровождающихся нестерильным иммунитетом, таким как туберкулез, лепра и некоторые другие. Пока что никто убедительно не объяснил, зачем организму нужен нестерильный иммунитет, но именно такой иммунитет характерен для хронических иммунных гранулем, в первую очередь для туберкулеза, лепры, особенно для ее туберкулоидного типа, возможно, и для некоторых других микобактериозов. Однако, несмотря на множество исследований этих болезней, особенно туберкулеза и лепры, в их патогенезе остается много неясного. Поэтому специалисты в своей практике пользуются сложившимися представлениями, часто не имеющими убедительных обоснований или объяснений.
Так, принято считать, что в формировании туберкулезной эпителиоидно-клеточной гранулемы и гранулемы при туберкулоидном типе лепры ведущую роль играет тот факт, что резидентные макрофаги теряют способность уничтожать микобактерии и поэтому в них происходит лишь эндоцитобиоз [7, 16]. Полагают, что это связано с особенностями бактерий, которые могут блокировать функцию лизосом [10]. Однако при анализе этого постулата возникает ряд вопросов.
Если макрофаги не способны уничтожать микобактерии туберкулеза, то каким образом и откуда иммунная система получает информацию об их антигенных детерминантах? Без такой информации невозможно формирование клеточного иммунитета по типу гиперчувствительности замедленного типа. Вместе с тем если макрофаги не уничтожают микобактерии, то возбудители должны размножаться внутри этих фагоцитов и в таком случае при туберкулезе и лепре количество микобактерий должно прогрессивно и быстро увеличиваться, что не может не сопровождаться нарастающей тяжелой интоксикацией с яркими клиническими и морфологическими проявлениями. Однако интоксикация развивается на более поздних этапах болезни и связана в основном с нарастающим казеозным некрозом и генерализацией процесса. Кроме того, при такой ситуации количество макрофагов должно быстро увеличиваться, так как их фагоцитарная функция сохраняется, а масса микобактерий также быстро нарастает. В этом случае гранулема достигала бы очень больших размеров и имела черты макрофагальной гранулемы, либо макрофаги не смогли бы локализоваться лишь в области гранулемы и распространялись с кровотоком, обусловливая генерализацию процесса. Если в макрофагах происходит эндоцитобиоз, то в чем смысл их трансформации в эпителиоидные клетки, которые практически не содержат лизосом, не образуют фагоцитарную вакуоль и, следовательно, не могут уничтожать микобактерии туберкулеза?
Каким образом происходит трансформация макрофагов в эпителиоидные клетки, если макрофаг является конечной формой дифференцировки клетки, которая не может больше делиться? Наконец, зачем вообще при таких болезнях нужна гранулема, в которой не уничтожается возбудитель, защищенный к тому же цитомембраной макрофагов или эпителиоидных клеток? На эти вопросы убедительных ответов нет.
С этих позиций многое становится понятным в пато- и морфогенезе туберкулеза и лепры, если учесть, что эти болезни также характеризуются нестерильным иммунитетом, т.е. для поддержания иммунитета как основного фактора защиты организма необходимо сохранение микобактерий. Наилучшим механизмом такой защиты является образование иммунной гранулемы. Однако для этого иммунная система вначале должна получить информацию об антигенных детерминантах возбудителей, для чего необходимы резидентные макрофаги с их обычной фагоцитарной функцией и большим количеством лизосом в цитоплазме. Без уничтожения возбудителя антиген не может быть выявлен.
При первичном инфицировании гранулемы нет, но есть первичный аффект, представляющий собой очаг некроза, вызванного микобактериями, и перифокального серозного воспаления. При этом закономерно в зоне воспаления появляются резидентные, а затем воспалительные макрофаги. Они содержат большое количество лизосом, фагоцитируют микобактерии, образуют фагоцитарную вакуоль и уничтожают их с помощью гидролаз лизосом, выявляя при этом антигенные детерминанты возбудителя, передают информацию о них в иммунную систему, которая начинает нарабатывать CD4 + T-лимфоциты подтипа T h1 (рис. 1, а б). 

Мы проверили в эксперименте такую возможность, создав условия для фагоцитоза макрофагами туши, после чего вводили в ту же ткань взвесь стафилококков [4, 6]. Было установлено, что макрофаги фагоцитируют тушь и образуют фагоцитарные вакуоли. Если при этом остается часть лизосом, то затем при инфицировании ткани стафилококками макрофаги их фагоцитируют и уничтожают. Однако если количество фагоцитированных капель туши столь велико, что все лизосомы расходуются на образование фаголизосом, то поглощенные затем микроорганизмы не уничтожаются лизосомами и вокруг них не образуются фагоцитарные вакуоли. По существу в макрофагах происходит эндоцитобиоз. Таким образом, эндоцитобиоз может развиваться в макрофагах при фагоцитозе ими количества возбудителей, превышающего потенциальные возможности этих клеток.
Вместе с тем микобактерии обладают способностью изменять рН цитоплазмы и «арестовывать» эндосомы макрофага [16]. Это означает, что основная масса лизосом будет израсходована на разрушение микобактерий, а новые не образуются. Таким образом, макрофаг практически лишается лизосом и трансформируется в эпителиоидную клетку, которая сохраняет функцию фагоцитоза, но не способна образовывать фагоцитарную вакуоль. В ней почти нет лизосом (рис. 2), 
Заключение
Таким образом, предложенная гипотеза ставит под сомнение ортодоксальный постулат о том, что хроническое воспаление всегда есть проявление неспособности организма обеспечить свою защиту от повреждающего фактора и поэтому является сугубо патологическим процессом. Она позволяет некоторые виды хронического воспаления, по крайней мере хроническое иммунное гранулематозное, рассматривать как приспособительный процесс, не только обеспечивающий защиту организма от генерализации инфекции, во всяком случае до тех пор, пока сохраняется достаточно высокая функция его иммунной системы, но и предохраняющий его от повторного заражения определенными микобактериями.
О том, что в организме здоровых людей, но перенесших инфицирование или заболевание туберкулезом, сохраняются микобактерии в очагах Гона, Симона и др., свидетельствует наличие у них специфических аллергических реакций, выявляемых известными пробами, а также то, что при ослаблении иммунитета у инфицированных больных в результате разнообразных дополнительных воздействий на иммунную систему развивается обострение туберкулеза и при этом гранулемы теряют черты эпителиоидно-клеточных. Мы понимаем, что эта гипотеза достаточно дискуссионна, может вызвать ряд возражений и нуждается в каких-то уточнениях, но полагаем, что она может заставить отказаться от сложившихся шаблонов и быть стимулом для попытки иного осмысления не вполне понятных механизмов патогенеза многих заболеваний и их осложнений.
Современные представления о хронической гранулематозной болезни (ХГБ)
Хроническая гранулематозная болезнь (ХГБ) — достаточно неплохо изученное на сегодняшний день наследственное заболевание, связанное с недостаточностью фагоцитарной системы, следствием которой является иммунодефицит. Впервые ХГБ была описана в 1959 году у детей, для которых болезнь оказалась смертельной [1]. Болезнь не поддавалась лечению; на аутопсии выявляли генерализованное гранулематозное воспаление, отличающееся по своей специфике от известных на тот момент инфекционных и неинфекционных заболеваний.
Сегодня нам известно намного больше. Заболевание в большинстве случаев более не является смертельным, выявляется в основном у детей (врожденный иммунодефицит проявляется достаточно быстро), неплохо купируется. Однако до сих пор ХГБ относится к заболеваниям неизлечимым.
Этиология и патогенез
Сущность хронической гранулематозной болезни — в недостаточности фермента НАДФ-оксидазы, который представляет собой комплекс каталитических протеинов. Этот фермент, находясь в фагоцитирующих клетках, обеспечивает перенос электрона с НАДФ на молекулярный кислород: происходит т. н. «респираторный взрыв» (см. Рис. 1). Строго говоря, данный фермент есть не только у фагоцитов: единственным специфичным для них белком является трансмембранный gp91, остальные же компоненты встречаются в самых разных клетках [2].
Обратимся к рисунку 1. Белки gp91 и p22 объединяют в цитохром b558 — мембраносвязанную часть фермента НАДФ-оксидазы, остальные протеины называют цитозольными. При активации фагоцита различными медиаторами цитозольные p47 и p67 фосфорилируются и связываются вместе. Комплекс приобретает сродство к белкам p47 и rac2 — таким образом, присоединяясь к ним, данные протеины вызывают конформационные изменения в мембранном цитохроме b558, — и комплекс приобретает оксидазную активность [2, 5]. НАДФ-оксидаза переносит электрон от своего кофермента НАДФ на кислород с формированием активных форм кислорода (АФК) — O 2- и H2O2. Вот здесь и начинается самое интересное.
Классически считается, что фагоцит убивает микробы, образуя фаголизосому с бактерией или грибом, воздействуя на них большими дозами высокотоксичных АФК; однако в последнее время приобретает актуальность иная точка зрения. В 2002 году в Nature была опубликована статья, авторы которой пересмотрели всю парадигму деактивации поглощенных микробов.
Ученые обнаружили, что если в фагоцитах мышей определяется нормальный уровень активных форм кислорода, но имеется недостаточность лизосомальных ферментов — животные будут беззащитны против стафилококковых и кандидозных инфекций. То есть, несмотря на наличие нормального респираторного взрыва, иммунодефицит все равно присутствует. Стало быть, эффекторами в инактивации микроба являются не сами АФК [6].
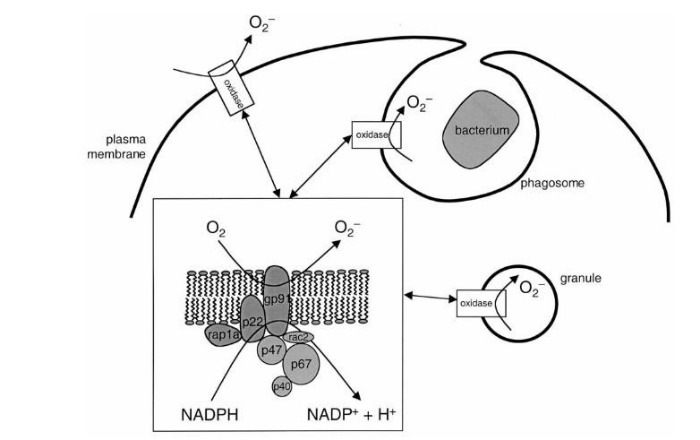
Согласно новой модели, АФК являются медиаторами в уничтожении микроба, а непосредственные «убийцы» — ферменты лизосом, обладающие протеолитической активностью. Как известно, при захвате фагоцитом микроба формируется вакуоль — (фагосома), с которой впоследствии сливается лизосома макрофага [7]. На мембране этой вакуоли и функционирует НАДФ-оксидаза, постоянно увеличивая концентрацию АФК. Однако как уже было сказано, данный процесс — не конечный эффекторный механизм.
Наследование и генетика
Хроническая гранулематозная болезнь имеет наследственную природу. Приблизительно данной патологией страдает 1 на 250 000 [9], что делает заболевание достаточно редким и потому трудным в диагностическом отношении. Заболевание вызывает мутация любого из четырех генов, кодирующих субъединицы ключевого фермента фагоцитоза НАДФ-оксидазы. Более двух третей случаев связаны с X-сцепленным наследованием (дефект гена CYBB, кодирующего белок p-91); остальные случаи связаны с аутосомно-рецессивным наследованием генов CYBA, NCF-1 и NCF-2, кодирующих белки p22, p47 и p67 соответственно. Исходя из этого болезнь обозначают как ХГБ X91, A22, A47 и A67 (в зависимости от типа наследования и локуса гена) [10].
Примечательно, что в литературе нет (или крайне мало) доказанных случаев наследственного дефекта других субъединиц. Однако в последнее время обнаруживаются все новые мутации генов, следствием которых становится ХГБ: например, в 2009 году выделили еще один подвид ХГБ, связанный с аутосомно-рецессивной мутацией гена p-40 [11], имеются также сведения о единственном пациенте с недостаточностью белка Rac2 — [10]. Вполне вероятно, что могут существовать и другие генетические патологии, вызывающие данное заболевание.
Диагностика
Диагностика ХГБ основана на выявлении клинических признаков, кроме того, важно выявить наличие или отсутствие респираторного взрыва. Последнее можно осуществить несколькими гистологическими и иммунологическими методами, например, окрашивание нитросиним тетразолием (НТЗ) позволяет определить, вырабатывают ли клетки АФК — НТЗ будет утилизироваться активными формами кислорода, в результате чего из бледно-желтого тетразолия образуется голубой формазан [12].
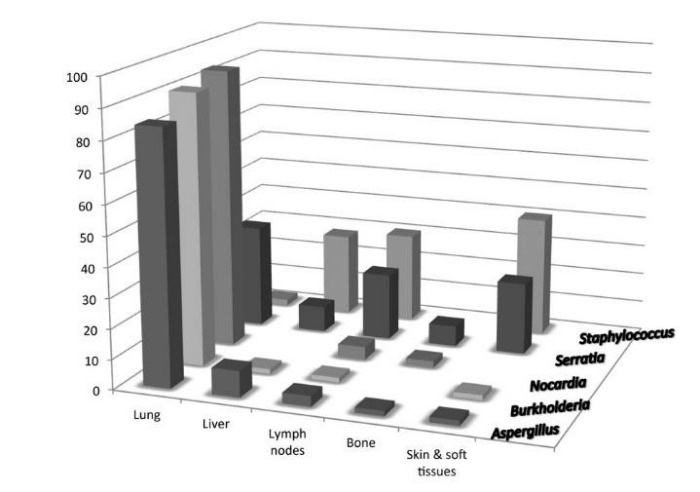
Среди наиболее ярких клинических симптомов можно выделить: пиодермию, пневмонию, воспалительные процессы желудочно-кишечного тракта, лимфаденит, абсцесс печени и остеомиелит [13] на фоне рецидивирующих бактериальных и грибных инфекций.
В крови выявляется гипергаммаглобулинемия и анемия. В местах дренажей — хроническое воспаление с образованием гранулем. Также гранулемы могут формироваться в различных тканях и органах: например, в желудке гранулематозное воспаление способно привести к обструкции желудочного канала, в урогенитальном тракте — к циститу. Также следует упомянуть, что почти 20 % больных ХГБ страдает от гранулематозного колита, который легко перепутать с болезнью Крона [14].
Также следует упомянуть о недавно открытой бактерии, выявленной у пациентов с ХГБ, которую исследователи предложили назвать Granulobacter bethesdensis. Это грамотрицательная палочка, которая на данный момент не может быть отнесена ни к одной из существующих таксономических групп; бактерия поражает лимфоузлы, кроме того, резистентна к антибиотикам in vitro и, скорее всего, — in vivo [18, 19]. Предполагается, что это — лишь первая из подобных бактерий, возникшая в эру антибиотиков. На данный момент Granulobacter bethesdensis не слишком распространена, однако имеет к этому весьма опасную тенденцию.
Лечение
В настоящее время активно разрабатываются методики, которые смогут не просто позволить больным с ХГБ жить полноценно, но и в перспективе совершенно избавить их от бремени заболевания. Поскольку болезнь наследственная, крайне трудно придумать что-то существенное, однако такие попытки предпринимаются, и некоторые из них обнадеживают.
Одна из них — лечение хронической гранулематозной болезни с помощью генной инженерии [20]. В 2006 году в Nature Medicine была опубликована статья, авторы которой сообщили об успешной коррекции генома двух пациентов с X-сцепленной формой ХГБ. После лечения у пациентов определяли активность нейтрофилов с помощью позитронно-эмиссионной томографии, а также других инструментальных методов. Исследование показало, что в обоих случаях фагоциты после проведенного лечения смогли оказать сопротивление инфекции. На данный момент это — одна из самых многообещающих методик.
Еще одним способом терапии является пересадка гемопоэтических клеток [21]. Двадцати семи пациентам после миелоаблативного режима кондиционирования (подготовка пациента к трансплантации с помощью лучевой или цитостатической терапии — прим. автора) пересадили гемопоэтические стволовые клетки от наиболее подходящих доноров (по белкам HLA — главного комплекса гистосовместимости). Двадцать три пациента вполне успешно перенесли операцию, а дальнейшее наблюдение позволило говорить об излечении этих пациентов от хронической гранулематозной болезни. Однако еще 4 пациента умерли от последующих инфекций (15 %).
В остальном же современная медицина может предложить крайне немного. Это — патогенетическая и симптоматическая терапия с использованием антибиотиков, дренажей и прочего. Излишне говорить, что подобное лечение не способно избавлять пациентов от ХГБ.
Профилактика инфекций.
Крайне важно предотвращение развития инфекционного процесса. Пациенты с ХГБ испытывают невероятные трудности в повседневной жизни, например, некачественная чистка зубов спокойно может окончиться гингивитом, а царапина — тяжелой бактериемией. Потому больным необходимо тщательным образом следить за гигиеной, выполнять профессиональную чистку зубов, обрабатывать все царапины антисептиком. И, разумеется, такие пациенты должны быть привиты по всем правилам [14]. В противном же случае даже достаточно простая инфекция может окончиться летально.
Источники: