Хроническая тканевая гипоксия что это
Механизмы гипоксии
Noreen R. Henig, David J. Pierson
Статья опубликована в журнале
Respiratory Care Clinics of North America
Volume 6, Number 4, December 2000
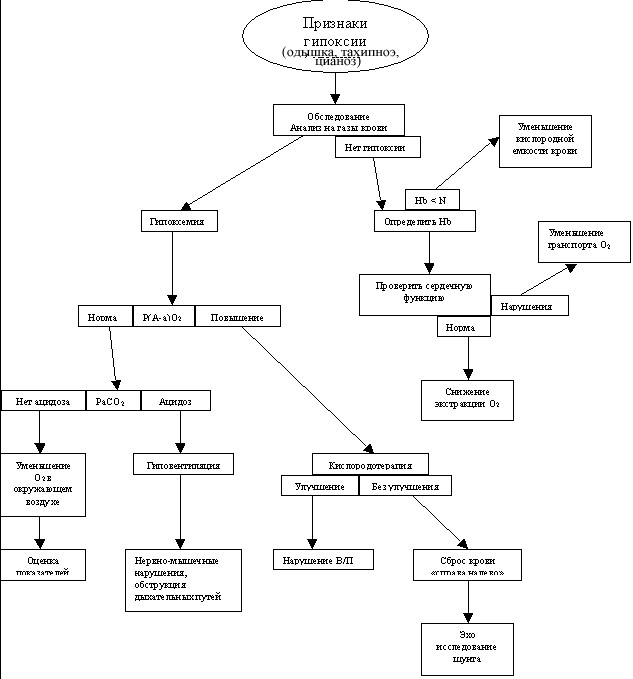
Четырьмя основными механизмами гипоксемии, которые необходимо запомнить каждому студенту медику являются низкий уровень кислорода, гиповентиляция, нарушение соотношения перфузии–вентиляции, сброс крови «справа налево». Если запомнить этот список и понять сами механизмы, то каждый может быстро и легко выявить причину гипоксии у пациента.
Человеческий организм является аэробным. Это значит, что все процессы клеточного метаболизма зависят от уровня молекул кислорода, которые поддерживают основные функции организма. Несмотря на то, что организму необходим кислород, клинически определить субоптимальные потребности очень тяжело и невозможно подсчитать. У пациентов с недостаточной оксигенацией могут наблюдаться цианоз, одышка, сердцебиение, потеря сознания, парестезии, усиление диуреза, гипотермия или боль. pH крови может быть понижен, а уровень лактата повышен в результате анаэробного метаболизма. Все или ни одного из этих признаков могут присутствовать, однако это дело лечащего врача подозревать гипоксию и выявлять ее причину.
В этой статье авторы обсуждают определение гипоксемии, обозревают анатомию легочной системы и этапы доставки кислорода и описывают четыре основные причины гипоксемии с примерами из практики. В заключении будет описан пятый механизм гипоксии, который у человека встречается очень редко. Вследствие того, что поместить кислород в кровоток человека это еще только полдела, авторы описали еще и механизм гипоксии тканей при адекватном обмене кислорода в легких.
Гипоксемия против гипоксии
Гипоксемия – это состояние, при котором парциальное давление кислорода в артериальной крови (РаО2) меньше нормального (менее 60 мм рт. ст.). Если пациент, дышит кислородом, но РаО2 у него ниже, чем ожидается, то необходимо исключить гипоксемию, даже если уровень РаО2 выше 60 мм рт. ст. Гипоксемия возникает вследствие непопадания кислорода в кровь. Гипоксия тканей возникает вследствие того, что клеткам не хватает кислорода для выполнения функции метаболизма. Хотя гипоксемия (слишком маленькое поступление кислорода в кровь) обычно является причиной гипоксии тканей, существуют другие состояния, которые прерывают поступление кислорода в кровь и приводят к гипоксии.
Для того чтобы понять обстоятельства, которые приводят к гипоксемии или гипоксии, необходимо представить путь, который проходят молекулы кислорода из воздуха в ткани, где они используются как топливо для клеток. Во время спонтанного дыхания мозг генерирует сигнал, который ведет к сокращению диафрагмы и расширению грудной клетки. При этом создается отрицательное давление в грудной полости, вследствие чего воздух проникает по дыхательным путям в альвеолы. Молекулы кислорода диффундируют через стенку альвеол в капилляры. В крови большинство кислорода переносится гемоглобином в эритроцитах, в то время как небольшой процент растворяется в плазме. Кровь перекачивается через легкие из правого желудочка сердца и после этого возвращается в левое предсердие и желудочек для того, чтобы оттуда разойтись по телу. По ходу того, как артерии разделяются на более мелкие капилляры, кислород освобождается из гемоглобина и поступает в ткани для питания клеток. Углекислый газ, который является продуктом клеточного метаболизма, диффундирует из тканей в капилляры и проходит по венозной системе в правое сердце. Кровь, насыщенная углекислым газом, проходит в легкие. Таким образом, углекислый газ может диффундировать через альвеолярно–капиллярный барьер, чтобы выйти из организма во время выдоха.
 |
| Рисунок 1. |
Таблица 1. Механизмы гипоксии
Гипоксемия с нормальным Р(А-а)О2
Гипоксемия с увеличением Р(А-а)О2
Гипоксия тканей без гипоксемии
Механизмы гипоксемии
Уменьшение кислорода в окружающем воздухе
Неадекватный транспорт кислорода
Если кислород попал в кровь и связался с гемоглобином, то доставка кислорода к тканям начинает зависеть от сердечного выброса. Отношение сердечного выброса (Qt) и транспорта кислорода (DO2) показано в таблице 2. Уменьшение сердечного выброса может привести к внутренней сердечной дисфункции или внешним сердечным нарушениям. В результате уменьшения или нарушения сердечного выброса развивается гипоксия тканей.
Внутренняя сердечная дисфункция
Первичные заболевания сердца зачастую возникают вследствие патологии коронарных сосудов и ишемической кардиомиопатии. Однако гипертензия, патология клапанов сердца, нарушения ритма и кардиомиопатии неишемической этиологии (алкоголь, вирус) также играют большую роль в дисфункции сердца. У пациентов с признаками гипоксии, при нормальном анализе крови на содержание кислорода, сердечная дисфункция является наиболее частой причиной данного состояния. Хотя при сердечной дисфункции чаще всего пациента госпитализируют, скрытые заболевания сердца часто обостряют основную причину заболевания. Сепсис может ухудшить тканевую гипоксию, связанную с гипотонией. Пациентам необходимо выполнить эхокардиографию, коронарную ангиографию, провести функциональные исследования, такие как стресс тест при подозрении на первичную патологию сердца.
Внешние сердечные нарушения
Неадекватная периферическая экстракция кислорода
Даже если кислород полностью связался с гемоглобином и был доставлен к тканям, то существует два обстоятельства, при которых нарушается утилизация кислорода клетками. Первым является тот факт, что кислород может быть сильно связан с гемоглобином, что препятствует переходу в ткани. Вторым является обстоятельство, при котором происходит интоксикация митохондрий, с помощью которых в клетке происходят процессы метаболизма.
Сродство гемоглобина к кислороду
Сродство гемоглобина к кислороду определяется по форме и позиции кривой диссоциации оксигемоглобина (рис. 6).
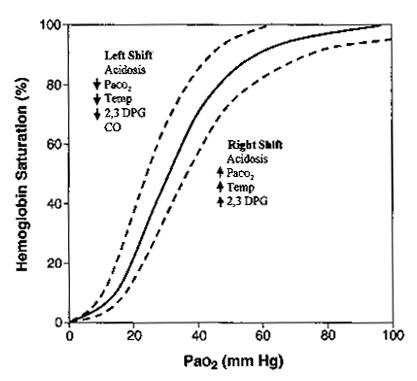 |
| Рисунок 6. Кривая диссоциации гемоглобина. Данная кривая показывает взаимоотношение РаО2 (по горизонтальной оси) с сатурацией гемоглобина (вертикальная ось). Существуют несколько факторов, которые влияют на способность гемоглобина связываться с кислородом. Кривая будет смещаться вправо, указывая на уменьшение связывания кислорода в легких или облегчение отдачи кислорода тканям. Данная картина встречается при ацидозе, гиперкапнии, гипертермии, повышения 2,3-дифосфоглицерата (2,3-ДФГ). Кривая будет отклоняться влево, увеличивая насыщение кислорода в легких и уменьшая отдачу кислорода тканям. Это встречается при алкалозе, гипокапнии, гипотермии, уменьшении 2,3-ДФГ, отравлении угарным газом. |
Когда кривая смещается вправо, сродство снижается и кислорода на грамм гемоглобина становится меньше, хотя на периферии кислород отсоединяется более легко. Когда кривая смещается влево и кверху сродство к кислороду увеличивается. Больше кислорода захватывается в легких где показатель РаО2 высокий, но на уровне тканей, где РаО2 низкий количество доступного кислорода снижается. Алкалоз, гипотермия, гипокапния, уменьшение 2,3-ДФГ приводят к сдвигу кривой влево. При переливании цельной крови происходит уменьшение 2,3-ДФГ, тем самым выражается вредное действие массивных гемотрансфузий. Так как 2,3-ДФГ вырабатывается эритроцитами, эффект обычно кратковременный. Угарный газ не сдвигает кривую влево, но занимает гемоглобиновые мостики и тем самым приводит к гипоксии.
Интоксикация митохондрий
Заключение
Существует большое количество заболеваний, которые могут закончиться гипоксемией. Гипоксемия возникает вследствие одного из этих факторов: снижение кислорода в окружающем воздухе, гиповентиляции, нарушения В/П, сброса крови «справа налево». При обследовании пациента необходимо установить действительно ли у него есть гипоксемия и если это так то необходимо определить Р(А-а)О2. Таким образом, определив газовый состав крови можно провести дифференциальный диагноз и правильно оценить ситуацию. Важно также запомнить, что при подключении более одного механизма необходимо снова и снова оценивать состояние пациента.
Хроническая тканевая гипоксия что это
13.1. Механизмы энергообеспечения клеток различной морфофункциональной организации в условиях нормы и гипоксических состояний
Гипоксия – типовой патологический процесс, осложняющий течение различных заболеваний.
Как известно, гипоксия определяет тяжесть течения ишемического поражения сердца, головного мозга, формирование полиорганной недостаточности при ДВС – синдроме, шоковых и коллаптоидных состояний, является неизменным спутником заболеваний инфекционной и неинфекционной природы, а также стрессовых ситуаций.
Тяжесть течения многих заболеваний и их исход в конечном итоге определяется особенностями вторичных неспецифических метаболических расстройств, степенью дестабилизации клеточных мембран, а также возможностями реактивации структурных и ферментных белков в условиях гипоксии.
Вышеизложенное указывает на необходимость дальнейшей детализации механизмов развития гипоксии на молекулярно-клеточном, органном, системном уровнях, а также патогенетического обоснования новых принципов медикаментозной коррекции метаболических и функциональных сдвигов при указанном типовом патологическом процессе.
Как указывалось выше, в соответствии с общепринятыми классическими описаниями происхождения и классификации гипоксических состояний различают гипоксии экзогенного и эндогенного происхождния. Последняя включает дыхательную, циркуляторную, гемическую и тканевую гипоксии системного или локального характера.
Общепринятым является представление о том, что в основе развития гипоксий различного генеза лежат нарушения окислительно-восстановительных реакций в связи с дефицитом кислорода. В то же время высказывается точка зрения о возможности развития субстратного типа гипоксии, обусловленной недостаточностью субстратов окисления, например, глюкозы для нервных клеток, жирных кислот для миокарда.
Как известно, динамика формирования структурных и функциональных сдвигов в различных органах и тканях при гипоксии определяются в значительной мере темпами ее развития, локализацией патологии, характером этиологических факторов, инициирующих гипоксию, и особенностями компенсаторно-приспособительных реакций в том или ином органе.
В соответствии с данными литературы устойчивость тканей различных органов и систем к гипоксии широко варьируют. Наиболее чувствительной к гипоксии является нервная система: при полном прекращении кровотока признаки повреждения коры головного мозга обнаруживается через несколько секунд. Снижение потребления кислорода на 20% структурами головного мозга вызывает потерю сознания. Через 5-6 мин аноксии головного мозга возникают глубокие структурные изменения нейронов, а в продолговатом мозге – через 10-15 мин.
В сердечной мышце мелкие очаги некроза появляются через 3-5 мин с момента, развития ишемии, а крупноочаговый инфаркт миокарда формируется уже спустя 20-30 мин.
Недостаток кислорода в тканях приводит, прежде всего, к дефициту макроэргических соединений, образуемых в сопряженных с окислительно-восстановительными процессами реакциях фосфорилирования на внутренней мембране митохондрий.
Основным энергетическим субстратом для нервной системы, а также для клеток других органов и тканей, является глюкоза. Между тем, при нормальной оксигенации миокарда основным источником его энергетического обеспечения являются высшие жирные кислоты. Так, при окислении 1 молекулы пальмитиновой кислоты образуется 130 М АТФ. В условиях ишемии миокарда усиливается конкурентное ингибирование использования жирных кислот лактатом, что приводит к значительному снижению энергообеспечения миокарда. Так, в процессе анаэробных гликолитических реакций энергетический выход на 1 молекулу глюкозы составляет 2 М АТФ.
Вышеизложенное свидетельствует о том, что независимо от характера этиологических факторов и механизмов развития гипоксии, наиболее ранними проявлениями нарушения оксигенации тканей являются сдвиги их энергетического обеспечения и связанные с ними нарушения углеводного, жирового и белкового метаболизма.
Как известно, процессы ресинтеза АТФ а митохондриях тесно связаны не только с окислительно-восстановительными реакциями, но и с реакциями гликолиза, липолиза, протеолиза, являющимися поставщиками Ац-СоА для цикла Кребса. Установлено, что регулирующими ферментами гликолиза являются фосфорилаза, гексокиназа, фосфофруктокиназа, пируваткиназа, поэтому их подавление в условиях гипоксии приводит к уменьшению образования свободной энергии и в ряде случаев носит необратимый характер. В то же время роль главного регуляторного фермента в последовательных реакциях гликолиза играет фосфофруктокиназа, которую ингибируют АТФ и цитрат, а стимулируют АМФ и АДФ.
Таким образом, в условиях гипоксии, в случаях увеличения потенциала фосфорилирования, возникает активация ключевого фермента гликолиза – фосфофруктокиназы (ФФК) и соответственно возрастание пропускной способности реакции анаэробного гликолиза. При этом резко снижается запас гликогена в сердце, мозге, печени, почках, мышцах и других тканях и соответственно накапливаются продукты гликолитических реакций – молочная и пировиноградная кислоты.
Так активация ФФК на начальных этапах ишемического или гипоксического повреждения клеток приводит к усилению мобилизации гликогена, несколько улучшает энергообеспечение тканей. При этом истощаются запасы гликогена, усиливается ацидоз, приводящий на пике своего развития к подавлению ФФК, и соответственно полной блокаде энергообеспечения клетки.
Развитие метаболического ацидоза при гипоксических состояниях усугубляется также недостаточностью реакций окисления жирных кислот, аминокислот, чрезмерным накоплением кислых продуктов метаболизма указанных соединений.
На обеих стадиях окисления жирных кислот атомы водорода или соответствующие им электроны передаются по митохондриальной цепи переноса электронов на кислород. С этим потоком электронов сопряжен процесс окислительного фосфорилирования АДФ до АТФ. Следовательно, в условиях гипоксии различного генеза блокируются процессы окисления жирных кислот в тканях, в избытке накапливаются кислые продукты, формируется метаболический ацидоз, и соответственно развиваются дефицит АТФ, подавление всех энергозависимых реакции.
Касаясь функциональной значимости метаболического ацидоза, закономерно развивающегося при гипоксии различного генеза, следует отметить ряд последующих неспецифических метаболических и функциональных расстройств, представляющих собой динамическую трансформацию реакций адаптации в реакции дезадаптации.
Как известно, типовой реакцией тучных клеток и тромбоцитов на развитие гипоксии и ацидоза является их дегрануляция с избыточным освобождением в окружающую среду высокоактивных соединений – гистамина, серотонина, ФАТ, ФХЭ, ФХН, лейкотриенов, интерлейкинов. В свою очередь, избыточное накопление ионов водорода, биологически активных соединений приводит к резкому увеличению проницаемости биологических мембран за счет структурных переходов в белках и липидах, и активации процессов свободно-радикального окисления.
Таким образом, среди механизмов, приводящих к повреждению биологических мембран при гипоксии различного генеза, необходимо выделить следующие:
1) развитие метаболического ацидоза,
2) выброс вазоактивных соединений тучными клетками,
3) активацию процессов липопероксидации,
4) высвобождение лизосомальных гидролаз при дезорганизации лизосомальных мембран с последующим усугублением метаболических сдвигов.
13.2. Механизмы развития гипоксического некробиоза.
В настоящее время очевидно, что развитие гипоксического некробиоза связано в значительной мере с дезорганизацией цитоплазматических, лизосомальных, митохондриальных, и других биологических внутриклеточных мембран, формирующих отдельные функциональные и структурные компартменты.
Причем наиболее ранние расстройства возникают у градиентсоздающих и сократительных систем клеток.
Важнейшим фактором повреждения клеток при гипоксии являются ионы кальция.
Как известно, внутриклеточная концентрация кальция в состоянии покоя поддерживается в среднем на уровне 10-7М, что в 100.000 раз меньше, чем в межклеточной жидкости. В период возбуждения кальций проникает из внеклеточной среды в клетку через потенциалзависимые кальциевые каналы. При этом возникают активация фосфолипазы С и образование липидных внутриклеточных посредников – диацилглицерина и инозинфосфамина. Цитоплазматический кальций взаимодействует с кальмодулином – внутриклеточным рецептором с последующей активацией кальмодулинзависимых протеинкиназ и включением тех или иных внутриклеточных реакций.
В условиях гипоксии, дефицита энергетического обеспечения клеток возникают недостаточность механизмов инактивации цитоплазматического кальция и удаления его из клеток в связи с подавлением активности АТФ-зависимого Са-насоса, натрий- кальциевого обменного механизма, дестабилизацией митохондриальных мембран и мембран эндоплазматического ретикулума, играющих в условиях нормы важную роль в поддержании баланса внутриклеточного кальция. При избытке внутриклеточного кальция усугубляются процессы набухания митохондрий, усиливаются дефицит АТФ и подавление всех энергозависимых реакций в клетке. Избыток кальция активизирует ядерные эндонуклеазы, фрагментирующие ДНК, индуцирует апоптоз. При высоком уровне внутриклеточного кальция активизируются нейтральные протеазы – кальципаины, разрушающие цитоскелет клетки, в частности, белки фоурин и В-актин, лизирующие рецепторы и протеинкиназу С.
При гипоксическом некробиозе вокруг гибнущих клеток формируется кальцийзависимая активация системы комплемента, активация коагуляционного и тромбоцитарного звеньев гемостаза, а также фибринолиза и калликреин-кининовой системы.
Активация под влиянием кальция мембранных фосфолипаз приводит к дальнейшей дезинтеграции мембран клеток, активации циклооксигеназы и липооксигеназы с последующим образованием простагландинов, лейкотриенов, свободных радикалов с выраженным цитотоксическим действием.
Чрезвычайно важна роль дезинтеграции митохондриальных мембран в механизмах гипоксического некробиоза клеток.
Как известно, в клетках эукариот все специфические дегидрогеназы принимают участие в окислении пирувата и других субстратов, локализованных в митохондриальном матриксе. Во внутренней мембране митохондрий локализуются переносчики электронов, составляющие дыхательную цепь и ферменты, катализирующие синтез АТФ из АДФ и фосфата.
В связи с этим очевидно, что продукты гликолиза, липолиза, протеолиза, вовлекаемые через ацетил-СоА в цикл Кребса, а также АДФ должны пройти через обе мнтохондриальные мембраны, в то время как новообразованные АТФ проникают из внутренней мембраны митохондрий в цитоплазму клетки и далее к местам энергетических трат. Установлено, что наружная мембрана легко проницаема для всех молекул и ионов небольшого размера, в то время как во внутренней мембране имеются специальные ферментативные транспортные системы, обеспечивающие трансмембранный перенос ионов и различных соединений.
Таким образом, при избыточном накоплении ионов кальция в клетке, активации процессов липопероксидации при гипоксии различного генеза резко повышается проницаемость митохондриальных мембран, возникает набухание митохондрий, пространственная дезориентация ферментативных систем транспорта электронов, синтеза АТФ. В результате происходят разобщение окислительного фосфорилирования и дыхания и соответственно подавление всех энергозависимых систем клетки: синтеза белка, трансмембранного переноса ионов, сопряжения процессов возбуждения и сокращения в мышечных структурах и т.д.
В процессе набухания митохондрии энергия потока электронов трансформируется в тепловую энергию.
Наряду с локальными и системными метаболическими сдвигами в тканях, обусловленными гипоксией, ацидозом, активизацией процессов липопероксидации, возникает комплекс метаболических и функциональных сдвигов, обусловленных выбросом гормонов адаптации – катехоламинов, глюкокортикоидов.
Как известно, при чрезмерной активации симпатоадреналовой системы (САС) реакции адаптации довольно быстро трансформируется в дезадаптационные процессы. Во-первых, при активации освобождения норадреналина происходит спазм сосудов переферических органов и тканей и соответственно усугубление циркуляторной гипоксии. На фоне активации САС при участии постсинаптических β-адренорецпторов возможна активация процессов гликолиза, гликогенолиза, липолиза, что, безусловно, усугубляет развитие ацидотических сдвигов, свойственных гипоксии.
Усиление адренергетических влияний закономерно сопровождается активацией процессов липопероксидации, что вносит весомый вклад в механизмы развития гипоксического некробиоза клеток органов и тканей, чувствительных к ишемии.
Синхронно с освобождением катехоламинов в условиях гипоксического стресса выбрасываются глюкокортикоиды, индуцирующие процессы лизиса и апоптоза в лимфоидной ткани, блокирующие процессы пролиферации и репаративной регенерации в ряде внутренних органов.
Хроническая тканевая гипоксия что это
11.1. Общая характеристика адаптивных реакций при острой и хронической гипоксиях
Так, под влиянием гипоксического фактора у человека наблюдается поведенческая реакция, направленная на выход из гипоксического состояния (например, выход из замкнутого пространства с небольшим содержанием кислорода и т.д.). Кроме того, формируется динамическая функциональная система, обеспечивающая активацию механизмов транспорта кислорода и субстратов обмена веществ к тканям и органам. Работа этой системы направлена на поддержание оптимального уровня биологического окисления в клетке. В структуру систем адаптации к гипоксии входят легкие, сердце, сосудистая система, кровь, системы биологического окисления и регуляторные системы.
Механизмы адаптации, формирующиеся в условиях острой гипоксии, носят преимущественно срочный, функциональный характер. Хронической гипоксии свойственна преимущественно долговременная структурная адаптация.
11.2. Адаптивные реакции при острой гипоксии
Система внешнего дыхания
Недостаточность биологического окисления при гипоксии приводит к гипервентиляции легких за счет углубления и учащения дыхательных экскурсий и вовлечения резервных альвеол с одновременным адекватным увеличением легочного кровотока. В результате минутный объем вентиляции и перфузии может увеличиваться в 10-15 раз по cравнению со спокойным состоянием. Развитие гипер- и тахипноэ при острой гипоксии обеспечивается за счет активации центральных и периферических хеморецепторов на фоне изменений газового состава крови, гипоксии, гиперкапнии, а также ацидотических сдвигов со стороны крови.
При острой гипоксии возникает выброс адаптивных гормонов, активируется симпатоадреналовая система, что приводит к развитию тахикардии, повышению УО и МОК, линейной и объемной скорости кровотока, увеличению выброса депонированной крови.
В условиях гипоксии развивается феномен перераспределения кровотока, обусловленный активацией симпатоадреналовой системы и выбросом катехоламинов. Последние вызывают сужение артериол при взаимодействии с α-адренорецепторами сосудов и снижение притока крови к большинству периферических тканей и органов (подкожная клетчатка, мышцы, органы брюшной полости и т.д.). В то же время возникает централизация кровотока в сосудах мозга, сердца и усиленно работающих дыхательных мышцах. При гипоксии в миокарде и ткани мозга накапливаются «метаболиты изнашивания» обладающие вазодилатирующим действием.
Под влиянием гипоксии наблюдаются количественные и качественные изменения со стороны сиcтемы крови.
Количественные сдвиги выражаются в появлении полицитемии (увеличении массы циркулирующей крови) за счет увеличения выброса эритроцитов из костного мозга и всех форменных элементов крови из депо. Причиной таких изменений является высокая концентрация в крови катехоламинов, тиреоидных и кортикостероидных гормонов.
Качественные адаптивные изменения связаны с увеличением сродства гемоглобина к кислороду в капиллярах легких и повышением степени диссоциации НbО2 в тканях.
Системы биологического окисления
11.3. Механизмы адаптивных реакций при хронической гипоксии.
Долговременная адаптация возникает при повторной или продолжающейся гипоксии, представляет собой сочетание структурных, функциональных и метаболических приспособительных реакций. Процессы приспособления формируются постепенно в результате многократной активации механизмов срочной адаптации к гипоксии, при этом создаются условия для оптимальной жизнедеятельности организма в новых, часто экстремальных условиях существования.
В адаптированном организме происходят снижение уровня основного обмена и уменьшение потребности тканей в кислороде. Это связано с увеличением в клетках количества митохондрий и их крист, повышением активности некоторых ферментов биологического окисления, особенно цитохромоксидазы. Наблюдается повышенная активность калий-натрий-зависимой и кальций-зависимой АТФ-азы, что способствует более полной утилизации АТФ.
Система внешнего дыхания
Дыхательная система обеспечивает достаточный уровень газообмена за счет увеличения емкости грудной клетки и мощности дыхательной мускулатуры, возрастания общей площади альвеол, числа капилляров в межальвеолярных перегородках, активации диффузионной способности альвеолярно-капиллярных мембран, повышения эффективности вентиляционно-перфузионного соотношения.
Одновременно развивается гипертрофия миокарда, увеличивается число функционирующих капилляров, митохондрий и их крист в миокарде, повышается эффективность трансмембранных процессов, наблюдается возрастание мощности и скорости взаимодействия актина и миозина в миофибриллах кардиомиоцитов. В результате, при долговременной адаптации к гипоксии увеличивается сила и скорость процессов сокращения и расслабления миокарда, наблюдается увеличение ударного и минутного объема сердечного выброса.
В условиях длительной гипоксии сосудистая система обеспечивает необходимый уровень перфузии тканей кровью за счет следующих механизмов: увеличения количества функционирующих капилляров, развития устойчивой артериальной гиперемии благодаря снижению миогенного компонента сосудистого тонуса и уменьшению чувствительности резистивных сосудов к действию вазоконстрикторов ( катехоламинам, вазопрессину, ангиотензину 2 и т.д.).
При долговременной адаптации к гипоксии в костном мозге наблюдается усиление эритропоэза вследствие усиленной выработки эритропоэтина почками. В периферической крови увеличивается содержание эритроцитов до 6-7 млн в 1 мкл и гемоглобина до 170-180 г/л.
У адаптированных к гипоксии животных и человека повышается резистентность нейронов к гипоксии и дефициту АТФ. Возникает гипертрофия ганглионарных нейронов вегетативной нервной системы и увеличение плотности их окончаний в сердце и некоторых других органах. Наблюдается увеличение числа рецепторов на клеточных мембранах и повышение чувствительности к медиаторам. В результате обеспечивается более экономная регуляция органов и повышается их устойчивость к гипоксии.
Происходит перестройка эндокринной системы: повышается чувствительность рецепторов клеток к гормонам, что вызывает уменьшение объема их синтеза в железах внутренней секреции. Повышается порог чувствительности гипоталамо-гипофизарно-надпочечниковой и других систем, что ограничивает активацию механизмов стресс-реакции и ее патогенные эффекты.