что такое взбитые сливки с точки зрения химии полароид или коллоид
Что такое коллоидное состояние вещества?
коллоидное состояние вещества это состояние, в котором содержится смесь, когда один из ее элементов в твердом состоянии диспергирован в другом, который находится в жидком или газообразном состоянии.
По этой причине часто говорят, что смесь находится в коллоидном состоянии или в суспензии, когда одновременно присутствуют 2 химические фазы. Когда система находится в коллоидном состоянии, она называется коллоидной.
Коллоид состоит из 2 фаз, они известны как дисперсная фаза и жидкая фаза. Дисперсная фаза соответствует твердому телу, диспергированному в очень мелких частицах (от 1 до тысячи нанометров)..
В то время как жидкая фаза, также известная как диспергатор, состоит из жидкости или газа, где твердые частицы разбросанный.
Вы можете быть заинтересованы в наиболее важных типов смесей.
Коллоидное или коллоидное состояние
Коллоиды часто создают путаницу в отношении состояния, в котором они находятся, потому что они визуально обладают характеристиками двух состояний вещества одновременно.
Желатин является примером коллоида, где твердые частицы (коллаген) диспергированы в жидкости (воде).
Слово коллоид происходит от греческого Колас, что означает прилипание, это потому, что трудно отделить 2 элемента коллоида.
Свойства коллоидного состояния
1- броуновское движение
Столкновение твердых частиц в суспензии с молекулами жидкости или газа приводит к тому, что они представляют нерегулярное и случайное движение через жидкую фазу.
Этот эффект известен как броуновское движение, и его легко заметить, если мы подвергаем коллоид, подобный твердому газу, световому лучу, например, путем освещения струи дыма или тумана..
2- Эффект Тиндалла
Если мы пропустим луч света через коллоид, он будет хорошо виден. Это явление, известное как эффект Тиндаля, происходит потому, что частицы из дисперсной фазы отражают свет во всех направлениях, делая его видимым.
Направляя лазерный луч на стакан с соком или желатином, вы можете увидеть эффект Тиндалла.
3- Диализ
Диализ заключается в разделении мелких элементов присутствующей жидкости с помощью мембраны, за исключением коллоидных частиц.
Это свойство, которое не является исключительным для коллоидов, позволяет удалять примеси из коллоида и очищать его..
Классификация коллоидов
В зависимости от состояния, в котором находятся фазы, существует 5 типов коллоидов:
1- Аэрозоль
Твердое вещество или жидкость, диспергированные в газе. Есть твердые аэрозоли, такие как дым или туман; и жидкие аэрозоли, такие как инсектициды. Сегодня слово аэрозоль, Наносится на любой аэрозольный продукт, например дезодоранты.
2- Эмульсия
Жидкость, рассеянная в другом. Наиболее распространенными обычно являются молочные продукты, где молочный жир рассеивается в воде. Например, масло.
3- пена
Газ рассеивается в твердом или жидком состоянии. Когда газ диспергируется в твердом веществе, он образует «тяжелую» пену, которая обычно используется в промышленности, например, полистирольные герметики и пены..
Жидкая пена легче и используется внутри страны, как пена для бритья или взбитые сливки.
4- гель
Жидкость диспергируется в твердом виде. Как желе, желе и гели для волос.
5- Солнце
Твердое вещество диспергируется в твердом или жидком состоянии. Они принимают жидкую консистенцию и становятся гуще, как краски и чернила.
Коллоиды
Коллоидные системы (коллоиды, др.-греч. κόλλα — клей и εἶδος — вид) — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями и эмульсиями.
Содержание
Основные свойства
Основные виды
Коллоидные системы, применяемые в химическом анализе
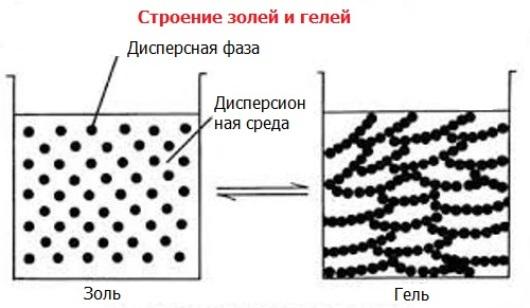
Из коллоидных систем наибольшее значение для химического анализа имеют гидрозоли — двухфазные микрогетерогенные дисперсные системы, характеризующиеся предельно высокой дисперсностью, в которых дисперсионной средой является вода — наиболее часто применяемый в аналитической практике растворитель. Встречаются также органозоли, в которых дисперсионной средой являются неводные (органические) растворители. В результате молекулярного сцепления частиц дисперсной фазы из золей при их коагуляции образуются гели. При этом не происходит разделения фаз; другими словами, переход золей в гель не является фазовым превращением.
При образовании геля вся дисперсионная среда (например, вода в гидрозоле) прочно связывается поверхностью частиц дисперсной фазы и в ячейках пространственной структуры геля. Гели способны обратимо восстанавливать свою пространственную структуру во времени, но после высушивания наступает разрушение их структуры и они теряют эту способность.
Коллоидные свойства галогенидов серебра
В процессе титрования галогенид-ионов растворами солей серебра получаются галогениды серебра, весьма склонные к образованию коллоидных растворов. В присутствии избытка На1—ионов, то есть до точки эквивалентности при титровании галогенидов ионами серебра или после точки эквивалентности при титровании ионов серебра галогенидами, вследствие адсорбции Hal—ионов взвешенные частицы AgHal приобретают отрицательный заряд:
В присутствии избытка Ag+-ионов (то есть до точки эквивалентности при титровании ионов серебра галогенидами или после точки эквивалентности при титровании галогенидов ионами серебра) взвешенные частицы приобретают положительный заряд:
Таким образом, заряд взвешенной частицы [AgHal]m•nHal- или [AgHal]m•nAg+ определяется зарядом ионов, адсорбированных на поверхности ядра мицеллы [AgHal]m, и зависит от наличия в системе избытка Hal- или Ag+, обусловливающих отрицательный или положительный заряд взвешенной частицы золя. Помимо адсорбционного слоя, находящегося на поверхности ядра мицеллы и обусловливающего определенный электрический заряд, в состав мицеллы входит также часть ионов противоположного знака, образующих второй (внешний) слой ионов.
Например, в процессе титрования иодида калия раствором нитрата серебра
образуются мицеллы следующего строения:
а) мицеллы, образуемые Ag при избытке нитрата серебра: <[AgI]m• nAg+ • (n-x)NO >x+ • xNO
б) мицеллы, образуемые AgI при избытке иодида калия <[AgI]m • nI- • (n-x)K+>x- • xK+
Коллоидные частицы, несущие одноимённые электрические заряды, отталкиваются друг от друга. Силы взаимного отталкивания мешают частичкам сблизиться настолько, чтобы произошло взаимное притяжение. В то же время заряженные частички обладают высокой адсорбционной способностью, они притягивают к себе частицы, несущие обратные по знаку электрические заряды, и образуют с ними малорастворимые соединения. В первую очередь на поверхности заряженных коллоидных частиц адсорбируются те ионы, которые дают наименее растворимые осадки с ионами, входящими в состав этих частиц. Кроме того, адсорбируются те ионы, концентрация которых наибольшая. Например, при осаждении AgI могут соосаждаться вместе с ним Вr-, CI-, SCN- и другие ионы. При титровании галогенидов, не содержащих посторонних примесей, осадком адсорбируются имеющиеся в растворе На1—ионы, сообщая частичкам AgHal отрицательные заряды. И в том, и в другом случаях результаты титрования искажаются. Поэтому требуется строго соблюдать условия осаждения, рекомендуемые в методиках определения тех или иных веществ.
Анализ коллоидных систем
Существует несколько методов анализа коллоидных систем, среди них есть химические и физико-химические методы: анализ с помощью адсорбционных индикаторов; методы на основе измерения рассеяния проходящего света (нефелометрия и турбидиметрия); методы на основе измерения скорости седиментации.
Сливки взбитые
Виды и свойства взбитых сливок
Взбитые сливки (крем Шантийи или Шантильи) — десерт, приготовленный из подслащённых взбитых сливок, часто с добавлением ванили.
Считается, что этот десерт изобрёл Франсуа Ватель, метрдотель замка Шантийи в XVII веке.
Используется в приготовлении пирожных, тортов и других десертов. Часто подаётся вместе с мороженым и используется для приготовления десертов из мороженого.
Большая часть содержимого взбитых сливок является воздухом.
В наше время взбитые сливки стали привычным продуктом питания, который можно легко приобрести практически в любом продовольственном магазине.
Как правило, готовые взбитые сливки расфасовывают в баллоны, благодаря которым удается сохранить оригинальную консистенцию продукта.
Состав взбитых сливок
В состав качественных взбитых сливок входит всего два компонента — сливки и сахар. В настоящее время состав взбитых сливок, реализуемых в готовом виде в магазинах, помимо основных ингредиентов содержит вкусовые добавки, красители и консерванты.
Виды взбитых сливок
Калорийность взбитых сливок
Энергетическая ценность взбитых сливок (Соотношение белков, жиров, углеводов — бжу):
Польза и вред взбитых сливок
Но, к сожалению, в сливках много холестерина, поэтому с больным сердцем или сосудами от них лучше отказаться.
Главное в употреблении взбитых сливок — это умеренность.
Как выбрать взбитые сливки
В состав качественных взбитых сливок должно входить всего два компонента — сливки и сахар.
Классификация сливок в зависимости от состава:
Часто в составе фабричных взбитых сливок в баллончиках натуральных ингредиентов минимум, одна лишь химия: ароматизаторы, эмульгаторы, фосфаты, стабилизаторы, модифицированный крахмал, глюкозный сироп и так далее.
Отечественные взбитые сливки довольно трудно найти в магазинах. Большинство из них попадают на прилавки от иностранных производителей.
Очень важно выбрать достойного и ответственного производителя.
Хранение взбитых сливок
Условия и сроки хранения закрытых взбитых сливок указаны на этикетке. Обычно это комнатная температура и 10 месяцев.
Начатый баллон со взбитыми сливками хранят в холодильнике до 2-х недель. После каждого использования рекомендуется промывать и высушивать распылитель.
Лучшие производители и торговые марки (бренды) взбитых сливок:
Определяются ежегодно по итогам крупных выставок (Продэкспо, WorldFood Moscow и др.), результатов проверок Роспотребнадзора, Росконтроля, Ростеста, Роскачества, рейтинговых оценок специализированных агенств (Expertology, Rate&Goods, Продуктцентр и др.) и отзывов покупателей (Irecommend, Отзовик, Otzyv, Яндекс Маркет и др.).
MEGGLE, TURM, АЛЬПЕНГУРТ, HULALA, HOCHWALD (SAHNE WUNDER), DR.OETKER, PRESIDENT, MILBONA, HAAS, БУРЕНКА, CAMPINA, СВИТЛОГОРЬЕ, ИЖМОЛОКО, HAPPY DAY, ДМИТРОВСКИЙ МОЛОЧНЫЙ ЗАВОД и др.
Если вы желаете участвовать в определении лучших производителей (торговых марок), присылайте свои обоснованные предложения по включению/удалению бренда из списка.
Что такое гель: понятие, определение, химические составы гелей, назначение и применение
Понятие «гель»
Слово «гель» латинского происхождения. Gelo в переводе означает «застываю», gelatus – означает «неподвижный, замороженный».

Определение понятию дает коллоидная химия – наука, изучающая дисперсные системы и поверхностные явления.
Что такое гель с точки зрения химии? Гель – это такая дисперсная система с дисперсионной средой, в которой частицы фазы формируют пространственную структурную сетку. В состав геля входят как минимум два компонента.
Гель – коллоидная система
Дисперсными называют такие системы, в которых частицы одного вещества равномерно распределены среди частиц другого вещества. В таких системах различают:
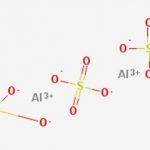
Частички фазы размером от 1 до 100 нм образуют коллоидные растворы. Эти системы характеризуются особыми свойствами, не характерными для истинных растворов и грубодисперсных систем. Коллоидные растворы – микрогетерогенные довольно устойчивые системы, их частицы не оседают со временем под действием силы тяжести. Примеры: водные коллоиды сульфидов металлов, серы.
Гели определяют по степени дисперсности фазы к коллоидным системам.
Агрегатное состояние фазы и среды в гелях
В зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы различают 8 типов дисперсных систем. Если среда – газ, то фаза может быть жидкостью (мы уже рассматривали туман) или твердым веществом. Например, дым или смог – в газообразной среде распределены частички твердой фазы. Оба варианта систем называют аэрозолем.
Если средой является жидкость, а в ней распределены твердые частички фазы, то такая система называется золем или суспензией, в зависимости от размера частиц. Из золей при определенных условиях получаются гели.
По определению химии гели – дисперсные системы, в которых дисперсионная среда – твердое вещество, дисперсная фаза – жидкость. То есть гель – название типа дисперсионной системы наряду с эмульсией, аэрозолем, суспензией и др.
Гели – растворы, потерявшие текучесть
Некоторые растворы высокомолекулярных веществ и золей при длительном хранении могут превращаться в гели. Частицы ВМС или золя связываются между собой, образуя сплошную сетку. Внутрь такой сетки проникают частицы растворителя. Таким образом, дисперсионная среда и дисперсная фаза меняются своими ролями. Фаза становится непрерывной, а частицы среды – изолированными. Так, система теряет текучесть и приобретает новые механические свойства. Что такое гель? Это коллоидные системы, потерявшие текучесть вследствие формирования в них внутренних структур.
Некоторые гели со временем расслаиваются, при этом происходит самопроизвольное выделение жидкости. Это явление называют синерезисом. Наблюдается уплотнение пространственной сетки, уменьшение объема геля, образование так называемого твердого коллоида.
Процессы превращения золя в гель и геля в твердый коллоид обратимы. Например, белок желатин, представляющий собой твердый коллоид, при набухании в воде превращается в желе – гель. Важно соблюдать температурный режим, доводить желатин до кипения, но не кипятить, иначе структура разрушается, и гель превращается в золь, приобретая текучесть.
При высыхании гели необратимо разрушаются.
Классификация гелей
В зависимости от химического характера дисперсионной среды различают гели: гидрогели, алкогели, бензогели и др. Гели, бедные жидкостью или совершенно безводные, называют ксерогелями. Ксерогелем является столярный клей в плитках, крахмал, сухой листовой желатин. Сложными по составу ксерогелями являются печенье, мука, сухари.
Некоторые гели содержат мало сухого вещества, но все равно обладают пространственной структурой. Это кисель, студень, простокваша, растворы мыл. Их называют лиогелями.
Выделяют группу коагелей. Это студенистые осадки, которые получаются при коагуляции золей (кремниевой кислоты, гидроксида железа (III) и пр.) и высаливании растворов полимеров. В коагелях дисперсионная среда образует отдельную фазу, только небольшая часть среды связана.
Использование и значение гелей в медицинской практике
В медицине гели используют:
Разогревающие гели
Популярные разогревающие гели изготавливают на основе:
При использовании разогревающих средств необходимо ознакомиться с инструкцией по применению гелей, учесть противопоказания и соблюдать частоту применения.
Охлаждающие гели
Разогревающие гели нельзя применять сразу после травм. В это время необходимо использовать наоборот охлаждающие средства. Лучше всего ненадолго приложить лед и использовать холодный компресс. Спортсмены применяют специальные охлаждающие спреи. Затем можно нанести охлаждающий гель, например с ментолом. Охлаждение предотвращает развитие отека и воспаления, обезболивает. Холод нужно применять в первые сутки после травмы. Через 2-3 дня начинают использовать разогревающие средства, усиливающие местный кровоток, что способствует рассасыванию гематом.
Определение прочности геля
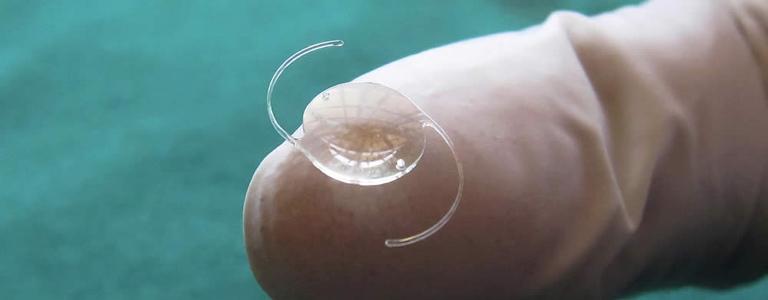
Производителям медицинских, фармацевтичеких, косметических гелей необходимо знать их твердость. Эластичность и сила разрыва гелей важна для изготовления коронарных стентов, материал которых должен быть сходен по механическим свойствам с живой тканью; контактных линз, свечей, гелеобразных смазочных веществ, питательных средств для культивирования микроорганизмов. Прочность гелей важна при изготовлении зубных паст, кремов, пастилок.
Для определения прочности геля по Блуму используют прибор Блума. На нем определяют нагрузку, необходимую для продавливания поверхности геля цилиндрической насадкой определенным диаметром (12,7 мм) на глубину 4 мм.
Что такое гель? Это дисперсные системы, которые характеризуются определенной структурой, придающей им свойства твердых тел. Гели состоят как минимум из двух компонентов, один из них непрерывно распределен в другом. Их можно получить коагуляцией золей. Для гелей характерно явление набухания. Надеемся, что если на экзамене вас попросят: «Охарактеризуйте понятие «гели»!», вы с легкостью сможете это сделать!
Урок №13. Коллоидные растворы
Дисперсные системы
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы — дисперсные системы и растворы.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких систем.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе.
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета — наш общий дом — Земля; без клеток не было бы живых организмов и т. д.
Классификация дисперсных систем и растворов
Взвеси
Взвеси — это дисперсные системы, в которых размер частиц фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсионная среда легко разделяются отстаиванием. Такие системы разделяют на:
1) эмульсии (и среда, и фаза — нерастворимые друг в друге жидкости). Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т. д.;
2) суспензии (среда — жидкость, а фаза — нерастворимое в ней твердое вещество). Это строительные растворы (например, «известковое молоко» для побелки), взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде — планктон, которым питаются гиганты-киты, и т. д.;
3) аэрозоли — взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различают пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний — взвесь мелких капелек жидкости в газе. Например, природные аэрозоли: туман, грозовые тучи — взвесь в воздухе капелек воды, дым — мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига — клинкера. Аналогичные вредные аэрозоли — пыли — имеются и в городах с металлургическими производствами. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающие изо рта больного гриппом, также вредные аэрозоли.
Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлив, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) — примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли — туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом.
Их подразделяют на золи (коллоидные растворы) и гели (студни).
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия («растворимого стекла») с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (Ш) в горячей воде. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся «светящейся дорожке» — конусу при пропускании через них луча света.