что такое внутригрудное давление
Что такое внутригрудное давление
В 1970 году, Sönderberg и Westin выявили корреляцию между прямым способом измерения ВБД во время лапароскопии и непрямым методом чрезпузырного измерения [40]. В 1972 Shenansky и Gillenwater доказали влияние ПВБД на сердечно-сосудистую и почечную системы [41]. Первые опыты проведения лапароскопических операций привели к признанию негативных последствий пневмоперитонеума при ПВБД. Ivankovich с соавторами описал случай развития у больной сердечно-сосудистой недостаточности при проведении гинекологической лапароскопии [32] в дальнейшем, начав изучение физиологии этого явления [25]. В 1976 году Lenz с соавторами изучал изменения в сердечно-сосудистой системе во время лапароскопии, подчеркнув опасность пневмоперитонеума у пациентов с сердечно-сосудистыми заболеваниями, анемиями, гиповолемией [30]. Одновременно, Richardson и Trinkle (1976) проводили исследование гемодинамических и респираторных изменений при ПВБД [37]. Еще раньше, в шестидесятых, а затем и в семидесятых годах двадцатого века, были проведены исследования в группе больных с асцитами, предоставляющие доказательства клинической значимости ПВБД, выявлена корреляция между развитием ВБГ и увеличением смертности от сердечно-легочной недостаточности [15, 21, 27]. Начало восьмидесятых ознаменовалось рядом ключевых исследований: Kashtan в соавторстве (1981) открыл влияние ВБД на гемодинамику [28]; Harman в соавторстве (1982) [23], а немного позднее Richards с соавторами (1983) [39], выявили негативные последствия ВБГ на функцию почек, а также доказали эффективность декомпрессивной лапаротомии.
Kron с соавторами (1984). в комбинированном клиническом и экспериментальном исследовании показал, что ВБД может быть использовано в качестве критерия для проведения повторных операций на брюшной полости, а также декомпрессии [29].
Потепенно в медицинских кругах рос интерес к проблеме ВБГ. Smith в соавторстве (1985) сообщил о снижении явлений послеоперационной анурии после декомпрессивной лапаротомии [42]. Barnes с соавторами (1985) изучал сердечно-сосудистую реакцию на повышение ВБД [10]. Caldwell и Ricotta (1987) изучали влияние ВБГ на висцеральный кровоток [13]. Jacques и Lee (1988) сообщили о восстановлении функции почек после снижения интраабдоминального давления [26]. Cullen в соавторстве (1989) выявил, что декомпрессивная лапаротомия способствует регрессии сердечно-сосудистой, почечной и дыхательной недостаточности [16]. Измерение ВБД с помощью катетера, установленного в мочевой пузырь, становится обыденным явлением в отделениях интенсивной терапии.
В 1989 году термин АКС окончательно вошел в обиход. Burch c соавторами [12] указывают, что первая публикация в печати с использованием данного термина принадлежит W. Beaumont: «. у четверых пациентов с разрывом аневризмы брюшной аорты после оперативного лечения увеличилось внутрибрюшное давление. Это сопровождалось повышением давления на вдохе и повышением центрального венозного давления, снижением количества выделяемой мочи, а также вздутием живота. Эта совокупность клинических проявлений получила название абдоминальный компартмент-синдром, вызванный массивным интерстициальным и забрюшинным отеком.. В реанимации выполнена декомпрессивная лапаротомия, после операции зарегистрировали существенное увеличение сердечного индекса, дыхательного объема и темпа диуреза, центрального венозного давления, снижение показателей давления в легочной артерии, максимального давления на вдохе, pCO2 в артериальной крови и уровня лактата плазмы».
В настоящее время существуют различные методы профилактики и лечения ВБГ и АКС. При наличии у больного высокого риска развития АКС его профилактику следует начинать интраоперационно [4, 6].
Лечение АКС должно носить комплексный характер, в котором важным звеном является совокупность консервативных методов. Особое место в консервативном лечении отводится искусственной вентиляции легких с увеличением положительного давления в конце выдоха [32]. Чрезмерно высокий уровень положительного давления в конце выдоха вызывает усиление гемодинамических нарушений, недостаточный уровень давления способствует развитию ателектотравмы. В условиях ВБГ снижается прежде всего комплайнс грудной стенки, поэтому оптимально использование малых дыхательных объемов (5-6 мл/кг) с целью предотвращения баро- и волюмотравмы [21]. Инфузионная терапия имеет патогенетическую направленность только перед подготовкой больного к операции [33, 36]. В случаях, когда декомпрессия не выполняется, массивные инфузии усиливают проявления АКС [19]. У пациентов с гнойно-септической патологией органов живота не обнаружено отрицательного влияния на регионарную перфузию тканей от применения норадреналина, а использование адреналина или допамина предположительно приводит к перераспределению крови в спланхническом бассейне [8]. Восстановление перфузии ранее неадекватно перфузированных тканей сопровождается высвобождением в общую циркуляцию большого количества токсических продуктов (лактат, аденозин, калий), что сопровождается развитием аритмии, депрессии миокарда, вазодилятацией [5].
Острая боль повышает ригидность мышц передней брюшной стенки [42]. Применение эпидуральной анестезии в предоперационном периоде у больных с экстренной хирургической патологией с синдромом интраабдоминальной гипертензии в 1,5 раза уменьшает степень выраженности болевого напряжения передней брюшной стенки, что в свою очередь значительно снижает клинические проявления дисфункции респираторной системы и гемодинамических нарушений [5].
Необходимость кишечной декомпрессии в лечении АКС не вызывает сомнений [2, 18, 47]. Предпочтительным для этой цели считается вариант использования назоинтестинальных зондов различных конструкций. Выбор способа интубации ЖКТ зависит от сложившейся клинической ситуации и от причин, вызвавших ОКН и перитонит.
Хирургическая декомпрессия до сих пор остается единственным методом лечения, сопровождающимся достоверным снижением летальности. Снижение летальности возможно до 20 % при ранней диагностике АКС и до 43-65 % при поздней диагностике [2]. Большинство исследователей [39, 42] основным методом лечения считают хирургическое вмешательство, oднако показания к оперативному лечению АКС до настоящего времени окончательно не разработаны. При увеличении ВБД свыше 20 мм рт. ст. тактика лечения зависит от наличия признаков недостаточности органов, обусловленных увеличением ВБД. При отсутствии органной недостаточности производится мониторинг ВБД каждые 4 часа до тех пор, пока пациент находится в критическом состоянии. При признаках недостаточности органов, связанных с увеличением ВБД, тактика различается в зависимости от причины АКС. При первичном АКС показана декомпрессия брюшной полости и при необходимости временное закрытие брюшной полости. При вторичном или рецидивирующем АКС при ВБД более 25 мм рт. ст. с прогрессирующей органной недостаточностью необходима декомпрессивная лапаростомия [1, 3, 4, 31]. По мнению M. Schein [22, 43], лапаростомия показана в тех случаях, когда «живот не может быть закрыт или не должен быть закрыт.» В работе C. Tons [47] показано, что декомпрессивная лапаростомия приводит к снижению ВБД с 31 до 17 см вод. ст. Необходимо отметить, что декомпрессивная лапаростомия может осложниться нарастанием острой сердечно-сосудистой недостаточности и асистолией в связи с резким снижением ВБД, общего периферического сопротивления, усугублением гиповолемии и реперфузией обширных ишемизированных зон, что может сопровождаться высвобождением в общую циркуляцию большого количества токсических продуктов (лактат, аденозин, калий) и развитием аритмии, депрессии миокарда, вплоть до асистолии [4, 5].
В резолюции 3-го мирового конгресса по АКС (Бельгия, 2007) признано, что окончательное закрытие брюшной полости возможно при ВБД ниже 10 мм рт. ст. [8].
Таким образом, к концу двадцатого века разработаны и внедрены в рутинную клиническую практику способы измерения ВБД, выявлены физиологические эффекты ВБГ, а с начала двадцать первого века стали разрабатываться способы ее лечения. В нашу задачу не входило описание всей истории вопроса, однако приведенные краткие сведения говорят о глубине рассматриваемой проблемы.
Рецензенты:
Быков А.В., д.м.н., профессор, зав. кафедрой хирургических болезней и нейрохирургии ФУВ ВолгГМУ, г. Волгоград;
Полянцев А.А., д.м.н., профессор, зав. кафедрой общей хирургии с урологией ВолгГМУ, г. Волгоград.
Интраабдоминальная гипертензия и абдоминальный компартмент-синдром
Интраабдоминальная гипертензия (ИАГ) (Intra-abdominal Hypertension (IAH)) и абдоминальный компартмент-синдром (АКС) (Abdominal Compartment Syndrome (ACS)) являются тяжелыми осложнениями заболеваний, как у хирургических, так и у нехирургических больных. Однако эти два сопутствующих явления, при своей высокой распространенности, часто остаются непризнанными или не диагностированными. ИАГ воздействует на региональную и общую перфузии, что может привести к полиорганной недостаточности и летальному исходу.
Наиболее ранним проявлением, даже при относительно низком уровне ИАГ, является олигурия и острое повреждение почек (ОПП). Профилактика ИАГ путем раннего выявления и мониторинга пациентов группы риска может полностью исключить развитие АКС. Понимание этиологии и патофизиологии ИАГ и AКС имеет важное значение для выявления патологии и может быть использовано в качестве руководства при его профилактике и осуществлении соответствующей терапии.
Определение
Определение и руководящие принципы ИАГ и АКС установлены Всемирным обществом абдоминального компартмент-синдрома (WSACS).
Интраабдоминальное давление (ИАД) — давление внутри брюшной полости.
В среднем у взрослого человека нормальный уровень ИАД находится в пределах 0–5 мм рт.ст., в то время как у тяжелобольных взрослых он обычно составляет 5–7 мм рт. ст.
Интраабдоминальная гипертензия (ИАГ) — постоянное или рецидивирующее патологическое повышение ИАД больше ≥ 12 мм рт.
Абдоминальный компартмент синдром (АКС) — устойчивая ИАГ (более 20 мм рт.ст.), при абдоминальном перфузионном давлении (АПД) 25 мм рт.
С другой стороны, АКС дополнительно классифицируется в зависимости от причины и продолжительности ИАГ на первичную, вторичную и рецидивирующую.
Эти системы классификационных групп, разработанные WSACS, облегчают последующее управление ИАГ и АКС в рамках организации поэтапного подхода к ведению больных.
Предрасполагающие условия и факторы риска
Наиболее распространенные факторы риска развития ИАГ и/или АКС в соответствии WSACS:
Примечание. Некоторые из этих факторов риска далеки от патофизиологического обоснования и клинического суждения.
Развитие ИАГ у пациентов, которым проводится интенсивная терапия, связано с ухудшением клинического исхода, и это может наблюдаться у пациентов с тяжелым острым панкреатитом, распространенность интраабдоминальной гипертензии у этого типа пациентов составляет около 40–50 %, что обычно является осложнением ранней и агрессивной инфузионной терапии.
Помимо серьезных ожогов и сепсиса, которые являются одними из причин вторичного ИАГ/АКС, травмы и хирургические манипуляции в области живота являются предрасполагающими условиями, влияющими на развитие первичного ИАГ/АКС и, следовательно, послеоперационной почечной недостаточности. В проспективном наблюдательном исследовании, которое включало 263 пациента, ИАГ (определяемая как ИАП, превышающая или равная 18 мм рт.ст.) была независимой причиной нарушения функции почек после абдоминальной операции.
Патофизиология
Чтобы понять основные принципы ИАГ и АКС, мы можем сравнить его в целом с компартмент-синдромом, когда повышение давления ухудшает капиллярный кровоток, в конечном итоге уменьшая приток в артериолы и уменьшая венозный отток. В дальнейшем это вызывает клеточную гипоксию, которая, в свою очередь, предшествует анаэробному дыханию и молочнокислому ацидозу.
Человеческое тело можно рассматривать как сочетания различных анатомических отделов, взаимодействующие друг с другом, по этой причине патофизиология внутриполостной гипертензии и компартмент-синдрома является многофакторной и может наблюдаться почти во всех системах органов.
ИАГ, очевидно, не только вызывает снижение перфузии во всех органах брюшной полости, но и оказывает влияние на внебрюшинные органы, а в некоторых случаях даже оказывает влияние на внутричерепное давление. Проще говоря, когда внутрибрюшное давление повышается, многие органы постепенно начинают отказывать. Было установлено, что ИАГ вызывает ряд патофизиологических изменений, начиная с региональных нарушений кровотока и заканчивая явной недостаточностью систем органов и развитием АКС.
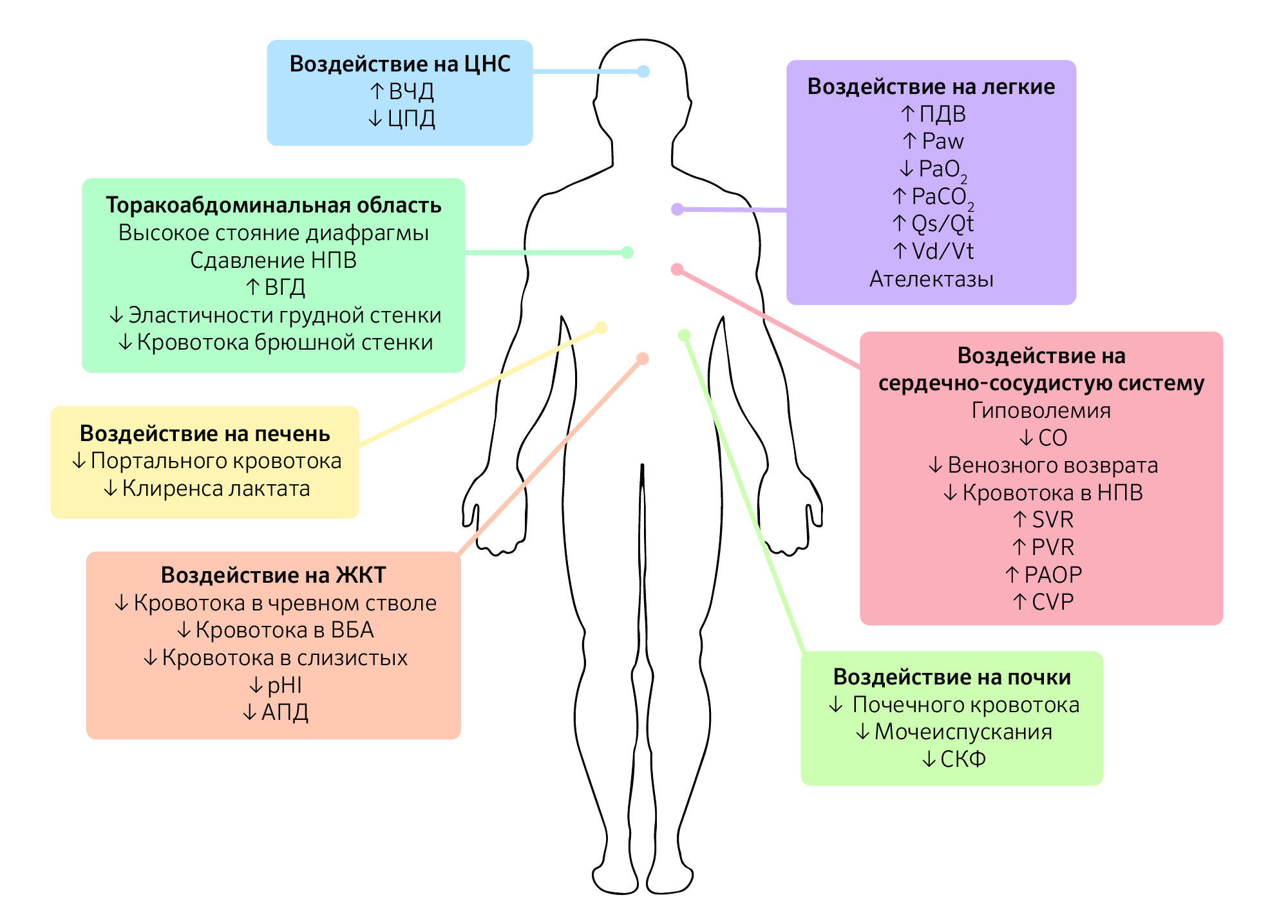
Помимо уровня ИАД и этиологии ИАГ у пациента, схожую по значимости роль играет коморбидность, которую следует принимать во внимание, поскольку это снижает порог ИАД, вызывающий клинические проявления (изображение 1).
Изображение 1 | Патофизиологические последствия интраабдоминальной гипертензии.
Последствия интраабдоминальной гипертензии не ограничиваются только органами брюшной полости, а, скорее, оказывают прямое или косвенное воздействие на каждую систему органов в организме. Схема влияния ИАГ на системы органов.
Сокращения: ВЧД — внутричерепное давление; ЦПД — церебральное перфузионное давление; ВГД — внутригрудное давление; НПВ — нижняя полая вена; ВБА — верхняя брыжеечная артерия; pHI — pH слизистой желудка ; АПД — абдоминальное перфузионное давление; ПДВ — пиковое давление вдоха; Paw, mean airway pressure —среднее давление в дыхательных путях; PaО 2 — парциальное давление кислорода в артериальной крови; PaCO 2 — парциальное давление углекислого газа в артериальной крови; Qs/Qt — внутрилегочный шунт; Vd/Vt — легочное мертвое пространство; CO, cardiac output — сердечный выброс; SVR — системное сосудистое сопротивление; PVR — легочное сосудистое сопротивление; PAOP — окклюзионное давление в легочной артерии; CVP — центральное венозное давление; СКФ — скорость клубочковой фильтрации.
Воздействие ИАГ и АКС на различные системы органов
Сердечно-сосудистая система
Повышение ИАГ увеличивает внутригрудное давление путем брюшно-грудной передачи через краниальное смещение диафрагмы. Это явление создает прямое сжатие внутригрудных органов. Прямая компрессия сердца вызывает снижение сократительной способности, наполнения сердца и эластичности правого желудочка. ИАГ также приводит к нарушению венозного возврата, поскольку давление нижней полой вены увеличивается параллельно увеличению ИАГ, это отмечается даже при ИАД 10 мм рт. ст. Кроме того, отклонение диафрагмы вызывает анатомическое сужение полой вены, что приводит к дальнейшему снижению венозного возврата к сердцу и, в конечном счете, сердечного выброса. С другой стороны, сдавление легочной паренхимы приводит к сдавлению сосудистой сети, тем самым увеличивая легочное, аортальное и системное сосудистое сопротивление. Потому, несмотря на снижение венозного возврата и сердечного выброса, среднее артериальное давление остается стабильным, что делает его неточным гемодинамическим маркером.
Измерение давления на основе внутрисердечного или внутрисосудистого объема также имеет тенденцию быть недостоверным. Это объясняется тем, что, как окклюзионное давление легочной артерии (pulmonary artery occlusion pressure, PAOP), так и центральное венозное давление (central venous pressure, CVP) измеряются пропорционально барометрическому давлению, когда на самом деле эти показатели — сумма внутрисосудистого и внутригрудного давления.
Параметрами, которые более точно отражают состояние внутрисосудистого объема, являются следующие: конечный диастолический объем правого желудочка (right ventricular end-diastolic volume, RVEDV), общий конечный диастолический объем (global end-diastolic volume, GEDV) и ударный объем, поскольку они остаются незатронутыми изменениями внутригрудного давления.
Дыхательная система
Аналогичным образом повышенное ИАД передается в грудную клетку главным образом через отклонение диафрагмы, вызывающее сдавление легочной паренхимы. Паренхиматозное сжатие при ИАД 16 мм рт. ст. снижает эластичность легочной ткани на 50 %. Паренхиматозное давление также вызывает снижение емкости вдоха и функциональной остаточной емкости, в то время как пиковое инспираторное, экспираторное и среднее давление в дыхательных путях увеличиваются. В результате возникает альвеолярный ателектаз, увеличивается альвеолярное мертвое пространство, снижается легочный капиллярный кровоток, что приводит к снижению транспорта кислорода и снижению экскреции углекислого газа, а также увеличению фракции внутрилегочного шунта (Qsp/Qt) и рассогласованию вентиляции и перфузии (VQ) и, в конечном счете, к гипоксемии и гиперкапнии.
Функция почек
Несколько механизмов были предложены в качестве этиологии для ИАГ-индуцированной почечной дисфункции и недостаточности. Компрессия почечных артерий и вен в сочетании с компрессией почечных канальцев — вероятный механизм, лежащий в основе ИАГ/АКС-индуцированной почечной дисфункции и недостаточности, сопровождающейся снижением сердечного выброса. Различные авторы предположили, что прямое сдавление паренхимы провоцирует развитие «синдрома почечного компартмента», при котором почечный артериальный кровоток уменьшается, а почечное венозное давление и почечное сосудистое сопротивление повышается. Это приводит к тому, что кровь шунтируется от коры почек и клубочков, что приводит к нарушению функции клубочков и канальцев, вызывая ишемию почек и последующую почечную недостаточность.
При ИАД более 15 мм рт.ст. отмечается олигурия, в то время как анурия проявляется при ИАД более 30 мм рт. ст. Клинически наблюдаются изменения в функции почек, такие как снижение СКФ, повышение содержания азота мочевины в крови (BUN) и креатинина в сыворотке крови, увеличение фракционной экскреции натрия, снижение концентрации натрия и хлорида в моче и увеличение концентрации калия в моче. Однако все эти изменения, по-видимому, могут быть устранены, если ИАГ диагностируется и успешно управляется до того, как произойдет существенная дисфункция органа.
Желудочно-кишечная система
Высокое давление в брюшной полости вызывает мальперфузию кишечника из-за нарушения артериального и венозного кровотока. Было показано, что повышение ИАД на 10 мм рт. ст. снижает брыжеечный кровоток. Снижение перфузии кишечника вызывает ишемию кишечника и даже отек кишечника и кишечную непроходимость. Перфузия слизистой оболочки кишечника также нарушается, вызывая снижение рН и молочнокислый ацидоз, который в конечном итоге повреждает слизистый барьер кишечника. Потеря слизистого барьера приводит к внутрипросветной бактериальной транслокации, приводящей к сепсису или септическому шоку и последующему ухудшению исхода.
Гепатобилиарная система
Повышенный ИАД существенно влияет на функцию печени. Прямое сжатие печени нарушает печеночный венозный и портальный кровоток. Кроме того, сужение печеночных вен на уровне диафрагмы ослабляет печеночный венозный кровоток, в то время как печеночный артериальный поток нарушается из-за снижения сердечного выброса.
На клеточном уровне микроциркуляторный кровоток также снижается, нарушая метаболизм глюкозы, вызывая увеличение производства лактата и одновременно нарушая механизм его утилизации.
Центральная нервная система
Устойчивое и длительное повышение внутрибрюшного и внутригрудного давлений вызывает повышение внутричерепного давления (ВЧД) и снижение церебрального перфузионного давления (ЦПД). Bloomfield и соавторами в ходе двух различных исследований было установлено, что при повышении внутригрудного давления снижается мозговой венозный поток, что, в свою очередь, вызывает внутримозговой отек.
Диагноз
Раннее выявление пациентов группы риска является первым шагом в диагностике ИАГ и АКС. WSACS рекомендует проводить скрининг на ИАГ/АКС при наличии двух или более факторов риска. Рекомендация состоит в том, чтобы оценить ИАД на исходном уровне, и, если оно повышено, то ИАД необходимо продолжать контролировать каждые 4-6 часов.
Клиническое обследование, такое как пальпация и измерение окружности живота, оказалось крайне неточным и ненадежным в диагностике ИАГ и/или АКС. Радиографический ввод, такой как обычная рентгенография грудной клетки и/или живота, УЗИ брюшной полости, компьютерная томография и МРТ брюшной полости, также оказался ограниченным, поскольку результаты не являются ни чувствительными, ни специфичными для ИАГ и АКС. Тем не менее они могут продемонстрировать наличие возможной причины ИАГ, а также могут выявить воздействие ИАД (высокий уровень стояния диафрагмы, уплощение нижней полой вены, сжатие почечных вен и повышенное усиление стенки кишечника).
Когда комбинация рентгенологических данных сочетается с клинической картиной, тогда рентгенолог и врач-клиницист должны поднять вопрос о возможной ИАГ и/или АКС в качестве дифференциального диагноза.
Лучшим методом установления или исключения факта ИАГ является измерение внутрибрюшного давления. Существуют прямые и косвенные способы определения ИАД. Прямое измерение внутрибрюшного давления может быть выполнено с помощью внутрибрюшинного катетера с датчиком давления. Методы косвенного измерения включают определение любого из следующих давлений:
В связи с положением мочевого пузыря в брюшной полости, внутрипузырный метод считается простым, точным и минимально инвазивным; следовательно, это надежный и воспроизводимый способ измерения ИАД.
Техника внутрипузырного метода измерения ИАД
При выполнении измерения, необходимо соблюдать несколько рекомендаций:
Необходимое оборудование
Изображение 2 | Система мониторинга ИАД ABVISER IPA
Шаги для измерения внутрипузырного давления:
Выводы
Установлено, что измерение ИАП имеет существенное прогностическое значение для тяжелобольных пациентов, так как ИАГ и АКС часто ассоциируются с неблагоприятными исходами. По этой причине ранняя и постоянная оценка, включая серийные измерения ИАД, должна контролироваться у любого пациента, у которого есть подозрение на ИАП/АКС.
Раннее распознавание имеет важное значение в управлении и благоприятном для пациента исходе. Необходимо понять патофизиологию ИАГ и АКС, исходить из более высокой настороженности и проверить наличие ИАГ у всех пациентов, имеющих факторы риска. В идеале хотелось бы иметь возможность диагностировать развивающийся ИАГ и АКС и вмешиваться до начала дисфункции и отказа органов и систем.
Предпочтительно, чтобы раннее терапевтическое вмешательство, будь то медицинские или хирургические попытки уменьшить ИАГ, рассматривалось как можно раньше. Руководящие принципы и рекомендации WSACS дают врачам полезное понимание ИАГ и АКС и их клинического управления для улучшения выживаемости пациентов.
Что такое внутригрудное давление
6.1. Патогенез обструктивной формы дыхательной недостаточности
1) обтурации (закупорки воздухоносных путей инородными телами, рвотными массами, мокротой, слизью, меконием (у новорожденных); воспалительных изменений слизистой оболочки дыхательных путей, гиперсекреции и диссекреции слизи, задержки в дыхательных путях патологического отделяемого (рис.7,8);
Рис.7. Обструкция дыхательных путей
Рис.8. Обструкция дыхательных путей у курильщика
2) компрессии (сдавления) дыхательных путей опухолью, гипертрофированной щитовидной железой, заглоточным абсцессом;
3) утолщения слизистой оболочки трахеи и бронхов вследствие отека слизистой дыхательных путей и клеточной нифильтрации при воспалении, иммуноаллергическом процессе;
4) стеноза при спазме мышц гортани психогенного (истерия) или рефлекторного характера (раздражение газообразными веществами), при формировании послеожогового рубца, при клапанной обструкции бронхов, характерной для хронической обструктивной эмфиземы легких; в результате утраты легкими эластических свойств и нарушения тонуса бронхиальной мускулатуры может развиться дискинезия (экспираторный стеноз) дыхательных путей.
Патогенетическую основу обструктивного синдрома дыхательных путей составляет повышение сопротивления воздушному потоку. Это приводит к тому, что снижается уровень альвеолярной вентиляции. Повышение сопротивления увеличивает нагрузку на дыхательную мускулатуру, и наблюдается быстрое утомление мышц. У больного развивается стенотическое дыхание (удлинение вдоха, т.е. инспираторная одышка).
Достаточно часто в клинической практике наблюдается хроническая бронхиальная обструкция, которая обозначается термином «хроническая обструктивная болезнь легких» (ХОБЛ). Причинами развития ХОБЛ являются: хронический бронхит (это самая частая причина), бронхиальная астма, эмфизема легких, муковисцидоз, бронхоэктатическая болезнь.
Обструкция конечного отдела дыхательных путей наблюдается при бронхо- и бронхиолоспазмах, спадении мелких бронхов, утративших эластичность, сужении просвета бронхиол вследствие отечно-воспалительных изменений, обтурации бронхиол патологическим содержимым (кровью, экссудатом), компрессии бронхиол в условиях повышенного внутригрудного давления (при кашле). При обструкции нижних дыхательных путей для осуществления полноценного выдоха необходимо участие дыхательных мышц, так как сила эластической тяги легких недостаточна для изгнания воздуха из альвеол. Давление и бронхиальное сопротивление на выдохе более выражены, чем на вдохе, при этом возникает удлинение выдоха по сравнению с вдохом (экспираторная одышка).
6.2. Патогенез рестриктивной формы дыхательной недостаточности
а) внелегочные факторы приводят к ограничению дыхательных движений вследствие сдавления легочной ткани (например, при гемо- и пневмотораксе, образовании плеврального выпота);
б) внутрилегочные факторы вызывают изменение эластичности легочной ткани. Основой рестриктивных нарушений является повреждение белков интерстиция под действием эластазы, коллагеназы и других протеаз. Как известно, основными компонентами интерстиция легких являются коллаген (60-70%), эластин (25-30%). Гликозаминогликаны составляют около 1%, а фибронектин – 0,5%. Фибриллярные белки обеспечивают стабильность каркаса легких, его растяжимость, эластичность, создают оптимальные условия для газообмена. При ряде патологических процессов в легких (воспалительного характера, нарушениях кровотока, при тромбозе, эмболии сосудов, застойных явлениях в легких, эмфиземе, опухолевом и кистозном поражении) возможна активация лизосомальных гидролаз, в частности, эластазы, коллагеназы. Последняя приводит к интенсивному распаду фибриллярных белков, что проявляется снижением эластичности легочной паренхимы и повышением эластического сопротивления легочной ткани вдыхаемому воздуху.
Снижение эластичности легочной ткани и развитие рестриктивной формы дыхательной недостаточности возникают при диффузном межальвеолярном разрастании соединительной ткани в случаях пневмосклероза, пневмофиброза, а также при отеке легких различного генеза.
Рестриктивные изменения легочной ткани обуславливают уменьшение глубины вдоха и вызывают тахипноэ, т.е. развивается «короткое» или поверхностное дыхание.
Достаточно часто в клинической практике наблюдается дыхательная недостаточность смешанного обструктивно-рестриктивного характера, когда сочетаются нарушение проходимости воздухоносных путей и ограничение подвижности легких. Последнее наблюдается при эмфиземе легких, крупозной пневмонии, бронхиальной астме, бронхоэктатической болезни, хронической пневмонии т.д.