что такое вирус клейта
Крохотные курьеры: как аденоассоциированные вирусы спасают жизни
Крохотные курьеры: как аденоассоциированные вирусы спасают жизни
Авторы
Редакторы
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
Эта история началась в середине 1960-х, когда в препаратах аденовируса обезьян случайно было обнаружено загрязнение из маленьких неизвестных частиц [1]. Эти частицы были впоследствии названы аденоассоциированным вирусом (сокращенно ААВ, англ. adeno-associated virus, AAV). Тогда мало кто мог предположить, что именно эти крошечные вирусы дадут надежду многим неизлечимым больным. И лишь несколько исследовательских групп, движимых чисто научным любопытством, отправились изучать базовую биологию ААВ.
Прошло несколько десятков лет, и стало понятно, что ААВ обладает множеством уникальных свойств. Эти особенности позволяют использовать его в поистине революционном направлении — генной терапии. По разным оценкам, около 5% новорожденных детей страдает от различных генетических заболеваний [2]. Долгие годы такие болезни считались неизлечимыми, и для многих подобный диагноз приравнивался к приговору. К счастью, времена изменились. Мы находимся на пороге эры лекарств принципиально нового типа [3], и немаловажную роль в этом сыграл аденоассоциированный вирус [4].
Биология вируса
Какими же уникальными особенностями обладает ААВ? Чтобы ответить на этот вопрос, нужно подробнее поговорить про его жизненный цикл и строение.
Аденоассоциированный вирус принадлежит к роду Dependoparvovirus семейства Parvoviridae. Название рода отражает его необычный жизненный цикл, когда для размножения необходимо наличие вспомогательного вируса (от лат. Dependo — «зависеть»). В качестве такого вируса-помощника, как правило, выступает аденовирус (что явно следует из названия) или представители семейства герпесвирусов [5].
ААВ настолько безобиден, что помимо неспособности самостоятельно размножаться, он не вызывает никаких заболеваний человека и животных. Более того, согласно некоторым исследованиям, большинство людей (>70%) в течение жизни были заражены одним или несколькими серотипами ААВ [6]. (Серотип — вариант вируса, который отличается от других антигенами на своей белковой оболочке).
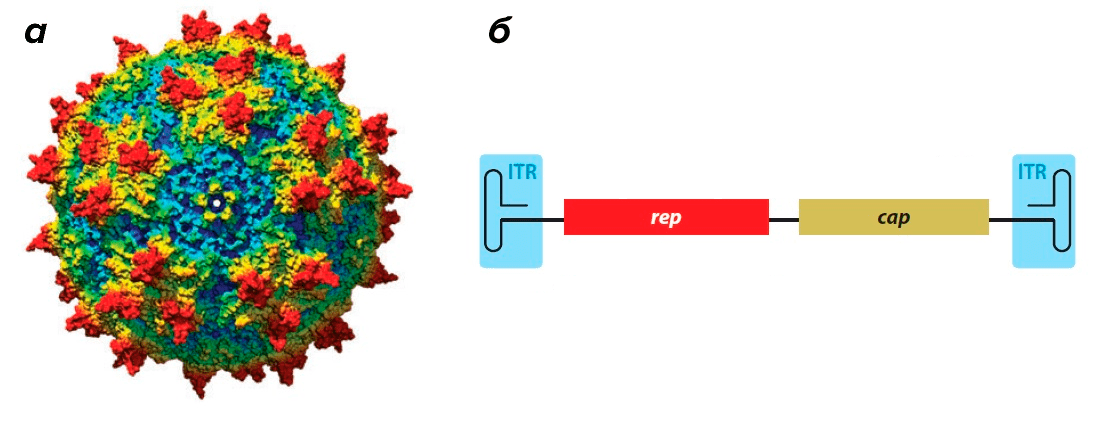
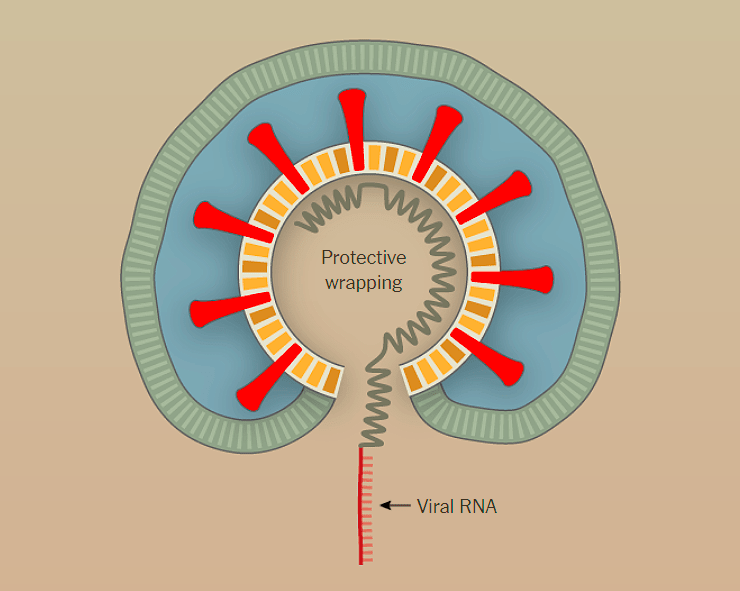
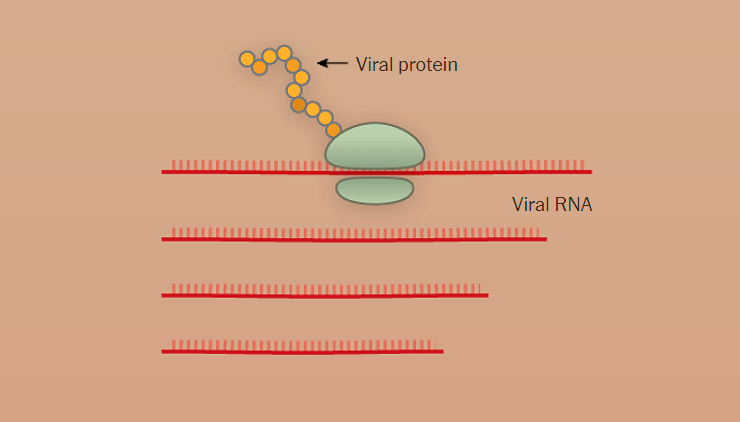
Вирус довольно мал — его икосаэдрическая белковая оболочка (капсид) в диаметре составляет всего около 25 нм (риc. 1а). Капсид необычайно стабилен: устойчив к кратковременному воздействию тепла, кислой среде и протеазам [7]. Геном, представленный одноцепочечной ДНК, по размерам также весьма скромен — всего 4,7 тысяч нуклеотидов [7].
Этот небольшой геном содержит минимальное количество генов. Ген rep (от слова replication) кодирует белки, необходимые для размножения вируса и его дальнейшей сборки внутри клетки (рис. 1б). Ген cap (от слова capsid) кодирует белки капсида (рис. 1б).
Геном ААВ обрамлен двумя Т-образными шпильками — инвертированными концевыми повторами (inverted terminal repeats, ITR) (рис. 1б).
Рисунок 1. Аденоассоциированный вирус. а — Модель капсида ААВ. б — Геном аденоассоциированного вируса. ITR (inverted terminal repeats) — инвертированные концевые повторы, образующие Т-образные шпильки; rep — ген, кодирующий белки, отвечающие за репликацию; cap — ген, кодирующий белки капсида.
Судьба вируса в клетке
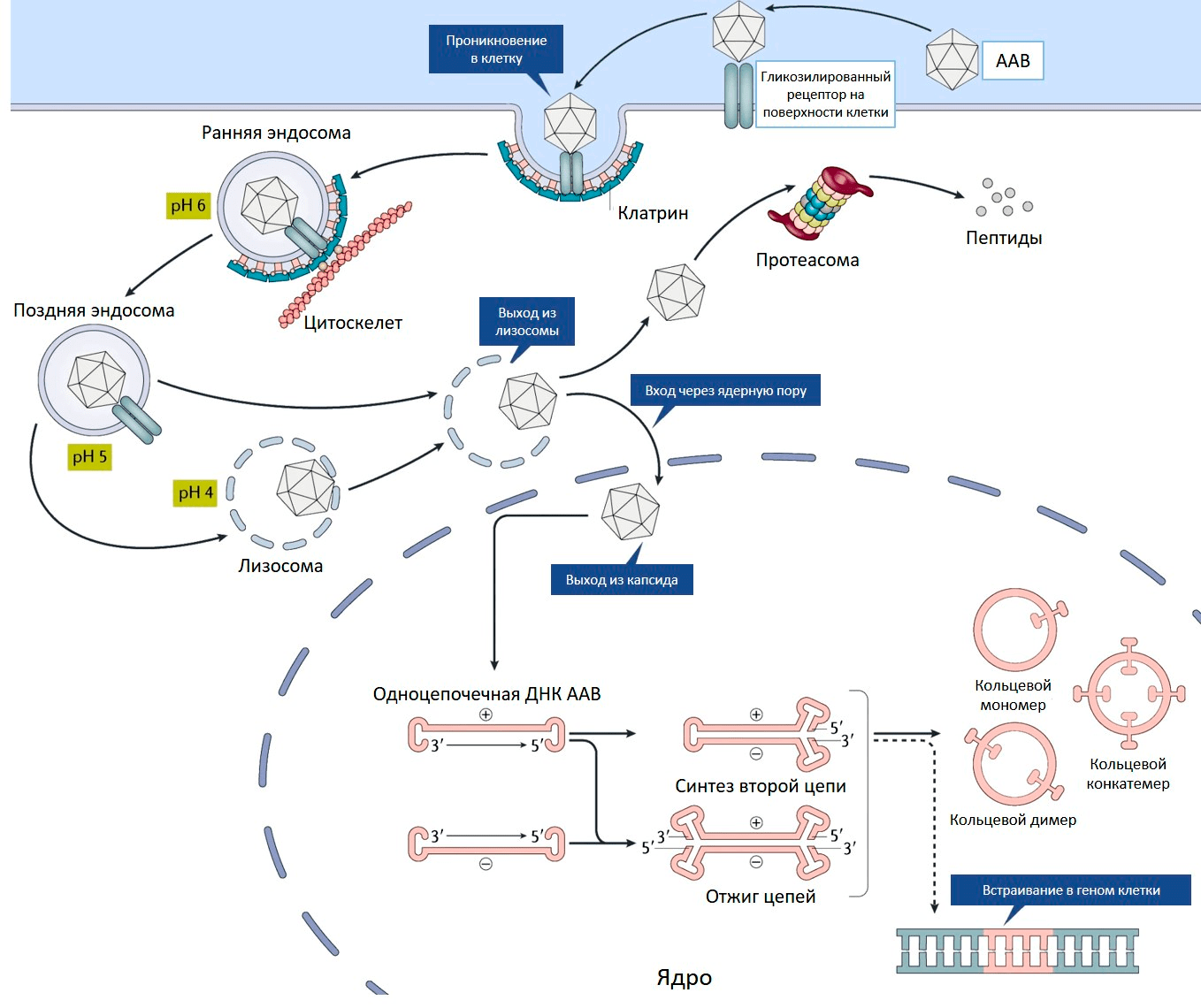
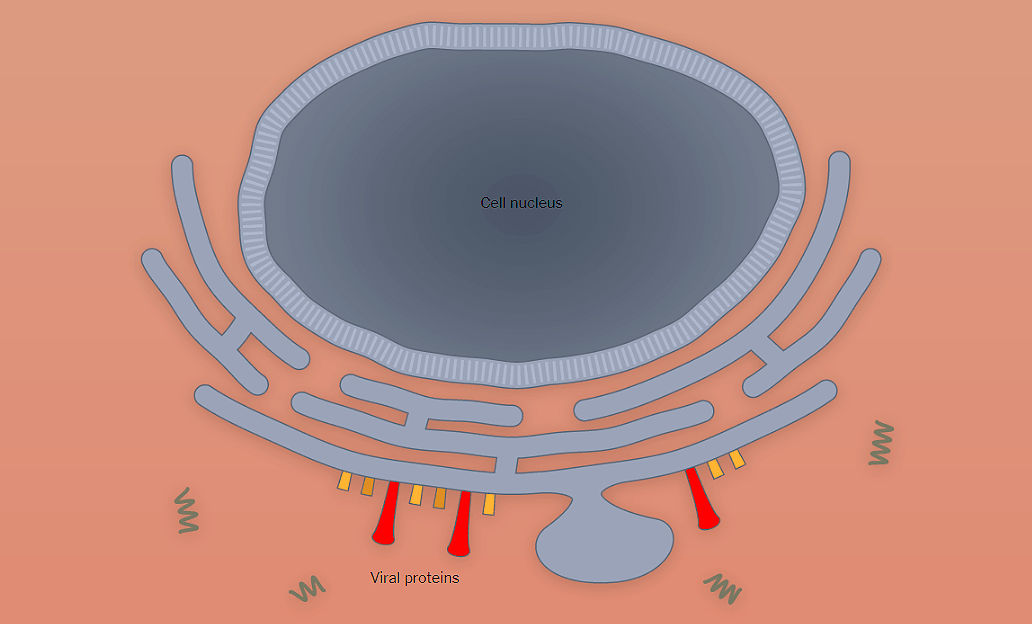
Ценное свойство ААВ — его способность проникать как в делящиеся, так и неделящиеся клетки [8]. На первом этапе аденоассоциированный вирус связывается с рецептором на поверхности клетки (рис. 2) [9]. Разные серотипы ААВ предпочтительно связываются со своими рецепторами, характерными для определенных типов клеток [10].
Рисунок 2. Проникновение ААВ внутрь клетки. Пояснения в тексте.
[9], рисунок с изменениями
И это важное свойство — определенный серотип преимущественно проникает лишь в конкретную ткань или орган, то есть обладает своим уникальным тропизмом.
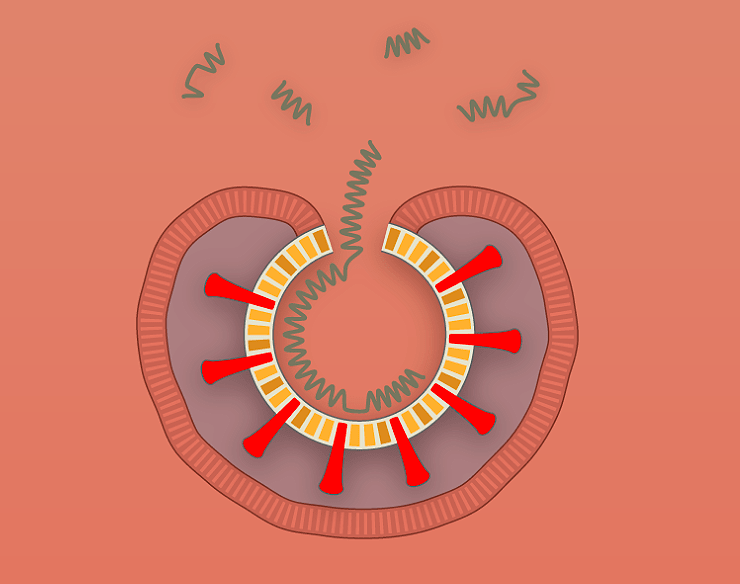
Связывание вируса с рецептором запускает процесс проникновения внутрь клетки. Эндосома (мембранный пузырек, содержащий вирусную частицу) передвигается в цитоплазме по цитоскелету. Постепенно среда в эндосоме закисляется, что приводит к изменениям капсида, необходимым для дальнейшего успешного заражения клетки. После выхода из эндосомы у вируса два пути. Либо он попадает в клеточную машину по уничтожению белков (протеасому) и разрушается, либо переносится в ядро, где вирусный геном высвобождается из капсида (рис. 2) [10].
С одноцепочечного вирусного генома еще не могут нарабатываться белки, для этого необходимо достроить вторую цепь ДНК. Она синтезируется с помощью ДНК-полимеразы клетки-хозяина, используя шпильку ITR в качестве затравки для построения второй цепи.
Вирусные ITR помогают не только строить вторую цепь ДНК, но способствуют межмолекулярной и внутримолекулярной рекомбинации геномов вируса. В результате в ядре клетки образуются кольцевые молекулы ДНК — эписомы (рис. 2). В такой форме геномы ААВ могут в течение многих лет присутствовать в ядре [10].
Кроме того, геном ААВ может с низкой частотой встраиваться в определенный локус на 19 хромосоме человека [11]. Этот феномен обусловлен сходством последовательностей ДНК данного локуса и ITR вируса. У ААВ, лишенного гена rep, способность к встраиванию своего генома сильно снижена. Такие вирусные геномы присутствуют в клетках в виде эписом.
Модификация ААВ для применения в генной терапии
Если в гене человека произошла мутация, которая привела к развитию заболевания, то болезнь можно победить или облегчить, если доставить в клетки организма рабочую копию поломанного гена. Вот тут и выходит на сцену аденоассоциированный вирус.
Что же нужно было в нем изменить, чтобы он стал курьером для доставки таких терапевтических генов? Как это часто бывает в биологии, ученые просто воспользовались успешными решениями, уже созданными природой. Раз капсид ААВ сам по себе является ключом к входу в клетку и ядро, то можно смело этим воспользоваться. Остается только заменить гены самого вируса на гены, интересующие исследователя, и вирусный курьер готов!
Модификация генома ААВ
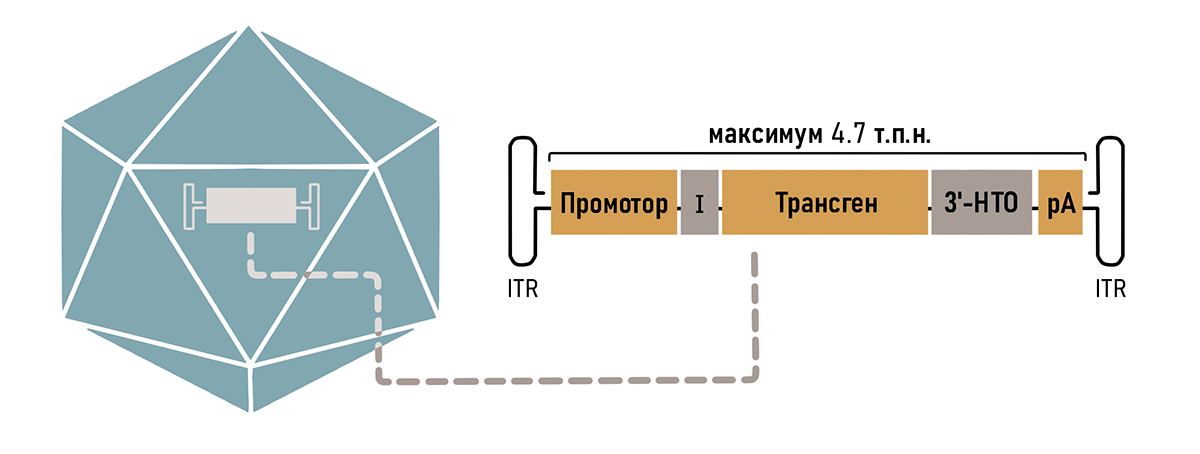
Оказалось, что от всего генома ААВ необходимо было оставить только концевые шпильки ITR, необходимые для сборки самого вируса и сохранения его генома в ядре (рис. 3) [12]. Таким образом, можно без последствий удалить до 96% генома ААВ, используя полученное пространство для кодирования нужных генов.
Так как ААВ вмещает в себя всего около 5000 пар нуклеотидов, то нужно очень тщательно продумать остальной состав кассеты. В первую очередь туда необходимо поместить рабочую копию гена (трансген), в зависимости от того генетического заболевания, на которое направлено лечение. Также обязательно наличие регуляторных последовательностей, таких как промотор и сигнал полиаденилирования (рис. 3). Разберем элементы кассеты подробнее.
Рисунок 3. Компоненты типичной кассеты ААВ вектора. Оранжевые блоки (промотор, трансген и сигнал полиаденилирования — рА) являются обязательными компонентами. Для повышения эффективности экспрессии могут быть включены необязательные регуляторные элементы, такие как интрон (I) и другие компоненты 3′-нетранслируемой области (НТО). Кассета обрамлена инвертированными терминальными повторами (ITR).
рисунок авторов статьи
Из-за ограниченной емкости вируса могут возникнуть трудности с доставкой больших терапевтических генов. Очевидное решение проблемы — разработка сокращенной версии гена, который кодирует усеченный, но функциональный белок. Создание таких укороченных генов требует глубокого понимания биологии терапевтического белка, взаимосвязи его структуры и функции. Такой подход уже успешно применяется в нескольких клинических испытаниях по лечению миодистрофии Дюшенна [13] (ссылки на клинические испытания: NCT03368742, NCT04281485, NCT03769116), в доклинических исследованиях по лечению дисферлинопатии, амавроза Лебера и многих других заболеваний.
Другим потенциально перспективным подходом для доставки слишком больших трансгенов может быть разделение гена между двумя ААВ-векторами [14]. Два этих векторных генома, попадая в одно и то же ядро клетки, могут подвергаться межмолекулярной рекомбинации с последующим восстановлением полноразмерного гена. Такой двухвекторный подход пока применяется лишь в редких клинических испытаниях (пример — NCT02710500). Низкая эффективность восстановления полноразмерного гена ограничивает более широкое применение этого приема.
Правильно выбранный промотор — во многом залог успешной генной терапии. Идеальный промотор должен запускать стабильную высокую экспрессию трансгена в пораженных органах в течение длительного периода, при этом быть неактивным в других тканях. Малая емкость ААВ также требует уменьшения размера промотора [15].
К кассету можно добавить необязательные элементы, способные улучшить экспрессию трансгена (рис. 3). Так, например, присутствие интрона повышает стабильность РНК в ядре [16], а также способствует эффективному транспорту мРНК из ядра в цитоплазму [17].
К обеспечению тканеспецифичности можно подойти с другой стороны — не только стимулируя экспрессию в целевых тканях, но и подавляя ее в нежелательных органах с помощью механизмов РНК-интерференции [18]. Для этого в 3′-НТО-кассеты добавляют сайты связывания микроРНК, присутствующих строго в нецелевых органах (рис. 3) [19]. Если трансген оказывается в нежелательном органе, то микроРНК связывается с комплементарными ей сайтами в транскрипте и запускает его деградацию.
Модификация капсида ААВ
Хотя капсид ААВ — сам по себе уже удачное изобретение природы, человечество не остановилось в своем научном поиске. Новые серотипы ААВ могут обладать рядом преимуществ:
Благодаря развитию новых методов анализа выделяют несколько основных направлений для создания или выявления новых серотипов.
К сожалению, всегда существует вероятность, что хорошо работающий in vitro модифицированный капсид в экспериментах на лабораторных животных продемонстрирует низкую эффективность или даже токсичность. Всестороннее изучение свойств разрабатываемых препаратов и строгий контроль качества призваны минимизировать риск неблагоприятного исхода исследований [23].
Применение ААВ в клинике
Целевые органы, на которые направлена терапия
К 14 декабря 2020 года 227 препаратов на основе ААВ проходят клинические испытания (по данным сайта ClinicalTrials.gov). Сегодня уже существует несколько препаратов на основе ААВ, которые получили одобрение от регулирующих органов для коммерческого использования у пациентов (подробнее про эти препараты можно почитать в [4]):
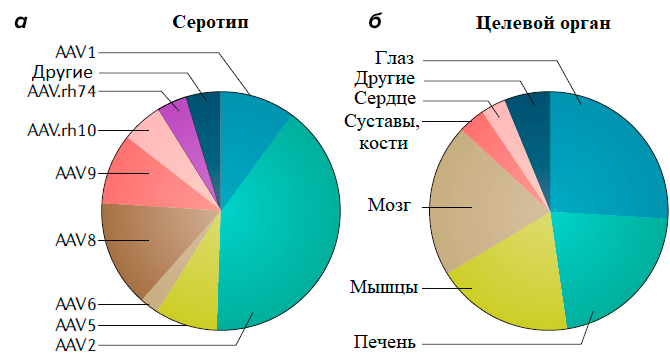
Большинство серотипов ААВ «предпочитают» проникать в такие органы, как печень, поперечно-полосатые мышцы и ЦНС, что и определило направление большинства программ генной терапии (рис. 4).
Рисунок 4. Данные с сайта ClinicalTrials.gov: на 13 ноября 2018 г. было зарегистрировано 145 клинических испытаний с использованием ААВ. а — Классифицикация клинических испытаний на основе примененного серотипа ААВ (AAV). б — Целевой орган, на который направлена терапия в указанных клинических испытаниях. Можно заметить, что спустя два года количество клинических испытаний с применением ААВ почти удвоилось (227 на сегодняшний день против 145 испытаний два года назад).
Почти все природные серотипы ААВ эффективно заражают печень после внутривенного введения. Благодаря данному свойству вируса в клинических испытаниях находятся препараты для лечения гемофилии A и B (NCT03392974, NCT03587116), семейной гиперхолестеринемии (NCT02651675), дефицита орнитинтранскарбамилазы (NCT02991144), мукополисахаридоза-IIIA (NCT03612869) и синдрома Криглера—Найяра (NCT03223194) [25].
Серотипы ААВ8 и ААВ9 могут эффективно заражать разные типы мышц по всему телу. Такое свойство делает их идеальными векторами для генной терапии множества мышечных заболеваний [26]. Так, активно исследуются в клинике препараты для лечения миодистрофии Дюшенна (NCT03375164), дисферлинопатии (NCT02710500), миотубулярной миопатии (NCT03199469), болезни Помпе (NCT03533673). Примечательно, что зараженная мышца может также служить биофабрикой для производства секретирующихся терапевтических белков для лечения немышечных заболеваний. Хотя большинство сердечных заболеваний полигенны и подвержены влиянию окружающей среды, ведется разработка препаратов генной терапии для лечения сердечной недостаточности [26].
Большой процент разрабатываемых препаратов на основе ААВ направлен на лечение неврологических и глазных болезней (рис. 4) [27], [28]. Глаз — весьма обособленный орган, обладающий уникальной иммунологической толерантностью, и легко доступный для прямого введения препарата. Нетрудно понять, почему один из первых одобренных препаратов, «Люкстурна», был направлен именно на лечение наследственной слепоты. Мозг, напротив, намного более крупный и сложно организованный орган. Прямая доставка препарата в мозг или спинномозговую жидкость позволяет локализовать вирус и снизить дозу препарата, но это инвазивная процедура, сопряженная со многими рисками. К счастью, такие серотипы, как ААВ9 или ААВrh.10, могут пересекать гематоэнцефалический барьер, что позволяет использовать рутинное внутривенное введение. В настоящий момент в клинических испытаниях уже находятся препараты для лечения болезни Паркинсона (NCT02418598), метахроматической лейкодистрофии (NCT01801709), болезни Баттена (NCT01414985), мукополисахаридоза 3 типа (NCT03300453).
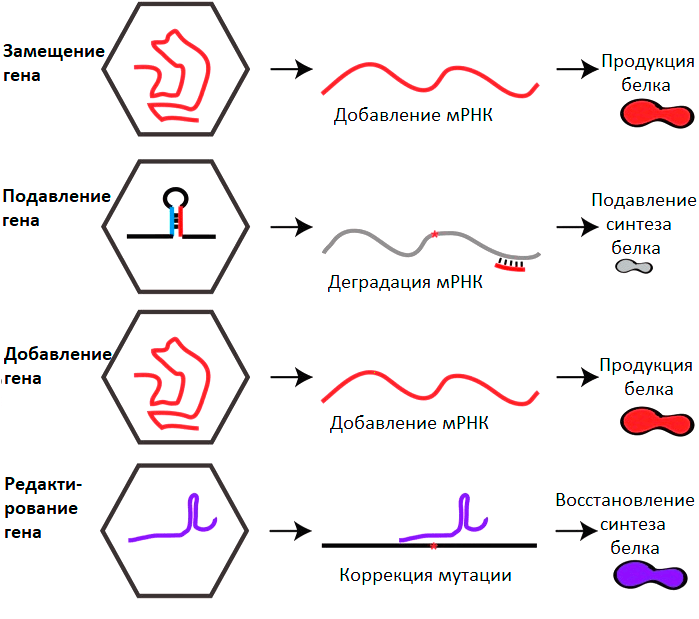
Основные стратегии генной терапии на основе рААВ
Можно выделить 4 глобальных направления генной терапии с применением ААВ (рис. 5).
Рисунок 5. Основные стратегии генной терапии на основе ААВ. Пояснения в тексте.
[29], рисунок с изменениями
Производство ААВ
Когда речь идет о клинических испытаниях, требуется очень большое количество вирусного препарата высокого качества. Его производство — весьма нетривиальная задача.
Вирусы не могут самостоятельно себя воспроизводить, им необходима помощь клеточной машинерии. Для наработки ААВ стали использовать культуры клеток. Вариантов может быть много: использование культуры дрожжей (Saccharomyces cerevisiae) [33], клеток насекомых (культура клеток Sf9 бабочки Spodoptera frugiperda) [34], человека — HEK293, HeLa. Некоторые из этих подходов, — скорее, экзотика, но использование культур клеток млекопитающих (HEK293) или насекомых (Sf9) уже прочно закрепилось на производстве.
Итак, для начала необходимо определиться с методикой производства, ведь от этого зависит, в чем будет расти сама культура. Вариантов масса: для клеток, растущих, прикрепившись к субстрату, это могут быть большие чашки Петри, специальные сосуды с множеством перегородок для увеличения площади поверхности (рис. 6а). Для культур, хорошо чувствующих себя в виде суспензии и при постоянном перемешивании, — колбы, герметичные пакеты и многое другое. При увеличении масштабов производства можно переходить на специальные биореакторы (рис. 6б). С их помощью можно следить за целой панелью важных для процесса параметров. Они делают производство более технологичным и позволяют увеличить объемы продукции до нескольких сотен литров вирус-содержащей суспензии за один цикл работы.
Рисунок 6. Производство ААВ: на культуральных чашках (а) и в биореакторе iCellis Nano (Pall corporation) (б)
фотографии авторов статьи
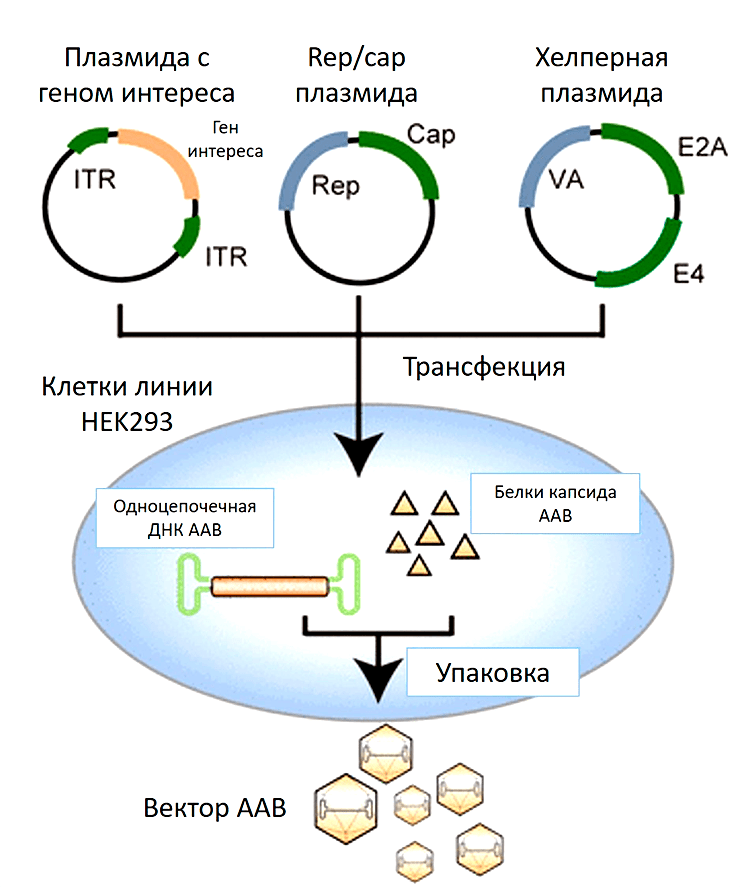
Что нужно сделать с культурой клеток, чтобы она стала биофабрикой по производству вирусных частиц? В такие клетки-производители вносят плазмидную ДНК, кодирующую необходимую для сборки вирусов информацию. Наиболее популярный протокол предполагает одновременное заражение клеток тремя плазмидами (рис. 7):
Кстати, вместо третьей плазмиды может быть добавлен сам вирус-помощник (аденовирус или герпесвирус), как это было в более ранних протоколах по производству частиц ААВ [35].
Рисунок 7. Производство ААВ, использующее в качестве клеток-производителей культуру клеток человека HEK293. Смесь трех плазмид доставляют внутрь клетки (плазмиду с терапевтическим геном, плазмиду, кодирующая гены rep/cap, и плазмиду с генами вируса помощника). Начинается наработка необходимых белков для сборки вирусных частиц. ДНК, содержащая терапевтический ген, упаковывается в готовый капсид ААВ.
Клетки начинают производить вирусные частицы, после чего их надо собрать и очистить.
Это критически важный этап, которому стоит уделить особое внимание [22], [23]. Любые примеси, которые будут содержаться в препарате, могут вызвать нежелательный иммунный ответ.
Вначале собирают сырой материал: это может быть клеточная среда, если вирусы выделяются клетками преимущественно в жидкость вокруг, а могут быть и сами клетки, если большинство вирусных частиц накапливается внутри. Как правило, это зависит от конкретного серотипа ААВ. Чтобы разрушить клеточные мембраны и высвободить вирус, клетки подвергают многочисленным циклам замораживания-оттаивания, ультразвуковой обработке или воздействию детергентов.
Теперь основная задача — очистить вирусные частицы от многочисленных примесей, находящихся в суспензии (рис. 8). В сыром материале находятся внутриклеточные свободные ДНК и РНК, белки и ферменты, крупные обломки клеточных мембран и многое другое. Способов очистки существует множество, и постоянно появляются как улучшенные версии уже применяемых методик, так и принципиально новые подходы. Все они различаются по уровням специфичности, эффективности и, разумеется, стоимости. Условно способы очистки можно разделить на серотип-специфичные и универсальные. К первой категории относится, например, аффинная хроматография [37], основанная на специфическом узнавании капсидов антителами. Ко второй — ультрацентрифугирование в градиентах плотности растворов йодиксанола или хлорида цезия, преципитация полиэтиленгликолем или сульфатом аммония, ионообменная хроматография и многие другие методы, основанные на общих физических свойствах вирусных частиц [38].
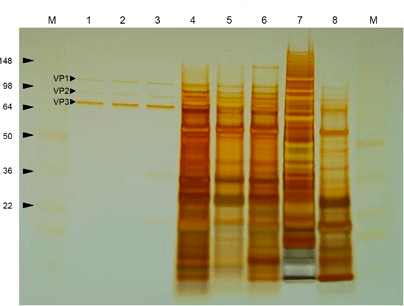
Рисунок 8. Окрашивание серебром очищенного (лунки 1–3) и загрязненного другими белками (лунки 4–8) препарата ААВ после гель-электрофореза [38].
Одна из неочевидных нежелательных примесей — так называемые пустые капсиды — вирусные частицы, не несущие в себе терапевтический ген, или содержащие внутри себя постороннюю ДНК. Дело в том, что изначально в клетке формируется пул пустых капсидов. Лишь потом ДНК связывается с пустым капсидом при помощи специальных сигналов на ITR и компактно упаковывается, формируя полноценную вирусную частицу. Но иногда пустой капсид может так и остаться пустым при нехватке вирусной ДНК или ее неэффективной упаковке. В пустой капсид может также упаковаться обрывок свободной ДНК, находящейся в клетке и содержащей последовательность, схожую с сигналом упаковки. Такие частицы (совсем пустые или несущие неправильную последовательность) не функциональны и подлежат удалению из очищаемого препарата. С определенной эффективностью их можно отделить от функциональных капсидов, используя градиенты плотности или методы хроматографии.
Основные проблемы
Наработка большого количества плазмид высокой степени очистки, поддержание культур клеток, дорогостоящие реактивы, сложный процесс очистки вирусных частиц и разработка аналитических методик для характеризации препаратов ведут к таким космическим ценам при масштабировании производства. На стоимость также влияет серьезный контроль качества вирусного препарата. Чтобы препарат вышел на рынок, проводятся исследования его токсичности, безопасности, биораспределения, эффективности. Оценивается содержание белковых примесей, бактериальных эндотоксинов, количество пустых капсидов, стерильность препарата, концентрация вирусных частиц в растворе и множество других характеристик [23]. В настоящий момент гиганты производств ААВ по всему миру работают над удешевлением препаратов, разрабатывая более эффективные протоколы сборки и очистки ААВ.
Иммунный ответ также представляет собой серьезную проблему. Потенциально иммунные реакции могут возникать на вирусный капсид, его геном, а также на белковый продукт трансгена. Препаратам на основе ААВ могут помешать нейтрализующие антитела к его капсиду [39]. Связываясь с вирусами в кровотоке, антитела препятствуют проникновению вирусных частиц в клетки, что ведет к низкой эффективности препарата. В настоящий момент обязательно проводится скрининг пациентов на наличие антител к применяемому серотипу ААВ [40]. В случае их обнаружения такой пациент исключается из клинических испытаний. Ведется разработка новых капсидов, которые не будут узнаваться нейтрализующими антителами [41]. После доставки терапевтических доз ААВ быстро развивается гуморальный иммунный ответ, который впоследствии помешает повторному введению препарата [42]. Именно поэтому большинство генотерапевтических препаратов на основе ААВ рассчитано на однократное введение. Для подавления Т-клеточного иммунного ответа у пациентов применяется фармакологическая супрессия стероидами [40].
Заключение
Генная терапия на основе ААВ — бурно развивающееся направление, и мы в данном обзоре затронули лишь небольшой кусочек этой удивительной области. Текущий экспоненциальный рост клинических испытаний с использованием ААВ предполагает, что мы находимся в самом начале эры новых генотерапевтических препаратов. Еще очень много задач предстоит решить, и для этого требуются мультидисциплинарные усилия. Дальнейшее развитие молекулярной биологии, биоинформатики, эпидемиологии, структурной биологии, иммунологии, геномики и других дисциплин, безусловно, будет способствовать совершенствованию технологии. Уже пройден длинный путь в попытке человечества победить генетические заболевания. Мы надеемся, что именно генная терапия приведет к окончательной победе!
COVID-19: что мы знаем и чего не знаем
«Биомолекула» разбирается в научных аспектах сегодняшней эпидемии
Автор
Редакторы
Рецензенты
«Биомолекула» продолжает отвечать на вопросы, связанные с эпидемией коронавируса SARS-CoV-2, и на этот раз рассматривает вирус с точек зрения биологии, медицины и фармацевтической индустрии. Для этого мы проконсультировались с шестью экспертами в этих областях.
Ситуация с коронавирусом столь актуальна в эти дни, что мы открыли на «Биомолекуле» новый раздел SARS-CoV-2, а также публикуем уже четвертый материал по этой теме. Первые три вот такие: «2019-nCoV: очередной коронованный убийца?» [2], «Хроника распространения SARS-CoV-2» [3] и «COVID-19: отвечаем на вопросы» [1]. Эта статья уже четвертая и, может статься, не последняя.
В подготовке материала участвовала команда из шести экспертов:
Антон Гопка, генеральный партнер биотехфонда ATEM Capital, член Консультационного совета Национального института рака США, декан факультета itmotech Университета ИТМО
Дмитрий Купраш, д.б.н., главный научный сотрудник ИМБ РАН, профессор кафедры иммунологии биологического факультета МГУ им. М.В. Ломоносова и кафедры молекулярной и клеточной биологии МФТИ
Андрей Летаров, д.б.н., проф. кафедры вирусологии биологического факультета МГУ
Дисклеймер: Андрей Летаров работает с бактериофагами и не является специалистом по вирусным инфекциям людей и животных, поэтому его ответы базируются на общей вирусологической эрудиции и знакомстве с материалами по теме.
Александр Панчин, к.б.н., с.н.с. ИППИ РАН, биоинформатик и известный российский популяризатор науки
фото Екатерины Мамонтовой
Василий Штабницкий, к.м.н., пульмонолог, врач клиник «Рассвет» и «Чайка»
Илья Ясный, к.х.н., руководитель научной экспертизы фармацевтического фонда «Инбио Венчурс»
1. Откуда взялся SARS-CoV-2?
Китайское правительство сообщило о первых случаях «пневмонии неизвестной этиологии» в Ухане 31 декабря, но вирус появился в Китае на несколько недель раньше. В январе количество случаев заражения в Китае начало быстро нарастать, в стране ввели карантин в нескольких крупных городах [4]. Параллельно вирус стал распространяться сначала по разным частям региона (китайские специальные административные регионы Гонконг и Макао, Тайвань, Япония, Корея, Сингапур), затем первые случаи обнаружили в США и Европе (во Франции). Сейчас уже несколько недель как именно Европа стала эпицентром эпидемии. Ситуация же в Китае стабилизируется, и власти заявили, что жесткий карантин в Ухане планируется снять 8 апреля. Тем не менее есть вероятность наступления второй волны заболевания, как случилось, например, в Гонконге (китайском SAR): туда возвращаются его жители, которые не могли вернуться раньше из-за карантина, и завозят вирус снова. Подробно об истоках вируса и хронике эпидемии «Биомолекула» уже писала [2], [3].
Команда исследователей показала, что геном вируса, выделенного у группы пациентов с атипичной пневмонией после посещения Уханя, на 89% совпадает с вирусом летучих мышей SARS-like-CoVZXC21 и на 82% — с человеческим вирусом SARS-CoV [5], эпидемия которого случилась в 2002–2004 годах. По этой причине вирус получил название SARS-CoV-2 [6]. Также геном вируса совпадает на 96% с геномом вируса летучих мышей RaTG13 (GenBank Sequence ID: MN996532.1)
Если у вас возникают сомнения в естественном происхождении вируса, ознакомьтесь с постскриптумом к этой статье.
2. Что особенного в этой эпидемии?
Стоит отметить, что эпидемии и даже пандемии случаются с человечеством довольно регулярно (о некоторых из них «Биомолекула» писала: «Объяснена различная вирулентность вирусов гриппа — возбудителей “испанки”» [7]), и переход вируса с животного на человека — тоже не редкость. Например, если даже вспомнить недавние случаи, вирус Зика передается через укус комара [8]; вирусы, вызывающие другие опасные заболевания SARS и MERS, попали к человеку через мясо диких животных (природные носители этих вирусов — летучие мыши); названия птичьего и свиного гриппов говорят сами за себя; заразиться вирусом Эбола можно при контакте с естественными жидкостями из организмов, например, обезьян, которые в свою очередь подхватили вирус от крылановых [9]. Но есть ли что-то необычное в эпидемии SARS-CoV-2?
«Особенность в том, что она случилось в XXI веке, — комментирует вирусолог Андрей Летаров. — Существенно изменились возможности человечества по борьбе с такими инфекциями. Изменились и этические установки: принято считать, что сейчас жизнь отдельного человека стала более важной ценностью для общества, чем, например, в XX веке. И можно предположить, что в середине XX века на такую эпидемию мало бы внимания обратили, лишь потом в семейных преданиях говорили бы, что “когда твоя бабушка была молодая, ходила какая-то страшная болезнь”.
Если сейчас не делать вообще ничего по предотвращению эпидемии, то потери, в сухом бухгалтерском подсчете, не будут очень большими, по сравнению с ежегодной смертностью от других причин. Биологически ничего экстраординарного в этой эпидемии нет.
Возможно, на мой взгляд, особенностью этого вируса является то, что для заражения нужно совсем небольшое его количество. Это рассуждение основано на том, что при таких симптомах люди продуцируют мало инфекционных аэрозолей (из чего можно было бы сделать вывод, что передаваться вирус должен не очень хорошо), но коэффициент R0 [«базовая способность к размножению», среднее количество людей, которых может заразить один носитель вируса — прим. автора] при этом больше двух. Основной способ передачи вируса, как указывает ВОЗ, — контактный или капельно-контактный, значит, “доза” вируса, необходимая для заражения, низка. И это объясняет также и проблемы с диагностикой: концентрация вируса в разных биологических жидкостях больного довольно низка, и обнаружить его может быть сложно».
Сейчас никто не знает, сколько будет продолжаться эпидемия SARS-CoV-2, но, предположительно, вспышки заболеваемости могут продолжаться в зимний сезон и после основной эпидемии [10]. Еще некоторые предположения о том, какие биологические особенности нового коронавируса «помогли» ему вызвать такую глобальную эпидемию, можно прочесть в статье Why the coronavirus has been so successful [11].
3. Сколько штаммов вируса выявлено и что это значит?
В статье в National Science Review от 3 марта 2020 года ученые при анализе 103 геномов вируса выделили два штамма: типа L и типа S, причем указали, что более агрессивный L мутировал из S [12]. Позднее они сделали апдейт: употребление термина «агрессивный» было неверным и вводящим в заблуждение (misleading). Сейчас, даже после анализа гораздо большего количества сиквенсов, все еще трудно точно сказать, насколько значимы различия штаммов коронавируса для течения и исхода COVID-19. Возможно, чтобы окончательно ответить на этот вопрос, понадобится немало времени.
«SARS-CoV-2 — это РНК-содержащий вирус, который в силу особенностей своего воспроизводства достаточно часто подвергается мутациям, — рассказывает вирусолог Андрей Летаров. — Уже сейчас наблюдается несколько десятков различных генетических линий вируса, причем их филогения (родственные отношения) хорошо коррелирует с местом выделения изолятов, то есть распространение вируса по планете происходит в масштабах времени, сопоставимых с накоплением генетических изменений в его геноме. Однако не все мутации имеют сколько-нибудь существенное значение. В определенной обстановке та или иная мутация может иметь больший репродуктивный успех, и тогда этот вариант получит большее распространение в определенной местности. И тогда мы сможем говорить о появлении нового штамма. Важно, чтобы это были не просто отличия по последовательности, но и отличия, которые сопряжены с изменением экологически важных свойств вируса, например, его контагиозности или тяжести заболевания, которое он вызывает.
В целом, сейчас вообще не стоит особо обращать внимание на информацию о количестве штаммов: пока прошло мало времени с начала эпидемии, мы толком не знаем, какие свойства разных типов вируса есть и какие будут найдены».
4. Что происходит с вирусом SARS-CoV-2 в организме?
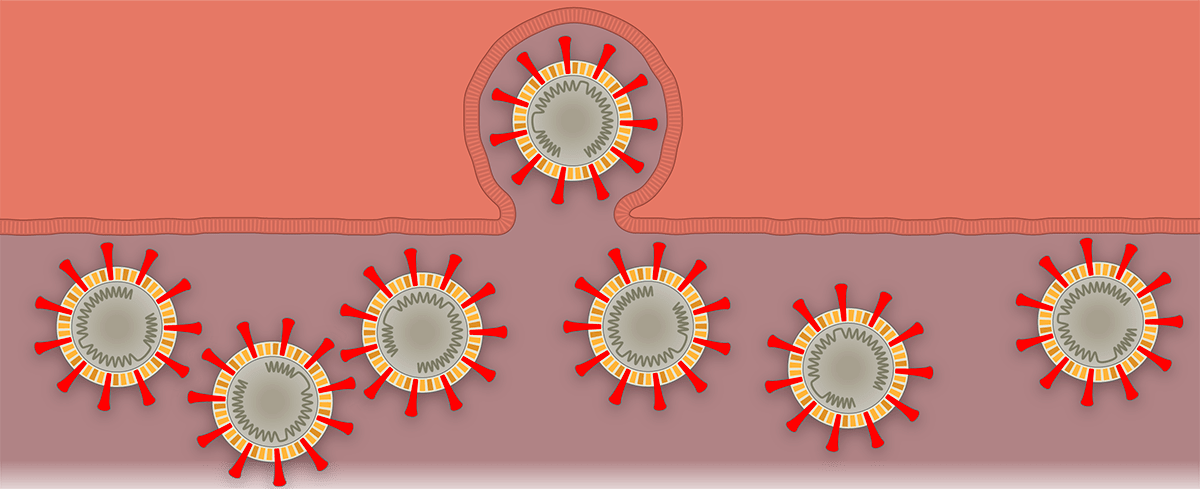
Наглядно попадание вируса в клетку, образование новых вирионов и распространение вируса по организму показано поэтапно на рисунке 1 с использованием графики The New York Times.
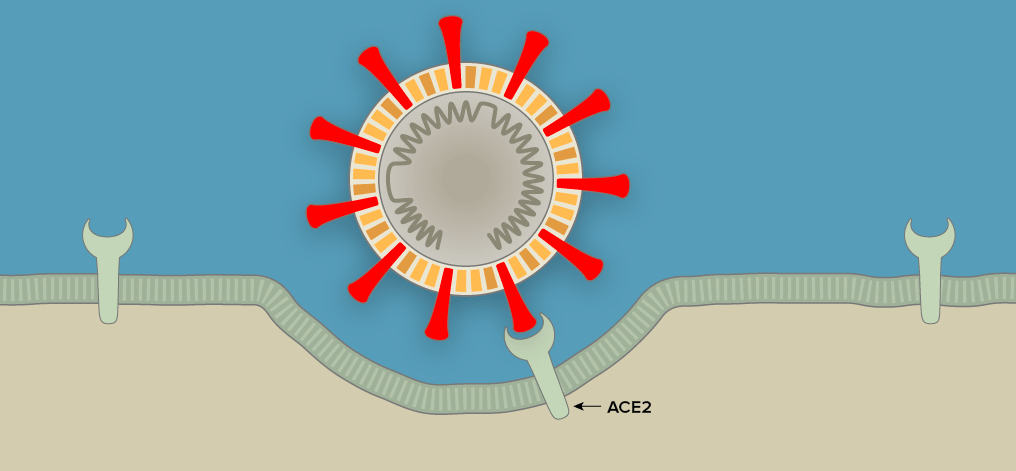
Рисунок 1а. Заражение SARS-CoV-2 клеток человека. SARS-CoV-2 проникает в организм через нос, рот или глаза, добирается до дыхательных путей и прикрепляется к альвеолярному эпителию (рецептор коронавируса — ангиотензинпревращающий фермент 2, ACE2) [13]. После того, как рецептор-узнающий белок Spike связывается с рецептором, вирусная частица попадает внутрь клетки путем эндоцитоза.
Рисунок 1б. Заражение SARS-CoV-2 клеток человека. Происходит слияние мембранной оболочки вируса с мембраной эндоцитозного пузырька, в результате чего содержимое вириона — РНК и некоторые белки — попадают в цитоплазму.
Рисунок 1в. Заражение SARS-CoV-2 клеток человека. Исполнение генетической программы, записанной на вирусной РНК, приводит к синтезу новых копий вируса.
Рисунок 1г. Заражение SARS-CoV-2 клеток человека. Вирионы окончательно собираются в аппарате Гольджи.
Рисунок 1д. Заражение SARS-CoV-2 клеток человека. Новые вирионы наполняются генетическим материалом.
Рисунок 1е. Заражение SARS-CoV-2 клеток человека. Вирионы выходят из клетки путем экзоцитоза. Они распространяются по организму дальше или выходят с кашлем или чиханием наружу, заражая других людей.
Есть основания думать, что новый вирус поражает дыхательные пути меньше, чем SARS-CoV. Рассказывает врач-пульмонолог Василий Штабницкий: «Учитывая высокую летальность первого SARS и MERS, можно говорить о том, что механизмы повреждения тканей у них схожие. И нам, конечно, крупно повезло, что летальность от SARS второго типа гораздо ниже, иначе паника была бы гораздо более выраженная.
Насчет механизма заражения можно отметить несколько важных моментов. Во-первых, вирус может непосредственно размножаться в альвеолярном эпителии, или альвеолоцитах, и повреждать легочную ткань напрямую. Во-вторых — цитокиновый шторм, массированный выброс воспалительных веществ. Это защитный механизм организма: он борется с инфекцией, выбрасывая различные активные молекулы, но вместо борьбы получается полное уничтожение легких и развитие чего-то вроде септического шока (хотя относительно септического шока у вирусных инфекцией — это очень дискуссионный вопрос). И третий момент, тоже очень интересный, но не до конца понятный, — это то, как коронавирус взаимодействует с моноцитами: судя по всему, размножается в этих клетках и каким-то образом мешает работе иммунной системы. Возможно, именно с этим связано достаточно длительное течение этой инфекции, быстрое распространение и тот факт, что человек становится заразным не только до возникновения клинических симптомов, но, возможно, остается какое-то время заразен и после выздоровления. Эти особенности, конечно, не играют нам на руку».
Иммунолог Дмитрий Купраш подтверждает, что, согласно литературным данным, при тяжелом течении заболевания наблюдается заражение вирусом моноцитов (что приводит к чрезмерному неспецифическому воспалению), а кроме того — уменьшение количества Т-лимфоцитов (что приводит к иммуносупрессии), «то есть нечем ни дышать, ни с вирусом бороться».
Пока что подробности того, какие именно структурные характеристики вируса с какими патогенетическими механизмами связаны, еще мало ясны. Например, есть данные, что вирусный белок nsp (nuclear shuttle protein) способен блокировать врожденный иммунный ответ хозяина и что одна из субъединиц гликопротеинов «шипов» оболочки вируса высококонсервативна. В теории и то, и другое можно использовать для создания терапии против вируса. Однако все это требует дополнительных исследований [4].
«Механизмы взаимодействия SARS-CoV-2 с иммунной системой еще недостаточно изучены, — продолжает Дмитрий Купраш. — Как указано в недавнем обзоре в The Lancet [14], особенностью тяжелой коронавирусной инфекции может быть ее усиление за счет взаимодействия Fc-рецепторов иммунных клеток с антителами против S-белка оболочки (Spike — “шип”, тот самый белок, из-за которого частица вируса похожа на корону). Пишут, что антитела против S-белка могут не защищать от инфекции, а, наоборот, помогать проникновению вируса в иммунные клетки. Поэтому при разработке вакцины следует особенно тщательно проводить испытания на животных».
Подробнее про разработку лекарств и вакцин читайте ниже.
5. Какие хронические заболевания повышают риск тяжелого протекания заражения?
Стоит отметить, что те оценки по тяжести симптомов и смертности, которые можно встретить в прессе, возможно, окажутся завышенными, говорят эксперты [15], поскольку часто в расчет берутся только случаи подтвержденного заражения. У большинства же болезнь проходит или бессимптомно, или в мягкой форме, и люди даже не подозревают, что болеют. Количество таких случаев оценить сложно, поскольку для этого требуется массовое и очень надежное тестирование на наличие вируса, а также тестирование на антитела, которое бы показало, переболел человек вирусом или нет.
Какие факторы повышают риски тяжелого протекания заболевания, кроме возраста?
Государственная служба здравоохранения Великобритании и CDC, тем не менее, относят людей с тяжелыми респираторными заболеваниями (муковисцидозом, тяжелой астмой и тяжелой хронической обструктивной болезнью легких и пр.) к группе риска (см. врезку).
Кто входит в группу риска?
Помимо людей старше 65 лет и людей с диабетом и ССЗ, в группу риска сейчас включают и людей с определенными заболеваниями или на определенных стадиях лечения [16], [17]. К ним относятся:
А как особенности иммунной системы влияют на тяжесть заболевания?
«Об этом известно мало, — говорит Дмитрий Купраш, — но можно проводить аналогии с SARS, поскольку наблюдается значительное структурное сходство В-клеточных и Т-клеточных эпитопов двух вирусов. Для SARS-CoV (который после появления SARS-CoV-2 стали называть SARS-CoV-1) показаны ассоциации определенных аллелей главного комплекса гистосовместимости (HLA) обоих классов с тяжестью заболевания. Это отражает тот общий факт, что Т-лимфоциты видят любой вирус “через призму” молекул HLA, и в зависимости от того, какие варианты HLA присутствуют у данного индивидуума, картина будет разной.
Однако имеющихся для SARS-CoV-1 данных недостаточно, чтобы влиять на выбор поведения или стратегии лечения (например, пока не описаны “защитные” аллели, делающие тяжелое течение невозможным). С SARS-CoV-2, вероятно, ситуация будет такой же. Однако если вирус широко распространится в популяции, и будет набрана большая статистика, могут появиться какие-то конкретные рекомендации, касающиеся персональной генетики (хотя мне кажется, что это маловероятно)».
6. Какими методами борются с вирусом сейчас?
Первая стадия борьбы — это идентификация вируса. Симптомы COVID-19 неспецифичны, их можно спутать с заражениями другими вирусами, например, гриппом, риновирусом (вирусом обычной простуды), метапневмовирусом человека (HmPV), респираторно-синцитиальным вирусом (RSV) и другими [4].
Поэтому применяют тесты для однозначного определения именно нового коронавируса (о тестах мы писали в первой части ответов на вопросы [1]). Например, буквально несколько дней назад FDA одобрило тест-систему от Cepheid, результат с помощью которой можно получить всего за 45 минут, причем персоналу не надо проходить специального обучения для проведения тестирования. Также появилось заявление сингапурских ученых о создании теста, который выдает результат и вовсе за 5–10 минут [18].
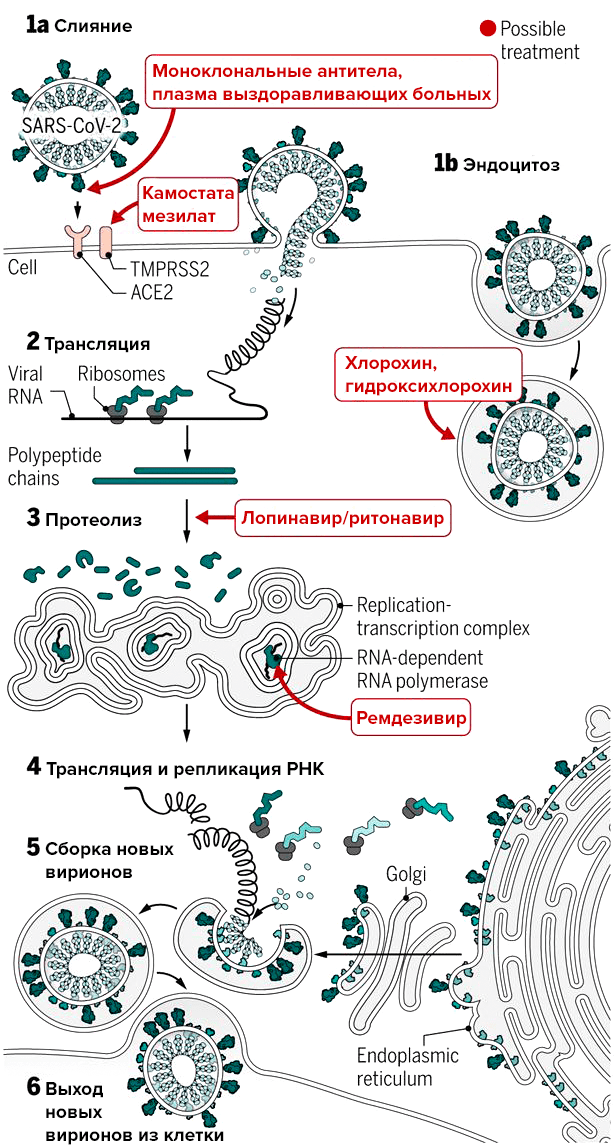
Специфического лекарства от SARS-CoV-2 еще нет, и врачи лечат болезнь симптоматически (информация суммирована на рис. 2). В тяжелых случаях может понадобиться оксигенотерапия и искусственная вентиляция легких. Как уже было отмечено выше, поражение легких часто является следствием излишней активации иммунной системы — так называемого цитокинового шторма. «При нем повышается уровень воспалительных цитокинов в крови, в частности, IL-6, — комментирует ситуацию редактор «Биомолекулы» Илья Ясный, руководитель научной экспертизы фармацевтического фонда «Инбио Венчурс». — Поэтому уже применяются антитела против этого цитокина, и компания Roche начала клиническое исследование фазы 3 у пациентов с COVID-19».
В качестве терапии из доступных средств исследуют альфа-интерферон и препарат лопинавир/ритонавир. Потенциально, по выводам, сделанным из доклинических исследований, возможно применение ремдезивира (GS-5734). Это противовирусный препарат, ингибитор РНК-полимеразы, который in vitro оказался эффективен против множества РНК-вирусов и был протестирован на модели MERS-CoV [4], [19], [20].
Рисунок 2. Воздействие экспериментальных препаратов, которые могут прерывать цикл репликации нового коронавируса на разных стадиях. На рисунке указан препарат камостата мезилат; остальные подробности — в тексте.
Исследования в Китае показывают, что эффективен и «приемлемо безопасен» (acceptable safety) оказался старый препарат для лечения малярии хлорохинфосфат [21]. Хотя это лекарство еще не одобрено для лечения COVID-19, в США компании Novartis, Mylan и Teva передают миллионы этих таблеток американским больницам и стараются наладить производство хлорохина и гидроксихлорохина на своих заводах.
Дополнительно об использовании старых лекарств в борьбе с новой эпидемией можно прочесть в статье How scientists are working 24/7 looking for old drugs that might treat COVID-19 [22].
«Разработка нового лекарства с нуля занимает лет восемь в среднем, в экстренной ситуации можно немного ускорить этот процесс, — говорит Илья Ясный. — Поэтому первое, за что все берутся, — это перепозиционирование существующих лекарств. (В новой статье Nature The pandemic pipeline [23] прекрасно описана ситуация с разработкой лекарств.) В этом направлении ведутся исследования японского фавипиравира, но результат пока неясен [в Китае его уже одобрили к использованию еще в середине февраля — прим. автора].
Только что было опубликовано французское исследование гидроксихлорохина в сочетании с азитромицином [24]. В группе, где пациенты получали комбинацию препаратов, на первый взгляд исходы были очень хорошие. Однако при внимательном рассмотрении публикации оказалось, что проведение исследования есть за что покритиковать: например, не были учтены пациенты, которые выбыли из исследования по разным причинам (среди них были и смертельные случаи). В общем, в достоверности данных можно усомниться, и рекомендовать эту комбинацию еще рано.
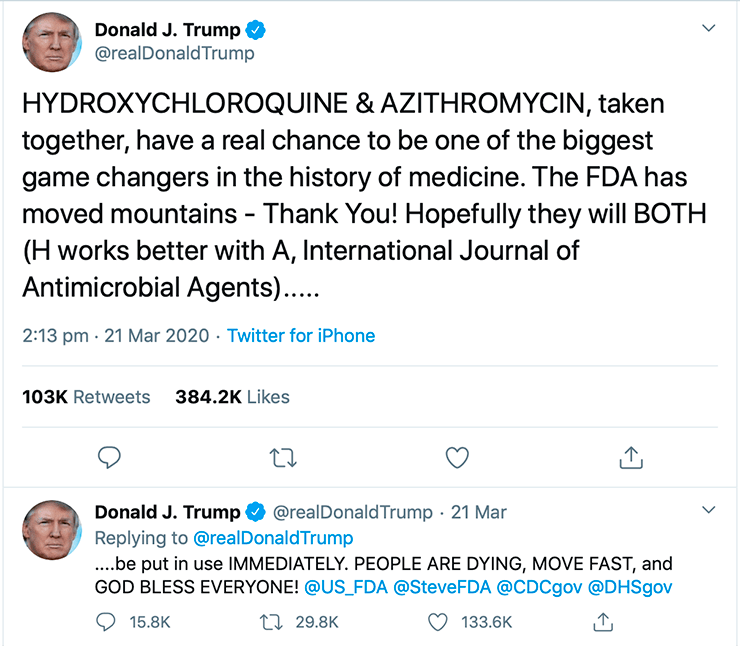
Большое возмущение вызвал и твит Дональда Трампа (рис. 3), где он призывает всех срочно принимать это сочетание препаратов. Такая комбинация в целом довольно токсична, поэтому всем точно не надо ее принимать в целях профилактики. В качестве терапии — может быть, если это будет доказано в дополнительном исследовании».
Рисунок 3. Твит Дональда Трампа, предлагающий использовать неодобренную и непроверенную комбинацию гидроксихлорохина и азитромицина, уже разошелся в интернете с шуточками, что фарма проплатила рекламу у известного блогера. Тем не менее некомпетентные рекомендации от такого публичного лица приводят к серьезным последствиям — подробности в тексте.
Также отравления хлорохинфосфатом отмечены в Нигерии [26].
7. Что является наиболее вероятными мишенями для будущих терапий?
Проблема с разработкой новых лекарств в первую очередь заключается в том, что новый вирус пока что плохо изучен, а значит, нам мало известно о мишенях на самом вирусе, на которые можно направить лекарства. Однако лекарства можно направлять и на мишени на клетках человека! Среди потенциальных кандидатов — ACE2, о котором шла речь выше (вирус связывается с этой молекулой на поверхности клетки), или фермент фурин, который необходим для размножения вируса [27].
О том, что такое лекарственная мишень и как ее найти, рассказывает статья «Поиск лекарственных мишеней» [28], опубликованная в рамках спецпроекта «Современные лекарства».
«Сейчас появилось более 20 различных разработок, — рассказывает Илья Ясный. — Среди них, например, моноклональные антитела, которые бы, например, препятствовали проникновению вируса в клетку; РНК-препараты, которые могли бы интерферировать с вирусной репликацией и вообще жизненным циклом вируса [то есть подавлять репродукцию вируса — прим. автора]. До появления таких препаратов на рынке тоже в самом лучшем случае пройдет года три. Как и в случае вакцин, помимо доклинических и клинических исследований, параллельно ведется фармацевтическая разработка процессов получения и контроля качества продукта. Она очень сложна, полна неожиданностей — в любой момент может что-то пойти не так. Сама по себе фармацевтическая разработка занимает месяцев 18, если все идет хорошо».
8. Как обстоят дела с вакциной?
«Теоретически, вакцины — это системное решение кризиса, — рассказывает Антон Гопка, генеральный партнер биотехфонда ATEM Capital, член Консультационного совета Национального института рака США, декан факультета itmotech Университета ИТМО. — Уже сейчас, согласно списку ВОЗ, ведется более 40 разработок. Две компании уже начали клинические исследования первой фазы: Moderna в США и CanSino Biologics в Китае».
«Разрабатываемые вакцины относятся к разным типам, — комментирует Илья Ясный. — На стадии доклинических испытаний находятся вакцины, которые используют ослабленные вирусы, субъединицы вируса. Например, в университете Пастера во Франции собираются использовать ослабленный вирус кори с антигеном коронавируса на поверхности. В России о начале работы над вакцинами заявили “Биокад” и “Вектор”. Китайские вакцины, которые сейчас входят в фазу клинических исследований, используют геномодифицированный аденовирус, выставляющий на своей поверхности белок коронавируса».
В компании Moderna же делают вакцину на основе мРНК. «Этот подход не валидирован — таких вакцин вообще нет. Поэтому трудно сказать, насколько он будет успешен», — говорит Илья Ясный. Кстати, именно такой подход, по заявлениям, был выбран и «Биокадом».
Эксперты единогласны, что в «нормальном темпе» подобная разработка занимает около десяти лет, и сокращение этой цифры даже до нескольких лет потребует больших усилий. «Во время пандемии такие разработки будут вестись в экстренном режиме, — комментирует Антон Гопка. — Но по словам главы Национального института аллергии и инфекционных заболеваний США Энтони Фаучи, первые результаты по эффективности вакцин мы сможем увидеть в самом оптимистичном сценарии в течение года-полутора. И я склонен согласиться с господином Фаучи, который вынужден регулярно в последние дни публично оппонировать Дональду Трампу, которому больше нравятся сроки в месяцы, чем в годы. Наглядный пример таких “ускоренных” разработок — история с вакциной против лихорадки Эбола. Разработок тоже было несколько десятков, а одобрена только одна вакцина от Merck в декабре прошлого года. Напомню, что она была впервые синтезирована учеными из канадского агентства здравоохранения еще в 2003 году. При этом предыдущие патогенные коронавирусы SARS и MERS так и остались без вакцин, потому что эти вспышки инфекций не оказались устойчивыми и достаточно быстро затухли».
«Ситуация с COVID-19 не настолько острая, чтобы пренебрегать необходимыми стадиями клинических испытаний, — добавляет Дмитрий Купраш, — поэтому вакцины, пригодные для широкого применения, появятся никак не раньше, чем через год, то есть даже не к следующей сезонной вспышке (если она будет), а в лучшем случае через одну. Даже если посмотреть на вебсайт Moderna, то видно, что ни один из продуктов их линейки пока не продвинулся дальше второй стадии клинических испытаний, так что практических результатов надо будет подождать, и в любом случае никакого влияния на нынешнюю эпидемию они точно не успеют оказать.
Про разработки вакцины российским государственным центром “Вектор” ничего определенного не могу сказать, — продолжает Дмитрий Купраш, — кроме того, что там работают разумные квалифицированные люди, которые ни законы природы, ни медицинские нормы нарушать не будут. Поэтому влияние их вакцинных разработок на текущую эпидемию также будет равно нулю».
Илья Ясный, напротив, считает, что в России или Китае можно представить ситуацию, когда будет заявлено о проведении клинического исследования за пару месяцев, после чего вакцину выпустят на рынок. «Но в таком случае у мирового сообщества не будет доверия к качеству продукта и проведенных исследований», — добавляет эксперт [29–31].
Возникает резонный вопрос: если разработка вакцины занимает так много времени, какая вероятность, что когда их все-таки выпустят на рынок, они не понадобятся (эпидемия закончится) или понадобятся в меньших количествах?
«Математические модели показывают [10], что вероятность того, что вирус будет полностью элиминирован, есть, но есть и вероятность того, что он станет сезонным, как грипп, — комментирует Илья Ясный. — Два ближайших родственника SARS-CoV-2 не вызывают долговременный иммунный ответ, он пропадает примерно через год. Таким образом, не исключено, что потребуется вакцинировать как можно больше людей. Кроме того, на самом деле, и вакцина может не получиться, поэтому так актуальна параллельная разработка множества подходов».
9. Какие стратегии применяют сейчас государства для защиты от эпидемии?
Но что же происходит сейчас? Большинство стран при резком возрастании количества случаев заболевания выбирали методы строгого карантина [32]. Про Китай речь уже шла [33]. В Италии, например, с 10 марта как минимум до 3 апреля ограничено передвижение людей без весомой причины [34]; закрылись школы, музеи, кинотеатры, театры и другие подобные заведения, как и большинство магазинов (кроме продуктовых и аптек); запрещены любые собрания в общественных местах. Похожие меры были предприняты во Франции.
В Великобритании, напротив, после первичной оценки ситуации власти решили, что распространение вируса уже не остановить, и поэтому надо направить всё внимание на защиту уязвимых групп населения. Так, несколько недель правительство давало только рекомендации по сокращению социальных контактов, избеганию общественного транспорта и работе из дома. Отказ от более строгих мер мотивировался стремлением попытаться развить коллективный иммунитет против вируса. Однако строгий карантин все же был введен 24 марта. Эту ситуацию комментируют наши эксперты.
«Про коллективный иммунитет уже много написано, в частности, очень хорошо это объяснил профессор Базыкин, — говорит Дмитрий Купраш. — Смысл в том, что пока вирус новый, один заболевший может заразить несколько окружающих, и инфекция распространяется в геометрической прогрессии. По мере того, как среди окружающих появляются переболевшие люди, у которых есть иммунитет, среднее число заражаемых (так называемый коэффициент R0) снижается, и когда он становится меньше 1, эпидемия идет на спад (люди выздоравливают быстрее, чем заболевают новые). В случае очень заразных заболеваний типа кори уровень коллективного иммунитета должен быть очень высоким, больше 90%, в частности поэтому так важно делать прививки (а не только чтобы не заболеть самому), и если уровень тяжелых последствий от заболевания достаточно высок, то прививки — более предпочтительный способ получения коллективного иммунитета, чем естественный. Британский эксперимент основан на том, что для SARS-CoV-2 группы риска ярко выражены, и в случае их эффективной изоляции риск естественного развития эпидемии для здоровой части популяции оказывается приемлемым, как и нагрузка на экономику. Теоретически, такая стратегия выглядит блистательно, а как она сработает на практике, покажет практика [вечером 23 марта премьер-министр Великобритании объявил о введении строгого карантина; на 25 марта в стране идентифицировано 8000 зараженных, среди которых и 71-летний принц Чарльз, наследник престола — прим. автора].
Согласно новому докладу команды Фергюсона [известного британского эпидемиолога, специализирующегося на построении математических моделей — прим. автора], британская система здравоохранения не выдержит контролируемой эпидемии, и надо применять жесткий карантин. И сам гуру уже приболел [тестирование подтвердило заражение — прим. автора]. Чего эта модель пока не учитывает — это возможного уменьшения летальности вируса по мере развития эпидемии, что кардинально облегчило бы ситуацию. Так ведут себя многие вирусы, но далеко не все, и для того, чтобы предсказать поведение SARS-CoV-2, пока недостаточно данных. Собственно, авторы много раз оговариваются, что надо постоянно мониторить ситуацию. Стоит отметить, что модель Фергюсона получила критику от коллег [35], в частности по поводу возможности в результате жестких мер отследить все контакты зараженных, всех посадить в карантин и таким образом полностью уничтожить вирус. Модель Фергюсона такую возможность в принципе не рассматривает и предполагает, что после ослабления карантина неизбежна новая вспышка, а оппоненты считают, что это не обязательно так. Все с замиранием сердца смотрят, что будет в Китае».
10. Какова ситуация в России?
Своим опытом делится врач Василий Штабницкий: «Любой врач сейчас готовится к инфекции, разрабатывает стратегию. Перерабатываются протоколы инфекционного контроля в частных и государственных клиниках, отрабатывают протоколы взаимодействия, когда поступает пациент с подозрением на коронавирусную инфекцию. Естественно, врачи каждый раз должны упоминать о необходимости соблюдения карантина, предосторожностей. Также, по моему мнению, упоминаться должна и необходимость ношения простых хлопчатобумажных масок, которые в целом могут снизить вероятность распространения вируса, особенно в скученных местах.
У меня опыт очень скромный. Один из моих друзей заболел инфекцией, очень похожей на коронавирусную, однако мы еще не получили официального результата тестирования (хотя прошло уже больше, чем 10 дней). К счастью, у него всё хорошо, пневмония разрешается. Также заболела его жена и сейчас сидит на карантине дома. Несколько человек с похожей на коронавирусную пневмонией уже госпитализированы в стационар. Очень много первичных контактов у тех пациентов, кто приезжает из других стран, и даже уже есть вторичные контакты, которые “чем-то” заболели. К сожалению, количество таких больных — подозрительно больных — сейчас будет становиться всё больше.
Есть и такие страны, как Италия, которые по количеству смертельных случаев находятся на уровне Китая, но есть и страны вроде Германии, где много выявленных случаев, но летальных из них очень мало. Это говорит о том, что эпидемия может проходить по-разному. Вряд ли дело в климате, скорее вопрос в готовности систем здравоохранения к проведению карантинных мероприятий или, например, малых больниц реагировать так же эффективно, как крупные. Если в нашей стране это удастся повторить, то это будет очень хорошо».
Что же можно сказать о сценариях развития ситуации в России?
«Сейчас мы имеем дело с инфекцией, от которой в разумный промежуток времени должна быть разработана вакцина, — рассказывает Андрей Летаров. — То есть стратегически можно ставить цель сдерживать эпидемию до тех пор, пока не появится возможность провести массовую вакцинацию населения. Я не знаю, в какой мере это реалистично в России, — для этого нужно обладать бóльшим объемом информации.
На момент написания статьи в России, по официальным данным, большинство случаев заражения — это люди, являющиеся непосредственными прямыми контактами тех, кто заразился первым и завез вирус в страну, — можно надеяться вручную контролировать все эпидемические цепочки. По этой причине и меры, которые сейчас принимают в Москве, не являются такими драматичными: метрополитен пока не закрывают, вузам дана рекомендация перейти на удаленное обучение, запрещают публичные мероприятия. Поэтому, если имеющаяся у населения информация соответствует действительности, эти решения оправданы.
Если же выход инфекции из-под “ручного контроля” всё же произойдет, и возникнут множественные очаги передачи инфекции, которые не удастся сразу отследить, тогда, по-видимому, потребуются более жесткие карантинные меры, которые позволят эти цепочки заражения прервать и свести к тому уровню, когда их можно контролировать.
Может возникнуть вопрос: почему наши власти не вводят жесткие карантинные меры сразу. На мой взгляд, ответ такой: если мы всех сейчас посадим по домам, то мы просто вернемся во времени немного назад. Случаи заражения исчезнут, но мы не можем остановить экономику и запретить все контакты навсегда. В какой-то момент эти жесткие меры придется снять, и тогда вся ситуация повторится вновь, поскольку восприимчивость населения к вирусу всё еще высока.
Кроме того, простой экономики чреват не только финансовыми потерями, но и человеческими, поскольку гибель от COVID-19, даже в Италии, не является ведущей причиной смертности в популяции. Если люди, например, с ССЗ, будут испытывать сложности с получением медицинской помощи, то можно получить еще больше смертей, чем от вируса. Так что карантин — безусловно, действенная мера, но он тоже имеет свою цену.
Есть и другой сценарий, который обсуждали в Великобритании. Если мы признаем, что не можем сдержать эпидемию совсем, то нам нужно размазать пик заболеваемости и принять полумеры, которые не остановят экономику совсем и несколько снизят эффективность передачи вируса. В таком случае вместо того, чтобы получить много больных сразу и перегрузить систему здравоохранения и, как следствие, увидеть возрастающую смертность (что и случилось в Италии), можно добиться более плавного нарастания количества случаев. В этой ситуации можно попробовать защитить группы риска.
В какой-то момент число переболевших в обществе достигнет критических величин, например, процентов 60 — включая тех, кто перенес инфекцию бессимптомно. Тогда количество иммуноустойчивых людей будет настолько велико, что параметр R0 упадет ниже единицы, и эпидемия затихнет.
Возможно, что в итоге будут реализованы какие-то промежуточные стратегии».
11. Как не допустить развития пандемий в будущем?
Согласно недавнему анализу, опубликованному в The Lancet, только у 104 (57%) из 182 стран мира есть функциональные возможности для выполнения мероприятий, связанных с эпидемией, на национальном и субнациональном уровнях [36]. 18% стран необходимы внешние ресурсы для контроля над ситуацией. Для эффективной борьбы эксперты настаивают на необходимости следующих шагов:
Наконец, очевидна необходимость разработки стратегий по предотвращению, обнаружению и борьбе со вспышками инфекционных заболеваний, поскольку идентификация вирусов у животных — один из важнейших этапов в предотвращении вирусных эпидемий.
«Как с любой заразой, самое действенное — это предотвращение контактов с источником заражения», — комментирует Дмитрий Купраш и добавляет, что Китай уже принимает меры на этот счет: временно запретили покупку, продажу и перевозку диких животных на рынках, в ресторанах и на онлайн-рынках по всей стране. Тем не менее остаются вопросы, например, насколько долгим будет этот запрет и на какие точно виды он распространяется.
12. Как SARS-CoV-2 влияет на фарминдустрию?
Радует, что противовирусные платформы вновь в фокусе интереса инвесторов. Уже многие годы этот сектор был недофинансирован в связи с тем, что эти препараты используются редко и коротко в жизни пациентов, регуляторный путь достаточно сложный, а цены низкие, несмотря на то, что препараты спасают жизни людей. Но есть риск, что при снижении давления эпидемии весь этот интерес и государственная поддержка улетучатся, как было в предыдущих случаях».
Эпидемия SARS-CoV-2 повлияла и на научное сообщество: обмен информацией происходит моментально, многие статьи «разлетаются» еще с платформ препринтов (хотя это может, конечно, отразиться и на качестве информации), лаборатории моментально заключают новые сотрудничества [37].
13. Есть ли хоть что-то позитивное в эпидемии SARS-CoV-2?
Как рассказывает Антон Гопка, COVID-19 стал тестом систем здравоохранения в мире: «Все явные перекосы и специфика государственного реагирования и финансирования проявились. Я очень рад, что в обществе и политике массово приходят к осознанию новых биоугроз. Что они готовились к достаточно маловероятным угрозам ядерной войны, и оказались фактически вообще не готовы к уже третьей вспышке распространения коронавирусной инфекции. При этом хорошо, что мы имеем дело с относительно “гуманным” вирусом, который позволит подготовиться к будущим возможным более тяжелым чрезвычайным ситуациям».
P.S.: 14. А вирус точно не из лаборатории? И вообще, это точно все не мировой заговор?
Честно говоря, у редакции были сомнения, комментировать ли такие слухи, но, видимо, все-таки это нужно сделать. Ученые убедительно показали, что новый вирус имеет естественное происхождение, и опубликовали свои результаты в рецензируемом уважаемом журнале [38]. Со статьей и ее аргументацией согласилось научное общество. Однако некоторых взбудоражила публикация 2015 года [39], где исследователи описали создание вполне конкретного гибридного коронавируса и показали, что он может инфицировать клетки человека. «А вдруг, — предположили любители конспирологических теорий, — это и есть тот же вирус, что и SARS-CoV-2, и произошла его утечка из лаборатории в Китае?»
«Любопытно, что Ши Чжэнли [знаменитый китайский вирусолог, открывшая десятки SARS-подобных вирусов и даже получившая прозвище Bat woman, поскольку она изучает летучих мышей — главного источника коронавирусов; ее лаборатория находится в Ухане — прим. автора] много дней не спала, перепроверяя лабораторные записи, чтобы убедиться, что ни один из штаммов, что был в работе у нее в лаборатории, не похож на SARS-CoV-2 [40], — добавляет Дмитрий Купраш. — То есть ключевой человек, лучше всех разбирающийся в теме, был до смерти напуган тем, что вспышка случилась около лаборатории, и всерьез рассматривал возможность утечки. А в США запретили подобные исследования (зря так сделали, но ведь сделали), и отношения между США и Китаем напряжены из-за споров о возможном источнике вируса. Так что биоинформатика — биоинформатикой, и сделанный анализ весьма убедителен, но все-таки это — не совсем конспирология на ровном месте. Как вести такие исследования — очень серьезная и непростая тема с рисками и ставками на уровне ядерной отрасли».
А так комментирует неутихающие слухи вокруг, казалось бы, уже решенного вопроса Александр Панчин, известный российский популяризатор науки и биоинформатик:
«Людям свойственно недооценивать вероятность случайных совпадений и находить закономерности там, где их нет. Есть замечательная статья психолога Питера Брюггера [41], который открыл эффект “избегания повторений”: людям, создающим случайные последовательности чисел, свойственно не ставить шестерку после шестерки, пятерку после пятерки и так далее. Причем верующим в странные вещи это свойственно еще больше обычного. Поэтому людям сложно смириться с фактом, что в месте, откуда вроде бы пошла инфекция, находится институт, сотрудники которого создавали гибридный коронавирус, способный инфицировать линию клеток человека.
Однако можно сравнить белки, кодируемые исходными вирусами, из которых делали гибрид 2015 года, с белками нового коронавируса. И такой анализ показывает, что сходства там очень мало. Зато очень много сходства между новым коронавирусом SARS-CoV-2 и вирусом, циркулирующим среди летучих мышей. И всё указывает на природное происхождение SARS-CoV-2. Специалистам это легко понять, но большинству людей понятно совпадение, а наука — нет». Александр опубликовал у себя в «Фейсбуке» небольшое биоинформатическое исследование, в котором показывает более вероятное происхождение SARS-CoV-2 от природных штаммов, нежели от «того самого» лабораторного штамма 2015 года.