что такое вбп в онкологии
Что такое вбп в онкологии
В настоящее время стандартом первой линии терапии рака яичников (РЯ) является проведение 6-8 курсов химиотерапии с использованием таксанов и препаратов платины. «Классический» и наиболее часто применяемый режим дозирования этих препаратов подразумевает использование схемы паклитаксел 175 мг/м 2 день 1 + карбоплатин AUC5/6 день 1, курсы терапии проводятся каждые 21 день. При этом существуют данные, указывающие на превосходящую эффективность так называемых «дозоинтенсивных» (dose-dense) режимов, которые предполагают сокращение интервалов времени между введениями препаратов и/или использование увеличенных доз цитостатических агентов.
Наиболее многообещающие результаты были получены в рандомизированном исследовании III фазы JGOG 3016 (n=631), проведенном в Японии. В этом исследовании было продемонстрировано выраженное улучшение результатов лечения при использовании режима терапии паклитаксел 80 мг/м 2 день 1, 8, 15 + карбоплатин AUC6 (курсы каждые 21 день) по сравнению с «классическим» трехнедельным режимом. Медиана выживаемости без прогрессирования (ВБП) составила 28,2 мес. и 17,5 мес. соответственно (отношение рисков [ОР] 0,76; p=0,0037), медиана продолжительности жизни (ПЖ) – 100,5 мес. и 62,2 мес. соответственно (ОР 0,79; p=0,039) [1].
В то же время европейское исследование III фазы GOG 262 (n=692), которое было посвящено «проверке» результатов JGOG 3016, не показало различий между группой дозоинтенсивной химиотерапии и стандартным режимом дозирования препаратов. Медиана ВБП составила 14,7 мес. в группе исследуемого режима по сравнению с 14,0 мес. в контрольной группе. При этом на результаты исследования мог оказать влияние тот факт, что 84% больных дополнительно получали терапию бевацизумабом. Среди пациенток, не получавших антиангиогенную терапию, было зарегистрировано значимое снижение риска прогрессирования заболевания на фоне использования дозоинтенсивного режима лечения. В данной категории пациенток медиана ВБП составила 14,2 мес. в группе исследуемого режима по сравнению с 10,3 мес. в группе стандартной терапии (ОР 0,62; p=0,03). В силу противоречивой доказательной базы роль дозоинтенсивных режимов терапии остается неизвестной.
На конференции Европейского общества медицинской онкологии (ESMO 2017) были представлены результаты рандомизированного исследования III фазы ICON8, посвященного изучению роли дозоинтенсивных режимов химиотерапии в первой линии лечения диссеминированного РЯ. В исследование включались пациентки со IIB-IV стадиями эпителиального РЯ вне зависимости от гистологического подтипа опухоли, участие пациенток с IC-IIA стадиями допускалось при высокой степени злокачественности опухолей. Включались как пациентки после первичной циторедукции, так и те, которым планировалась неоадъювантная химиотерапия. Авторы исследования выбрали для изучения три режима химиотерапии (таблица 1) [3].
Таблица 1. Режимы лечения в исследовании ICON8.
| «Классический» режим | DD паклитаксел | DD паклитаксел/карбоплатин | |
|---|---|---|---|
| Паклитаксел | 175 мг/м 2 1 раз в 3 нед. | 80 мг/м 2 еженедельно | 80 мг/м 2 еженедельно |
| Карбоплатин | AUC5 1 раз в 3 нед. | AUC5 1 раз в 3 нед. | AUC2 еженедельно |
| Длительность каждого курса терапии – 21 день; всего – до 6 курсов. | |||
Рандомизация осуществлялась в соотношении 1:1:1, стратификация – в соответствии со стадией заболевания, типом хирургического вмешательства (первичная vs интервальная циторедукция) и его результатами. Проводилось до 6 курсов химиотерапии, в случае назначения неоадъювантной химиотерапии хирургическое вмешательство настоятельно рекомендовалось выполнять после 3 курсов лечения. В качестве первичных конечных точек были выбраны ВБП и ПЖ пациенток.
Всего в исследовании приняли участие 1566 пациенток, 89% было включено на территории Великобритании. Сформированные группы были сбалансированы по основным демографическим характеристикам, показателям распространенности заболевания и типам хирургического вмешательства. Медиана возраста больных составила 61-63 года, у 70% пациенток были IIIC-IV стадии заболевания, неоадъювантная химиотерапия была назначена 52% пациенток.
По результатам исследования значимых различий между группами выявлено не было, результаты исследования ICON8 суммированы в таблице 2. Как видно из таблицы, несмотря на некоторое преимущество в числовом выражении ВБП в группах дозоинтенсивной терапии, различия не имели статистической значимости. Можно сделать вывод, что «классический» трехнедельный режим дозирования паклитаксела и карбоплатина не уступает по эффективности дозоинтенсивным режимам лечения.
Таблица 2. Результаты лечения пациенток.
| Ptx q1w + Cpt q3w | Ptx/Cpt q3w | Ptx/Cpt q1w | ||||
|---|---|---|---|---|---|---|
| Медиана ВБП | 20,6 мес. | 17,9 мес. | 21,1 мес. | |||
| HR 0,92; p = 0,45 | HR 0,94; p = 0,56 | |||||
| Медиана ВБП – перв. циторедукция | 43,2 мес. | 49,3 мес. | 43,7 мес. | |||
| Медиана ВБП – неоадъювантная ХТ | 14,6 мес. | 13,8 мес. | 15,4 мес. | |||
| Медиана ПЖ | 48,1 мес. | 46,5 мес. | 54,0 мес. | |||
Ptx – паклитаксел, Cpt – карбоплатин; q3w – каждые 3 недели, q1w – еженедельно; ВБП – выживаемость без прогрессирования, ПЖ – продолжительность жизни, * «незрелые» данные в связи с недостаточным количеством событий для анализа.
Некоторые аспекты этого исследования заслуживают отдельного обсуждения.
1. Высокое качество хирургического лечения у пациенток, прошедших циторедуктивное вмешательство на первом этапе.
К сожалению, авторы не представили точные данные о частоте достижения полной и оптимальной циторедукции в подгруппе пациенток, которым на первом этапе лечения было проведено хирургическое лечение. Тем не менее, высокие показатели медианы ВБП в данной подгруппе (43-49 мес.) свидетельствуют о хорошем качестве хирургического лечения. Для сравнения, в ранее опубликованном исследовании ICON7, которое провела та же кооперативная группа, медиана ВБП составила ≈18,0 мес. [4].
2. Около 50% пациенток получили неоадъювантную химиотерапию.
Одной из задач исследования ICON8 было уточнение целесообразности использования дозоинтенсивных режимов лечения в качестве неоадъювантной терапии при диссеминированном РЯ. С целью ответа на данный вопрос авторами исследования дополнительно были проанализированы исходы хирургических вмешательств в этой группе пациенток, результаты суммированы в таблице 3. Полученные данные убедительно доказывают, что интенсификация химиотерапии не позволяет увеличить ни количество операбельных пациенток, ни долю оптимальных и полных циторедукций.
Таблица 3. Результаты хирургического лечения после неоадъювантной терапии
| Ptx q1w + Cpt q3w | Ptx q3w + Cpt q3w | Ptx q1w + Cpt q1w | |
|---|---|---|---|
| Выполнена циторедукция | 89% | 86% | 86% |
| Полная циторедукция | 57% | 60% | 51% |
| Оптимальная циторедукция | 14% | 23% | 15% |
Ptx – паклитаксел, Cpt – карбоплатин; q3w – каждые 3 недели, q1w – еженедельно.
3. Пациентки, получавшие неоадъювантную химиотерапию, характеризовались значительно менее благоприятным прогнозом, несмотря на высокое качество хирургического лечения.
У ≈80% пациенток после неоадъювантной химиотерапии была выполнена полная/оптимальная циторедукция (у ≥50% – полная циторедукция), однако медиана ВБП в данной категории пациенток была многократно ниже, чем у пациенток, прошедших хирургическое лечение на первом этапе. Эти результаты подчеркивают прогностическую неравноценность полной/оптимальной циторедукции после первичной и интервальной циторедукции и важность хирургического вмешательства на первом этапе лечения.
4. Различия в профиле безопасности терапии.
Тяжелые (степени ≥3 по CTCAE) нежелательные явления (НЯ) были зарегистрированы у 42% пациенток в группе стандартного режима лечения, 63% – в группе еженедельной терапии паклитакселом и 53% – в группе еженедельной терапии паклитакселом и карбоплатином. Увеличение частоты тяжелых НЯ в основном было обусловлено неосложненной нейтропенией. Данные по частоте развития отдельных нежелательных явлений представлены в таблице 4. Примечательно, что на фоне применения еженедельной терапии паклитакселом и карбоплатином развитие тяжелой анемии отмечалось реже, чем в группе еженедельной терапии только паклитакселом, несмотря на большую суммарную дозу платинового агента.
Таблица 4. Профиль безопасности терапии.
| Ptx q1w + Cpt q3w | Ptx q3w + Cpt q3w | Ptx q1w + Cpt q1w | |
|---|---|---|---|
| Всего | 63% | 42% | 53% |
| Фебрильная нейтропения | 6% | 4% | 3% |
| Анемия | 13% | 5% | 5% |
| Нейропатия (grade ≥2) | 25% | 28% | 23% |
Ptx – паклитаксел, Cpt – карбоплатин; q3w – каждые 3 недели, q1w – еженедельно.
Результаты исследования ICON8 не подтвердили превосходящей эффективности дозоинтенсивных режимов лечения в первой линии терапии рака яичников при использовании в европейской популяции пациентов. Одним из наиболее важных факторов, определяющих прогноз течения болезни, по-прежнему остается качественное циторедуктивное вмешательство, выполненное на первом этапе лечения больных. Применение интенсифицированных режимов лечения в условиях отсутствия дополнительных критериев отбора пациенток представляется нецелесообразным.
Что такое вбп в онкологии
Совсем недавно описать первую линию химиотерапии (ХТ) при распространенном раке яичников (РЯ) можно было двумя предложениями. В первом постулате мы бы указали, что «золотым стандартом» первой линии неизменно являются 6 курсов ХТ паклитакселом и карбоплатином. Во втором, что в качестве поддерживающего лечения возможно добавление бевацизумаба у больных с неблагоприятным прогнозом течения заболевания (III-IV стадия с остаточными проявлениями после хирургического лечения). В настоящий момент ситуация кардинально изменилась, число возможных опций поддерживающего лечения увеличивается с каждым годом. Попытаемся разобраться в последних значимых исследованиях и новых показаниях.
Неоднократно жизнь показывает, что результат зависит от серьезности намерений и подходов. Так и при РЯ прогноз больной определяется не только характеристиками самой опухоли, но и качеством начального этапа лечения пациентки. Важным фактором является фактор хирурга, ответственно подходящего к своей задаче по выполнению максимальной циторедукции, четко оценивающего возможности первичного хирургического вмешательства на первом этапе и стремящегося к достижению этой цели. Химиотерапевты, которые занимаются лечением РЯ, отмечают, что в подавляющем большинстве пациентки распространенным РЯ достигают полного эффекта после первой линии ХТ и имеют максимально длительные сроки ремиссии именно после первой линии лечения. При этом отмечается хорошее качество жизни, позволяющее больным вернуться к обычному распорядку дня, почувствовать себя выздоровевшими и надеяться на излечение. Поэтому такое большое значение в лечении РЯ уделяется первой линии и поддерживающей терапии после нее. Задачей исследователей является максимально увеличить светлый промежуток до возникновения рецидива и перехода болезни в хроническое течение или, как конечная цель, излечить пациентку. Поэтому эксперты неоднократно просят уделять внимание именно этому этапу терапии РЯ, а именно адекватному и вовремя выполненному хирургическому вмешательству, соблюдению сроков начала ХТ первой линии, дозировок, графика введения цитостатических агентов и правильному назначению поддерживающего лечения.
В 2018 году изменился наш подход к лечению больных распространенным РЯ, когда появились первые данные исследования SOLO1 [1]. Результаты исследования SOLO1 позволили зарегистрировать олапариб в поддерживающем лечении после первой линии у больных III-IV стадий с патогенной мутацией BRCA1/2 в случае эффекта платиносодержащей терапии, в России это произошло в ноябре 2018 г. Исследование включало больных РЯ III-IV стадий с серозной High-Grade и эндометриоидной аденокарциномами (N=391) и наличием мутации в генах BRCA1/2. После проведения стандартной ХТ первой линии (паклитаксел и карбоплатин) и достижения полного или частичного эффекта пациентки рандомизировались на два рукава. В исследовательской группе больные получали олапариб в таблетированной форме 300 мг 2 раза в сутки в течение 2-х лет в качестве поддерживающего лечения, в контрольной группе – плацебо. Стоит напомнить, что когда результаты были доложены на ESMO 2018, то вся медицинская общественность, посвященная в проблему лечения РЯ, ликовала, поскольку появилась надежа на излечение такой категории больных или, как минимум, на достижение длительной ремиссии. Напомню, что за 3 года наблюдения медиана времени без прогрессирования (ВБП) не была достигнута в группе больных, получавших олапариб, в то время как в группе плацебо составила 13,8 мес. с момента рандомизации в исследование. Эти данные кардинально изменили нашу тактику: все пациентки РЯ III-IV стадий с серозным High-grade и эндометриоидным РЯ обязательно проходили тестирование на мутации в генах BRCA1/2 до начала или вовремя первой линии ХТ с целью идентификации больных с герминальными или соматическими мутациями в этих генах. Алгоритм определения мутации генов BRCA1/2 может включать в себя ПЦР диагностику для определения частых типичных герминальных мутаций, но при отрицательном результате обязательно требует полного геномного секвенирования (NGS) для исключения редких герминальных и соматических мутаций. Безусловно, онкологи столкнулись с трудностями тестирования, поскольку ПЦР-диагностика доступна в нашей стране, но проведение полного геномного секвенирования полностью ложится финансовым бременем на пациентку, а также является сложной методикой с биоинформатическим анализом, и не все лаборатории ею владеют полноценно. В настоящее время есть движение вперед, в ближайшем будущем часть регионов будет включать полногеномное секвенирование в программу ОМС.
Поданализ исследования SOLO1 продемонстрировал, что назначение олапариба становится предиктивным фактором, определяющим благоприятный прогноз течения заболевания у больных РЯ с мутацией генов BRCA1/2. У пациенток с интервальной циторедукцией, неоптимальным хирургическим вмешательством, получавших олапариб, в два-три раза увеличивается медиана ВБП по сравнению с группой плацебо. Важным является понимание специалистов, что назначение олапариба у таких больных не должно являться инструментом, прикрывающим погрешности наших хирургических возможностей. Поскольку выполнение полных оптимальных циторедукций на первом этапе с последующим назначением олапариба в поддержке позволяет превалирующему большинству больных иметь шанс на излечение.
Российские онкологи накопили за 2019-2020 годы собственный опыт лечения олапарибом больных РЯ с мутацией в генах BRCA1/2, в то же время с любопытством ожидая дальнейшего анализа исследования SOLO1. На ESMO 2020 были доложены результаты наблюдения за больными в течение 5 лет [2]. Важно отметить следующее. Во-первых, достигнута медиана ВБП в группе олапариба, она составила 56,0 мес., риск прогрессирования снижается на 67% (HR 0,33; 95% CI 0,25-0,43). Что это означает? Что в 50% случаев больные проживают более 4,5 лет без признаков прогрессирования! Это действительно революция в лечении распространенного РЯ, поскольку таких показателей не было получено до настоящего времени ни в одном исследовании. Ведь обычно медиана продолжительности жизни (ПЖ) таких больных составляет 49-56 мес., а здесь, еще раз подчеркиваю, это медиана ВБП! Во-вторых, частота возникновения прогрессирования не увеличивается после окончания приема олапариба через 2 года, и 48% больных переживает рубеж 5 лет без возврата болезни, тогда как в группе плацебо – только 21%, что соответствует данным литературы. В-третьих, для больных, достигших полного эффекта после ХТ первой линии, медиана ВБП не была достигнута после 5 лет наблюдения, 52% пациенток, получавших олапариб, не прогрессировали в течение этого времени, а в группе плацебо эта цифра составила 22% (HR 0,37; 95% CI 0,27-0,52). В-четвертых, такая же тенденция наблюдалась при оценке времени до последующего прогрессирования или смерти или времени до последующей терапии или наступления смерти. Таким образом, обновленные данные исследования SOLO1 безоговорочно подтверждают, что назначение олапариба в поддержке у больных распространенным РЯ с мутациями в генах BRCA1/2 позволяет надеяться на длительную ремиссию и даже на излечение.
Напомню, что в 2019 году эффективность поддерживающей терапии PARP ингибиторами была подтверждена публикацией данных нескольких исследований. В Европе и США зарегистрирован не только олапариб, но и нирапариб. В исследовании PRIMA пациентки с РЯ вне зависимости от мутации BRCA1/2 получали либо нирапариб, либо плацебо после окончания ХТ первой линии [3]. Результаты данного исследования позволили зарегистрировать поддерживающую терапию нирапарибом всем больным вне зависимости от статуса мутации BRCA1/2.
Встает логичный вопрос, где же теперь остается место бевацизумаба после 1-й линии химиотерапии? В 2019-2020 годах после регистрации олапариба в первой линии в России место бевацизумаба оставалось у больных распространенным РЯ III-IV стадий с наличием остаточной опухоли или неоперабельных вовсе, то есть больных с неблагоприятным прогнозом, при отсутствии у них мутации в генах BRCA1/2. В том случае, если бевацизумаб был начат совместно с первой линией терапии и у больной в процессе лечения выявлялась мутация BRCA1/2, рекомендовалось завершить терапию бевацизумабом и начать поддерживающую терапию олапарибом в течение двух лет, поскольку риск возникновения прогрессирования снижается в 3 раза при замене бевацизумаба на олапариб (таблица 1). И все было понятно, пока не были опубликованы результаты исследования PAOLA-1 [4].
Итак, перейдем подробно к этому неоднозначному исследованию. В работу было включено 806 пациенток с РЯ III-IV стадий, получивших хирургическое лечение и начавших ХТ 1-й линии. Пациентки начинали получать бевацизумаб во время ХТ. После окончания цитостатического лечения при достижении эффекта на терапию пациентки рандомизировались в два рукава. Контрольная группа получала стандартное лечение бевацизумабом в течение 15 мес. и плацебо. Экспериментальная группа – олапариб в таблетированной форме в течение 2 лет и бевацизумаб в течение 15 мес. Когда планировалось исследование, не было данных по подгрупповому анализу исследования ICON7, поэтому все пациентки в исследовании вне зависимости от группы прогноза получали стандартную химиотерапию и бевацизумаб в течение 15 мес. Первичной конечной точкой в исследовании была медиана ВБП. В обеих группах число больных с мутацией BRCA1/2 составило 30%. Хирургическая тактика больных, включенных в исследование, соответствует стандартам качественно работающего диспансера. В 50% случаев пациентки были прооперированы на первом этапе, при этом в большинстве случаев без остаточной опухоли (59% и 62%). В группе интервальных хирургических вмешательств цифра полных циторедукций достигала 71% и 68%. Получается, что согласно поданализу исследования ICON7, более половины больных не нуждались в добавлении бевацизумаба в поддерживающем режиме.
Перейдем к анализу результатов, доложенных на ESMO 2019. Медиана ВБП в группе комбинации олапариба и бевацизумаба составила 22,1 мес., в группе одного бевацизумаба – 16,6 мес. (HR=0,59; 95% CI 0,49-0,72; p
Что такое вбп в онкологии
В ежегодном Симпозиуме по урологическим опухолям ASCO (GU ASCO) в Сан-Франциско приняли участие 5000 онкологов из различных стран. С каждым годом симпозиум становится все более привлекательной площадкой для представления результатов главных исследований в области онкоурологии. Раку почки был посвящен целый день, и большинство докладов касалось иммуноонкологии.
Наиболее ярким событием всего симпозиума стало представление результатов клинического исследования 3 фазы IMmotion151, в котором изучалась комбинация ингибитора контрольных точек атезолизумаба и таргетного препарата бевацизумаба у больных метастатическим почечно-клеточным раком (ПКР), ранее не получавших лекарственное лечение [1].
915 пациентов были рандомизированы в соотношении 1:1 в группу атезолизумаба/бевацизумаба (n=454) и в группу сунитиниба (n=461). 362 (40%) пациента были положительными по PD-L1. Экспрессия PD-L1 оценивалась на иммунных клетках, инфильтрирующих опухоль, иммуногистохимически клоном Ventana SP142. Положительным статус считался при окрашивании более 1% клеток. 10% больных имели неблагоприятный прогноз по критериям MSKCC в обеих группах, 17-18% – метастазы в печень, 15-16% – саркоматоидный вариант ПКР. Первичными конечными точками в исследовании были выживаемость без прогрессирования (ВБП), оцененная исследователями в когорте пациентов с PD-L1 экспрессией, и общая выживаемость (ОВ) всех пациентов, принявших участие в исследовании.
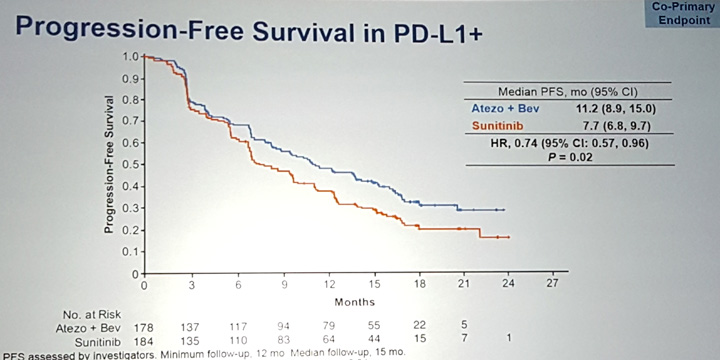
Медиана ВБП в когорте PD-L1 положительных пациентов составила 11,2 мес. и 7,7 мес. для комбинации и сунитиниба соответственно (рис. 1). Различия были статистически достоверными (HR=0,74; P=0,02). Следовательно, первый главный критерий эффективности был подтвержден. При анализе ВБП вне зависимости от статуса PD-L1 медиана составила 11,2 мес. и 8,4 мес. в этих группах (HR=0,83).
Рисунок 1. ВБП в когорте PD-L1 положительных пациентов (оценка проводилась исследователями).
Слайд R. Motzer с соавт., GU ASCO 2018.
Частота объективных ответов у PD-L1 положительных пациентов составила 43% (из них 9% полных ответов) в группе атезолизумаба/бевацизумаба и 35% (из них 4% полных ответов) в группе сунитиниба. Медиана продолжительности ответа не была достигнута при ответе на комбинацию и в группе сунитиниба оказалась 12,9 мес. У 65% и 53% ответивших больных в этих группах эффект продолжается на момент анализа.
При независимой оценке результаты ВБП и частоты объективных ответов у PD-L1 положительных пациентов были несколько другими. Так, медиана ВБП в группах комбинации и сунитиниба составила 8,9 мес. и 7,2 мес. (HR=0,93), а частота ответов – 36% и 33%. Однако в настоящем исследовании независимая оценка не являлась запланированной для подтверждения главных конечных точек, поэтому ее значение носит лишь описательный характер.
Медиана ОВ во всей когорте пациентов не была достигнута, анализ продолжается. Однако ОВ у больных, экспрессирующих PD-L1, оказалась прогнозируемо лучше для атезолизумаба с бевацизумабом – медиана не достигнута по сравнению с 23,3 мес. в группе сунитиниба (HR=0,68).
Важным вопросом представляется оценка частоты нежелательных явлений. Общая частота всех побочных эффектов была сопоставимой: 91% и 96% в экспериментальной и контрольной группах. Частота токсичности 3-4 степени составила 40% и 54% в этих группах. У 5% и 8% больных пришлось отменить терапию атезолизумабом/бевацизумабом и сунитинибом из-за развившихся нежелательных явлений. 16% пациентов были назначены кортикостероиды в связи с развитием нежелательных явлений комбинированной терапии.
Проф. R. Motzer, представлявший результаты исследования, сделал вывод об эффективности первой линии комбинированной терапии атезолизумабом и бевацизумабом у пациентов с метастатическим ПКР, имеющих экспрессию PD-L1. Переносимость комбинации была удовлетворительной и соответствовала таковой для каждого из препаратов. Надо подчеркнуть, что это первое исследование 3 фазы, в котором была продемонстрирована эффективность комбинации таргетного препарата и ингибитора контрольных точек. IMmotion151 повторяет результаты крупного исследования 2 фазы [2], в котором медиана ВБП у больных с экспрессией PD-L1, получавших комбинацию атезолизумаба и бевацизумаба, составила 14,7 мес., а частота объективных ответов в общей группе была 32%.
Результаты еще одного исследования, изучающего комбинированный подход, были представлены на GU ASCO 2018 в качестве устного доклада. Речь идет об исследовании 1b фазы [3, 4], в котором таргетный препарат акситиниб был использован в комбинации с ингибитором PD-1 пембролизумабом.
Критериями включения были светлоклеточный метастатический ПКР, отсутствие терапии в анамнезе, удаленная первичная опухоль, ECOG PS 0-1. Первичной конечной точкой, учитывая, что это исследование 1b фазы, была дозолимитирующая токсичность (ДЛТ) в течение первых двух циклов терапии. После установления максимально переносимой дозы (МПД) набор начинался в расширенную когорту, в которой происходила оценка безопасности и параметров эффективности.
В целом 52 пациента было включено в исследование, из них 41 – в расширенную когорту. Большинство больных имели благоприятный и промежуточный прогноз (90,4%) и ECOG PS=0 (75%). Из 11 больных ДЛТ была зафиксирована у 3 пациентов. Оцененная МПД составила 2 мг/кг каждые 3 недели для пембролизумаба и 5 мг 2 раза в день для акситиниба. Частота нежелательных явлений 3 степени и выше более чем у 2 пациентов составила 65,4%, при этом частота иммуноопосредованных нежелательных явлений 3 степени и выше – 21,1%.
Частота объективных ответов была высокой – 73,1% (38/52 пациентов); полный ответ был зафиксирован у 8% больных. Прогрессирование болезни отмечено только у 3 (5,8%) больных. Медиана продолжительности ответа составила 18,6 мес. Ответ развивался быстро – через 2,8 мес. Медиана ВБП составила 20,9 мес., медиана ОВ не была достигнута при наблюдении 20,9 мес.
Заключая, проф. M. Atkins подчеркнул, что переносимость комбинации была удовлетворительная, а предварительные результаты эффективности подтверждают необходимость проведения исследования 3 фазы, в котором комбинация пембролизумаба и акситиниба будет сравниваться с сунитинибом в первой линии терапии метастатического ПКР.
Оценка эффективности новых препаратов важна не только в регистрационных исследованиях, но и в исследованиях, приближенных к реальной жизни. L. Albiges представила результаты проспективного многоцентрового французского исследования NIVOREN GETUG-AFU 26 [5], в котором приняли участие 729 больных метастатическим ПКР, имевших ранее прогрессирование на ингибиторах тирозинкиназы. В исследовании изучалась безопасность (главная цель) и эффективность (дополнительная цель) ниволумаба.
Важным отличием этого крупного исследования от регистрационного было включение больных, соответствующих «реальной жизни». Например, 29,7% пациентов имели более 2 предшествующих линий терапии, 27,5% – mTOR ингибиторы в предшествующих линиях, 14,7% – ECOG PS=2, 14% – несимптомные метастазы в головной мозг, 34,3% – нарушение функции почек и, наконец, 26,1% относились к группе плохого прогноза согласно критериям IMDC.
При медиане наблюдения 13,3 мес. и анализе данных 528 пациентов частота всех нежелательных явлений ≥3 степени токсичности составила 55,9%, однако частота ассоциированных с лечением побочных эффектов – 14,6%, что ниже, чем в регистрационном исследовании CheckMate 025 (20%) [6]. Серьезные осложнения, приводящие к отмене терапии, были отмечены только у 12,1% больных.
Частота объективных ответов была 18,5%. Медиана ВБП составила 4,0 мес., 1-летняя ВБП – 23,7%. Медиана ОВ составила 18,6 мес., 1-летняя ОВ – 66,3%.
Авторы сделали вывод, что безопасность и эффективность ниволумаба в «реальной жизни» является сопоставимой с результатами регистрационного исследования. У пациентов с ECOG PS 2 медиана ВБП достоверно не отличалась (P=0,07), однако ОВ была ниже (P