что такое синтез белка в клетке
Что такое синтез белка в клетке
В самом общем понимании термин «синтез белка» означает несколько процессов, необходимых для преобразования гена в функциональный белок. Каждый процесс состоит из нескольких этапов, а регулирование может происходить на одном или нескольких этапах в рамках каждого процесса.
За последние 30 лет были достигнуты определенные успехи в понимании регуляции синтеза белка на молекулярном уровне, и теперь благодаря сведениям о полной последовательности генома у все большего числа различных организмов, в том числе грызунов и человека, новая информация, проясняющая и расширяющая наше понимание регуляции синтеза белка, накапливается быстрее, чем когда бы то ни было в прежние времена.
Обнаружение того, что геном человека содержит около 35 000 генов — примерно в 2 раза больше, чем было выявлено у беспозвоночных, — заставило научное сообщество пересмотреть влияние генома на разнообразие и сложность строения животного мира. В настоящее время принято считать, что движущей силой клеточного разнообразия является более глобальная регуляция синтеза белка.
Несомненно, у недоношенных и доношенных новорожденных движущей силой роста и развития является интенсификация синтеза белка. Основной прогресс в понимании того, каким образом нутритивные вещества (в частности, аминокислоты и глюкоза) регулируют синтез белка у недоношенных детей в возрасте до 1 мес, был достигнут с развитием модели новорожденных поросят.
Инфузия меченых аминокислот-маркеров в сочетании с разработанными в молекулярной биологии методами предоставила научному и медицинскому сообществу возможность более глубокого осмысления факторов, контролирующих накопление белков организмом. Кроме того, эти технологические достижения позволили исследовать влияние получаемого с питанием белка на отдельные ткани и органы в естественных условиях.
В эукариотических клетках способность экспрессировать биологически активные, или функциональные, белки попадает под основное регулирование по нескольким пунктам: транскрипция ДНК, обработка РНК, стабильность мРНК, трансляция мРНК и посттрансляционная модификация белка и его сворачивание.
Если бы содержание белков в клетке определялось на уровне транскрипции, взаимозависимость между уровнями белка и мРНК была бы линейной. На самом же деле связь между уровнями мРНК и содержанием белка в одной клетке является слабой, подчеркивая тот факт, что в регуляции содержания белка в клетке доминируют посттранскрипционные процессы. По этой причине двум последним пунктам регулирования (трансляция мРНК и посттрансляционные модификации белков и их сворачивание) в следующих статьях на нашем сайте уделено особое внимание.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Биосинтез белка кратко и понятно
Процесс синтеза в биологии, как и в любой другой отрасли — это образование сложных структур из менее сложных. При этом строение составных элементов может частично, или даже полностью сохраняться в неизменном виде, а может полностью изменяться. В первом случае синтез напоминает строительство конструкций из кубиков Лего, а во втором — образование сложных сплавов, солей и гидроксидов, свойства которых совершенно другие и ничем не напоминают исходные элементы.
Биосинтез — один из самых сложных видов таких преобразований исходных компонентов. Сюда входят процессы формирования ДНК из отдельных нуклеотидов, строительство белков из аминокислот, фотосинтез. Биосинтез может происходить (и происходит как естественным путем, в организме человека, животных и некоторых растений, так и искусственным — производство белковых питательных веществ.
Биосинтез белка
Это один из самых важных процессов в организме человека. Все характерные признаки и функции каждой клетки определяются белковой структурой. Сложность существования организма на клеточном уровне определяется тем, что длительность жизни белка непродолжительна. Без постоянного синтеза новых молекул клетки не смогут восстанавливаться и функционировать надлежащим образом. Синтезируются тысячи белковых структур, и это только в пределах одной клетки.
Рис.1. Структура ДНК
Исследования в области биосинтеза белков начались в 40-х годах прошлого столетия и дляться до сих пор. Самые важные открытия совершили Макс Бергманн, Джек Шульц, Торбьерн Касперссон, Раймонд Джиннер и другие ученые. В 50-х годах Ф.Крик установил правило синтеза, ставшее аксиомой — ДНК → РНК → белок. Свойства конкретного белка определяются последовательностью расположения аминокислот в молекулах. За правильное размещение структурных элементов отвечают гены — части ДНК, в которых зашифрована минимальная часть наследственной информации.
Этапы биосинтеза
Каждый белок синтезируется по одной схеме, состоящей из двух этапов, получивших название транскрипции и ретрансляции. В свободном переводе, это снятие информации с гена ДНК и передаче ее на строящиеся аминокислоты. Техника такой передачи достаточно сложная и энергоемкая, без притока внешней энергии она невозможна.
Рис 2. Схема биосинтеза
Транскрипция
На первом этапе транскрипции с цепочки ДНК снимается абсолютно точная копия, в результате которой получается идентичная с исходной цепочка РНК. Для такой информационной копии нужен катализатор, в роли которого выступают ферменты, и источник питания, в случае синтеза белка — это АТФ. Процесс синтеза происходит с высокой скоростью — в пределах одного организма за минуту осуществляется до 60 000 связей на уровне пептидов.
Рис 3. Сравнение ДНК и РНК.
Двойная цепочка ДНК расположена в ядре клетки в виде спирали. В начале транскрипции она разматывается и на одной из частей начинается синтез иРНК, так называемая информационная. Это одинарная цепь, точно повторяющая структуру ДНК. Поэтому реакции биосинтеза белка называют матричными. Вместо тимина, находящегося в нематричной цепочке ДНК, в иРНК используется урацил. В качестве катализатора «работает» РНК-полимераза.
Сложность возникает в том, что генов в молекуле ДНК очень много, а копировать нужно только один из них, причем, строго определенный. То есть, начинать снятие информации РНК должна не только в заданный момент, но и с заданного места. Для исключения ошибок в начале каждого фрагмента ДНК расположен специальный маркер, комбинация нуклеотидов под названием «промотор». Копирование с такого маркера начинается и на таком же, но с противоположной стороны, заканчивается. Конечный маркер получил название «терминатор».
Трансляция
Для построения нового белка в клетке должен быть набор необходимых аминокислот, которые вырабатываются в организме, или получаются при переваривании поступающей извне пищи. Это говорит о том, что для полноценной деятельности организма питание должно быть полным и сбалансированным, с достаточным количеством белка. Аминокислоты, в основном, поступают после расщепления пищевого белка.
Поступающие аминокислоты переносятся специальными транспортными РНК, которые реагируют на информацию в виде кодона, единицы генетического кода. На аминокислоте должен быть соответствующий тринуклелеотид — антикодон. На рибосоме закрепится только та аминокислота, код которой подходит. На каждый элемент цепочки уходит 0,2 с. Именно на такое время останавливается рибосома, движущаяся по цепочке иРНК.
Между аминокислотами, поступающими на рибосому на каждом последующем участке, формируются пептидные связи. Они возникают благодаря наличию в начале участка одной аминокислоты аминогруппы, а на соответствующем конце соседней — карбоксильной группы. Связь возникает прочная и неразрывная.
Белковая цепочка заканчивает формирование после контакта рибосомы к определенным маркером, обозначающим конец этого этапа синтеза. Цепочка аминокислот отрывается от иРНК и передвигается в цитоплазму, для формирования вторичных и третичных структур. Процесс синтеза происходит непрерывно, после перехода рибосомы на следующую позицию на ее место тут же заступает другая и копирует цепочку с иРНК. Выполнившая свою задачу рибосома переходит на другую РНК и формирует другой белок.
Биосинтез белка и генетический код: транскрипция и трансляция белка
Биосинтез белка и генетический код
Биосинтез белка — это ферментативный процесс синтеза белков в клетке, в котором принимают участие три структурных элемента клетки: ядро, цитоплазма и рибосомы.
Молекулы ДНК в ядре клетки сохраняют информацию обо всех белках, синтезирующихся в этой клетке. Эта информация находится в зашифрованном виде — шифруется 4-буквенным кодом.
Генетический код представляет собой последовательность расположения нуклеотидов в молекуле ДНК, определяющей последовательность аминокислот в молекуле белка.
Генетический код обладает следующими свойствами:
К примеру, такая кислота как цистеин кодируется при помощи триплета А-Ц-А. В отношении валина — это Ц-А-А.
Если взять аминокислоту тирозин, то она кодируется при помощи двух триплетов.
УАГ, УАА, УГА — три несодержательных кодона, не кодирующие аминокислоты. Предполагается, что они выступают в качестве стоп-сигналов, благодаря которым происходит разделение генов в молекуле ДНК.
Ген — участок молекулы ДНК, для которого свойственна определенная последовательность нуклеотидов. Ген определяет синтез одной полипептидной цепи.
Этапы биосинтеза белка: транскрипция и трансляция
Транскрипция белка
Этапы биосинтеза белка основаны на двух процессах: транскрипции и трансляции.
Самый популярный вопрос в рамках этой темы — где происходит синтез белка. И только потом разбираются с этапами синтеза белка (и схемой биосинтеза белка).
Любая белковая молекула имеет структуру, закодированную в ДНК. В ее синтезе эта ДНК не принимает непосредственного участия. Роль белковой молекулы — роль матрицы для синтеза РНК.
Далее охарактеризуем функции различных видов РНК в биосинтезе белка.
Где и как происходит биосинтез белка? Синтез белка происходит в, а точнее, синтез белка происходит на рибосомах — в основном они размещаются в цитоплазме. Поэтому, чтобы генетическая информация из ДНК передалась к месту, где белок синтезируется, необходим посредник.
Роль такого посредника играет иРНК.
Первый этап биосинтеза белка — транскрипция.
Транскрипция (переписывание) — процесс синтеза молекулы иРНК на одной цепи молекулы ДНК, в основе которого лежит принцип комплементарности.
Биосинтез белка происходит в рибосомах — с этим мы разобрались.
Где происходит транскрипция? Этот процесс осуществляется в ядре клетки.
Транскрипция происходит в одно и то же время не на всей молекуле ДНК — для этого достаточно одного небольшого участка, отвечающего за определенный ген. Часть двойной спирали ДНК раскручивается, и короткий участок одной из цепей оголяется. Роль матрицы в синтезе молекул иРНК выполняет этот же участок.
Далее в дело вступает фермент РНК-полимераза, который движется вдоль этой цепи. Он соединяет нуклеотиды в цепь иРНК, тем самым удлиняя ее.
Процесс транскрипции осуществляется одновременно на нескольких генах одной хромосомы и на генах разных хромосом.
иРНК, образованная в результате, имеет последовательность нуклеотидов — точную копию последовательности нуклеотидов на матрице.
Если молекула ДНК содержит азотистое основание цитозин, то иРНК — гуанин и наоборот. Комплементарная пара ДНК — аденин-тимин, РНК — аденин-урацил.
тРНК и рРНК (другие типы РНК) синтезируются на специальных генах.
Специальные триплеты строго фиксируют начало и конец синтеза всех типов РНК на матрице ДНК. Они же осуществляют контроль запуска и остановку синтеза (инициирующие и терминальные). Между генами они играют роль «разделительных знаков».
Аминокислоты соединяются с тРНК в цитоплазме. По своей форме молекула тРНК — лист клевера. Вверху этого листа находится антикодон: триплет нуклеотидов, отвечающий за кодировку аминокислоты (ее эта тРНК и переносит).
Количество тРНК определяется количеством аминокислот.
Так как много аминокислот кодируется при помощи нескольких триплетов, то количество тРНК превышает 20. Сегодня известно примерно 60 тРНК.
Ферменты — связующее звено между аминокислотами и тРНК. С помощью молекул тРНК осуществляется транспортировка аминокислот к рибосомам.
Кратко о трансляции в биологии
Что такое трансляция в биологии и как связан с трансляцией биосинтез белка?
В биологии трансляция — это процесс реализации информации о структуре белка, представленной в иРНК последовательностью нуклеотидов, как последовательности аминокислот в синтезируемой молекуле белка.
Как и где происходит биосинтез белка в рамках трансляции и какова схема синтеза белка?
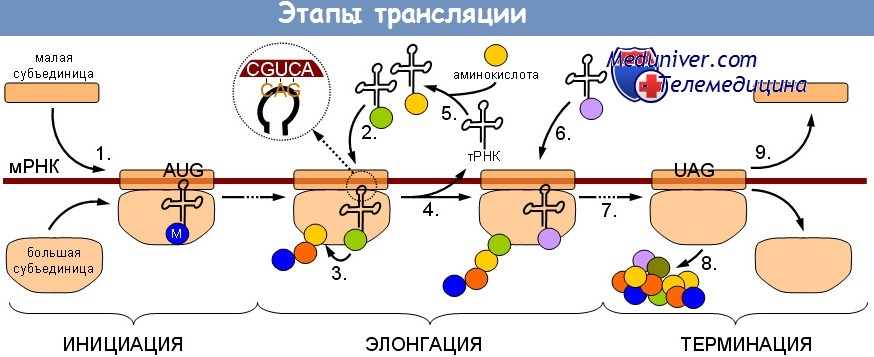
Первый этап трансляции белка — присоединение иРНК к рибосоме. Далее трансляция в биологии — это нанизывание первой рибосомы, синтезирующей белок, на иРНК. Далее трансляция синтеза белка основывается на нанизывании новой рибосомы — по мере того, как предыдущая рибосома продвигается на конец иРНК, который освобождается.
Одна иРНК может одновременно вмещать свыше 80 рибосом, синтезирующих один и тот же белок.
Полирибосома или полисома — группа рибосом, соединенных с одной иРНК,
Информация, записанная на иРНК (а не рибосома), определяет вид синтезируемого белка. Разные белки могут синтезироваться одной и той же рибосомой. Рибосома отделяется от иРНК после того, как синтез белка завершается. Заключительный этап трансляции — это синтез белка или его поступление в эндоплазматическую сеть.
Рибосома включает две субъединицы: малую и большую. Присоединение молекулы иРНК происходит к малой субъединице. Место, в котором рибосома и иРНК контактируют, содержит 6 нуклеотидов (2 триплета). Из цитоплазмы к одному из триплетов постоянно подходят тРНК с различными аминокислотами. Своим антикодоном они касаются кодона иРНК. В случае комплементарности кодона и антикодона, возникает пептидная связь: она образуется между аминокислотой уже синтезированной части белка и аминокислотой, доставляемой тРНК.
Фермент синтетазы участвует в соединении аминокислот в молекулу белка. После отдачи аминокислоты молекула тРНК переходит в цитоплазму, в результате чего рибосома перемещается на один триплет нуклеотидов. Таким образом, происходит последовательный синтез полипептидной цепи. Этот процесс длится до момента достижения рибосомой одного из трех терминирующих кодонов: УАА, УАГ или УГА. Как только это происходит, синтез белка останавливается.
Последовательность того, как аминокислоты включаются в цепь белка, определяется последовательностью кодонов иРНК. В каналы эндоплазматического ретикулюма поступают синтезированные белки. Синтез одной молекулы белка в клетке происходит в течение 1-2 минут.
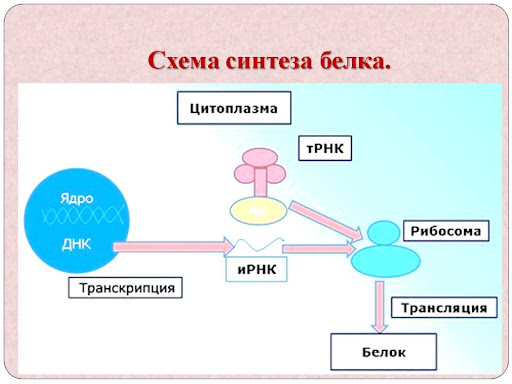
Схема синтеза белка выглядит следующим образом:
Из схемы биосинтеза белка выше вы можете понять, на чем осуществляется синтез белков, как происходит биосинтез белка, и что кроется за трансляцией и транскрипцией.
Также предлагаем изучить таблицу биосинтеза белка. Здесь описано, как осуществляется синтез белков в клетке, описываются кратко транскрипция и трансляция (этапы синтеза белка).
Таблица биосинтеза белка:
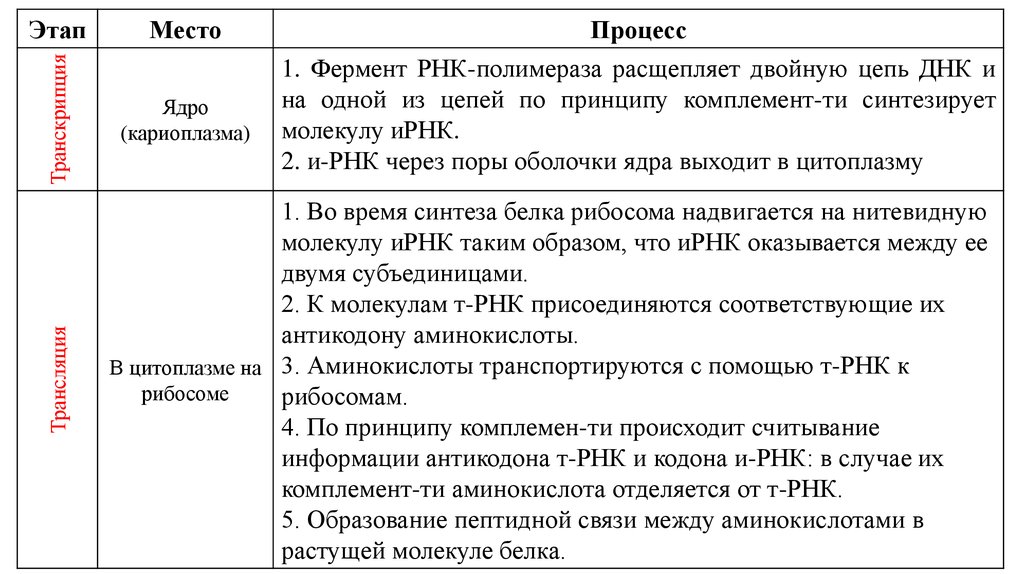
Из таблицы становится ясно, как проходит синтез белка, какие основные этапы синтеза белка, какова роль транскрипции в биосинтезе белка, где происходит синтез белков (место), а также кратко описаны стадии биосинтеза белка.
Таким образом мы охарактеризовали функции различных видов РНК в биосинтезе белков. На примере трансляции и транскрипции мы рассмотрели основные этапы биосинтеза белка.
Это информация о синтезе (биосинтезе) белка кратко.
Общая информация о биосинтезе белка: значение, код ДНК, процесс считывания и передачи информации
Общая информация о биосинтезе белка
Значение биосинтеза белка в клетке
Процесс биосинтез белка — наиболее значимая реакция пластического обмена. Способность синтезировать белок есть у всех клеток живых организмов: сложных и простых, грибов, растений и животных. Клетка содержит несколько тысяч различных белков. При этом, для каждого вида клеток характерны специфические белки.
Способность к синтезу собственных уникальных белков является наследственной и сохраняется на протяжении всей жизни организма. Биосинтез белков происходит наиболее интенсивно, когда клетки активно растут и развиваются.
Что такое биосинтез белка?
Процессом синтеза белка называется — процесс, состоящий из множества стадий, на которых происходит синтез белковой макромолекулы и последующее созревание (формирование) белка, и происходящий в живых организмах.
Фотосинтез связан с большими энергетическими затратами. Благодаря ему происходит обеспечение клеток так называемым строительным материалом, биологическими катализаторами (ферментами), регуляторами и средствами защиты организма.
Каково значение белков в клетке? Значение белков неоценимо. Для этого рассмотрим, что такое биосинтез подробнее.
Код ДНК
Определение места синтеза белковых макромолекул — наивысшее достижение молекулярной биологии. ДНК играет ключевую роль в определении структуры синтезируемого белка. Молекула ДНК содержит информацию о первичной структуре молекулы белка.
Геном — часть молекулы ДНК, содержащая информацию о первичной структуре одного белка.
Генетический код — единая для всех живых организмов система сохранения полной наследственной информации.
Если говорить о структуре, то она представляет собой определенную последовательность нуклеотидов в молекулах нуклеиновых кислот. Эта последовательность задает последовательность введения аминокислотных остатков в полипептидную цепь в ходе ее синтеза.
Согласно исследованиям ученых, каждая аминокислота в полипептидной цепи кодируется последовательностью, которая состоит из 3 нуклеотидов (это триплет нуклеотидов).
Всего выделяют 20 основных аминокислот. Каждая аминокислота имеет способность кодироваться несколькими разными триплетами.
Матрица — молекула ДНК, которая содержит информацию.
Процесс считывания и передачи информации
Расположение молекул ДНК — ядро клетки. Также они могут находиться в пластидах и митохондриях. В определенный момент происходит деспирализация молекулы ДНК и расхождение ее параллельных цепей.
В соответствии с принципом комплементарности, на этих цепях происходит синтез небольших молекул и-РНК (информационной РНК). Это транскрипция или считывание.
Молекула и-РНК, синтезированная таким образом, направляется к месту синтеза белка.
Трансляция — процесс переноса и-РНК из ядра к месту синтеза белка.
Механизм биосинтеза белка
Синтез белковых молекул осуществляется на мембранах ЭПС (эндоплазматическая сеть). Рибосома является органеллой, которая отвечает за синтез белка. Рибосомы, нанизываясь на молекулу и-РНК, формируют полисому. Молекула т-РНК (транспортная РНК), которая несет кислотный остаток, подходит к каждой рибосоме.
т-РНК отличается формой трилистика: верхушка — это триплет нуклеотидов или антикодон. Он формирует комплементарную пару с соответствующим триплетом и-РНК (кодоном).
Рибосома в процессе синтеза белка надвигается на нитевидную молекулу и-РНК, которая оказывается двумя ее субъединицами. Присоединение т-РНК к и-РНК происходит в определенном месте — в месте совпадения кодона и антикодона. Присоединение аминокислотных остатков к синтезируемой цепи происходит при помощи полипептидных связей. Происходит отсоединение т-РНК, после чего она покидает рибосому.
Это продолжается до завершения синтеза нити аминокислотных остатков (белковой молекулы).
Заключительный этап — приобретение синтезированным белком пространственной структуры. Благодаря соответствующим ферментам от него отщепляются лишние аминокислотные остатки, происходит введение небелковых фосфатных, карбоксильных и других групп, присоединение углеводов, липидов и т. д. Белок «созревает». Как только все эти процессы заканчиваются, молекула белка становится полностью функционально активной.
Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?
Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?
3D-структура эукариотической рибосомы
визуализация автора статьи с использованием скрипта проф. Ненада Бана на основе структуры рибосомы 4V88 [17]
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Биосинтез белка (трансляция) — ключевой процесс клеточного метаболизма, в ходе которого специальные молекулярные машины — рибосомы, — раскодируя последовательность нуклеотидов в матричной РНК, производят полипептидную цепь. Как и к любым другим биомолекулам, к компонентам трансляционного аппарата можно подобрать ингибиторы. Подавление трансляции в эукариотических клетках с помощью малых молекул в последние годы всё чаще применяется при терапии различных заболеваний (в том числе генетических). Казалось бы, для чего ингибировать процесс, который обеспечивает клетку строительным материалом, ферментами, регуляторами и прочими необходимыми для жизни компонентами? Дело в том, что часто при раковой трансформации или вирусной инфекции рибосомы начинают «подыгрывать» врагу, смещая трансляцию в сторону «нежелательных» мРНК. Например, вирусы, чтобы качнуть чашу весов в свою сторону, могут использовать множество интересных механизмов для модификации клеточной трансляции. Таким образом, лекарства, которые подавляют биосинтез белка, могут намного сильнее затормозить рост клеток, вышедших из-под контроля, нежели «законопослушных». Это их свойство и используется при терапии.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания Cytiva.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Я работаю в лаборатории системной биологии старения в отделе взаимодействия вирусов с клеткой НИИ физико-химической биологии имени А.Н. Белозерского МГУ. На втором курсе моя курсовая работа была связана с поиском ингибиторов трансляции у эукариот и созданием базы таких ингибиторов. Данная статья подготовлена по материалам обзора, опубликованного в спецвыпуске журнала «Биохимия» [1].
Молекулярный аппарат трансляции и его консервативность
Трансляционный цикл на множестве этапов может быть нарушен или замедлен многочисленными и разнородными по химическому строению ингибиторами. Ключевые компоненты трансляционного аппарата клетки — это рибосомы и факторы трансляции (белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла), а также большое количество вспомогательных белков, необходимых для обеспечения синтеза нужными материалами: например, аминоацил-тРНК-синтетазы (АРСазы) — ферменты, соединяющие тРНК с соответствующей ей аминокислотой; или регуляторы биосинтеза белка — компоненты сигнальных путей, связанных с трансляцией. При подборе ингибиторов нельзя не учитывать, что многие из этих молекул есть у всех живых организмов, и некоторые из них довольно консервативны. А значит, одни и те же вещества могут действовать как на про-, так и на эукариот, что не всегда приемлемо.
Каждый живой организм на Земле может быть отнесен к одному из трех доменов жизни: это максимально удаленные друг от друга в эволюционном смысле группы — эукариоты (здесь ищите самые известные царства: животных, растений и грибов), бактерии и археи [2]. Эта удаленность означает, что они давно разошлись (то есть их последний общий предок жил давно [3]), и у представителей групп накопилось множество отличий. Но есть и признаки, по которым представители различных доменов похожи друг на друга. Речь идет об основополагающих признаках: например, способности удваивать ДНК, синтезировать на ее основе РНК и в конце концов получать закодированный в ней белок. Трансляция относится к самым консервативным биологическим процессам.
При ближайшем рассмотрении оказывается, что устройство белоксинтезирующего аппарата довольно схоже у представителей разных доменов. К примеру, основные факторы инициации и элонгации у бактерий имеют гомологов у архей, а рибосомы архей по многим аспектам строения очень напоминают рибосомы эукариот (что даже позволило создать из рибосом дрожжей гибридные рибосомы, в которых одна из субъединица очень напоминала рибосомную субъединицу архей [4]). В пределах этих трех доменов есть отличия, но мы видим, что трансляционная машинерия в целом очень консервативна, и таких отличий не так много. Это является несомненным свидетельством общности (монофилетичности) происхождения жизни.
Хотя это зависит от того, какие критерии для отнесения к живому используются. В зависимости от них под определение «живое» может попасть даже клетка из компьютерной игры Конвея «Жизнь», но под критерии классического определения жизни подпадают всё же только представители этих трех доменов.
Ингибиторы трансляции как антибиотики
Подробнее про различные классы антибиотиков и про то, как они действуют, можно прочитать в статье «Биомолекулы» «Антибиотики vs Бактерии. “Война Бесконечности” или всему есть предел?» [6].
Однако в этой статье речь пойдет об ингибиторах эукариотической трансляции — ведь многие из них служат мощными противоопухолевыми и антивирусными препаратами, используются для иммуносупрессии при пересадке органов или для обезболивания. Некоторые из этих веществ рассматривают даже как возможное «лекарство от старости». Но перед тем как переходить к их рассмотрению, нам придется вспомнить основные этапы трансляционного цикла.
Трансляционный цикл
Чтобы оценить все разнообразие ингибиторов биосинтеза белка, давайте для начала ознакомимся с теми этапами трансляционного цикла, на которые может быть направлено их действие. Эти этапы изображены на рисунке 1 (кликнув на элемент, вы можете прочитать про него подробнее в «Википедии»). Кстати, некоторые этапы этого сложного процесса до сих пор плохо изучены.
Рисунок 1. Трансляционный цикл эукариот (с подсказками!) и избранные сигнальные каскады, влияющие на него. Также показаны самые известные и изученные ингибиторы цикла (черная рамка означает принципиально другой механизм действия). Вещества сгруппированы в соответствии со стадиями синтеза белка, в которых участвуют их мишени. Стадии обозначены кодами. Инициация трансляции: i.1 — связывание eIF2 с Met-тРНК и образование тройного комплекса eIF2/Met-тРНКi/GTP (TC); i.2 — взаимодействие eIF4A и eIF4G; i.3 — взаимодействие eIF4E и eIF4G; i.4 — связывание eIF4E с m 7 G-кэпом на 5′-конце мРНК; i.5 — ингибирование хеликазной (расплетающей мРНК) активности eIF4A при посадке eIF4F на мРНК и последующем рибосомном сканировании; i.6 — узнавание AUG-кодона при сканировании; i.7 — взаимодействие eIF5B с 60S-субъединицей; i.8 — взаимодействие eIF6 с 60S-субъединицей; i.9 — присоединение 60S-субъединицы к 48S преинициаторному комплексу (48S PIC) с образованием 80S инициаторного комплекса (80S IC). Элонгация и сопутствующие реакции: e.1 — аминоацилирование тРНК; e.2 — диссоциация eEF1A/GDP после доставки аминоацил-тРНК (Аа-тРНК); e.3 — продвижение полипептида в рибосомном тоннеле; e.4 — декодирование; e.5 — пептидилтрансферазная реакция; e.6 — транслокация; e.7 — диссоциация eEF2/GDP после транслокации. Терминация: t.1 — узнавание стоп-кодона; t.2 — гидролиз пептидил-тРНК. Рециклинг: r.1 — диссоциация 60S-субъединицы. Коды модуляторов сигнальных каскадов: s.1–s.3 — активаторы киназ фактора eIF2; s.4 — ингибиторы фосфатаз фактора eIF2; s.5 — ингибиторы киназы PI3K; s.6 — ингибиторы активного центра киназы mTOR; s.7 — аллостерические ингибиторы mTOR в составе комплекса mTORC1. Рисунок позаимствован из нашей статьи в журнале «Биохимия» [1]. Более полная его версия с поясняющими таблицами доступна на сайте базы ингибиторов EuPSIC
Схема может показаться сложной, но в действительности это не так. Попробуйте выхватить взглядом желтую 40S-субъединицу (в свободном от других компонентов трансляции виде ее можно найти рядом со стадией i.1) и пройтись по циклу, как в настольной игре, посмотрев на все, что успевает с ней за это время произойти. Особенно любознательным предлагаем покликать по элементам схемы и прочитать о каждом из этапов дополнительно.
Этапы трансляции
Трансляционный цикл принято подразделять на несколько этапов:
Отдельно происходит активация аминокислот с помощью аминоацил-тРНК-синтетаз (см. e.1 на рисунке 1).
Некоторые трансляционные факторы известны уже очень давно, для них понятна функция, известны ортологи у архей и бактерий (подробнее про гомологичные взаимоотношения генов можно прочитать здесь [7]) и выяснено, являются ли они строго необходимыми для синтеза белка — ведь некоторые вирусные мРНК, например, могут обходиться без целого ряда факторов инициации трансляции [8], [9]. Роль других участников была открыта относительно недавно. Примером таких белков служат факторы DENR и MCTS1 (см. область рециклинга (r) на рисунке 1), изучением которых, кстати, занимается наша лаборатория.
На рисунке 1 (см. s.1, s.2) также изображена часть путей внутриклеточного сигналинга, которые непосредственно регулируют трансляцию. Кроме того, существует еще и сложнейший процесс сборки рибосомы из рибосомной РНК и белков, который протекает по большей части в ядре. Его также можно подавить низкомолекулярными веществами, но о них известно гораздо меньше, а их специфичность часто оставляет желать лучшего.
Типы ингибиторов
С ингибиторами трансляции удобно знакомиться, если классифицировать их согласно мишеням, на которые они воздействуют.
Ингибиторы эукариотической рибосомы
Многие из ингибиторов действуют на рибосомы. При этом они могут быть универсальными (подавлять трансляцию у всех доменов живого), а могут — специфичными (например, к рибосоме эукариот или даже каких-то узких таксономических групп). Специфичность действия, как правило, определяется тонкими различиями в строении места связывания: структурные исследования показывают, что часто достаточно замены одного нуклеотида в рРНК или разницы в единственной аминокислотной позиции рибосомного белка, чтобы конфигурация участка не позволяла ингибитору связаться. Подавляющее большинство ингибиторов рибосомы действует на стадии элонгации, однако существуют и другие типы, перечисленные в таблице 1 (заметьте, что пункты могут перекрываться).
| Типы ингибиторов | Классы химических веществ и известные представители | Краткие комментарии |
|---|---|---|
| Рибосом-направленные ингибиторы инициации трансляции | Эдеин, MDMP, eIFsixty-4 | Небольшая группа ингибиторов, механизмы действия которых сильно различаются. Основной механизм — нарушение взаимодействия с лигандами: блокирование связывания факторов инициации или нарушение аккомодации инициаторной тРНК (рис. 1: i.6–i.9). |
| Рибосом-направленные ингибиторы элонгации (кроме веществ, вызывающих ошибки декодирования) | Анизомицин, гомохаррингтонин, трихотецины, квассиноиды, амикумацин A, циклогексимид, эметин, лиссоклимид, гигромицин B, тетраценомицин X и другие | Большая и разнообразная по химическому строению и механизмам действия группа. Могут действовать на транспептидацию, транслокацию, вызывать преждевременную терминацию или блокировать пептидный тоннель. Как правило, связываются с функциональными сайтами рибосомы. Эти сайты вместе с избранными ингибиторами, присоединенными к рибосоме, можно изучить на рис. 5. Интересно, что некоторые ингибиторы элонгации, действующие на ее самые начальные стадии, часто путают с ингибиторами инициации. Самым известным таким ингибитором является гомохаррингтонин (рис. 2). Все ингибиторы, представленные на рисунке 5, кроме TC007 и паромомицина, относятся именно к данному типу (рис. 1: e.3, e.5, e.6). |
| Вещества, вызывающие ошибки декодирования | Аминогликозиды (преимущественно с 2-DOS кольцом) и ряд других ингибиторов [6] | Основное место связывания таких веществ на эукариотической рибосоме — декодирующий центр малой субъединицы (спираль h44, см. рис. 5). Это связывание вызывает стабилизацию той конформации, которую рибосома должна принимать при наличии «правильной» аминоацил-тРНК в А-сайте. В результате реакция по переносу остатка аминокислоты может произойти, даже если там находится не соответствующая кодону тРНК, что вызывает ошибки декодирования, а также «проскок» стоп-кодона (подробнее это описано ниже на примере аталурена) — рис. 1: e.4. |
| Рибосомные ингибиторы, влияющие на терминацию | Аминогликозиды, гиролин | Совсем небольшая группа ингибиторов. У эукариот вещества, специфично блокирующие собственно терминацию (высвобождение полипептида), изучены плохо. Поэтому список ингибиторов t.1 в основном представлен веществами из предыдущего списка (e.4), т.к. их влияние на точность декодирования сказывается в том числе и на узнавании стоп-кодона, что вызывает его «проскок». Подтвержденным ингибитором высвобождения пептида у эукариот является, пожалуй, пока только гиролин (рис. 1: t.1, t.2). |
| Ингибиторы рибосомного рециклинга | Некоторые аминогликозиды, бацифелацин и неоквассин | Пока что веществ, которые бы специфично действовали на эту стадию, не обнаружено, но, возможно, это просто вопрос времени. Механизмы рециклинга и вовлеченные в него факторы сильно различаются у эукариот и бактерий, а у архей эта стадия изучена особенно плохо (рис. 1: r.1). |
Если классифицировать по сайтам связывания, то выделяют: ингибиторы пептидилтрансферазного центра; ингибиторы транслокации, узнающие E-сайт; ингибиторы, связывающиеся в пептидном тоннеле; ингибиторы, взаимодействующие с декодирующим центром; ингибитор, связывающийся с ГТФаза-активирующим центром (пока достоверно описан только один такой пример).
Пока не так много веществ этого типа допущены до практического применения (самое известное из них — гомохаррингтонин (рис. 2)), но их число постепенно растет. Клинические и доклинические испытания проходили, например, такие ингибиторы пептидилтрансферазного центра, как ликорин, нарциклазин и бруцеантин, а ингибитор транслокации эметин используется как антигельминтное и противомалярийное средство.
Интересные случаи применения
Гомохаррингтонин. Рибосом-направленные ингибиторы элонгации
Гомохаррингтонин — ингибитор пептидилтрансферазного центра в виде полусинтетического аналога омацетаксина мепесукцината (продаваемого под торговой маркой Synribo; рис. 2) активно применяется для лечения хронического миелоидного лейкоза, а также проходит испытания в терапии ряда других онкологических заболеваний. Кроме того, его широко используют в научной работе: его способность прекращать трансляцию новоинициировавших рибосом (при этом не трогая рибосомы, которые уже успели синтезировать несколько пептидных связей) применяется для картирования старт-кодонов в мРНК.
Рисунок 2. «Синрибо». Применяется для лечения хронического миелоидного лейкоза у людей, лечение которых ингибиторами тирозинкиназ не дало желаемого эффекта. Одобрен одновременно как американским (FDA), так и европейским (EMA) медико-биологическим агентствами.
Аталурен и гентамицин. Вещества, вызывающие ошибки декодирования
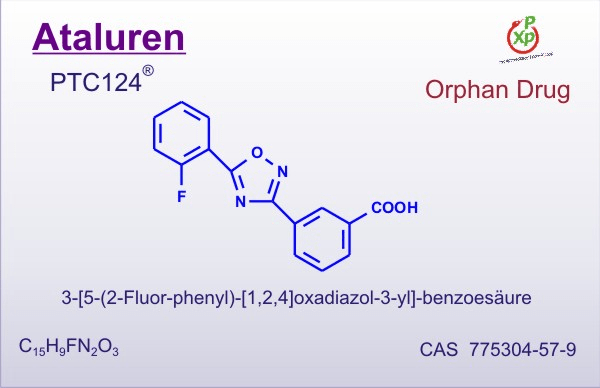
Рисунок 3. Аталурен. Индуцирует «проскакивание» стоп-кодонов. Лекарство применяется для лечения людей с генетическими заболеваниями, вызванными появлением преждевременного стоп-кодона в важных генах (нонсенс-мутациями). В том числе зарегистрирован и в России. К сожалению, из-за очень высокой цены — от пяти до семи тысяч евро за упаковку, которой хватит на месяц, — не все могут получить доступ к этому лечению.
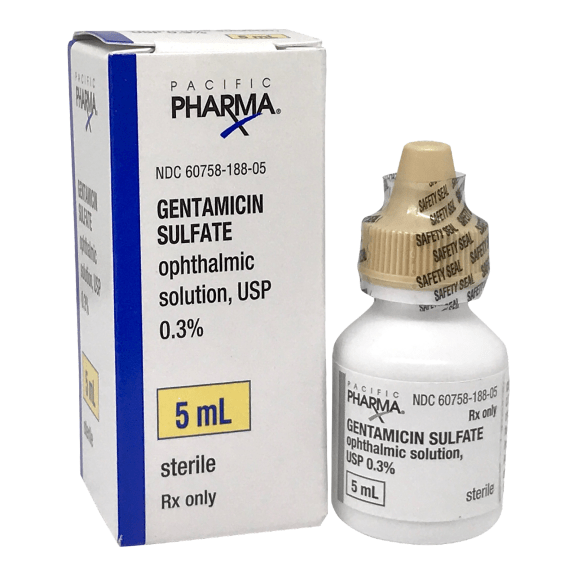
Рисунок 4. Гентамицин. Пока что препарат прошел клинические испытания только как антибиотик, однако у его производных есть потенциал и в терапии генетических заболеваний. Препарат, продаваемый в аптеках, представляет собой смесь более четырех похожих веществ. Его стоимость куда ниже, чем у аталурена: купить тюбик мази для наружного применения можно за 40 рублей. Однако в нынешнем виде гентамицин нельзя принимать в дозах, достаточных для устранения эффектов нонсенс-мутаций: из-за воздействия на рибосомы митохондрий он имеет побочные эффекты в виде нефро- и ототоксичности.
Более 10% генетических заболеваний вызвано однонуклеотидными мутациями, которые привели к появлению преждевременного стоп-кодона в кодирующей части какого-либо важного гена (такие мутации называют нонсенс-мутациями). К примеру, нонсенс-мутации в гене белка дистрофина могут вызывать миодистрофию Дюшенна. Интересно, что механизм терминации на таком случайно возникшем, не прошедшем эволюционный отбор стоп-кодоне несколько отличается от нормального. Это связано с тем, что получившийся «преждевременный» сигнал терминации чаще всего находится далеко от 3′-конца мРНК и расположен не в последнем экзоне (как «настоящие» стоп-кодоны), а также лишен нужного нуклеотидного контекста. В клетке действует специальная защитная система, которая обнаруживает «неправильную» терминацию на таком стоп-кодоне и отправляет транскрипты с нонсенс-заменой на деградацию. Однако примерно в одном из 100–10000 случаев (в зависимости от условий) рибосома проскакивает стоп-кодон, вместо терминации вставляя в пептид какую-либо аминокислоту и продолжая синтез [10], [11]. Долю таких сквозных прочтений можно увеличить с помощью специальных ингибиторов, самыми известными из которых являются аталурен и аминогликозиды, к коим относится гентамицин (рис. 4). Несмотря на то, что сквозные прочтения могут вызывать несколько классов веществ, обычно эта активность ассоциируется с самым большим классом — аминогликозидами. Эти вещества сильнее действуют на преждевременные стоп-кодоны, чем на «правильные», благодаря чему они могут иметь потенциал в терапии заболеваний, вызываемых нонсенс-мутациями. Однако аминогликозиды известны своей токсичностью — ведь они, помимо индукции сквозного прочтения, еще и снижают точность работы рибосомы. Из веществ неаминогликозидной природы, действующих аналогичным образом, лучше всего изучен аталурен (рис. 3), однако он также не очень хорошо показал себя в клинических испытаниях; более того, в некоторых работах приведены аргументы в пользу того, что это вещество может и вовсе не работать так, как заявлено, а его эффекты в экспериментах были связаны с влиянием на стабильность белка-репортера. Поэтому поиски индукторов ошибок декодирования, приемлемых для терапии наследственных заболеваний, продолжаются.
Чтобы понять, как именно ингибиторы могут подавлять активность рибосомы, полезно вспомнить ее общее строение. Это удобно сделать с помощью интерактивного аплета (см. рис. 5).
Рисунок 5. Пристальный взгляд на эукариотическую рибосому. В верхней кнопочной панели можно изучить структурные элементы рибосомы. Для того чтобы узнать о структурном элементе или сайте связывания, наведите курсор на кнопку. В нижней панели можно найти распространенные ингибиторы, которые действуют на разные части эукариотической рибосомы, визуализированные в предыдущем разделе. В виде на лиганд взаимодействующие основания выделены оранжевым. Встроенный в статью этот апплет очень маленький, поэтому рекомендуем открыть полноэкранную версию.
Для показа структурных элементов использована структура дрожжевой рибосомы, полученная методом криоэлектронной микроскопии группой Р. Бекманна (6SNT). Для визуализации используется веб-плагин MolStar.
Ингибиторы трансляционных факторов
Трансляционные факторы — белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла. Чаще всего эти факторы жизненно необходимы для нормального синтеза белка в клетках или митохондриях/пластидах, которые, как правило, тоже имеют свой трансляционный аппарат.
Эта группа веществ взаимодействует с факторами в растворе, блокируя их активность или препятствуя присоединению к рибосоме (во втором случае они могут контактировать не только с фактором, но и с рибосомой, что приводит к неоднозначности в классификации: иногда их относят к ингибиторам рибосомы).
Ингибиторы факторов инициации трансляции
Инициация трансляции в эукариотических клетках устроена сложнее, чем у бактерий: факторов инициации здесь больше, и многие из них являются эукариот-специфичными. Поэтому и набор мишеней для ингибиторов довольно разнообразен. Со всем многообразием факторов инициации и их набором у трех доменов живого удобно ознакомится в таблице 2.
Наиболее перспективными с точки зрения применения в клинике блокаторами этой стадии являются, пожалуй, ингибиторы РНК-хеликазы eIF4A, которые демонстрируют яркую антивирусную активность. В частности, два вещества, относящиеся к семейству рокаглатов, — сильвестрол и зотатифин — в данный момент проходят клинические испытания на больных COVID-19 [12], [13]. Вообще, биосинтез белка является «ахиллесовой пятой» многих вирусов, поскольку большинству клеток обычно не нужно синтезировать белки в таких количествах, как при вирусной инфекции, и незараженная клетка может безболезненно пережить невысокие концентрации трансляционных ингибиторов, которые убьют инфицированную или просто заблокируют размножение вируса.