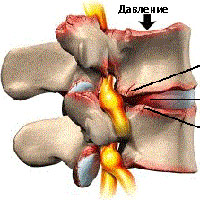
что такое синдесмофиты в позвоночнике
Остеофиты позвоночника
Причины
Повседневные нагрузки на позвоночник со временем приводят к дегенерации межпозвонковых дисков и изнашиванию суставов позвоночника. При сочетании таких факторов как возраст, травмы, плохая осанка увеличивается воздействие на костные структуры и суставы позвоночника. По мере изнашивания межпозвонкового диска происходит большая нагрузка на связки и суставы, что приводит к утолщению связок, накопление извести в связках, а также трение в суставах, в свою очередь, ведет к избыточному росту костных образований. Это способствует образованию остеофитов.
Дегенеративные изменения в тканях начинаются уже в молодом возрасте, но обычно это медленный процесс и не приводит к воздействию на нервные структуры до тех пор, пока человек не достигает возраста 60-70 лет.
Факторы, которые могут ускорить дегенеративный процесс и рост остеофитов в позвоночнике, включают в себя:
Наиболее частой причиной развития остеофитов считается артроз фасеточных суставов, что нередко способствует возникновению болей в спине у пациентов в возрасте старше 55 лет. Артроз фасеточных суставов может приводить к болям в пояснице и скованности в утренние часы, болевой синдром по мере двигательной активности уменьшается, а к вечеру вновь усиливается.
Наиболее распространенной причиной шейного и поясничного остеоартрита является генетическая предрасположенность. Пациенты могут отмечать появление симптомов остеоартрита в возрасте от 40 до 50. Мужчины более склонны к развитию симптомов в более раннем возрасте, однако у женщин с наличием остеофитов симптоматика бывает более выраженной.
Симптомы
Наиболее частыми симптомами являются боль в пояснице или боль в шее, вследствие воспалительных процессов в суставах и мышечного спазма, как реакция на воспаление. Типичные симптомы включают в себя:
Симптомы, обусловленные остеофитами усиливаются при физических нагрузках и уменьшаются после отдыха. Кроме того, симптомы могут уменьшаться после наклона туловища вперед и сгибании в талии. При компрессии остеофитами нервов могут появиться следующие симптомы:
В очень редких случаях могут быть нарушения функции кишечника и мочевого пузыря. Но такие симптомы могут быть связаны не только с остеофитами, но и с такими заболеваниями, как сахарный диабет, нарушение кровообращения в конечностях, опухоли спинного мозга, переломы позвоночника, инфекции позвоночника. Кроме того, многие симптомы при остеофитах аналогичны таковым при ревматологических заболеваниях (ревматоидный артрит, СКВ), а также похожи на симптомы при компрессии грыжей диска нервных корешков. В связи с тем, что симптомы при остеофитах схожи с другими медицинскими состояниями, необходимо полноценное обследование для выяснения точного диагноза.
Диагностика
Диагностика начинается с клинического обследования. Врач должен сначала провести детальный осмотр, неврологическое обследование для оценки работы нервных корешков и выявление признаков компрессии корешков или спинного мозга. На основании осмотра, истории заболевания, жалоб пациента врач назначает необходимый план обследования, включающий следующие методы исследования:
ЭНМГ позволяет определить нарушение проводимости по нервному волокну и определить как степень повреждения, так и уровень повреждения нервных волокон. Рентгенография нередко назначается в первую очередь для диагностики остеофитов и позволяет визуализировать остеофиты в позвоночнике. Кроме того рентгенография позволяет обнаружить и другие изменения в костных тканях позвонков.
Компьютерная томография (КТ) или МРТ может предоставить более подробную информацию об изменениях в структурах позвоночника как в костных, так и мягкотканных, и обнаружить наличие компрессии нервных корешков или спинного мозга.
Данные нейровизуализации позволяют врачу выбрать адекватную тактику лечения как консервативную, так и в случаях необходимости оперативную, в зависимости от наличия признаков компрессии нервных структур в корреляции с клиническими данными.
Лечение
Существует широкий спектр возможных вариантов лечения остеофитов, сопровождающихся симптоматикой.
У большинства пациентов с мягкой или умеренной компрессией нервов и раздражением от остеофитов возможно консервативное лечение.
Медикаментозное лечение, например противовоспалительные препараты или мышечные релаксанты, в течение нескольких недель.
Покой в течение короткого промежутка времени, который позволяет уменьшить воспалительные явления в суставах.
ЛФК. После уменьшения болевой симптоматики подключаются физические упражнения с постепенным увеличением объемов нагрузки.
Мануальная терапия и массаж позволяют увеличить мобильность двигательных сегментов, снять мышечный спазм.
Эпидуральные инъекции стероидов могут быть полезны при воспалительных процессах в фасеточных суставах, позволяя уменьшить воспаление, отек, и, таким образом, улучшить симптоматику.
Физиотерапия. В настоящее время существуют физиотерапевтические методы лечения (например, ХИЛТ – терапия или УВТ) которые позволяют добиваться хороших результатов лечения.
В тех случаях, когда консервативное лечение оказывается не эффективно или же есть выраженная компрессия корешков или спинного мозга, необходимо решать вопрос об оперативном лечении.
Задача хирургических методов лечения это провести декомпрессию нервных структур. Удаление остеофитов позволяет избавиться в большинстве случаев от симптоматики. Но иногда бывает так, что неврологическая симптоматика может сохраняться и в послеоперационном периоде, и в таких случаях имеет место длительный период компрессии нервных структур и необратимые изменения в нервных волокнах. Или: Но в некоторых случаях неврологическая симптоматика может сохраняться и в послеоперационном периоде, и тогда наиболее вероятен длительный период компрессии нервных структур и необратимые изменения в нервных волокнах.).
Исследования показали, что возраст не является основным фактором, определяющим возможность проведения оперативного лечения остеофитов. Тем не менее, заболевания, часто связанные с возрастом, такие, как гипертоническая болезнь, диабет, заболевания сердца могут увеличивать риск хирургических операций и замедлять восстановительные процессы, и, следовательно, должны приниматься во внимание при принятии решения об оперативном лечении.
Использование материалов допускается при указании активной гиперссылки на постоянную страницу статьи.
Недифференцированный спондилит
Междисциплинарное взаимодействие неврологов и ревматологов позволило выявить редкую причину болевого синдрома.
Одной из самых частых жалоб, с которой сталкиваются в клинической практике врачи-неврологи, являются жалобы на боли в спине. Согласно статистическим данным, до 80% населения хотя бы раз в своей жизни сталкивались с подобным синдромом. В большинстве случаев боль является вертеброгенной и обусловлена остеохондрозом позвоночника. Однако встречаются и редкие причины, диагностика которых требует более длительного и тщательного обследования пациентов.
Одной из редких причин болевого синдрома является спондилоартропатия.
К спондилоартропатиям относят:
Распространённость спондилоартропатии составляет 5—12 на 1000 населения. Данная группа заболеваний является одной из редких причин болевого синдрома в спине, поэтому не всегда специалистам удаётся установить правильный диагноз и назначить лечение.
Пример из клинической практики нашего отделения.
Пациент М., 53 года, 18.03.2019 экстренно госпитализирован в 1 неврологическое отделение КБ№1 с жалобами на интенсивные боли в нижне-грудном и поясничном отделах позвоночника с иррадиацией по задней поверхности левой ноги до большого пальца (до 10 баллов по ВАШ), невозможность стоять и ходить из-за болей.
Состояние при поступлении: Общее состояние: удовлетворительное. Кожные покровы: обычной окраски, влажность нормальная. Отеки отсутствуют. Дыхание через нос свободное. Аускультативно везикулярное. Пульс: 72 уд. в мин., удовлетворительного наполнения, ритмичный. АД 140/90 мм рт.ст. Тоны сердца: ритмичны. Язык чистый. Пальпация живота безболезненна. Дизурических расстройств нет.
Неврологический статус: В сознании, контактен, ориентирован. Тревожен, фиксирован на собственных ощущениях. Менингеальных знаков нет. Глазные щели D=S. Зрачки D=S. Фотореакции живые. Движения глазных яблок не ограничены. Нарушений чувствительности на лице нет. Лицо симметрично. Нистагма нет. Слух не нарушен. Глотание, фонация не нарушены. Язык по средней линии. Парезов нет. Сухожильные рефлексы живые, S=D. Патологических рефлексов не выявляется. Чувствительность не нарушена. Дефанс, болезненность при пальпации паравертебральных мышц в грудном и поясничном отделах. Симптом Ласега отрицательный с 2-х сторон.
Лабораторные обследования:
В анализах крови – повышение уровня С-реактивного белка (43.43 мг/л), СОЭ (50 мм/час).
Анализ мочи – без патологии.
Инструментальные обследования:
На МРТ поясничного отдела позвоночника выявлены дегенеративные изменения, малая грыжа межпозвонкового диска L5-S1 4 мм, спондилоартроз в дугоотростчатых суставах, выраженный на уровне L4-L5 с периартикулярной кистой слева и признаками воспалительного процесса в периартикулярных мягких тканях, спондилез.
На МРТ грудного отдела позвоночника выявлены умеренные дегенеративные изменения, артроз реберно-позвоночных суставов, протрузии межпозвонковых дисков TH7-Th9, TH4- TH5, спондилез.
Обращало на себя внимание несоответствие клинической картины (выраженные боли до 10 баллов по ВАШ) и изменений на МРТ (малая грыжа L5-S1 4мм), неэффективность стационарного лечения в предыдущую госпитализацию, повышение показателей воспаления (С-РБ, СОЭ).
Пациент был консультирован ревматологом. Предположен воспалительный генез заболевания. Зачастую спондилоартропатии ассоциированы с урогенитальной инфекцией, однако выявить специфического возбудителя по анализам крови и при исследовании простатического сока в данном случае не удалось. Анализ на HLA-B27 – отрицательный.
Начата гормональная терапия глюкокортикостероидами (Дексазон 12 мг в сутки), и антибактериальная терапия Ципрофлоксацином 500 мг х 2 раза/сут. На фоне гормональной и антибактериальной терапии отмечалась положительная динамика в виде уменьшения болевого синдрома до 1-2 баллов по ВАШ. Пациент выписан с улучшением и рекомендациями по продолжению антибактериальной терапии сроком до 3-х месяцев с последующей консультацией ревматолога.
Таким образом, междисциплинарное взаимодействие неврологов и ревматологов позволило выявить редкую причину болевого синдрома, установить правильный диагноз и назначить лечение.
Как остановить прогрессирование структурных изменений при анкилозирующем спондилите
Анкилозирующий спондилит (АС), или болезнь Бехтерева, характеризуется такими ключевыми патологическими признаками, как развитие энтезитов, сакроилеита и спондилита с образованием новой костной ткани с возможным развитием костного анкилоза. Рентгенологическое прогрессирование поражения позвоночника и активность заболевания признаны двумя основными детерминантами нарушения подвижности позвоночника и функционального статуса при АС. Общепринятая методика оценки рентгенологического прогрессирования пролиферативных изменений – модифицированный Stoke Ankylosing Spondylitis Spine Score (mSASSS). Однако есть ряд методических сложностей при оценке прогрессирования при АС, таких как необходимость длительного (не менее двух лет) наблюдения и разные темпы остеопролиферации в разных отделах позвоночника и у разных пациентов.
Объективная оценка рентгенологического прогрессирования и его предотвращение являются важными практическими задачами. В настоящее время в отношении последнего выдвинуто предположение о существовании «окна возможностей».
В статье рассматривается влияние на рентгенологическое прогрессирование АС нестероидных противовоспалительных и биологических противоревматических препаратов, в частности ингибиторов фактора некроза опухоли альфа (ФНО-альфа) и интерлейкина 17А (ИЛ-17А).
Структурно-модифицирующее действие ингибиторов ФНО-альфа доказано в ряде рандомизированных и наблюдательных исследований с большим объемом клинического материала, включая массивные когорты больных. Аналогичный эффект продемонстрировали ингибиторы ИЛ-17А, хотя клинический материал
был менее обширен.
Анкилозирующий спондилит (АС), или болезнь Бехтерева, характеризуется такими ключевыми патологическими признаками, как развитие энтезитов, сакроилеита и спондилита с образованием новой костной ткани с возможным развитием костного анкилоза. Рентгенологическое прогрессирование поражения позвоночника и активность заболевания признаны двумя основными детерминантами нарушения подвижности позвоночника и функционального статуса при АС. Общепринятая методика оценки рентгенологического прогрессирования пролиферативных изменений – модифицированный Stoke Ankylosing Spondylitis Spine Score (mSASSS). Однако есть ряд методических сложностей при оценке прогрессирования при АС, таких как необходимость длительного (не менее двух лет) наблюдения и разные темпы остеопролиферации в разных отделах позвоночника и у разных пациентов.
Объективная оценка рентгенологического прогрессирования и его предотвращение являются важными практическими задачами. В настоящее время в отношении последнего выдвинуто предположение о существовании «окна возможностей».
В статье рассматривается влияние на рентгенологическое прогрессирование АС нестероидных противовоспалительных и биологических противоревматических препаратов, в частности ингибиторов фактора некроза опухоли альфа (ФНО-альфа) и интерлейкина 17А (ИЛ-17А).
Структурно-модифицирующее действие ингибиторов ФНО-альфа доказано в ряде рандомизированных и наблюдательных исследований с большим объемом клинического материала, включая массивные когорты больных. Аналогичный эффект продемонстрировали ингибиторы ИЛ-17А, хотя клинический материал
был менее обширен.
Анкилозирующий спондилит (АС), или болезнь Бехтерева, – хроническое воспалительное заболевание неизвестной этиологии с первичным поражением осевого скелета – крестцово-подвздошных суставов (КПС) и вышележащих отделов позвоночника, начинающееся в большинстве случаев в возрасте до 45 лет и ассоциированное с антигеном класса I комплекса гистосовместимости HLA-B27 (определяется в 80–90% случаев) [1]. Проявлениями АС могут быть периферический артрит и энтезит, а также передний увеит, псориаз и воспалительное заболевание кишечника [2]. По разным оценкам, распространенность АС составляет от 0,1 до 1,4% [3]. Заболевание характеризуется активным воспалением в КПС и позвоночнике, которое сопровождается болью и скованностью, на структурном уровне – избыточным образованием новой костной ткани, что приводит к развитию синдесмофитов и анкилоза. Поздними последствиями патологического процесса являются анкилоз КПС и «бамбукообразный» позвоночник. Как следствие, значительные функциональные нарушения. Не случайно патология признана значимой социально-экономической проблемой [4, 5].
Особенности структурного прогрессирования
Для АС характерны такие ключевые патологические признаки, как развитие энтезитов, сакроилеита и спондилита с образованием новой костной ткани и, возможно, костного анкилоза [6]. Поэтому структурное повреждение при АС отличается от структурного повреждения при ревматоидном артрите (РА). В последнем случае процессы остеопролиферации отсутствуют или выражены слабо и преобладает деструкция хряща и костной ткани, сопровождающаяся потерей костной массы и развитием типичных эрозий костей [7, 8]. При этом именно на модели РА можно продемонстрировать значение структурного прогрессирования для определения тяжести состояния независимо от активности болезни [8]. Скорость прогрессирования, с одной стороны, общепризнанный фактор для оценки прогноза [9], с другой – способ верификации эффекта базисных синтетических или биологических противоревматических препаратов в отношении замедления рентгенологического прогрессирования патологии [8]. Эрозивный процесс считается отличительной чертой РА – наблюдается практически у 98% больных [10]. Для оценки прогрессирования заболевания, отражающего кумулятивный ущерб с течением времени, наиболее предпочтительным методом визуализации остается рентгенография [11]. Достоверные рентгенологические изменения рассматриваются как признак необратимого повреждения тканей сустава [10]. Структурное прогрессирование ассоциируется с ухудшением функциональных возможностей больного [12], хотя становится определяющим только на относительно поздних стадиях болезни [13, 14]. Несомненно, быстрое структурное прогрессирование сопровождается выраженной потерей функции [15], а его замедление приводит к более благоприятному функциональному исходу [16–18].
Закономерности, изученные на модели РА, в значительной степени справедливы в отношении АС, несмотря на то что основной патологический процесс при АС (остеопролиферация) в определенной степени противоположен таковому при РА (образование эрозий). Новообразование костной ткани в позвоночнике, в частности появление синдесмофитов между телами позвонков на рентгенограммах, расценивается как признак рентгенографического прогрессирования воспалительного поражения позвоночника [19]. В ряде работ показано, что рентгенологическое прогрессирование и активность заболевания являются двумя основными детерминантами нарушения подвижности позвоночника и функционального статуса при АС [5, 20], так же как при РА. Сохранение высокой воспалительной активности АС ассоциируется с выраженным рентгенологическим прогрессированием. Так, по данным 12-летнего наблюдения 184 больных АС в рамках международной когорты OASIS [21], при оценке активности болезни с помощью Ankylosing Spondylitis Disease Activity Score (ASDAS) [22] и прогрессирования рентгенологических изменений в позвоночнике с помощью модифицированного Stoke Ankylosing Spondylitis Spine Score (mSASSS) [23] установлено, что повышение ASDAS на 1 балл приводило к повышению mSASSS на 0,72 балла за два года. У пациентов с очень высокой активностью АС (ASDAS > 3,5 балла) по сравнению с пациентами с неактивным АС (ASDAS
Спондилодисцит: причины, симптомы, диагностика, лечение
Инфекционные заболевания позвоночника возникают по двум причинам:
Возбудителями заражения МП диска в большинстве случаев выступают те же гноеродные бактерии, что вызывают наиболее опасные поражения костных тканей (остеомиелит, туберкулез):
Гематогенное инфицирование тканей позвоночника вторично по характеру, т.к. сначала бактериальной атаке подвергаются внутренние органы грудной и брюшной полостей и таза.
Для информации: согласно статистике воспалительный процесс в центре МП диска возникает по необъяснимой причине в каждом третьем случае.
Спондилодисцит с большей частотой поражает детей и подростков (от 7-8 лет до 18-20 лет) в период активного роста позвоночника, а также взрослых людей в возрасте после 45-50 лет. Как и большинство инфекционных заболеваний позвоночника, спондилодисцит чаще выявляется у мужчин (60-70%). Инфекционное воспаление МП диска может быть (и бывает) множественным: в случае гематогенного инфицирования поражаются соседние позвонки. Чаще такие поражения бывают у детей 8-10 лет.
Механизм развития и симптоматика
Болезнетворные микроорганизмы проникают в центральную часть межпозвоночного диска через малейшие повреждения фиброзного кольца или кровеносные капилляры в гиалиновом слое замыкательной пластинки, вплотную касающейся жидкой «сердцевины». Любое нарушение целостности матрикса может стать «открытыми воротами» для гноеродных бактерий, атакующих хондробласты и хондроциты. Протеолитические ферменты, выделяемые бактериями, разрушают белковую оболочку клеток, что позволяет микроорганизмам — «агрессорам» питаться продуктами разложения или проникать в цитоплазму.
Воспалительно-деструктивный процесс начинается с замыкательных пластинок. Затем гнойный расплав, содержащий живые бактерии, лимфоциты, бактериофаги, антигены, антитела и смесь ферментов, выделенных погибшими бактериями и иммунными клетками, распространяется в более плотных тканях фиброзного кольца и в самом тонком месте (в центре диска) прорывается в пульпозное ядро.
Абсцесс в межпозвоночном пространстве создает эмбол (пузырек) с истонченными стенками, внутри которого повышенное давление жидкого содержимого вызывает болезненные ощущения в позвоночнике: корешки спинномозговых нервов сигнализируют о раздражении, создаваемом выпирающими краями фиброзного кольца (как при остеохондрозной протрузии).
Гнойная масса может стать причиной инфицирования внешних мягких тканей надкостницы и связок, расположенных в паравертебральном (околопозвоночном) пространстве.
Прорыв экссудатов в спинномозговой канал вызывает образование эпидурального абсцесса, инфицирование спинномозговых оболочек и компрессию спинного мозга. Возможные последствия: парезы мускулатуры, дисфункции внутренних органов, нарушение двигательной функции.
Расплавление хрящевых тканей МП диска не остается только в пределах межпозвоночного пространства: активная бактерицидная атака иммунной системы может повредить костные ткани тел позвонков. Остеолитические ферменты, выделяемые некоторыми видами гноеродных бактерий и бактериофагами, разрушают поверхностные слои остеоцитов. Начинаются эрозия и деминерализация костных тканей, соседствующих с замыкательными пластинками. Это может стать предпосылкой для более глубокого инфицирования тел позвонков.
Рассасывание абсцесса после прекращения иммунной реакции становится первой фазой восстановительного процесса. Клетки соединительной ткани замещают пострадавшую хрящевую прослойку, что не восстанавливает межпозвоночный диск. Наоборот, менее прочная соединительная ткань истирается, костные тела позвонков соприкасаются.
Поверхностно расположенные остеобласты (несозревшие клетки костной ткани) начинают активно делиться по краям тела позвонка, дифференцироваться в полноценные остеоциты, наполняться соединениями кальция. Выросты («остеофиты») растут до тех пор, пока не сцепятся с выростами соседнего позвонка и не образуют прочное соединение. Процесс сращения позвонков сопровождается блокированием спинномозговых нервов, что приводит к параличам и сильным болям в спине и конечностях.
Симптоматика инфекционных заболеваний вторичного характера, к которым можно отнести спондилодисцит, схожа в рамках иммунной реакции:
Болевой синдром в спине и частях тела зависит от локализации в позвоночнике. В результате ущемления верхних корешков блокируются нервные импульсы от сенсорных рецепторов (ослабляется острота ощущений вплоть до онемения). Блокирование нижних корешков, передающих командные импульсы от спинного и головного мозга, влечет за собой ослабление двигательных функций конечностей и нарушение деятельности дыхательной, сердечнососудистой, пищеварительной, выделительной и половой систем.
Чаще всего от инфекционных поражений страдают позвонки поясничного и грудного отделов. Гематогенное заражение от инфицированных органов мочеполовой системы и легких (туберкулезная инфекция) является причиной до 50% всех известных случаев спондилодисцита.
Воспаление мягких тканей в паравертебральной области определяется по отечности и повышенной кровенаполненности пораженного участка. Болевой синдром выражается в тупых тянущих болях с приступами при поворотах и наклонах. Спазмы глубоких мышц, соединяющих поперечные отростки, искажают осанку и стесняют движения пораженного отдела позвоночника. Длительное спазмирование и дорсомиалгия (болезненные ощущения в мышцах спины) приводят к нарушению кровообращения, с чего и начинается дистрофия мышечных волокон.
Спондилодисцит может протекать скрытно, «маскируясь» под приступы болей, характерные для остеохондроза, неспецифического спондилита, спондилоартрита. Для них всех характерны корешковый синдром, сильные приступы ишиалгии, торакоалгии. Кроме того, инфекционное воспаление не всегда вызывает активную иммунную реакцию организма: повышение температуры на 0,5 градуса не будет считаться полноценным симптомом. Врач сделает заключение о наличии инфекции в позвоночнике на основе анализов и визиоскопических исследований.
Исследование мягких тканей позвоночника с помощью рентгенографии дает неоднозначные результаты: явственно различить нарушения целостности МП дисков не удается. Гнойное расплавление и формирование абсцессов можно определить только по размыванию контуров замыкательных пластинок и искажению очертаний тел позвонков.
Компьютерная томография делает изображение более наглядным, представляя на экране монитора в виде трехмерной фигуры, и позволяет точнее оценить размеры абсцесса.
Обзорные спондилограммы пораженного участка, выполненные с помощью рентгеновской установки, дают визуальную информацию об эрозии поверхностных слоев и склеротизации костной ткани по краям позвонков.
В диагностике заболеваний позвоночника большей популярностью пользуется магнитно-резонансная томография (или точнее «ядерно-магнитно-резонансная»), более безопасная и чувствительная, чем жесткое рентгеновское излучение. На снимках костные структуры получаются черными, но мягкие ткани, наполненные водой, передают все оттенки серого и белого цветов. Это позволяет обнаруживать мельчайшие объекты (узелковые образования, инфильтрации) и отслеживать динамику развития абсцесса.
Первостепенная задача при инфекционном воспалении – правильно определить вид микроорганизма-возбудителя болезни. Наличие инфекции определяется по общим и клиническим анализам крови:
Биопсия или пункция с забором экссудата из очага воспаления — наиболее эффективный способ получить достоверные результаты. Микробиологические исследования выявляют ненормально размножившуюся бактерию, уточнят концентрацию. Высеянные культуры также испытываются на чувствительность к антибиотикам.
Тактика лечения инфекционных заболеваний позвоночника опирается на консервативные методы: медикаментозную терапию, щадящий двигательный режим (в крайнем случае – иммобилизация, т.е. постельный режим). Спондилодисцит лечится по такой же схеме.
Первоначально для уничтожения агрессивной микрофауны используются антибиотики (целевые, если возбудитель известен; широкого спектра действия, если в анализах обнаружено несколько видов болезнетворных микроорганизмов и заключение спорно). В течение первых 2-4 недель лекарства вводятся внутривенно. Затем, если анализы крови (СОЭ) оказывают положительную динамику, больной получает менее активные формы лекарств.
Когда врачи считают, что инфекционная атака подавлена, больному назначаются регенеративные препараты (хондропротекторы), противовоспалительные нестероидные средства. Дополнительно прописываются витамины и иммуностимуляторы.
Иммобилизация рекомендуется пациентам, перенесшим операцию на позвоночнике или тем, у кого воспаление достигло значительной стадии разрушения дисков. Жесткий ложемент помогает сохранить неподвижность.
Хирургические операции по удалению абсцесса и реконструкции МП диска назначаются 25% пациентов. Откачивание экссудата (дренирование) из центральной области межпозвоночного пространства – самая простая из операций при спондилодисците. Дренирование внутренних многокамерных абсцессов (внутри спинномозгового канала) занимает больше времени, т.к. требуется создавать доступ через мягкие или костные ткани.
Также проводятся ламинэктомии (удаления костных пластинок) для высвобождения корешков из-под осевших суставных отростков. Декомпрессия спинномозговых нервов – наиболее важная из причин для проведения операций.
Дискэктомия (удаление разрушенного диска) и корпэктомия (удаление фрагмента тела позвонка) позволяют полностью очистить пораженные ткани. Внедрение распорочных трансплантатов (вырезанных из костных структур, взятых в ребрах или гребне подвздошной кости) позволяет хрящевым тканям начать восстанавливаться, а фиксирующие позвоночный столб титановые конструкции временно снимут нагрузку на пострадавшие позвонки. Реабилитация занимает от 3 месяцев до полугода. Прогноз на излечение спондилодисцита всегда положителен.