что такое симптоматическое лечение остеоартроза
Симптоматические препараты замедленного действия в терапии остеоартроза

Рассмотрены принципы терапии остеоартроза, состав и схемы применения хондропротекторов (глюкозамина, хондроитина сульфата, гиалуроновой кислоты, диацереина, экстрактов авокадо и сои, морских рыб и хрящевой ткани и мозга телят), анализ цен фармацевтическо
Principles of osteoarthrosis therapy were considered, as well as the composition and usage schemes of chondroprotectors (glucosamin, chondroitin sulfate, hyaluronic acid, diacerein, avocado and soya extracts, salt-water fish and calves’ cartilaginous tissue and cerebrum), price analysis of pharmaceutical market as of March 2012.
Дегенеративно-дистрофические поражения суставов являются одними из наиболее распространенных заболеваний и встречаются у 10–12% населения земного шара. Данная группа заболеваний объединена в 10-й Международной классификации болезней под общим термином «остеоартроз» (ОА) [12]. Установлено, что одним из основных факторов риска развития ОА является возраст. Так, в возрасте 50 лет этому заболеванию подвержены около 50% населения, 60 лет — 80% населения, 70 лет — около 90%, причем более 25% пациентов не могут справляться с основными ежедневными двигательными функциями, остальные предъявляют жалобы на затруднение выполнения функциональных обязанностей, особенно вне дома [21–23, 30, 39]. Среди больных ОА в молодом возрасте преобладают мужчины, а в пожилом возрасте — женщины. По тяжести нарушения функции опорно-двигательного аппарата первое место занимают тазобедренный, коленный и голеностопный, а также плечевой суставы [3, 5].
Экономические аспекты лечения остеоартроза
Экономический ущерб, связанный с патологией костно-мышечной системы (КМС), является достаточно значимым и сопоставим с затратами на лечение онкологических больных [19].
Одно из ведущих мест среди заболеваний КМС занимает ОА. На него приходится до 80% всей суставной патологии и более 50% всех ревматических болезней. Распространенность ОА в разных регионах мира колеблется от 13,6 до 41,7% и значительно увеличивается по мере старения [11].
ОА болеют 10–12% обследованного населения США и Европы всех возрастных групп. Проблема ОА чрезвычайно актуальна и для России. Так, из 11 млн обращений пациентов в связи с ревматическими заболеваниями, зарегистрированными в 1996 г., по меньшей мере 16% (примерно 1 млн 800 тыс.) были связаны с ОА [10].
По данным ежегодных статистических отчетов количество зарегистрированных по обращаемости больных с болезнями КМС и соединительной ткани достигло 11 835,1 тыс. человек, увеличившись за 10 лет более чем на 42%. Первичная заболеваемость всеми ревматическими заболеваниями составила 25,7 на 1000 для общероссийской популяции, в том числе 37,98 на 1000 для взрослых и подростков. Трудовые потери общества, связанные с болезнями КМС и соединительной ткани, постоянно увеличиваются. Среди всех причин временной нетрудоспособности по России они занимают 2-е место в случаях и 3-е — в днях. Ревматические заболевания ежегодно приводят к потере более 65 млн трудовых дней [16, 17].
Все экономические затраты на медицинское обеспечение больных можно подразделить на три группы: прямые, непрямые и дополнительные. Прямые затраты идут на оплату диагностических мероприятий, амбулаторного медикаментозного (чаще всего пожизненного) и немедикаментозного лечения, лабораторных и инструментальных исследований, пребывания в стационаре, зарплату участвующего в обследовании, лечении и реабилитации медицинского персонала, а также оплату ряда немедицинских услуг (транспорта, питания и др.) [14, 20, 38].
Непрямые затраты связаны с непроизведенной продукцией вследствие снижения или утраты трудоспособности пациентов, а нередко — и преждевременным летальным исходом [6, 14, 32, 38].
Согласно официальным статистическим данным, ежегодно в стационарах Санкт-Петербурга больные ОА проводят 30,2 тыс. дней (в 2002 г. было госпитализировано 1866 человек, средняя длительность койко-дня — 16,2). Исходя из средней стоимости койко-дня, определенного системой обязательного медицинского страхования (ОМС), стоимость собственно госпитализации этих больных на тот момент составляла 4,1 млн руб./год. Таким образом, приблизительные общие экономические потери, связанные с заболеваемостью ОА в Санкт-Петербурге, рассчитанные в модельных исследованиях, составляют почти 3,3–6,1% всего бюджета территориального Фонда ОМС Санкт-Петербурга [9].
Отличительной особенностью ревматических заболеваний является высокая инвалидизация. По данным многоцентрового эпидемиологического исследования, проведенного Институтом ревматологии РАМН, данной патологии принадлежит 5-е место среди всех причин инвалидности по показателю первичного выхода (21,3 на 10 000 жителей Российской Федерации) [1, 4].
При OA показатели временной и стойкой утраты трудоспособности сравнимы с таковым при сердечно-сосудистой патологии и выше, чем при любых других заболеваниях [2, 15, 18].
Одними из наиболее экономически затратных элементов в терапии ОА являются операции по протезированию суставов, стоимость которых составляет более 200 тыс. рублей. При этом сами операции не влияют на дальнейшее прогрессирование ОА в других суставах.
Принципы терапии остеоартроза
Основной целью фармакотерапии ОА является минимизация основных клинических проявлений, т. е. улучшение качества жизни пациента, чему способствует назначение эффективных и безопасных для больного лекарственных средств.
Фармакотерапия ОА является длительной и дорогостоящей. Выделяют два направления: 1) быстрое снижение болевого синдрома и воспалительных изменений в суставах с использованием анальгетиков, нестероидных противовоспалительных препаратов (НПВП) и глюкокортикостероидов; 2) замедление деградации компонентов хряща и прогрессирования болезни с помощью симптоматических препаратов замедленного действия (Symptomatic slow acting drugs for osteoarthritis — SYSADOA) [8, 13]. Неселективные НПВС, обеспечивающие эффективное купирование симптомов остеоартроза, часто вызывают побочные эффекты со стороны желудочно-кишечного тракта, сердечно-сосудистой системы и способны усугублять тяжесть ОА, неблагоприятно влияя на состояние хряща путем снижения синтеза глигозаминогликанов, необходимых для его регенерации. Поэтому наиболее перспективной группой являются SYSADOA.
Данная группа, в РФ получившая название хондропротекторов, представлена препаратами глюкозамина, хондроитина сульфата, гиалуроновой кислоты, диацереина, экстрактов авокадо и сои, морских рыб и хрящевой ткани и мозга телят.
Глюкозамина сульфат, хондроитина сульфат, гиалуроновая кислота, экстракт из морских рыб являются базисными препаратами, обеспечивающими компенсацию дефицита гликозаминогликанов, защиту хряща от дегенерации, и оказывают противовоспалительное и вторичное обезболивающее действие.
До 30% глюкозамина сульфата абсорбируется суставным хрящом вследствие тропизма и небольшого размера молекул, что позволяет ему встраиваться в структуры хрящевой ткани, препятствуя ее деградации и стимулируя синтез протеогликанов и гиалуроновой кислоты в синовиальной жидкости [7, 34].
Диацереин подавляет синтез интерлейкина-1, защищая хрящ от дегенерации, а также ингибирует действие других цитокинов, вызывающих воспаление.
Уровень доказательности эффективности применения глюкозамина сульфата и хондроитина сульфата при ОА коленного сустава оценивается как IА, а диацереина и экстрактов из авокадо и сои — IB. Строгие доказательства эффективности экстрактов морских рыб отсутствуют [8].
Биодоступность инъекционных форм существенно выше, чем пероральных. Так, для глюкозамина сульфата она составляет 26% при пероральном приеме и 95% при парентеральном [35]. Пероральная биодоступность хондроитина сульфата равна 13%, данные по биодоступности при парентеральном введении хондроитина отсутствуют [8].
Препараты на основе глюкозамина сульфата, являющиеся наиболее эффективными из группы SYSADOA и с успехом использующиеся в комплексной терапии ОА, до последнего времени не имели российских аналогов. С 2010 года в рамках программы импортозамещения начался выпуск препарата Эльбона, содержащего глюкозамина сульфат.
Инъекционные формы хондропротекторов являются универсальными, так как могут быть использованы как в рамках инициальной терапии ОА для индукции ремиссии, так и для систематического применения в лечении заболевания. Поэтому в данной статье будут рассмотрены 4 парентеральных ЛС.
Состав и схема применения данных препаратов представлены в табл. 1.
Приведенные в таблице препараты вводятся внутримышечно, Алфлутоп также можно вводить внутрисуставно. Дона и Эльбона также имеют пероральные формы (саше, содержащие 1500 мг глюкозамина сульфата № 20), что обеспечивает широкие возможности для применения их в терапии ОА.
Особенностью применения препаратов группы SYSADOA является наступление эффекта спустя 2–8 недель от начала терапии и его сохранение в течение 2–3 месяцев после окончания лечения. Исходя из проведенных клинических исследований, можно сделать следующие выводы: противовоспалительный эффект препаратов группы SYSADOA сравним с НПВП, их можно сочетать друг с другом, эффект сохраняется после окончания курса лечения; применение позволяет снизить дозу НПВП, практически не развиваются побочные эффекты, снижается риск деструкции хряща на фоне приема НПВП.
Ценовая характеристика препаратов
Нами был проведен анализ цен розничного фармацевтического рынка по состоянию на март 2012 года. Средняя цена за упаковку по инъекционным лекарственным формам составила: Дона — 1176,60 ± 82,64 руб., Эльбона — 664,62 ± 51,69 руб., Хондролон — 974,68 ± 107,52 руб., Алфлутоп — 1394,30 ± 202,02 руб. Для получения клинически значимых эффектов структурно-модифицирующих препаратов необходимо, как минимум, проведение двух курсов лечения в год в течение двух лет [26, 29]. В соответствии с этим рассчитана стоимость курса препаратов на год, исходя из того, что глюкозамина сульфат (Дона и Эльбона) применяется в течение 4–6 недель, а для Алфлутопа и Хондролона после первого курса (25–30 инъекций Хондролона, 20 инъекций Алфлутопа) рекомендован второй. Стоимость курса терапии представлена в табл. 2 и на рис.
Клиническая эффективность препаратов SYSADOA
По данным Кокрановского обзора глюкозамина сульфат является одним из наиболее изученных базисных препаратов для лечения ОА и обладает как симптоматическим, так и структурно-модифицирующим действием, потенциально замедляя прогрессирование болезни. Доказательная база включает более 20 исследований, как коротких, так и проспективных, с высокой качественной мощностью (по шкале Gotzsche), отвечающих критериям доказательной медицины [25, 27, 31, 36, 37, 40].
Согласно рекомендациям Европейской антиревматической лиги (European League Against Rheumatism, EULAR) (2003), для ОА коленных суставов доказанным является симптоматический эффект глюкозамина сульфата и хондроитина сульфата [28].
В рандомизированном, плацебо-контролируемом, двойном слепом исследовании показано, что лечение ОА коленного сустава глюкозамином сульфатом, в течение 12 месяцев — 3 лет, предотвращает полную замену сустава в течение контрольного наблюдения после исследования с медианой продолжительности 5 лет. Уменьшение риска хирургической замены коленного сустава составило 73%, по сравнению с пациентами, ранее получавшими плацебо [24].
Для ОА тазобедренных суставов также определены симптоматический эффект и низкая токсичность этих веществ, однако выраженность их влияния на восстановление хряща недостаточная, четкие критерии отбора больных для лечения отсутствуют.
Эффективность и безопасность применения препарата Эльбона подтверждается Отчетом о клиническом исследовании эффективности и безопасности у больных остеоартрозом коленных суставов в Научно-исследовательском институте ревматологии РАМН. На фоне курсового лечения ОА коленного сустава было отмечено достоверное снижение интенсивности боли по шкале ВАШ с 61,8 мм до 38 мм (р
Д. Ю. Ивкин, кандидат биологических наук
А. С. Ивкина
ГБОУ ВПО СПХФА Минздравсоцразвития России, Санкт-Петербург
Что такое остеоартроз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Фомичев А. А., травматолога со стажем в 8 лет.
Определение болезни. Причины заболевания
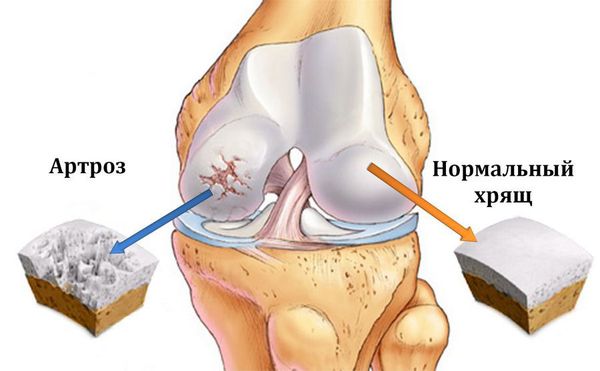
Остеоартроз (артроз) — заболевание суставов, характеризующееся дегенеративным изменением покрывающего кость хряща, проще говоря, его разрушением.
Подавляющее число поражаемых суставов — это коленный, тазобедренный, плечевой и первый плюсне-фаланговый. Поражение других суставов встречается намного реже и часто является вторичным. Остеоартроз поражает 12% трудоспособного населения только европейской части Российской Федерации, причем в последние годы вызванная им нетрудоспособность выросла в 2 раза. [1]
Как и у любого заболевания, у остеоартроза также имеются факторы риска его развития, которые и сегодня активно изучаются, и список ежегодно расширяется. [5] Основными принято считать:
— нарушения обмена веществ;
— повышенный вес тела;
— неполноценное и нерегулярное питание;
— артрит (воспалительный процесс в суставе);
— очаги хронической инфекции или воспаления (например, хронический тонзиллит).
— варикозное расширение вен нижних конечностей.
Симптомы остеоартроза
Общие симптомы артроза включают:
Суставная боль редко бывает острой, чаще ноющего или тупого характера, как правило, прекращающаяся во время покоя. Симптомы часто носят волнообразный характер, могут возникать и прекращаться без попыток лечения. Они могут быть незначительными, умеренными или тяжелыми. Жалобы при остеоартрозе могут оставаться примерно одинаковыми в течение многих лет, но со временем прогрессируют, и состояние ухудшается. Незначительные и умеренные симптомы возможно контролировать на одном уровне, а вот тяжелое течение заболевания может привести к хронической боли, неспособности выполнять ежедневные бытовые действия, что влечет за собой и потерю трудоспособности, вплоть до инвалидизации.
Патогенез остеоартроза
Классификация и стадии развития остеоартроза
Разделяют заболевание на 2 большие группы: первичный (или идиопатический) и вторичный. Первая группа развивается в результате либо неясной причины, либо в результате возрастных изменений. Вторая характеризуется четкими причинами и развивается в результате их патологического процесса (например, на фоне туберкулеза, рассекающего остеохондрита, субхондрального некроза и т.д.)
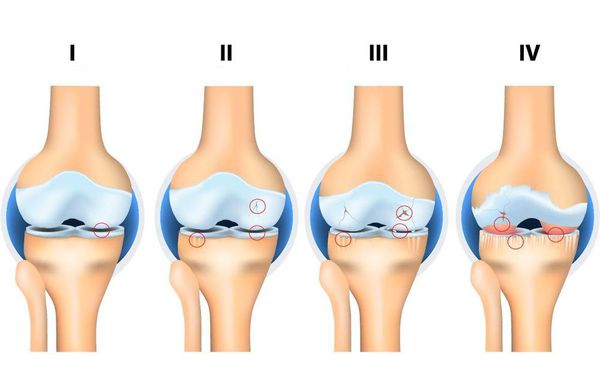
Независимо от причин, которые явились фактором развития остеоартроза, различаются 4 стадии его развития:
1 стадия: твердые структуры сустава в процесс разрушения не вовлекаются, имеются начальные изменения в его мягких структурах и в составе суставной жидкости (которая является питательной средой и снижающей трение сустава), происходит нарушение питания сустава.
2 стадия: сопровождается «запуском» механизма разрушения твердых структур сустава, образуются краевые твердые образования (экзостозы, остеофиты). Умеренные жалобы на изменения в объеме движений.
3 стадия: сопровождается сужением суставного просвета, выраженным разрушением нагружаемой поверхности с образованием костно-хрящевых дефектов, выраженным ограничением движений, постоянным чувством «хруста» при движении, начальными изменениями оси конечности.
4 стадия: тяжелая, при которой движения выраженно ограничены в суставе вплоть до полного его отсутствия (анкилоз), выраженным воспалительным процессом, его деформацией, образованием костных дефектов (в результате полного отсутствия хрящевого покрова).
Осложнения остеоартроза
Без лечения любое заболевание дает осложнения, и артроз не исключение. Если это первичная форма, то к основным осложнениям относятся:
Если это вторичная форма, то осложнения зависят от процесса, вызвавшего развитие артроза. Например, это может привести к остеопорозу, хроническому заболеванию, которое характеризуется прогрессирующим нарушением обмена веществ в костной ткани. Вследствие этого кости становятся хрупкими, нарушается их питание, в итоге остеоартроз осложняется угрозой внутрисуставных переломов. Поэтому так важно обратиться к врачу своевременно. Как писал выдающийся русский хирург Н.И.Пирогов: «Будущее принадлежит медицине профилактической».
Диагностика остеоартроза
Диагностика артроза часто начинается с врача (как правило, это травматолог-ортопед) медицинской помощи первого звена (поликлиники), где выполняется клинический осмотр и интерпретируются данные обследования (КТ, МРТ, рентгенограммы и т.п.), чтобы определить степень и тип остеоартроза. Диагностика и постановка диагноза обычно не вызывают затруднений. Если диагноз неясен или врач предполагает вторичное развитие заболевания, то для уточнения пациент направляется к врачам других специальностей (например, ревматологу). Поставить степень артроза без результатов обследования очень затруднительно. Важным для постановки диагноза и определения тактики лечения является также история заболевания, способы и попытки лечения, так как перед врачом часто стоит сложная задача дифференциальной диагностики (например, симптомы артроза и артрита часто совпадают).
Лечение остеоартроза
На начальных стадиях остеоартроз поддается консервативному лечению при условии комплексного подхода. Лечение требует длительного времени и преследует основную цель: либо остановить процесс разрушения на той стадии, на которой начато лечение, либо этот процесс замедлить. Комплекс включает в себя медикаментозное и немедикаментозное лечение, в который входят курсы ЛФК (лечебной физкультуры и гимнастика), физиотерапия (чаще это фонофорез и магнитотерапия), плавание, противовоспалительная терапия (либо прием внутрь, либо местно в виде гелей или крема), хондропротективной терапии (прием препаратов на основе хондроитина сульфата и глюкозамина) и внутрисуставных инъекций (это могут быть как гомеопатические препараты, так и препараты гиалуроновой кислоты). Хондропротекторы до сих пор применяются врачами-травматологами-ортопедами на территории РФ и СНГ, их назначают курсами внутрь, однако результаты последних научных исследований западных стран опровергают положительное действие в сравнении с эффектом плацебо. [2] При выраженных симптомах и тяжелых стадиях консервативное лечение становится неэффективным, что ставит на первое место лечение оперативное. Учитывая показания, это может быть как малоинвазивное лечение — артроскопия, так и эндопротезирование. При артроскопии (эндоскопии сустава) выполняется его санация под контролем видео-оптики, производится удаление экзостозов (при возможности) и повреждения мягких структур, что при таких стадиях наблюдается достаточно часто. Однако в последнее время пользу от такого вида вмешательства при остеоартрозе все чаще стали ставить под сомнение, так как оно не имеет должного эффекта при хронической боли, [3] а в ряде случаев и может нанести значительный вред при некачественном выполнении. [4]
Эндопротезирование – технически сложная и тяжелая операция, цель которой — создать искусственный, полностью новый сустав. Требует четких показаний и определения рисков при наличии противопоказаний. Сегодня успешно используются эндопротезы для коленного, тазобедренного и плечевого суставов. Дальнейшее амбулаторное наблюдение врачом снижает риски и сроки реабилитации, улучшает качество и эффективность выполненной операции.
Прогноз. Профилактика
Прогнозирование зависит от своевременного обращения к врачу-травматологу-ортопеду и начала комплекса лечения. В плане ликвидации морфологических изменений при остеоартрозе прогноз неблагоприятный, так как полностью восстановить хрящевую структуру сустава невозможно. В пожилом возрасте течение заболевания более тяжелое, чем в молодом. Однако при своевременном обращении к врачу и соблюдении всех рекомендаций можно добиться устранения всех жалоб и восстановить полноценную двигательную функцию сустава.
Симптоматическая терапия боли при остеоартрозе
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Вряд ли можно получить от ревматолога какой-то другой ответ на вопрос, какой диагноз на амбулаторном приеме он ставит чаще всего, кроме как диагноз остеоартроза (ОА). О том, что это один из самых часто выставляемых диагнозов, можно услышать и от врачей общей практики, ортопедов, хирургов, неврологов. Действительно, именно ОА – самое часто регистрируемое заболевание суставов независимо от популяции (примерно 4 из 5 больных ревматическими заболеваниями – больные ОА). ОА – заболевание, основу которого составляет поражение всех компонентов сустава, включая хрящ, субхондральную кость, синовиальную оболочку, связки, капсулы, окружающие сустав мышцы. Основной клинический признак заболевания – боль, которая вкупе с постепенно формирующейся деформацией суставов приводит к нарушению их функции и, как следствие, к инвалидизации. Особенно часто, в т.ч. по данным эпидемиологических исследований, проведенных в России, поражаются коленные и тазобедренные суставы, вовлечение которых является основной причиной снижения качества жизни и развития нетрудоспособности [1]. Социальную значимость ОА может подчеркнуть тот факт, что только в США ежегодно проводится около 250 тыс. операций по эндопротезированию тазобедренных суставов и около 500 тыс. подобных операций на коленных суставах, причем потребность в них неуклонно растет [2].
Независимо от наличия или отсутствия факторов риска (как правило, у больного выявляются одновременно несколько факторов риска ОА: например, пожилой возраст, женский пол при ОА коленных суставов, наследственная предрасположенность, травмы, профессиональные занятия спортом, ожирение, различные заболевания, например, сахарный диабет или гипотиреоз) лечение заболевания проводится по схожим принципам и преследует 2 основные цели: уменьшение боли и предотвращение развития функциональной недостаточности суставов (при ее нарушении – восстановление их функции).
Существующие рекомендации по лечению ОА основываются на оптимизации симптоматической терапии заболевания и включают в себя немедикаментозное лечение: увеличение физической активности, снижение массы тела, коррекцию плоскостопия, разгрузку суставов при помощи ортезов и трости и т.д., что может привести к уменьшению интенсивности боли. Но, к сожалению, часто этого недостаточно, и возникает потребность в медикаментозном лечении.
До настоящего времени препараты, способные полностью остановить прогрессирование ОА, не разработаны, а средства, обладающие свойством замедлять процессы деструкции хондроцитов, не всегда могут существенно уменьшить основные симптомы болезни (боль и воспаление) даже при длительном применении. Эти препараты классифицируются как медленно действующие препараты, модифицирующие симптомы болезни (влияние на клинические проявления ОА, прежде всего на боль, может быть достигнуто не раньше чем через несколько недель, а то и месяцев от начала терапии), хотя предполагается, что они обладают и структурно-модифицирующим эффектом. Поэтому одним из основных медикаментозных методов лечения ОА остается применение препаратов, эффект которых позволяет быстро уменьшить боль и симптомы воспаления. К препаратам первой линии медикаментозной терапии ОА относят, таким образом, анальгетики (парацетамол) и нестероидные противовоспалительные препараты (НПВП).
Парацетамол имеет как ряд преимуществ (минимальное в сравнении с действием НПВП влияние на желудочно-кишечный тракт (ЖКТ) и сердечно-сосудистую систему), так и ряд ограничений, осложняющих его применение при ОА. С одной стороны, эффективность парацетамола при назначении больным с легкой или умеренной болью была показана довольно давно, но с другой, анальгетическое действие парацетамола уступает таковому НПВП [3, 4]. В связи с этим интересны данные недавно проведенного метаанализа, демонстрирующего, что применение парацетамола у больных ОА ни в отношении аналгезии, ни в отношении функциональной активности, ни в отношении скованности суставов не было клинически значимым [5].
Следует отметить, что безопасность парацетамола в отношении ЖКТ не абсолютна. Применение препарата в дозе 3 г/сут увеличивает независимый относительный риск госпитализаций, обусловленный перфорацией или язвенным кровотечением, в 1,2 раза [5]. Наибольшего эффекта у взрослых парацетамол достигает в дозе 1000 мг, и дальнейшее ее увеличение не усиливает аналгезию, но увеличивает токсичность [6], при этом длительность аналгетического действия составляет всего 3–4 ч, что предопределяет необходимость приема препарата несколько раз в день. Однако терапевтическое окно у препарата очень узкое, и даже небольшая передозировка может привести к развитию побочных эффектов, включая тяжелые поражения печени и почек, особенно если передозировка происходит неоднократно [7–9]. Это обусловлено действием метаболитов парацетамола, образующихся в печени и почках, которые могут накапливаться при его передозировке, вызывая повреждения тканей. Риск поражения печени при приеме парацетамола многократно возрастает при употреблении алкоголя, недостатке глутатиона любого генеза, параллельном приеме ряда препаратов, метаболизируемых при помощи ферментов цитохрома P450 (карбамазепин, барбитураты, фентонин и многие другие). В этих случаях для развития поражения печени может быть достаточно даже минимальных доз препарата.
НПВП больным ОА рекомендуется назначать максимально короткими курсами с целью купирования боли при недостаточной эффективности аналгетиков (парацетамол), наличии экссудативных явлений и скованности в суставах. И выбор в пользу НПВП при назначении симптоматической терапии ОА часто бывает безальтернативным. Как и при ОА, НПВП широко используются при лечении неспецифических болей в спине. Эффективность применения НПВП имеет максимальный уровень доказательности в сравнении с эффективностью других методов терапии.
Лечение боли при ОА должно быть первостепенной задачей не только исходя из необходимости улучшения качества жизни, социальной адаптации, восстановления сниженных функциональных возможностей. Доказано, что хроническая боль является практически при любых заболеваниях фактором, влияющим негативно на продолжительность жизни, в т.ч. и у больных ОА, причем боль при ОА даже более опасна, чем при тяжелых коморбидных заболеваниях [10, 11]. Можно предположить, что адекватное обезболивание может уменьшать такие ассоциации, но при этом прием любого НПВП сопряжен с рисками развития побочных эффектов. Естественно, что принципиально важным является назначение лекарственных препаратов, обеспечивающих достаточный анальгетический и противовоспалительный эффекты при максимально хорошей переносимости, тем более что при ОА индивидуальные различия в эффективности НПВП встречаются довольно часто.
Основное терапевтическое действие НПВП обусловлено блокадой ферментов циклооксигеназы-1 (ЦОГ-1) и циклооксигеназы-2 (ЦОГ-2), что приводит к снижению синтеза простагландинов, индуцирующих развитие воспаления. Механизмы действия всех НПВП схожи, считается, что и эффективность отдельных препаратов сопоставима, тем не менее далеко не все исследования это подтверждают. Например, по данным M. Bianchi, применение нимесулида больными ОА приводило к более выраженному и быстрому аналгетическому эффекту, чем применение целекоксиба [12]. Авторы статьи показали, что причиной этого могут быть эффекты нимесулида, не связанные с ЦОГ. Оказалось, что, как после однократного, так и после повторного приема, под действием нимесулида существенно снижалась концентрация в синовиальной жидкости субстанции Р и интерлейкина-6 (ИЛ-6), а при приеме целекоксиба отмечалось только снижение уровня ИЛ-6 и лишь на 14-й день терапии. Переносимость препаратов не отличалась и была оценена как хорошая. Нимесулид, назначаемый в дозе 100 мг/сут в течение 7-ми дней больным ОА коленных суставов, превосходил по выраженности аналгетического эффекта целекоксиб (200 мг/сут) и рофекоксиб (25 мг/сут) [13]. Опрос, проведенный по завершении исследования, показал, что больные, принимавшие нимесулид и рофекоксиб, согласны были использовать эти препараты и дальше, среди больных, принимавших целекоксиб, желающих продолжать прием было меньше.
Влияние НПВП на хрящ также может быть разным – например, нимесулид, в отличие от индометацина, не оказывает на него повреждающего действия и даже способен ингибировать коллагеназу в синовиальной жидкости [14, 15]. В другом сравнительном исследовании (препарат сравнения – напроксен) была показана способность препарата ингибировать синтез ИЛ-6, фактор некроза опухоли-α и фермент урокиназы, что может быть важными факторами, уменьшающими деградацию хряща [16]. Наконец, нимесулид способен подавлять продукцию супероксидных анионов и оказывать антиоксидантное действие, что является благоприятным фактором, влияющим на хрящ [17].
Короткий курс терапии нимесулидом был эффективнее, чем курс диклофенака при ОА коленных суставов, по данным Q. Gui-Xin et al., при лучшем профиле безопасности нимесулида [18]. Сравнение 10-дневного курса терапии ибупрофеном, принимаемым в дозе 1800 мг/сут, и нимесулидом (200 мг/сут) при болях в нижней части спины продемонстрировало, что прием и того, и другого препарата приводил к купированию боли в большинстве случаев, но прием нимесулида характеризовался лучшим эффектом при более редких случаях развития нежелательных явлений (при применении нимесулида они регистрировались в 1,5 раза реже) [19]. Показано, что при лечении боли в нижней части спины, причиной которой нередко бывает спондилоартроз, с успехом можно применять различные НПВП, но переносимость при приеме препаратов с преимущественным подавлением ЦОГ-2 (нимесулид, коксибы) намного лучше, а частота нежелательных явлений – ниже, чем у неселективных к ЦОГ-2 препаратов [20].
Но именно небезупречная безопасность НПВП является основной проблемой, возникающей при их назначении. Результаты небольших рафинированных сравнительных исследований в отношении рисков развития нежелательных явлений при приеме НПВП не всегда могут отражать реальную картину, потому особый интерес представляет анализ крупных баз данных. Одно из наиболее значительных подобных исследований было проведено на основании анализа огромной базы данных (около 1,2 млн человек), включавшей всех жителей одного из районов Италии [21]. В исследуемую группу включали всех жителей, постоянно проживавших в районе не менее 1 года, которым были назначены различные НПВП в период с 2001 по 2008 г. включительно. Принципиально важно, что из исследования не исключали какие-либо группы больных. Каждого участника наблюдали от начала приема НПВП до наступления конечной точки – госпитализации по причине развития осложнений со стороны верхних отделов ЖКТ. В анализ, проведенный методом «случай – контроль», было включено 2735 пациентов с осложнениями со стороны верхних отделов ЖКТ (в 86,9% случаев это было кровотечение) и 27 011 пациентов, составивших группу контроля, в возрасте 20–89 лет. Проведение логистической регрессии показало, что при применении всего трех препаратов (нимесулида, целекоксиба и эторикоксиба) относительный риск развития осложнений был меньше (2,0): например, относительный риск язвенного кровотечения при применении нимесулида был в 2 раза меньше, чем при приеме диклофенака и ибупрофена.
Еще одним потенциально опасным явлением, связанным с приемом НПВП, является поражения печени. Данные статистики свидетельствуют, что подобные осложнения развиваются крайне редко, но, учитывая, что они могут приводить к внутрипеченочному холестазу и острой почечной недостаточности, заслуживают отдельного обсуждения. Наиболее крупное эпидемиологическое исследование, основанное на сравнительной оценке рисков гепатотоксичности отдельных НПВП показало, что суммарный относительный риск развития гепатопатий был равен 1,4, а индивидуальная частота разнилась довольно широко: для нимесулида она составила 35,3 на 100 тыс. человеко-лет, а для ибупрофена – 44,6 [22]. По другим данным поражения печени развиваются не чаще, чем у 1 из 10 тыс. больных, принимающих нимесулид [23]. Не меняет отношения к гепатоксичности нимесулида и подробный анализ последних данных, опубликованных в обзоре, посвященном 25-летию нимесулида, где приводятся факты, подтверждающие, что гепатотоксичность препарата не отличается от таковой у других НПВП [24]. Интересно, что и попытки замены нимесулида на другие НПВП не только не способствовали снижению риска гепатотоксичности, но и привели к выраженному росту случаев желудочно-кишечных кровотечений [25].
Комбинированная терапия боли при ОА может включать также физиолечение, в т.ч. местное применение тепловых и холодовых процедур, чрескожную стимуляцию, санаторно-курортное лечение, лечебную физкультуру, локальную терапию (мази и гели с НПВП, используемые коротким курсом, «отвлекающие» мази, например, с капсаицином). Большое значение может иметь динамическое наблюдение врачом больного. Иногда, при превалировании сопутствующих мышечно-тонических синдромов, применяют миорелаксанты центрального действия, при наличии стойкого синовита возможно (при отсутствии противопоказаний) использование локальных инъекций глюкокортикоидов.
Остается надеяться, что возможности терапии боли при ОА, включая НПВП нимесулид (Найз®), физиотерапию, будут расширяться, и течение заболевания без лечения, а также необходимость проводить хирургическое вмешательство останутся в прошлом.
_575.gif)
.gif)