что такое серозно геморрагическая жидкость
Геморрагический плеврит ( Серозно-геморрагический плеврит )
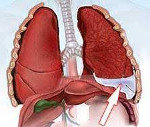
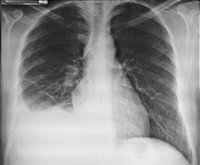
Геморрагический плеврит – это патологическое состояние, характеризующееся наличием плеврального выпота с большим количеством эритроцитов. Проявляется сухим рефлекторным кашлем, одышкой, ощущением тяжести в груди. К основным диагностическим методам относятся рентгенография, КТ органов грудной клетки, пункция плевральной полости с последующим исследованием экссудата, торакоскопия и биопсия плевры. В лечебных целях выполняется эвакуация выпота, осуществляется терапия основной патологии. При необходимости консервативное лечение дополняется хирургическим.
МКБ-10
Общие сведения
Геморрагический (серозно-геморрагический) плеврит развивается как результат воспалительного, травматического или опухолевого поражения плевры. От гемоторакса – скопления крови между листками плевры – отличается меньшим количеством эритроцитов в единице объёма. Чаще всего примесь эритроцитов в экссудате встречается при онкологической патологии органов дыхания, травме грудной клетки. Геморрагический выпот определяется приблизительно у 20% пациентов, страдающих раком лёгких, у 30% больных мезотелиомой, в 40-50% случаев после травмы груди. Плеврит осложняет 30-50% всех случаев тромбоэмболии лёгочной артерии. У большинства пациентов экссудат кровянистый. В детском возрасте геморрагический плеврит наблюдается редко.
Причины
Экссудативный плеврит является преимущественно вторичной патологией, осложняет течение около 50 заболеваний различных органов и систем. Геморрагический характер плеврального выпота наблюдается у пациентов с болезнями инфекционной и неинфекционной этиологии. К основным причинам возникновения данного состояния относятся:
К редким причинам возникновения данной патологии относятся гемофилия, тромбоцитопеническая пурпура и другие геморрагические диатезы, а также системные заболевания соединительной ткани. В медицинских статьях по пульмонологии описаны единичные случаи обнаружения плеврального содержимого геморрагического характера у лиц, страдающих паразитарными заболеваниями (парагонимоз) и авитаминозами (цинга).
Патогенез
Механизм образования патологического содержимого в плевральной полости зависит от повреждающего плевру агента. При бактериальных или вирусных инфекциях микроорганизмы проникают в орган лимфо-, гематогенным или контактным путями, при инфаркте лёгкого асептическое воспаление распространяется с лёгочной паренхимы, при новообразованиях плевра повреждается опухолевыми клетками и продуктами распада. Травматический плеврит обусловлен реакцией плевральных листков на попадание в их полость воздуха или крови.
Плевра отвечает на действие патологического агента воспалительной реакцией. Воспаление приводит к повышению проницаемости, ломкости капилляров листков висцеральной и париетальной плевры. Увеличивается продукция плевральной жидкости. В экссудат пропотевают эритроциты. Травматизация или опухолевое поражение самого органа и регионарных лимфатических узлов становится причиной нарушения кровообращения и лимфооттока. Замедляется обратное всасывание выпота, он накапливается в полостях плевры. При значительном количестве экссудата лёгкое коллабируется, средостение смещается в здоровую сторону. Нарушается гемодинамика.
Симптомы геморрагического плеврита
Клиническая картина патологии во многом зависит от первопричины её возникновения. Инфекционный плеврит манифестирует интенсивной болью в груди на стороне поражения, резко усиливающейся при глубоком вдохе, кашле, движении. Процесс сопровождается повышением температуры до фебрильных значений, ознобами. Такое же начало характерно для травматического плеврита, возникающего через несколько дней после травмы. По мере накопления плеврального экссудата исчезают боли, вместо них появляется ощущение тяжести, присоединяется сухой кашель, затруднение дыхания.
Выраженность одышки варьируется от незначительной, появляющейся при физическом усилии, до постоянной, присутствующей в состоянии покоя. Из-за смещения средостения страдает работа кардиоваскулярной системы. Возникает тахикардия, перебои сердечного ритма, гипотония. Накопление жидкости при опухолевом процессе протекает незаметно. Клиническая симптоматика нарастает медленно и постепенно. Болевой синдром выражен слабо или отсутствует. Признаки плеврита появляются при скоплении большого объёма экссудата. На первое место часто выступают симптомы основного заболевания.
Осложнения
Небольшой по объёму геморрагический выпот может резорбироваться самостоятельно в сроки от двух недель до нескольких месяцев. Самым часто встречающимся осложнением длительно текущего процесса являются плевральные сращения. Иногда развивается полная облитерация плевральной полости. Нарушается дыхательная экскурсия лёгкого, что приводит к появлению респираторной недостаточности. Геморрагический экссудат инфекционного или травматического генеза в 2-10% случаев нагнаивается. Возникает эмпиема плевры. Летальность при этом осложнении достигает 15%.
Диагностика
Пациента с подозрением на плеврит осматривает врач-пульмонолог. В целях диагностики первопричины патологического состояния к обследованию могут привлекаться онкологи, фтизиатры и другие специалисты. При осмотре обнаруживается асимметрия грудной клетки, отставание одной её половины в акте дыхания. Для массивного выпота характерен симптом Винтриха – утолщение кожной складки в проекции скопления плеврального содержимого.
Наличие экссудата в полости плевры определяется физикальными методами в том случае, если его количество превышает 300-500 мл. Над плевральным выпотом ослаблено голосовое дрожание, резко укорочен перкуторный звук. При аускультации этой зоны дыхательные шумы отсутствуют. Выше области укорочения перкуторного звука выслушивается бронхиальное дыхание. Окончательное подтверждение наличия плеврального выпота и установление его характера осуществляется с помощью:
Лечение геморрагического плеврита
В лечении патологического процесса используются многочисленные консервативные методики и разнообразные хирургические вмешательства. Выбор тактики ведения пациента зависит от характера первичного заболевания, выраженности клинической симптоматики, наличия осложнений и противопоказаний. В ряде случаев терапия основной патологии приводит к исчезновению симптомов, резорбции плеврального выпота.
Консервативная терапия
Геморрагический плеврит с клиническими проявлениями является показанием к назначению постельного или полупостельного режима, обильного питья, легкоусваиваемого питания. Лечение обычно осуществляется в стационарных условиях. Применение лекарственных средств определяется течением заболевания, которое привело к возникновению плеврита. Группы фармакологических препаратов и лечебных мероприятий по своему действию делятся на:
Хирургическое лечение
Основными показаниями для оперативного вмешательства являются нагноительные осложнения и «ненасытный» плеврит. Последний характерен для мезотелиомы, раковых метастазов в плевру, проявляется стремительным накоплением геморрагического экссудата после его эвакуации. Лечение эмпиемы осуществляется путём дренирования плевральной полости до излечения пациента. При неэффективности консервативной терапии канцероматозного плеврита выполняется плевродез – склеивание плевральных листков химическими веществами или плеврэктомия, в качестве паллиативной меры устанавливается постоянный интраплевральный дренаж.
Прогноз и профилактика
Прогноз определяется течением основного заболевания. Небольшое количество геморрагического выпота подвергается обратному всасыванию с образованием плевральных шварт. Своевременное лечение плеврита инфекционного генеза приводит к полному выздоровлению. При ТЭЛА и другой кардиоваскулярной патологии прогноз серьёзный. Появление кровянистого плеврального экссудата при онкологических заболеваниях считается прогностически неблагоприятным, но современные методы терапии позволяют продлить жизнь больного, улучшить её качество. Профилактические меры сводятся к лечению основной патологии.
Исследование выпотных жидкостей. Клиническое значение.
Исследование выпотных жидкостей актуально в современном мире лабораторной диагностики и имеет высокую значимость в определении патологических состояний. Полученные данные исследования выпотных жидкостей позволяют врачу получить информацию о патогенезе образования выпота и корректно организовать лечение и спрогнозировать динамику развития заболевания.
Исследование выпотных жидкостей. Клиническое значение.
Выпотные жидкости – жидкости, образующиеся и накапливающиеся в серозных полостях организма (плевральной, брюшной, полости перикарда, а также в синовиальных полостях суставов). Получают выпотные жидкости для исследования путём пункции. Плевральную пункцию делают в восьмом или девятом межреберье, брюшную – по средней линии живота.
Несмотря на достижения в области визуализации грудной клетки и других методов инструментальной диагностики, различение экссудатов и транссудатов остается важным первым шагом в оценке пациентов с плевральными выпотами. В будущем усовершенствованные подходы к исследованию плевральной жидкости позволят выявлять конкретные заболевания и уменьшать важность классификации выпотов как транссудатов и экссудатов.
Необходимо разграничивать понятия транссудата от экссудата:
Транссудаты возникают в результате фильтрации сыворотки через плевральные мембраны и являются результатом дисбаланса гидростатического или осмотического давления. Большинство транссудатов возникает при клинически очевидных состояниях, таких как:
Наличие транссудата обычно позволяет клиницистам лечить основное заболевание и наблюдать за выпотом для отслеживания динамики развития заболевания.
Экссудаты – жидкости воспалительного происхождения (при плевритах, перитонитах, перикардитах, артритах). Экссудативный выпот развивается вследствие воспалительных или злокачественных заболеваний, таких как пневмония, онкологические заболевания или туберкулез, которые увеличивают проницаемость капилляров и позволяют соединениям с большим молекулярным весом проникать в плевральную полость. Обнаружение экссудата часто требует дополнительного тестирования, которое может быть инвазивным. Поскольку классификация плевральной жидкости как экссудата или транссудата имеет важное значение для лечения пациентов, клиницистам требуется четкое понимание диагностической эффективности имеющихся лабораторных тестов и стратегий тестирования, используемых для классификации плевральной жидкости.
Лабораторные методики исследования выпотов.
Оценка физико-химических свойств:
Прозрачность
Транссудаты и серозные экссудаты прозрачные
Геморрагические, гнойные, хилезные экссудаты — мутные.
Проба Ривальта
Экссудат содержит серомуцин, который дает положительную пробу Ривальта.
Микроскопическое исследование высотной жидкости:
Микроскопию выпотных жидкостей проводят после центрифугирования и приготовления препаратов из осадка. Микроскопическое исследование следует производить в нативных и окрашенных препаратах. В препарате можно обнаружить лейкоциты, эритроциты, клетки мезотелия, опухолевые клетки, кристаллы холестерина, нейтрофилы, лимфоциты, эозинофилы, плазматические клетки, гистиоциты, макрофаги, клетки мезотелия а также клетки злокачественных опухолей.
Научная электронная библиотека
Сологуб Т. В., Романцова М. Г., Кремень Н. В., Александрова Л. М., Аникина О. В., Суханов Д. С., Коваленко А. Л., Петров А. Ю., Ледванов М. Ю., Стукова Н. Ю., Чеснокова Н. П., Бизенкова М. Н., Понукалина Е. В., Невважай Т. А.,
3.6. Экссудация. Общая характеристика и механизмы развития
В зависимости от особенностей клеточного и биохимического состава различают следующие виды экссудата:
Серозный экссудат образуется при воспалении серозных оболочек (серозный плеврит, перикардит, перитонит и др.), а также при ожоговом, вирусном или аллергическом воспалении. Серозный экссудат легко рассасывается и не оставляет никаких следов или образует незначительное утолщение серозных оболочек.
Прогноз фибринозного воспаления в значительной мере определяется локализацией и глубиной процесса.
На серозных оболочках массы фибрина частично подвергаются аутолизу, а большая часть организуется, то есть прорастает соединительной тканью, в связи с чем могут образовываться спайки и рубцы, нарушающие функцию органа.
Гнойное воспаление может возникать в любой ткани, органе, серозных полостях, коже и протекать в виде абсцесса или флегмоны. Скопление гнойного экссудата в полостях организма носит название эмпиемы.
Этиологические факторы гнойного воспаления разнообразны, оно может быть вызвано стафилококками, стрептококками, менингококками, гонококками, микобактериями, патогенными грибками и др.
5. Гнилостный экссудат (ихорозный) развивается при участии в воспалительном процессе патогенных анаэробов. Воспаленные ткани подвергаются гнилостному разложению с образованием дурно пахнущих газов и грязно-зеленого экссудата.
6. Геморрагический экссудат характеризуется содержанием различного количества эритроцитов, вследствие чего он приобретает розоватую или красную окраску.
Экссудация служит одним из признаков венозной гиперемии и в то же время определяет характер тканевых изменений в очаге воспаления.
Большое значение в развитии экссудации принадлежит осмотическому и онкотическому факторам.
Кроме этого, в самой ткани под влиянием лизосомальных протеаз происходит распад сложных белковых макромолекул, что также способствует повышению онкотического давления в тканях очага воспаления.
Фактором, способствующим экссудации, является увеличение гидростатического давления в микроциркуляторном русле и площади фильтрации жидкой части крови.
Биологический смысл экссудации как компонента воспаления заключается в том, что вместе с экссудатом в альтерированную ткань выходят иммуноглобулины, активные компоненты комплемента, ферменты плазмы, кинины, биологически активные вещества, которые освобождаются активированными клетками крови. Поступая в очаг воспаления, они совместно с тканевыми медиаторами, обеспечивают опсонизацию патогенного агента, стимулируют фагоцитирующие клетки, участвуют в процессах килинга и лизиса микроорганизмов, обеспечивают очищение раны и последующую репарацию ткани. В экссудате обнаруживаются продукты обмена веществ, токсины, токсические факторы патогенности, вышедшие из тока крови, т.е. фокус очага воспаления выполняет дренажную функцию. За счет экссудата происходит сначала замедление кровотока в очаге воспаления, а затем и полная остановка кровотока при сдавлении капилляров, венул и лимфатических сосудов. Последнее приводит к локализации процесса и препятствует диссеминации инфекции и развитию септического состояния.
В то же время скопление экссудата может приводить к развитию сильных болевых ощущений, вследствие сдавления нервных окончаний и проводников. В результате сдавления паренхиматозных клеток и нарушения в них микроциркуляции могут возникнуть расстройства функций различных органов. При организации экссудата могут образовываться спайки, вызывающие смещение, деформацию и патологию функций различных структур. В ряде случаев течение воспалительного процесса осложняется поступлением экссудата в альвеолы, в полости тела и приводит к развитию отека легких, плеврита, перитонита, перикардита.
Что такое серозно геморрагическая жидкость
Местные отеки могут возникать в результате экссудации или транссудации.
Жидкость невоспалительной природы именуется транссудат, а воспалительной природы – экссудат.
В патогенезе местных отеков (в зоне воспаления, тромбоза, эмболии, сдавления венозных или лимфатических сосудов) ведущая роль отводится изменению соотношения гидродинамического и коллоидно-осмотического давления в артериальном и венозном сегментах капилляров, повышению проницаемости сосудистой стенки и возрастанию гидрофильности тканей.
Этиология и патогенез экссудации
Экссудация – выход жидкой части крови вместе с форменными элементами в зону альтерации при развитии воспалительного процесса.
В зависимости от особенностей этиологического фактора, степени повреждения сосудистой стенки и, соответственно, состава отечной жидкости выделяют следующие виды экссудатов: серозный, фибринозный, гнойный, гнилостный, геморрагический. Экссудат – высокоактивная биологическая жидкость (особенно гнойный, гнилостный и геморрагический), содержащая большое количество лизосомальных ферментов, лизоцима, лактоферрина, фагоцитирующих лейкоцитов, продуктов их жировой дегенерации. Последнее определяет двоякую роль экссудации в организме: с одной стороны, деградирующий эффект на клеточные элементы и межклеточное вещество соединительной ткани, а с другой, – защитная функция в связи с наличием иммуноглобулинов и ряда факторов неспецифической резистентности. Касаясь механизмов развития экссудации следует остановиться на закономерностях развития воспаления.
Как известно, воспаление – типовой патологический процесс, возникающий под влиянием различных патогенных факторов инфекционной и неинфекционной природы и характеризующийся развитием типового комплекса сосудистых и тканевых изменений. Сосудистые изменения проявляются в зоне острого воспаления в виде последовательной смены спазма сосудов, артериальной и венозной гиперемией с развитием престаза и стаза.
Тканевые изменения включают стадии альтерации, экссудации и пролиферации. Следует отметить, что стадия экссудации формируется на фазе венозной гиперемии, когда в зоне воспаления накапливаются чрезмерно-высокие концентрации вазоактивных медиаторов альтерации. Как известно, медиаторы альтерации имеют гуморальное происхождение (активированные фракции компллемента, системы свертывания крови, фибринолиза, калликреин-кининовой системы), а также образуются в клетках различной морфофункциональной организации. Медиаторы клеточного происхождения играют важную роль в повышении проницаемости сосудистой стенки, активации ее тромбогенных эффектов. Среди вазоактивных медиаторов клеточного происхождения следует отметить такие, как нейропептиды, гистамин, серотонин, лейкотриены, простагландины, свободные радикалы, а также ряд провоспалительных цитокинов, лизосомальных ферментов. Важная роль в повышении проницаемости сосудистой стенки отводится развитию метаболического ацидоза. В связи с этим очевидно, что ведущим патогенетическим фактором экссудации является мембраногенный фактор, который характеризуется существенным повышением проницаемости стенок сосудов микроциркуляторного русла для воды, мелко- и крупномолекулярных веществ. Если в норме через стенку капилляров проходят молекулы диаметром менее 5 нм, то при воспалении начинают проходить более крупные частицы. Причины повышения проницаемости сосудистых стенок: ацидоз, активация гидролитических ферментов, перерастяжение стенок сосуда, изменение формы клеток эндотелия. Повышение проницаемости сосудов ( венул и капилляров ) зоне воспаления развивается в результате воздействия медиаторов воспаления и в ряде случаев самого воспалительного агента.
Касаясь молекулярно-клеточных механизмов развития экссудации под влиянием ряда медиаторов альтерации, в частности гистамина, следует отметить, что источником этого биологически активного соединения являются тучные клетки и базофилы крови.
Гистамин. Образуется из аминокислоты гистидина под влиянием фермента гистидиндекарбоксилазы, депонируется в гранулах лаброцитов и базофилов в комплексе с гепарином, ФАТ и другими соединениями. Освобождение гистамина из клеток может возникать в результате физиологического экзоцитоза или при повреждении и распаде клеток. В качестве либераторов гистамина могут выступать бактериальные, вирусные патогенные факторы, разнообразные антигены, С3 и С5 фракции комплемента, катионные белки полиморфноядерных лейкоцитов, химические, физические, термические воздействия, индуцирующие процесс альтерации.
Высвобождение гистамина из клеток – одна из первых реакций ткани на повреждение наряду с интенсификацией выделения сенсорных нейропептидов (субстанция Р, пептид гена, родственный кальцитонину). Эффект этого медиатора на сосудистую стенку в зоне острого воспаления реализуется главным образом через Н1-рецепторы в виде вазодилатации и повышения проницаемости. Кроме того, в очаге острого воспаления гистамин вызывает боль, повышает адгезивные свойства эндотелия сосудов, способствует эмиграции лейкоцитов. Вследствие быстрого разрушения гистамина под влиянием фермента гистаминазы биологические эффекты его на микроциркуляцию кратковременны и в последующем пролонгируются другими медиаторами воспаления.
Из гранул лаброцитов и базофилов освобождаются в зону альтерации хемотаксический фактор эозинофилов (ФХЭ), хемотаксический фактор нейтрофилов (ФХН), фактор активации тромбоцитов (ФАТ), нейтральные протеазы и др.
Другой вазоактивный медиатор воспаления – серотонин представляет собой производное аминокислоты триптофана, значительная часть серотонина депонируется в тромбоцитах. Однако серотонин обнаружен и в других клетках, в частности в нейронах мозга, лаброцитах, базофилах, энтерохромаффинных клетках пищеварительного тракта. Под влиянием различных активаторов – коллагена, тромбина, АДФ, ФАТ – происходит секреция серотонина из тромбоцитов и хромаффинных клеток, одновременно из тучных клеток освобождается гистамин. В умеренных концентрациях серотонин вызывает расширение артериол, сокращение миоцитов в стенках венул и венозный застой. В высоких концентрациях серотонин обусловливает спазм артериол, а в случае их повреждения способствует остановке кровотечения.
Важное значение в развитии воспаления имеют медиаторы воспаления, образуемые полиморфноядерными лейкоцитами. Так, катионные белки, фактор активации тромбоцитов вызывают дегрануляцию тучных клеток и тем самым повышают проницаемость микроциркуляторных сосудов. Способствуют повышению проницаемости также активные метаболиты кислорода (супероксид радикал, синглетный кислород, перекись водорода).
При воспалении в результате повреждения эндотелия сосудов происходит активация фактора Хагемана, который запускает кининогенез и идет превращение прекалликреина в калликреин. Активация калликреина приводит к образованию брадикинина и каллидина. Кинины расширяют кровеносные сосуды и повышают их прницаемость, причем в большей степени, чем гистамин.
Важная роль в повышении проницаемости сосудистой стенки отводится простагландинам и эйкозаноидам.
Механизмы реализации мембраногенного фактора:
1) облегчение фильтрации воды из крови в интерстициальное пространство. Этот механизм может быть сбалансирован повышением реабсорбции воды в посткапиллярах в связи с истончением их стенок;
2) увеличение выхода молекул белка из плазмы крови в межклеточную жидкость ведёт к включению онкотического фактора. Такой механизм лежит в основе развития отёка при воспалении, местных аллергических реакциях, укусах насекомых и змей.
Возрастание проницаемости при воспалении, как правило, является двухфазным и включает немедленную (раннюю) и замедленную (позднюю) фазы.
Первая фаза – ранняя, немедленная, развивается вслед за действием альтерирующего агента и завершается в среднем в течение 15-30 мин. Эта фаза обусловлена в первую очередь действием гистамина, а также лейкотриена Е4, серотонина, брадикинина на венулы диаметром не более чем 100 мкм. Проницаемость капилляров при этом практически не меняется. Повышение проницаемости на территории венул связано с сокращением эндотелиоцитов сосуда, округлением клеток, образованием межэндотелиальных щелей, через которые происходит выход жидкой части крови и клеток.
Вторая фаза – поздняя, замедленная, развивается постепенно, достигает максимума через 4-6 ч, когда происходит фиксация лейкоцитов к эндотелию сосудов и длится иногда до 100 часов в зависимости от вида и интенсивности воспаления. Для этой фазы характерно стойкое увеличение проницаемости сосудов (артериол, капилляров, венул), обусловленное главным образом продуктами, освобождаемыми лейкоцитами – лизосомальными ферментами, активными метаболитами кислорода, простагландинами, комплексом лейкотриенов, водородными ионами. Кроме того при воспалении возможно повышение проницаемости в результате структурных изменений сосудистой стенки, вызванное лизосомальными протеазами, активацией процессов перекисного окисления липидов.
В механизмах развития экссудации, помимо увеличения проницаемости сосудов, определенная роль принадлежит пиноцитозу – процессу активного захватывания и проведения через эндотелиальную стенку мельчайших капелек плазмы крови. В связи с этим экссудацию можно рассматривать как своеобразный микросекреторный процесс, обеспечиваемый активными транспортными механизмами. Активация пиноцитоза в эндотелии микрососудов в очаге воспаления предшествует увеличению проницаемости сосудистой стенки за счет сокращения эндотелиоцитов.
Нарушение проницаемости сосудистой стенки лежит в основе развития отеков в зоне воспаления в случаях развития декомпенсированного метаболического ацидоза, а также неврогенных отеков (при поражениях задних корешков и столбов спинного мозга).
Проницаемость сосудистой стенки может повышаться под влиянием токсических соединений бактериальной природы (токсины дифтерийный, сибиреязвенный и др.), при действии экзогенных химических веществ (хлор, фосген и др.), при действии некоторых ядов различных насекомых и пресмыкающихся (комары, пчелы, шершни, осы, змеи и др.). Под влиянием воздействия этих агентов, помимо повышения проницаемости сосудистой стенки, происходит нарушение тканевого обмена и образование продуктов, усиливающих набухание коллоидов и повышающих осмотическую концентрацию тканевой жидкости. Возникающие при этом отеки называются токсическими.
Таким образом, одним из ведущих патогенетических факторов развития местного отека является мембраногенный фактор, связанный с повышением проницаемости сосудистой стенки.
Как отмечено ранее, механизмами реализации мембранногенного фактора развития отека являются облегчение фильтрации жидкости в микрососудах, избыточный транспорт белков, ионов из микрососудов в интерстициальную жидкость. Осмотическому и онкотическому факторам принадлежит большое значение в развитии воспалительного отека.
Гиперосмия тканей в очаге воспаления обусловлена повышением в них концентрации осмоактивных частиц – ионов, солей, органических соединений с низкой молекулярной массой. К факторам, вызывающим гиперосмию, относятся усиленная диссоциация солей вследствие ацидоза тканей (лактатный ацидоз типа А), выход из клеток калия и сопутствующих ему макромолекулярных анионов, повышенный распад сложных органических соединений на менее сложные, мелкодисперсные, а также сдавление и тромбоз лимфатических сосудов, препятствующие выведению осмолей из очага воспаления.
Одновременно с увеличением осмотического давления наблюдается увеличение и онкотического давления в тканях очага воспаления, в то время как в крови онкотическое давление снижается. Последнее обусловлено выходом из сосудов в ткани, в первую очередь, мелкодисперсных белков – альбуминов, а по мере повышения проницаемости сосуда – глобулинов и фибриногена. Кроме этого, в самой ткани под влиянием лизосомальных протеаз происходит распад сложных белковых макромолекул на более мелкие, что также способствует повышению онкотического давления в тканях очага воспаления. Это вызывает снижение эффективной онкотической всасывающей силы плазмы крови.
Возрастание гидростатического давления в фазу венозной гиперемии имеет место в связи с развитием тромбоза, эмболии, престаза, приводящих к нарушению оттока венозной крови. В то же время экссудат при воспалении вызывает сдавление венозных и лимфатических сосудов и усугубляет нарушение оттока крови. При этом площадь и интенсивность пропотевания плазмы крови на территории сосудов микроциркуляторного русла увеличивается.
Таким образом, при возрастании гидростатического давления в сосудах микроциркуляторного русла (при воспалении, тромбозах, эмболии, беременности и др.) возникают условия для развития отеков.
В развитии местного отека также играет роль снижение внутрисосудистого коллоидно-осмотического давления за счет локальной гипопротеинемии связанной с повышением проницаемости сосудистой стенки в зоне альтерации.
Гиперонкия, гиперосмия тканей в зоне альтерации, повышение их гидрофильности в связи с плазмопотерей в зону альтерации в комплексе с белками, а также развитием цитолиза, выходом внутриклеточных электролитов и белков также способствует развитию отека. Происходит уменьшение резорбции жидкости из интерстиция в посткапиллярах и венулах.
Впервые экспериментальные доказательства значения онкотического фактора в развитии отеков были получены Э.Старлингом (1896).
В ряде случаев в развитии местных отеков лежит нарушение лимфодинамики. Лимфогенный (лимфатический) фактор развития местного отека характеризуется затруднением оттока лимфы от тканей вследствие либо механического препятствия, либо избыточного образования лимфы. Причинами включения лимфогенного фактора являются:
1) врождённая гипоплазия лимфатических сосудов и узлов;
2) сдавление лимфатических сосудов (например, опухолью, рубцом);
3) эмболия лимфатических сосудов (например, клетками опухоли, паразитами);
4) опухоль лимфоузла, а также метастазы в лимфоузел опухолей других органов;
5) значительное увеличение образования лимфы в тканях, приводящее к перегрузке лимфатических сосудов и замедлению оттока от тканей.
В зависимости от особенностей этиологического фактора, степени повреждения сосудистой стенки и, соответственно, состава отечной жидкости выделяют следующие виды экссудатов: серозный, фибринозный, гнойный, гнилостный, геморрагический.
Механизмы развития, характеристика транссудации
Транссудация – выход жидкости из сосудистого русла в неповрежденную ткань; имеет место в условиях нормы, обеспечивает обмен между кровью и тканями электролитами, трофическими субстанциями, газообразными соединениями, продуктами метаболизма.
В связи с тем, что транссудация жидкости в ткани в условиях нормы и при ряде форм патологии происходит через неповрежденную сосудистую стенку или на фоне незначительного возрастания ее проницаемости, транссудат по химическому составу и биологической активности значительно отличается от экссудата. Так, удельная плотность транссудата ниже, чем экссудата. Это обусловлено высоким содержанием белка и форменных элементов в экссудате. Транссудат содержит белка менее 30 г/л, и общее количество клеток в нем, как правило, не превышает 100, в то время как в экссудате содержание белка превышает 30 г/л, а клеточных элементов более 3000. Экссудат содержит значительное количество иммуноглобулинов, факторов свертывания крови, лейкоцитов, эритроцитов, медиаторов воспаления, в связи с чем является биологически активной жидкостью, обеспечивающей одномоментное развитие как защитно-приспособительных реакций в зоне воспаления, так и дезорганизации, деградации структур клеток и межклеточного вещества.
Резюмируя вышеизложенное, следует заключить доминирующую роль мембраногенного фактора в инициации местных отеков воспалительного генеза с последующим присоединением онкотического фактора и возрастанием гидродинамического давления в зоне тромбоза и эмболии сосудов при венозной гиперемии.
Активация процессов транссудации в нормальную по структуре и функции не поврежденную ткань связана с инициирующим воздействием возрастания гидростатического давления в сосудах микроциркуляторного русла и увеличением площади трассудации, нарушением обратного траспорта тканевой жидкости в систему микроциркуляции.
Чрезмерная транссудация лежит в основе ряда местных и системных нарушений распределения внутри- и внесосудистой внутриклеточной и внеклеточной жидкости.
Таким образом, при возрастании гидростатического давления в сосудах микроциркуляторного русла (при тромбозах, эмболии, беременности) возникают усиление транссудации, развитие застойных отеков.