что такое секвенирование генома человека
Полное секвенирование генома
Полезная информация для каждого
Полное секвенирование генома
Два одинаковых человека могут иметь абсолютно разные наследственные предпосылки к разным заболеваниям и по-разному реагировать на одни и те же лекарства.
Что такое секвенирование?
Полное секвенирование генома (от лат. sequentum — последовательность) — исследование всей вашей наследственной информации, хранящейся в ДНК. В каждой клетке вашего тела содержится набор хромосом, кодирование которых определяет всю вашу жизнь — какой у вас пол и цвет глаз, к каким заболеваниям вы более предрасположены и к каким менее, какие лекарственные препараты на вас действуют, а какие нет.
Раньше для того, чтобы выявить определенное наследственное заболевание, врачи проводили генетические тесты. Такие тесты позволяли за один раз исследовать один ген, определяющий вероятность развития того или иного заболевания.
Весь спектр заболеваний
Что вам дает секвенирование?
Полученную при секвенировании информацию можно использовать не только сейчас, но и в будущем, ведь база данных, в которой генная информация сопоставляется с определенными заболеваниями или эффективностью действия тех или иных лекарственных средств, постоянно пополняется за счет непрекращающихся исследований.
Секвенирование позволяет сделать выводы о том, какие болезни вы уже перенесли, какие заболевания вам грозят в будущем и какие наследственные патологии смогли «перекочевать» от вас к вашим детям, но еще не проявили себя.
Прецизионная медицина или персонализированная медицина — это медицина завтрашнего дня, когда выбор того или иного лекарственного препарата, постановка того или иного диагноза будут диктоваться анализом вашей наследственной информации. И основа такого анализа — данные секвенирования генома, которые вы можете получить уже сегодня.
Проведя полное секвенирование всего один раз, вы получите данные, которые специалист сможет использовать для диагностики уже имеющихся или пока спящих заболеваний. Сравнивая эти данные с уже имеющимся научным материалом, который постоянно накапливается в международных базах данных, можно определить риск развития онкологических и сердечно-сосудистых заболеваний, остеопороза, любых других патологий.
Этим занимается наука фармакогеномика — направление фармакологии, которое изучает возможности «прицельного» применения лекарственных веществ на основе экспрессии разных генов. Используя содержащуюся в геноме информацию, можно прописывать вам лекарственные препараты, которые окажутся по-настоящему эффективными, более того, можно корректировать их дозировку.
Первое полное секвенирование генома в 2003 году обошлось мировой науке почти в три миллиарда долларов. Через несколько лет первая в мире коммерческая система полного секвенирования делала один анализ за 300 тысяч долларов. Сегодня у вас появилась возможность пройти полное секвенирование по цене билета на концерт.
Секвенирование генома. С чего все начиналось?
Предпосылками для формирования генетики как самостоятельной научной области послужило открытие законов Менделя. В дальнейшем в XX веке было сделано четыре открытия, положивших начало развитию генетики [1]:
• установлены клеточные основы наследственности — хромосомы;
• определена молекулярная основа наследственности — двойная спираль ДНК;
• открыта информационная основа наследственности, а также биологический механизм, с помощью которого клетки считывают информацию, содержащуюся в генах;
• изобретены технологии клонирования и секвенирования рекомбинантных ДНК.
Последняя четверть прошлого века была отмечена неустанным стремлением расшифровать сначала гены, а затем и целые геномы [2].
Первая рабочая концепция секвенирования — метод Сэнгера, также известный как метод обрыва цепи, — была предложена в 1977 году. За это открытие Фредерик Сэнгер был удостоен Нобелевской премии по химии в 1980 году. Этот метод секвенирования применялся в течение 40 лет, а его усовершенствование и коммерциализация привели к широкому распространению секвенирования [2].
Описание метода Сэнгера
Секвенирование Сэнгера — метод, при котором используются олигонуклеотидные праймеры для поиска определенных областей ДНК. Этот процесс начинается с деспирализации двухцепочечной ДНК [5]. Одна цепочка ДНК является матрицей для синтеза комплементарной цепочки при помощи фермента ДНК-полимеразы. Реакцию с одной и той же цепочкой проводят в четырех разных пробирках, каждая из которых содержит [3]:
— праймер;
— четыре дезоксинуклеотида (дезоксиаденозинтрифосфат, дезоксигуанозинтрифосфат, дезоксицитидинтрифосфат и тимидинтрифосфат);
— небольшое количество (1 к 100) одного из радиоактивно меченных дезоксинуклеотидов (для визуализации продуктов реакции).
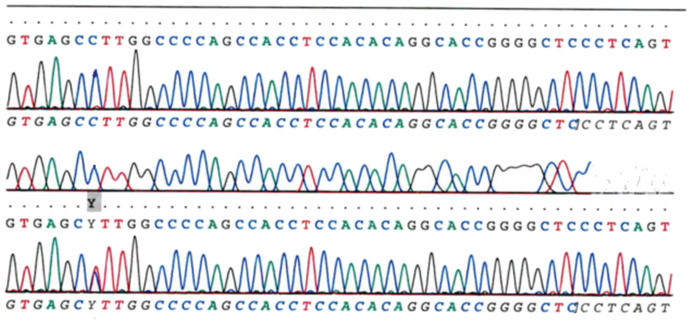
В каждой пробирке образуется набор фрагментов ДНК разной длины, заканчивающихся одним и тем же нуклеотидом. После завершения реакции содержимое пробирок разделяют электрофорезом в полиакриламидном геле в денатурирующих условиях и затем проводят авторадиографию гелей. Каждый дезоксинуклеотид отмечен флуоресцентным маркером: A — зеленый цвет, T — красный, G — черный и C — синий. Лазер в автомате, используемый для считывания последовательности, фиксирует интенсивность флуоресценции. Когда в последовательности встречается гетерозиготный вариант, локусы захватываются двумя флуоресцентными красителями одинаковой интенсивности. Если присутствует гомозиготный вариант, ожидаемый флуоресцентный цвет заменяется цветом комплементарного основания [5].
Продукты четырех реакций формируют «секвенирующую лестницу», которая позволяет «прочитать» нуклеотидную последовательность фрагмента ДНК. Метод Сэнгера позволяет также определять нуклеотидную последовательность РНК, но она предварительно должна быть «переписана» в формат ДНК с помощью обратной транскрипции [3].
Секвенирование Сэнгера — это надежный метод для определения генных мутаций, который широко использовался в течение нескольких десятилетий. Метод Сэнгера является геноспецифичным, и с его помощью анализируют небольшое подмножество генов. Секвенирование Сэнгера позволяет идентифицировать мозаичные мутации. Но метод секвенирования Сэнгера не позволяет проводить точную количественную оценку, то есть нельзя сделать вывод о том, в каком количестве клеток есть мутация [5].
Метод дробовика
Метод дробовика используется для секвенирования длинных участков ДНК. Суть метода состоит в получении случайной массированной выборки клонированных фрагментов ДНК данного организма, на основе которых восстанавливается исходная последовательность ДНК [6].
Первые методы секвенирования способны восстанавливать небольшие последовательности ДНК (порядка 1000 нуклеотидов), следовательно, для секвенирования более длинных последовательностей требовалось разработать новый подход. При секвенировании методом дробовика ДНК случайным образом фрагментируется на мелкие участки с помощью сайт-неспецифичных нуклеаз. Затем фрагменты секвенируют любым доступным методом, например, методом секвенирования по Сэнгеру. Полученные перекрывающиеся случайные фрагменты ДНК собирают с помощью специального программного обеспечения в одну целую последовательность. Данный метод оставался фундаментальным методом секвенирования генома в течение 20 лет [2]. В 1981 году метод применен на практике — полное секвенирование генома вируса мозаики цветной капусты [7].
На практике трудности возникают из-за повторяющихся последовательностей. Например, можно легко секвенировать типичные бактериальные геномы (около 1,5 % повторов) или эухроматическую часть генома мухи (около 3 % повторов). Человеческий геном содержит более чем 50 % повторяющихся последовательностей. Такие особенности усложняют сборку правильной и законченной последовательности генома [2].
В дальнейшем этот подход совершенствовался: были улучшены механизмы фрагментации и клонирования ДНК. В 1990 году был предложен метод секвенирования парных прочтений. Результаты первого применения метода секвенирования парных концов на практике были опубликованы в 1990 году в работе, посвященной секвенированию человеческого гена гипоксантин-гуанинфосфорибозилтрансферазы [4].
При секвенировании парных прочтений ДНК разрезается на случайные фрагменты, которые затем группируются по весу и клонируются в векторах. Клоны секвенируют с обоих концов с использованием метода обрыва цепи, в результате которого образуются две коротких последовательности [4].
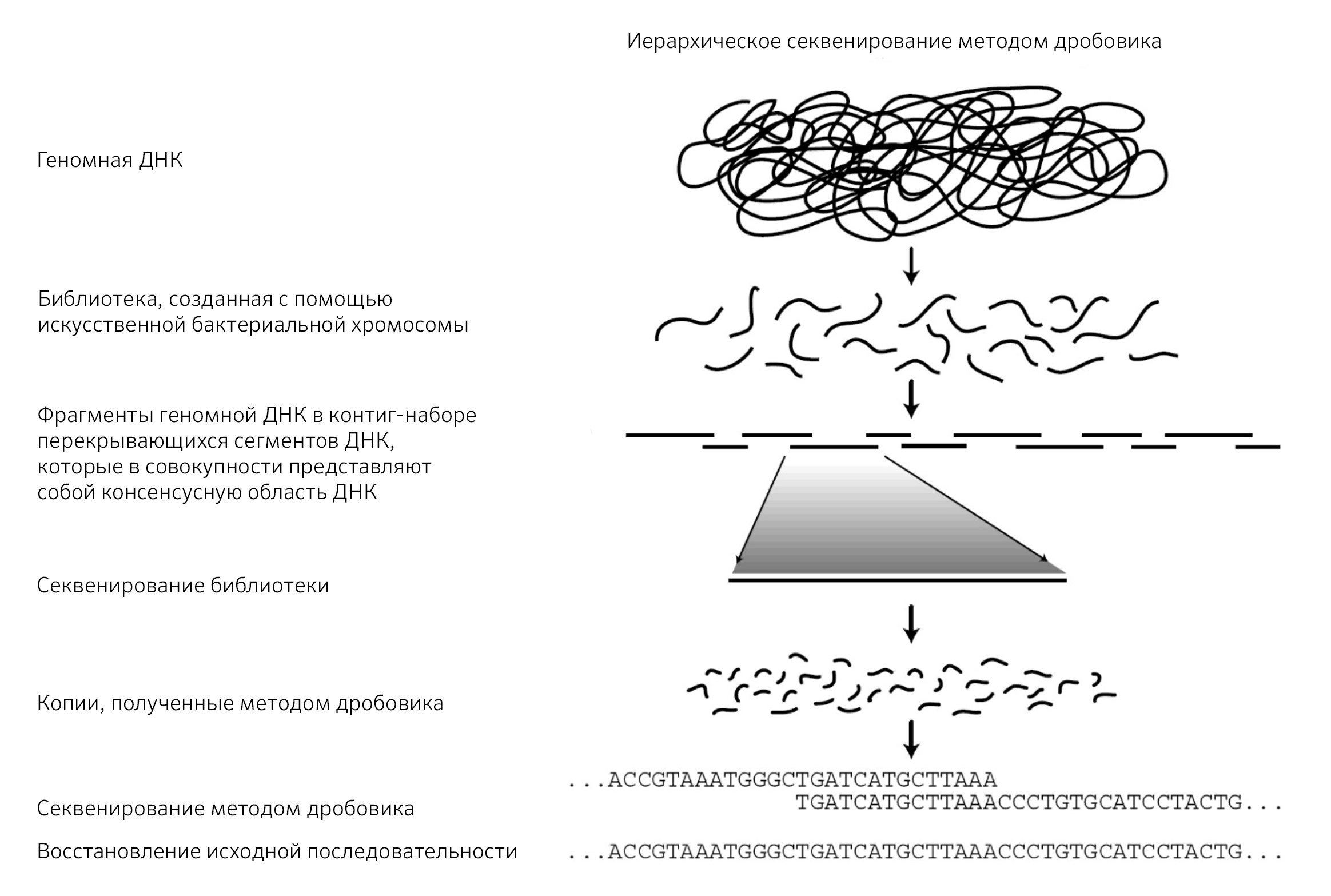
Иерархическое секвенирование методом дробовика
Для секвенирования больших геномов, содержащих повторяющиеся последовательности, используется подход «иерархического секвенирования методом дробовика» [2].
Данный метод — технически более сложный из-за необходимости обработки больших объемов данных. Это служит причиной тому, что метод иерархического секвенирования имеет более высокую стоимость [2].
Переломной точкой развития методов секвенирования стало появление и широкое распространение технологий ПЦР, автоматизация этапов «чтения» ДНК, совершенствование программного обеспечения. Все это дало начало созданию методов секвенирования следующего поколения. Секвенаторы нового поколения значительно дешевле и гораздо эффективнее своих предшественников. На сегодняшний день производительность некоторых секвенаторов измеряется уже сотнями миллиардов пар оснований, что, например, позволяет подобным приборам сканировать индивидуальный геном человека всего за несколько дней.
Источники:
КЛИНИЧЕСКОЕ СЕКВЕНИРОВАНИЕ
Самый современный метод диагностики наследственных заболеваний.
Точные методы диагностики:
Что такое секвенирование
Секвенирование — это метод определения нуклеотидной последовательности ДНК и РНК. Тестирование используется для определения генетических повреждений (мутаций) в ДНК, которые являются причиной наследственных болезней, наследственных предрасположенностей или особенностей организма. Существует несколько разновидностей секвенирования, которые позволяют выявлять возможные генетические отклонения и редкие генетические варианты, тонко влияющие на появление определенных патологий в человеческом организме.
Показания к проведению анализа с помощью метода секвенирования:
Для получения более подробной информации об исследовании вы можете позвонить по телефону:
либо воспользоваться консультацией врача-генетика
Основные этапы исследованияя
Вне зависимости от типа секвенирования процедура делится на несколько основных этапов:
Таргетное секвенирование
Возможности таргетного секвенирования
Метод таргетного секвенирования позволяет выделять и исследовать конкретные области геномов или отдельные гены. Технологии нового поколения позволяют рассчитывать время и затраты на исследование. Таргетному анализу могут подвергаться отдельные интересующие пациента гены, участки генов и митохондриальные ДНК.
Преимущества таргетного секвенирования
По сравнению с комплексными методами анализа таргетное секвенирование более выгодно. Исследуются лишь отдельные участки генов, в которых могут определяться мутации. В таком случае для диагностики требуется меньше ресурсов, поэтому таргетный поиск отдельных отклонений обойдётся гораздо дешевле, нежели полная диагностика.
Панели генов
Таргетные панели были разработаны в отношении групп заболеваний, объединенных какими-то общими симптомами, например, аутизм, задержка психического развития, онкологические заболевания и т.д. К примеру, если в истории семьи обнаруживаются признаки одного или нескольких различных наследственных опухолевых заболеваний, то семья вполне может быть носителем опухолевого наследственного заболевания. Панель “наследственный рак” объединяет серию генетических мутаций, которые могут приводить к наследственному раку. В некоторых случаях наиболее эффективной может оказаться первоначальная проверка при помощи таргетных панелей нового поколения, таких как CancerNext, с целью добиться полного покрытия задействованных генов.
Мультигенные панели
Группа исследований, предназначенных для диагностики клинически сходных заболеваний. Такие исследования могут включать от 10 до 600 генов. Они могут быть эффективны для уточнения диагноза, дифференциальной диагностики и поиска патогенных мутаций.
Полногеномный анализ
Полногеномное секвенирование дает максимально полный набор данных о структуре генетического материала и позволяет детально оценить все индивидуальные генетические вариации. Секвенатор нового поколения IlluminaNextSeq 500 может определять полную структуру генома человека за 2 дня. Каждый участок генома при этом прочитывается 30 раз для повышения точности полученных данных.
Достоверность диагностики при выборе данного вида анализа повышается, если обследовать всю семью: ребенка и родителей.
Что можно получить при полногеномном секвенировании?
Этот метод позволяет обнаружить целый ряд отклонений.
Когда нужно делать секвенирование генома?
Секвенирование генома проводится в следующих случаях.
Анализ данных
В результате полногеномного секвенирования получается огромный объем данных, который требует специальной обработки. Такая обработка включает несколько этапов.
Секвенирование экзома
Секвенирование экзома – это тест для определения генетических повреждений (мутаций) в ДНК, которые являются причиной наследственных болезней, наследственных предрасположенностей или особенностей организма.
Некоторые нуклеотиды исчезают или наоборот удваиваются или заменяются. Во многих случаях это ведет к неправильному формированию организма. Это может проявляться в виде врожденных пороков или малых аномалий развития, задержке психического развития, аутизме и других формах отклонений.
Ученые считают, что полное секвенирование экзома поможет не только обнаружить болезнь, но и предсказать ход прогрессирования заболевания и вовремя начать необходимое лечение. Выявление наследуемых мутаций также важно для оценки репродуктивных рисков.
Клиническое секвенирование экзома
Полное секвенирование экзома
Этот тест включает в себя глубокий анализ 4800 клинически значимых генов, которые связаны с известными наследственными заболеваниями. Наличие обнаруженных мутаций подтверждается классическим секвенированием по Сэнгеру. При необходимости проводится поиск аналогичных мутаций у родителей.
Цель теста – исследование экзома конкретного пациента. Метод клинического секвенирования экзома подходит для обнаружения точечных мутаций, вставок, делеций, инверсий и перестановок в экзоме. Пациент получает заключение об изменениях, связанных с его заболеванием. В то же время лечащий врач может дополнительно запросить более подробную информацию, включая данные о потенциально патогенных вариантах, локализованных в хорошо изученных областях экзома.
Результаты анализируются и проверяются целой командой специалистов медиков. Отчет об обнаруженных изменениях сопровождается подробными комментариями.
Перед проведением тестирования рекомендуется дополнительная консультация врача-генетика. В таком случае пациент может убедиться в необходимости прохождения того или иного набора тестов. Также в ходе консультации рассказывается о возможных преимуществах и рисках генетического тестирования. Дело в том, что потенциальную опасность может представлять не само тестирование (оно совершенно безвредно для пациента), а информация об обнаруженных в генетическом материале отклонениях. В частности, сведения о врожденной предрасположенности к тому или иному заболеванию обычно не сообщаются лицам, не достигшим совершеннолетия. Каждая лаборатория вырабатывает свою политику поведения в подобных случаях.
Преимущества
Ход анализа
В качестве образца для анализа сдается около 10 мл крови.
Часто задаваемые вопросы
Что включает клиническое секвенирование экзома?
Клиническое секвенирование экзома разделяется на несколько этапов.
Секвенирование: Диагностическое секвенирование экзома (DES) включает секвенирование примерно 20 000 генов. Это отличает его от секвенирования всего генома, поскольку метода нацелен на исследование 1-2% областей генома, кодирующих синтез белков, которые предположительно ответственны за появление примерно 85% от числа известных заболеваний. Целью DES является выявление изменений, которые определяют фенотип пациента.
Анализ и проверка: после завершения секвенирования все полученные данные пропускаются через биоинформационный конвейер и последовательно анализируются коллективом медиков. Для каждой обнаруженной альтерации проводится проверка, является ли она связанной с исследуемыми особенностями фенотипа. Потенциально связанные альтерации отправляются на ко-сегрегационный анализ.
Формирование отчета: каждый отдельный случай проходит несколько уровней медицинской проверки, и только после последней из них формируется отчет. Каждый отчет является специфическим для пробанда (человека, генетика которого исследуется) и включает проверку и анализ в том числе литературных данных. Подготовка отчета может длиться от нескольких дней до нескольких недель в зависимости от сложности исследования.
Доступные варианты секвенирования экзома:
Первый уровень (Клиническое секвенирования): Анализ примерно 4 800 клинически охарактеризованных генов. Полное секвенирование экзома пробанда. Проведение ко-сегрегационного анализа семьи для всех положительных или неоднозначных результатов.
Второй уровень (Полное секвенирование экзома): Анализ всех предоставленных генов с целью проведения поиска новых генов (порядка 20 000 генов по всей базе NCBI RefSeq). Полное секвенирование экзома семейного трио. Семейный ко-сегрегационный анализ для обнаруженных позитивных или неоднозначных результатов. Обязательное требование: минимум три образца от членов семьи. Тестирование на образцах эмбрионов не проводится.
Какие данные входят в отчет?
Общие результаты: положительный, предположительно положительный, отрицательный, неоднозначный.
Первичные сведения могут ограничиваться информацией, напрямую связанной с фенотипом. Это помогает выделить наиболее полезную для диагностики болезни информацию. Дополнительные сведения чаще содержат более подробные данные, относящиеся к экзому в целом, безотносительно связи с фенотипом.
Дополнительные сведения: Они варьируются в зависимости от предпочтений и возраста пациента. Данный отчет обсуждается отдельно. В дополнительные сведения попадают только установленные патогенетические или предположительно патогенетические альтерации. О клинически незначимых и доброкачественных альтерациях не сообщается. Дополнительные сведения передаются только пробанду. Прочие члены семьи не получают отчета с дополнительной информацией, однако носительство может быть предположено на основании результатов пробанда.
Когда следует заказывать таргетное секвенирование (целевая панель генов) вместо полного сквенирования экзома?
Перед тем, как начать клиническое секвенирования экзома, важно определить возможность использования таргетных панелей, которые разработаны в отношении некоторой группы заболеваний, например, аутизм, задержка психического развития и пр. К примеру, если в истории семьи обнаруживаются признаки одного или нескольких различных наследственных опухолевых заболеваний, то семья вполне может быть носителем опухолевого наследственного заболевания.
В таком случае более эффективным подходом может оказаться первоначальная проверка при помощи таргетных панелей нового поколения, таких как CancerNext, с целью добиться полного покрытия задействованных генов, поскольку такая проверка позволяет получить в том числе полностью отрицательный результат и исключить наличие мутаций в основных опухолевых генах.
Можно ли комбинировать секвенирование экзома с проведением иных генетических тестов (к примеру, хромосомным микроматричным анализом) в рамках одного заказа?
Мы рекомендуем вначале делать хромосомный микроматричный анализ, а затем выполнять секвенирование экзома.
Что необходимо предоставить для клинического секвенирование экзома?
Для выполнения секвенирования экзома необходимы:
Принимаются ли для тестирования материалы только пробанда, когда образцы родителей или иных родственников первой степени предоставить невозможно (к примеру, для приемных детей)?
Если для тестирования предоставляются только образцы пробанда либо предоставляется менее трех образцов от родственников первой степени, то можно заказать лишь проведение тестирования первого уровня (FTE).
Есть ли у клинического секвенирования экзома технические ограничения?
Да, ограничения существуют.
Можно ли сделать повторный анализ данных, полученных при секвенировании?
Да, мы предоставляем такую возможность.
Повторный анализ данных без взимания дополнительной платы возможен в течение двух лет после получения образцов.
Можно ли провести полное секвенирование экзома для эмбриональных образцов?
Эмбриональные образцы принимаются только в случае гибели плода. Для эмбриональных образцов доступно тестирование первого уровня (FTE).
Если вариант ДНК был пересмотрен и классифицирован иначе, получит ли врач уведомление об этом, чтобы сообщить обновленную информацию своему пациенту?
Секвенирование экзома в нашей лаборатории предполагает повторную классификацию вариантов. Получение дополнительной информации основанной на больших популяционных исследованиях помогает облегчить интерпретацию и уточнить диагноз. Наша лаборатория, как и все научное сообщество вовлечены в активную работу с целью лучшего понимания человеческого генома. Интерпретации и методы постоянно совершенствуются.
Проверяются ли новые гены?
Новые гены анализируются при условии выбора DES тестирования (клиническая диагностика экзома). Под новыми генами подразумеваются альтерации в генах, которые ранее не связывались с болезнями. В связи со сложностью анализа новых генов, клиническая диагностика экзома (DES) требует больше времени для выполнения заказа по сравнению с тестированием первого уровня экзома (FTE).
Если альтерации в новых генах уже обнаружены и описаны, все усилия направляются на изучение гена, включая координационные исследования и функциональные исследования с группами исследователей, изучающих ген, при наличии таковой возможности.
Предоставляет ли лаборатория полный список вариантов по пациенту?
Да, список предоставляется.
Примечание: не все альтерации из списка вариантов проходят подтверждение другими методами, и потому эти данные должны использоваться лишь в исследовательских целях.
Включает ли проводимое тестирование секвенирование митохондриального генома?
Если было обнаружено, что пациент является носителем мутации (или мутаций), можно ли протестировать членов его семьи?
Да, для членов семьи пациента можно провести односайтовый анализ альтераций, классифицированных как причины болезни.
Родственники первой степени и прочие родственники с тем же фенотипом проверяются в рамках ко-сегрегационного анализа, если соответствующие образцы были получены вместе с образцами пробанда для тестирования.
Биоинформатический анализ экспертного уровня:
Возможен анализ данных, предоставляемых заказчиком. Для уточнения информации свяжитесь с врачом-генетиком.
Биоинформационный анализ включает: