что такое рфс на ээг
Детская абсансная эпилепсия
Эффективность лечения эпилепсии определяется в первую очередь адекватной диагностикой конкретной формы эпилепсии или эпилептического синдрома. От формы эпилепсии или эпилептического синдрома зависит очень многое как в прогнозе течения заболевания (сохран
Эффективность лечения эпилепсии определяется в первую очередь адекватной диагностикой конкретной формы эпилепсии или эпилептического синдрома. От формы эпилепсии или эпилептического синдрома зависит очень многое как в прогнозе течения заболевания (сохранность интеллекта, чувствительность к антиконвульсантам), так и в тактике лечения. Именно нозологический диагноз диктует то, как быстро надо начинать противосудорожную терапию, какими именно препаратами осуществлять лечение, какими должны быть дозы антиконвульсантов и продолжительность лечения [1].
Детская абсансная эпилепсия (ДАЭ) — форма идиопатической генерализованной эпилепсии, проявляющаяся в основном типичными абсансами с дебютом в детском возрасте и наличием на ЭЭГ специфического паттерна (генерализованной спайк-волновой активности с частотой 3 Гц) [2]. Это одна из самых изученных форм эпилепсии. Несмотря на широкую распространенность ДАЭ, а также длительное ее изучение, диагностика ДАЭ только на первый взгляд кажется простой. Имеется немало нерешенных вопросов, касающихся как этиологии, так и дифференциального диагноза и прогноза этого заболевания. В отечественной литературе существует множество обзоров, посвященных ДАЭ. Прежде всего, это главы в больших монографиях по эпилепсии, авторами которых являются М. Ю. Никанорова и К. Ю. Мухин [3, 4]. Однако следует отметить, что большинство обзоров построено на литературных данных и не учитывает внедрение видео- ЭЭГ-мониторинга в широкую клиническую практику. В настоящее время в ходе подготовки новой Международной классификации эпилепсий и эпилептических синдромов эпилептологи пытаются сформулировать более четкие критерии диагноза ДАЭ. Вышесказанное позволило нам еще раз затронуть как известные, так и малоизученные аспекты этой проблемы.
В Международной классификации эпилепсий и эпилептических синдромов 1989 г. приводятся следующие критерии диагноза детской абсансной эпилепсии [2, 3, 4]:
Ниже мы остановимся на том, как видоизменяются эти критерии диагноза в свете современных знаний о ДАЭ.
В общей популяции больных с эпилепсией детская абсансная эпилепсия встречается в 2–8% случаев [2]. Считается, что ДАЭ составляет 10–12,3% всех эпилепсий в возрасте до 16 лет. Ежегодно регистрируются 6,3/100 тыс. — 8,0/100, 000 случаев заболевания в популяции детей до 15 лет. От 60 до 70% всех пациентов — девочки.
Детская абсансная эпилепсия относится к разряду идиопатических, т. е. таких, при которых нет другой причины эпилепсии, кроме наследственной предрасположенности. Тип наследования точно не установлен. Раньше предполагался аутосомно-доминантный тип наследования с пенетрантностью, зависящей от возраста. Позднее была выдвинута гипотеза о полигенном наследовании. P. Loiseau и соавт. считают наиболее вероятным тот факт, что генетически детерминированы эпилептический ЭЭГ-паттерн и предрасположенность к возникновению эпилепсии, а сама ДАЭ мультифакториальна и является результатом взаимодействия генетических и экзогенных факторов [2]. Установлено, что наследственная отягощенность по эпилепсии отмечается только у 17–20% пациентов [2]. В таких случаях у родственников пробанда отмечаются как типичные абсансы, так и генерализованные типы приступов. Большинство же случаев ДАЭ носит спорадический характер. A. V. Delgado-Escueta и соавт. [5] приводят несколько локусов, ассоциированных с ДАЭ (табл. 1).
Из таблицы следует, что только немногие семьи с локусом 8q24 соответствуют классическим критериям диагноза ДАЭ, а пациенты с локусом 1p или 4p, скорее всего, страдают ювенильной миоклонической эпилепсией с атипичным вариантом течения.
Тем не менее у 75% монозиготных близнецов, чьи сибсы болели ДАЭ, наблюдается в дальнейшем развитие той же формы эпилепсии. P. Loiseau и соавт. считают, что риск развития эпилепсии у ребенка, чьи родители страдают ДАЭ, составляет всего 6,8% [2].
Клинические проявления
Считается, что эпилептические приступы при ДАЭ могут начинаться в возрасте от 4 до 10 лет. Максимальное число случаев заболевания приходится на 5–7 лет. Начало данной формы эпилепсии до четвертого года жизни маловероятно, а после 10 лет наблюдается исключительно редко [2].
Тип эпилептического приступа. Согласно Международной классификации эпилепсии и эпилептических синдромов 1989 г., для ДАЭ считаются характерными два типа генерализованных приступов — типичные абсансы и ГТКС. Исследования последних лет показали, что эти два типа приступов не могут возникать одновременно при ДАЭ. Для начала ДАЭ характерны только типичные абсансы, а ГТКС могут наблюдаться в подростковом возрасте (после 12 лет), когда абсансы уже исчезают.
Как известно, типичный абсанс — это короткий (в течение нескольких секунд) генерализованный тип приступа
с внезапным началом и окончанием на фоне нарушенного сознания. Типичные абсансы имеют свои клинические и ЭЭГ-особенности при различных абсансных эпилепсиях (см. дифференциальный диагноз). Ребенок прекращает целенаправленную деятельность (разговор, ходьбу, еду), становится неподвижным, а его взгляд — отсутствующим. Часто отмечаются негрубые автоматизмы, особенно в первые секунды приступа, а также клонический или тонический компонент приступа. Возможна бледность. Исключительно редко отмечается мочеиспускание. Ребенок никогда не падает во время приступа и возобновляет целенаправленную деятельность через несколько секунд после конца приступа.
Для ДАЭ типичен абсанс, имеющий следующие характеристики:
Согласно P. Loiseu et al. (2002), клиническими критериями исключения диагноза ДАЭ являются [2]:
Последнее утверждение спорно, и с ним соглашаются далеко не все авторы. В то же время все исследователи сходятся на том, что наличие миоклонического компонента типичного абсанса, как правило, достоверно чаще отмечается при ДАЭ, резистентной к антиконвульсантам.
Данные по частоте генерализованных тонико-клонических приступов у подростков с ДАЭ противоречивы. Считается, что они отмечаются в 30–60% всех случаев. Возможно, такой высокий процент судорожных приступов обусловлен тем, что исследователи не всегда жестко соблюдают критерии диагноза ДАЭ, и часть наблюдавшихся пациентов страдали другими абсансными эпилепсиями. ГТКС начинаются через 5–10 лет после начала абсансов. Исследователи отмечают тот факт, что приступы носят редкий характер и хорошо купируются с помощью антиконвульсантов [2]. У части пациентов могут возникать единичные приступы после недосыпания или на фоне стрессорной ситуации. Факторами, повышающими риск возникновения ГТКС в подростковом возрасте, являются мужской пол пациента, относительно поздний дебют эпилепсии (в возрасте 9–10 лет) и позднее начало лечения (в 68% случаев) [2].
Нервно-психический статус у большинства больных с детской абсансной эпилепсией остается нормальным. Интеллектуальные нарушения отсутствуют [3, 4]. Тем не менее синдром гиперактивности и/или дефицита внимания наблюдается у 30–50% детей, что значительно превышает популяционную частоту, равную 5–7%. У большинства пациентов имеются трудности в обучении [6], которые, как и поведенческие особенности, могут быть вызваны разными причинами: и самими приступами, и влиянием антиконвульсантов, и психологическими изменениями, наблюдающимися у родителей пациентов [2].
Статус абсансов. У части детей с ДАЭ (в 7–24% всех случаев) возможно возникновение эпизодов статуса абсансов. При этом частота абсансов увеличивается, что приводит к развитию особого состояния, характеризующегося прежде всего различной степенью нарушения сознания: от легкой сонливости до ступора и летаргии. Подобное состояние продолжается от одного часа до нескольких суток и часто заканчивается генерализованным тонико-клоническим приступом.
Электроэнцефалографическая характеристика ДАЭ
Приступная ЭЭГ. Характерен билатеральный, синхронный, симметричный разряд комплексов «спайк-медленная волна». Частота пароксизмальных аномалий на ЭЭГ значительно возрастает при гипервентиляции и во время сна (при переходе REM в NonREM-фазу). Для провокации эпилептического паттерна можно использовать как гипервентиляцию, так и запись ЭЭГ бодрствования после депривации сна. Необходимо подчеркнуть, что различные ЭЭГ-варианты типичного абсанса при ДАЭ встречаются гораздо чаще, чем некий «идеальный» усредненный ЭЭГ-паттерн, описанный в большинстве руководств по эпилептологии [7].
Для ДАЭ характерны следующие особенности спайк-волнового комплекса:
P. Loiseau et al. (2002) считают, что для ДАЭ не характерны фрагментация (разрыв) разряда на ЭЭГ, наличие множественных спайков и фоточувствительность. Последнее утверждение представляется не очень правильным. Фоточувствительность (или фотосенситивность) — это возникновение комплексов «полиспайк–медленная волна» на ЭЭГ в ответ на фотостимуляцию. Фоточувствительность, по всей видимости, наследуется отдельно от ДАЭ и может при ней наблюдаться, но с частотой, не превышающей таковую в общей детской популяции. Считается, что пик частоты фотопароксизмального ответа приходится на возраст детей от 7 до 14 лет — он наблюдается у 14% мальчиков и 6% девочек. После пубертатного возраста частота фотосенситивности в популяции здоровых людей составляет 1%. Во всяком случае, по-видимому, бесполезно подвергать детей с ДАЭ повторным тестам на фоточувствительность при отрицательном первом исследовании. Для того чтобы запретить ребенку с ДАЭ смотреть телевизор или играть на компьютере, необходимо доказать не саму фоточувствительность, а факт наличия у него фотогенной эпилепсии (с развитием эпилептических приступов в ответ на специфический провоцирующий фотогенный фактор). У ребенка в такой ситуации следует провести тщательное тестирование с целью определения характера фотогенного провоцирующего фактора, а он может быть самым разным (мелькание солнечного света, мигающий искусственный свет на дискотеке, мерцание экрана телевизора или компьютера и т. д.).
Предполагается, что генерализованный разряд «спайк-медленная волна» генетически детерминирован, но наследуется отдельно от ДАЭ [7]. Поэтому он может встречаться при самых разных генерализованных формах эпилепсии и у здоровых людей. Гипотеза об аутосомно-доминантном типе наследования этого ЭЭГ-паттерна в настоящее время считается несостоятельной. Необходимо учитывать данные о том, что генерализованный разряд «спайк-медленная волна» может встречаться примерно у 1,5-2% детей, не страдающих эпилепсией. Как правило, это здоровые сибсы детей, больных эпилепсией. В этих случаях (при отсутствии клинических приступов) разряды не имеют клинического значения, но отражают генетическую предрасположенность к развитию приступов. Лечение, по мнению H. Doose [7], необходимо только в тех случаях, когда частота и выраженность этих ЭЭГ-проявлений нарастает с течением времени. Поэтому диагноз ДАЭ должен ставиться не по энцефалографическим данным, а исключительно на основании совокупности клинической и энцефалографической картины.
Межприступная ЭЭГ при ДАЭ обычно описывается как «нормальная». Однако возможны некоторые варианты нарушений основной биоэлектрической активности. Довольно часто отмечаются теменно-затылочные дельта-ритмы, которые уменьшаются при открывании глаз [7]. Данный феномен расценивается как благоприятный прогностический симптом — у таких пациентов в дальнейшем реже отмечаются ГТКС. Если имеет место диффузное замедление основной биоэлектрической активности, то в первую очередь мы должны исключить передозировку лекарственных средств, наличие вальпроатной энцефалопатии. Замедление может быть и при неадекватном лечении ДАЭ фенитоином.
На ЭЭГ во время статуса абсансов регистрируется непрерывная генерализованная эпилептическая активность, часто, но не всегда похожая на ту, которая характерна для единичного типичного абсанса.
Дифференциальный диагноз
Дифференциальный диагноз необходимо проводить с другими формами эпилепсий, для которых характерны типичные абсансы. В «континуум» абсансных эпилепсий кроме ДАЭ входят следующие формы эпилепсий:
Для всех вышеуказанных форм эпилепсии характерны типичные абсансы, но их клинические особенности, а также особенности течения видоизменяются в зависимости от формы эпилепсии. Абсанс при этих формах эпилепсии может быть как единственным типом приступа, так и сочетаться с другими типами генерализованных приступов (ГТКС, миоклониями), может быть как коротким (6–10 с), так и длительным (около 30 с). Он может протекать как с полным, так и с частичным нарушением сознания [8, 9]. Степень выраженности автоматизмов и двигательных компонентов абсанса также различна при отдельных формах эпилепсии (табл. 2).
Достаточно сложная диагностическая ситуация возникает в тех случаях, когда типичные абсансы начинаются в возрасте до 4 лет. Как правило, если абсансы возникают в раннем детстве, они отличаются от таковых при ДАЭ. Абсансы в этом случае имеют спаниолептическое течение, могут сочетаться с другими типами приступов (миоклониями, ГТКС), они резистентны по отношению к антиконвульсантам. Дети с такой разновидностью абсансов, как правило, имеют неврологические нарушения и страдают умственной отсталостью. Абсансная эпилепсия раннего детского возраста, описанная H. Doose et al. в 1965 г. и включенная в Международную классификацию эпилепсий и эпилептических синдромов 1989 г., в настоящее время не считается нозологически самостоятельной. Описаны типичные абсансы и в структуре симптоматической эпилепсии при самых разных повреждениях головного мозга — артериовенозных мальформациях, опухолях, менингитах и др. [2]. В данной ситуации до сих пор остается неясным, являются ли типичные абсансы следствием мозгового повреждения или же случайного сочетания мозгового повреждения и идиопатической формы эпилепсии.
Определенные диагностические сложности могут возникать в ходе дифференциальной диагностики типичного абсанса и сложного фокального приступа. Как правило, лобный фокальный приступ клинически может выглядеть как абсанс, так как при нем возможно быстрое распространение приступа на оба полушария. Тем не менее на ЭЭГ заметны фокальные изменения, предшествующие появлению спайк-волновых комплексов.
Эволюция и прогноз течения
Средняя продолжительность течения абсансов при ДАЭ составляет 6,6 лет,т. е. абсансы исчезают в возрасте 10–14 лет [2]. Исчезновение абсансов не всегда означает выздоровление от эпилепсии, так в пубертате возможно возникновение ГТКС (см. выше). В 6% всех случаев ДАЭ абсансы сохраняются и у взрослых. Они становятся редкими, иногда возникают на фоне провоцирующих факторов (недосыпание, менструация), их клинические проявления менее выражены [2].
Пациенты с ДАЭ нуждаются в назначении антиконвульсантов, так как эпилептические приступы наблюдаются очень часто и могут вызывать нарушение познавательных функций. Кроме того, необходимо учитывать возможность развития бессудорожного статуса. Целью лечения ДАЭ является достижение клинико-энцефалографической ремиссии, т. е. стойкого (не менее двух лет) отсутствия клинических приступов и нормализации ЭЭГ. По данным разных авторов, клинико-лабораторная ремиссия на фоне антиконвульсантов возможна в 75–90% всех случаев [2, 3, 4].
Эпилептические приступы при ДАЭ хорошо подавляются как антиконвульсантами широкого спектра действия (вальпроат натрия, ламотриджин), так и антиабсансными средствами (этосуксимид). С другой стороны, эпилептические приступы при ДАЭ склонны к аггравации (учащению приступов и развитию эпилептического статуса) при назначении карбамазепина или вигабатрина. Некоторые препараты (фенитоин и фенобарбитал) не эффективны в лечении абсансов [10].
Считается, что вальпроат натрия (депакин, конвулекс, конвульсофин) и этосуксимид (суксилеп) имеют равную эффективность в лечении ДАЭ, и именно они являются препаратами первого выбора [1, 2, 3, 4, 10, 11]. При ДАЭ без генерализованных судорожных припадков базовым препаратом при монотерапии является этосуксимид (cуксилеп), который назначается по следующей схеме: детям до 6 лет начинают с 10–15 мг/кг (не более 250 мг/сут) с постепенным повышением дозы каждые 4–7 дней до достижения ремиссии приступов или появления первых признаков непереносимости препарата. У детей старше 6 лет можно начинать с 250 мг/кг, поддерживающая доза — 15–30 мг/кг/сут.
Возможность достижения ремиссии при монотерапии вальпроатом натрия и этосуксимидом составляет 70–75%, при применении ламотриджина (ламиктала) — 50–60% [2]. Помимо несколько более низкой эффективности ламотриджин имеет еще один недостаток — медленный темп введения. При применении вальпроата натрия предпочтение должно отдаваться лекарственным формам пролонгированного действия [11], а именно депакину хроно. Двукратное применение депакина хроно в течение суток обеспечивает стабильную концентрацию препарата в крови, а следовательно, его эффективность и уменьшение риска развития побочных эффектов. Кроме того, удобная дозировка (2 раза в день) облегчает и соблюдение режима приема препарата пациентом.
Незначительная часть пациентов (от 10 до 15% всех случаев ДАЭ) достигают ремиссии при назначении низких доз депакина хроно (10–15 мг/кг веса в сутки). Если ремиссия не достигнута, то доза должна быть повышена до 20–30 мг/кг веса в сутки. При необходимости повышается до 40 мг/кг веса в сутки при условии хорошей переносимости препарата. Нельзя считать монотерапию неэффективной до тех пор, пока не достигнуты максимально переносимые дозы антиконвульсантов. Если максимальные хорошо переносящиеся дозы депакина хроно не эффективны, возможна альтернативная монотерапия этосуксимидом (до 20 мг/кг веса в сутки) или ламотриджином (до 10 мг/кг веса в сутки) [2, 11].
При неэффективности последовательных монотерапий показано применение 2 антиконвульсантов [1, 2, 3, 4]. Доказана большая эффективность комбинации вальпроата натрия и этосуксимида по сравнению с монотерапией этими препаратами. Предполагается также, что вальпроат натрия и ламотриджин обладают синергичным действием [1]. Поэтому данная комбинация возможна в лечении ДАЭ. Доза ламотриджина, если он сочетается с вальпроатом натрия, должна быть уменьшена до 5 мг/кг веса в сутки.
Резистентность к антиконвульсантам наблюдается в 5–10% всех случаев ДАЭ. Даже при наличии подобной резистентности, как правило, возможно значительное уменьшение числа приступов под воздействием антиконвульсантов.
Отмена антиконвульсантов возможна через 1,5-2 года после прекращения эпилептических приступов. До сих пор не известна оптимальная продолжительность антиконвульсантного лечения ДАЭ, она может быть определена только при проведении долгосрочных проспективных мультицентровых исследований по этому вопросу. Условием отмены антиконвульсантов является также нормализация ЭЭГ. Считается, что отмена антиконвульсантов должна проводиться постепенно (в течение 4-8 недель), с целью профилактики возникновения рецидивов. Если в пубертатном возрасте возникают неоднократные ГТКС, это служит поводом к повторному назначению антиконвульсантов.
Эпилептология — отрасль неврологии, для которой характерно чрезвычайно быстрое развитие. Наши представления об этиологии и течении различных эпилепсий и эпилептических синдромов все время меняются, пересматриваются и критерии их диагноза. Надеемся, что в новой классификации эпилепсий и эпилептических синдромов, которая сейчас создается, будут учтены все последние данные, касающиеся ДАЭ.
По вопросам литературы обращайтесь в редакцию.
Е. Д. Белоусова, кандидат медицинских наук
А. Ю. Ермаков, кандидат медицинских наук
МНИИ педиатрии и детской хирургии МЗ РФ, Москва
ЭЭГ-мониторинг или лекция для тех кому любопытно
1. Введение
Широкое распространение метода ЭЭГ-мониторинга в первой половине 90-х гг. произвело буквально революционные изменения в диагностике эпилепсии, позволило распознавать сложные в клиническом отношении судорожные припадки. Стало ясно, что многие виды судорожных приступов не укладываются в классическую картину, описанную в медицинских учебниках, что привело к пересмотру взглядов на диагностику и тактику лечения пациентов.
Проведение ЭЭГ назначается для получения ответов на следующие вопросы:
Прежде чем приступить к ответу на эти вопросы необходимо понять происхождение этого метода, а потом прийти к плодам, результатам многолетних исследований, которые в изобилии разрослись на этом мощном стволе.
2. Понятия, определяющие ВЭЭГ
2.1. ЭЭГ и эпилепсия
Основные понятия, которые можно выделить, разбирая понятие видео-ЭЭГ-мониторинг — ЭЭГ и эпилепсия.
Электроэнцефалография — метод исследования биоэлектрической активности головного мозга, основанный на определении разности электрических потенциалов, генерируемых нейронами в процессе их жизнедеятельности. Регистрирующие электроды располагают так чтобы на записи были представлены все основные отделы мозга. Получаемая запись — ЭЭГ — суммарная электрическая активность миллионов нейронов, представленной преимущественно потенциалами дендритов и тел нервных клеток: возбудительными и тормозными постсинаптическими потенциалами и частично — потенциалами дендритов и тел нервных клеток. То есть ЭЭГ — как бы визуализированный результат функциональной активности головного мозга.
Здесь наверное стоило бы уделить долю внимания анатомии нейрона и его физиологии.
Нейрон является главной клеткой центральной нервной системы. Формы нейронов чрезвычайно многообразны, но основные части неизменны у всех типов нейронов: тело и многочисленных разветвленных отростков. У каждого нейрона есть два типа отростков: аксон, по которому возбуждение передается от нейрона к другому нейрону, и многочисленные дендриты (от греч. дерево), на которых заканчиваются синапсами (от греч. контакт) аксоны от других нейронов. Нейрон проводит возбуждение только от дендрита к аксону.
Основным свойством нейрона является способность возбуждаться (генерировать электрический импульс) и передавать (проводить ) это возбуждение к другим нейронам, мышечным, железистым и другим клеткам.
Нейроны разных отделов мозга выполняют очень разнообразную работу, и в соответствии с этим форма нейронов из разных частей головного мозга также многообразна.
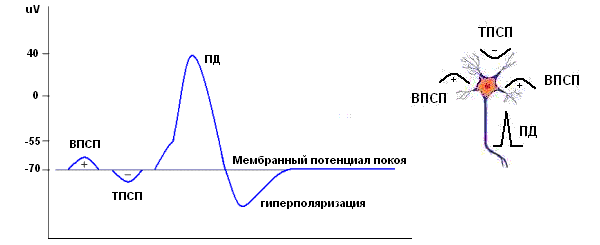
Нейрон. Возбуждающие и тормозные ПСП, потенциал действия.
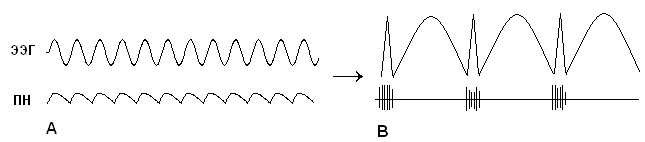
Обычная спонтанная ЭЭГ, ее основные ритмы возникают в результате пространственной и временной суммации постсинаптических потенциалов (ПСП ) большого количества корковых нейронов. Временные характеристики процесса суммации достаточны медленны по сравнению с длительностью ПД.
Таким образом, в генерации ЭЭГ принимают участие и постсинаптические потенциалы и потенциалы действия. Основная ритмика ЭЭГ определяется градуальными изменениями постсинаптических потенциалов благодаря пространственной и временной суммации отдельных ПСП в больших популяциях нейронов, которые относительно синхронизированы и находятся под воздействием подкоркового водителя ритма. Пароксизмальные же события, синхронизирующие значительное количество нейронов, которые продуцируют вспышки потенциалов действия, отвечают за формирование многих эпилептиформных феноменов ЭЭГ, в частности комплексов спайк-волна.
Собственно изучением всего этого процесса и занимается электроэнцефалография.
2.2. История изучения ЭЭГ
Начало изучению электрических процессов мозга было положено Д. Реймоном (Du Bois Reymond) в 1849 году, который показал, что мозг, также как нерв и мышца, обладает электрогенными свойствами.
Начало электроэнцефалографическим исследованиям положил В.В.Правдич-Неминский, опубликовав 1913 году первую электроэнцефалограмму записанную с мозга собаки. В своих исследованиях он использовал струнный гальванометр. Так же Правдич-Неминский вводит термин электроцереброграмма.
Первая запись ЭЭГ человека получена австрийским психиатром Гансом Бергером в 1928 году. Он же предложил запись биотоков мозга называть «электроэнцефалограмма ».
По мере совершенствования компьютерной техники в 1996 году осуществлена методика амбулаторной полиграфической записи посредством 17-канального электроэнцефалографа (16 каналов ЭЭГ и 1 канал ЭКГ) с использованием переносного персонального компьютера (ноутбука ) [Ebersole J. S. et al, 1996].
И наконец к концу 20 века у в арсенале эпилетологических и нейрофизиологических служб получается несколько видов методики ЭЭГ: рутинная ЭЭГ, холтеровское ЭЭГ и ВЭЭГ.
ЭЭГ стал «лезвием бритвы», наиболее качественным и информативным методом диагностики формы эпилепсии и позволяет регистрировать клинико-электроэнцефалографический коррелят эпилептического приступа, что дает возможность установить более точный диагноз и назначить рациональную схему антиэпилептической терапии.
3. Проведение ЭЭГ. Взгляд с 3 позиций
ЭЭГ мониторинг можно рассмотреть с 3 позиций: пациента, врача который проводит исследование в данный момент и со стороны врача, который расшифровывает видео-ЭЭГ-мониторинг постфактум.
Как предисловие стоит просто назвать показания и противопоказания к проведению этого исследования (Авакян )
Противопоказания:
Противопоказаний к проведению ЭЭГ нет.
3.1. Устройство ВЭЭГ-лаборатории
Сутью метода ВЭЭГ является непрерывная запись ЭЭГ сигнала и видеоизображения пациента в течение длительного времени. Минимальная продолжительность исследования 15 минут, максимальная не лимитирована (до 7-14 суток). Обязательным условием является идеальная синхронизация видеоизображения и ЭЭГ во времени.
Основой системы ЭЭГ-мониторинга является многоканальный усилитель сигналов, имеющий возможность записи 19-32-64-128-канальной ЭЭГ, ЭКГ-канала, датчика дыхания, электромиографических и электроокулографических каналов.
К усилителю подключаются соответствующие регистрирующие датчики. Крепление ЭЭГ-электродов для длительной регистрации производится с помощью специальной шапочки или клеящей пасты. Конструкция электродной системы позволяет пациенту перемещаться по палате, не доставляет неудобств и делает проведение исследования комфортным.
Сигналы с усилителя посредством проводной или беспроводной связи направляются на рабочую компьютерную станцию.
Видеоизображение записывается посредством цифровых видеокамер, количество их может быть произвольным, в большинстве систем предусмотрена возможность использования 1-2 камер.
Обработка результатов производится изучением синхронного изображения ЭЭГ и видеоизображения, скорость прокрутки изображения выбирается произвольно. Программа обработки ЭЭГ включает возможности спектрального и когерентного анализа, программ трехмерной локализации диполя, и других вариантов компьютерного анализа.
Отделение видео-ЭЭГ-мониторинга должно включать в себя 3 основных звена:
3.2. Схемы монтажа, подготовка пациента и начало исследования
В соответствии с системой «10 –20» у испытуемого делают три измерения черепа:
Электроды, расположенные по средней линии, отмечаются индексом Z; отведения на левой половине головы имеют нечетные индексы, на правой — четные.
Отведения в системе «10 –20»:
Крепление и наложение электродов осуществляется в следующем порядке:
После правильной установки и калибровки начинается само ВЭЭГ-исследование. В сегодняшней практике используются ВЭЭГ исследования длиной 4-5 часов (утренние /дневные/вечерние), длиной 9-10 часов (ночные ), длиной 24 часа и более (холтеровские ВЭЭГ-мониторинги). Наиболее распространенными сегодня, являются короткие ВЭЭГ-исследования (60 %), далее ночные — 36%, холтеровские — 4-5%
Премедикация перед исследованием, как правило, не проводится, поскольку введение препаратов, не входящих в схему лечения, может менять картину ЭЭГ, что не позволит оценить истинные параметры биоэлектрической активности мозга.
Не рекомендуется отмена или изменение схемы лечения в день исследования, что не позволит оценить эффекты терапии.
Принципиальное значение в диагностике эпилепсии имеет ЭЭГ сна. По мнению ведущих специалистов».. регистрация ЭЭГ в течение одной минуты поверхностного сна дает больше информации для диагностики эпилепсии, чем час исследования в состоянии бодрствования».
4. Понятия нормы и патологии в ВЭЭГ
Стойкое увеличение амплитуды бета активности свыше 25 мкВ, особенно с распространением её на задние отведения — признак патологии, однако, нозологически не специфичной. Традиционно усиление бета активности ( «excessive fast») связывалось с текущим эпилептическим процессом.
Тета ритм. Ритм частотой 4-7 Гц, по амплитуде, обычно превышающий основную активность фоновой записи. Встречается различной степени выраженности на ЭЭГ у всех здоровых детей. Тета активность начинает регистрироваться в центральных отделах уже с 3-недельного возраста, постепенно нарастая с возрастом и достигая максимума в 4-6 лет. В этом возрасте тета ритм является доминирующим на ЭЭГ у детей. Большинство исследователей считают, что у подростков и молодых взрослых при бодрствовании с закрытыми глазами низкоамплитудная тета активность (не превышающая амплитуды фона) частоты 6-7 Гц с бифронтальным преобладанием является нормальной, если она не превышает 35% фоновой записи.
Сон является мощным активатором эпилептиформной активности. Неврологу, а тем более эпилептологу, важно уметь идентифицировать фазы и стадии сна. Известно, что эпилептиформная активность отмечается преимущественно в I и II стадии медленного сна, тогда как во время «дельта сна» и в периоде ФБС она чаще всего подавляется.
В настоящее время для дифференциации стадий сна применяется классификация Dement & Kleitman в модификаций Recbtshaffen & Kales (1968 ), Согласно этой классификации выделяются 2 фазы сна: фаза медленного сна (ФМС ) и фаза быстрого сна (ФБС ),
ФМС (в англоязычной литературе — non-REM sleep) развивается на фоне ослабления влияния активизирующей коры, восходящей ретикулярной формации и усиления активности синхронизирующих тормозящих структур.
В ФМС выделяют 4 стадии.
I стадия сна (дремота ) характеризуется умеренным замедлением основной активности на ЭЭГ. Проявляется постепенным исчезновением альфа ритма и появлением ритмичной тета активности в центральной и лобно-центральной области, Может появляться периодическая ритмическая высокоамплитудная медленная активность частотой 4-6 Гц в лобных отведениях. Длительность I стадии сна у здорового человека составляет не более 10-15 минут.
II стадия сна (стадия «сонных веретен»). Наблюдаются следующие феномены. 1. Характерный признак II стадии сна — появление «сонных веретен» или сигма-ритма. Этот феномен представляет собой ритмические веретенообразно нарастающие и снижающиеся по амплитуде вспышки с частотой 12-16 Гц и амплитудой 20-40 мкВ, преимущественно в центрально-париетальных отделах. Длительность «сонных веретен» колеблется от 0 до 2 сек. Высокоамплитудные и продолжительные (около 3 сек) сонные веретена с преобладанием в лобных отведениях — обычно признак патологии.
III стадия сна характеризуется нарастанием амплитуды и количества медленных волн, преимущественно, дельта диапазона. Регистрируются К-комплексы и «сонные веретена». Дельта волны на эпохе анализа ЭЭГ занимают до 50% записи. Отмечается снижение индекса бета активности.
IV стадия сна характеризуется исчезновением «сонных веретен» и К-комплексов, появлением высокоамплитудных (не менее 50 мкВ> дельта волн, которые на эпохе анализа ЭЭГ составляют более 50% записи. III и IV стадии сна являются наиболее глубоким сном. Они объединены под общим названием «дельта сон».
В фазе быстрого сна (парадоксальный сон, REM-сон) отмечается ослабление влияния тормозящей ретикулярной формации и усиление десинхронизирующих активизирующих механизмов. При входе в ФБС нарастает бета активность. Данная фаза сна характеризуется появлением на ЭЭГ картины десинхронизации в виде нерегулярной активности с одиночными низкоамплитудными тета волнами, редкими группами замедленного альфа ритма и острыми «пилообразными » волнами. ФБС сопровождается быстрыми движениями глазных яблок и диффузным снижением мышечного тонуса. Именно в эту фазу сна у здоровых людей происходят сновидения. Начало сна с фазы быстрого сна или возникновение ее менее, чем через 15 минут после засыпания — признак патологии.
Нормальный сон взрослых и детей состоит из чередования серии циклов ФМС и ФБС. ФМС наиболее выражена в первую половину ночи и занимает 75% всего сна. Во второй половине ночи наиболее представлена ФБС (фаза сновидений), которая занимает около 25% ночного сна. Продолжительность одного цикла сна у детей младшего возраста составляет 45-55 минут; у взрослых 75-100 минут. За ночь у здорового человека возникает от 4 до 6 циклов сна.
4.3. Медленноволновая активность.
Медленноволновая активность. Этот термин включает в себя активность на ЭЭГ в форме замедления ритма по сравнению с возрастной нормой. Согласно международной классификации выделяют следующие варианты медленноволновой активности:
Замедление основной активности констатируется, когда основные ритмы имеют более медленные частотные характеристики по сравнению с возрастной нормой: в 1 год — частота менее 5Гц, в 4 года — менее 6 Гц, в 5 лет — менее 7Гц, в 8 лет и старше — менее 8 Гц.
Периодическое замедление. Периодическое замедление может быть нерегулярным и ритмическим, генерализованным и региональным. Выраженное периодическое ритмическое генерализованное замедление (обычно с преобладанием в лобных отведениях) иногда наблюдается при генерализованных формах эпилепсии. Нерегулярное региональное замедление (чаще в височных отведениях) может быть косвенным ЭЭГ признаком парциальной эпилепсии или локального органического поражения головного мозга.
4.4. Провоцирующие пробы
Провоцирующие пробы. Фоновая запись биоэлектрической активности головного мозга осуществляется в состоянии пассивного бодрствования пациента с закрытыми глазами. С целью выявления нарушений ЭЭГ применяются провоцирующие пробы, Наиболее значимые из них следующие:
Подробно остановимся на первых.
Проба на открывание-закрывание глаз служит для установления контакта с пациентом. При этом медицинский работник убеждается, что пациент находится в сознании и выполняет инструкции. Данная проба позволяет выявить реактивность альфа-ритма и других видов активности на открывание глаз. В норме при открывании глаза блокируется альфа ритм, нормальная и условно нормальная медленноволновая активность. Наоборот, отсугсгвие реакции паттернов на открывание глаз — как правило, признак патологической активности. Блокирование при открывании глаз затылочной пик-волновой активности у пациентов с доброкачественной затылочной эпилепсией Гасто является важным дифференциальным признаком с симптоматической затылочной эпилепсией. Следует помнить, что при некоторых формах фотосенситивной эпилепсии, эпилепти-формная активность на ЭЭГ возникает в момент закрывания глаз. Это может быть связано с исчезновением фиксации взора при закрытых глазах. Данный феномен был описан Panayiotopoulos (1998 ) и назван им «fixation off» или фотосенситивностью.
Гипервентиляция реально проводима у детей после 3-х лет. Продолжительность от 3 мин у детей до 5 мин у взрослых. Гипервентиляцию нельзя проводить в самом конце записи ЭЭГ, так как патологическая активность нередко появляется спустя некоторое время после окончания пробы. Основное назначение гипервентиляции — выявление генерализованной пик-волновой активности, а иногда и визуализация самого приступа (обычно абсанса). Реже появляется региональная эпилептиформная активность. Согласно наблюдениям Благо-склоновой Н.К. и Новиковой Л. А. (1994 ), появление пароксизмальных вспышек медленных волн при гипервентиляции свойственно здоровым детям и подросткам и является вариантом нормы. По мнению Daly & Pediey (1997 ), патологическая реакция на гипервентиляцию включает только появление на ЭЭГ пик-волновой активности или выраженной асимметрии паттернов. Принципиально важно, что любая другая реакция, в том числе и появление дельта активности, — индивидуальный вариант нормы. Таким образом, согласно современным воззрениям, оценка пароксизмальной генерализованной (нередко с бифронтальным преобладанием) ритмической тета-дельта активности при гипервентиляции как гипотетической «дисфункции мезо-диэнцефальных структур» несостоятельна. Подобная оценка нормальных, по своей сути, паттернов не имеет никакого значения для клиники, приводит к терминологической путанице и напрасному беспокойству, как врачей неврологов, так и самих пациентов.
Ритмическая фотостимуляция (РФС ) является важнейшей пробой для выявления патологической активности при фотосенситивных формах эпилепсии. Используется классическая методика Jeavons & Harding (1975 ). Лампа стробоскопа должна находиться на расстоянии 30 см от закрытых глаз пациента. Необходимо использование широкого спектра частот, начиная от 1 вспышки в сек и, заканчивая частотой 50 Гц. Наиболее эффективна в выявлении эпилептиформной активности стандартная РФС с частотой 16 Гц. Возможны следующие реакции на РФС:
Артефакты представляют собой любые графоэлементы на ЭЭГ, не являющиеся отражением электрической активности головного мозга. Подразделяются на механические и биоэлектрические. Механические артефакты бывают инструментальные, электродные и от электросети. Наиболее распространен артефакт вследствие «наводки » от сети переменного тока (отсутствие заземления, использование рядом различной медицинской аппаратуры) в виде появления синусоидальных колебаний частоты 50 Гц.
Биоэлектрические артефакты подразделяются на следующие:
При этом врач осуществляющий мониторинг должен уметь дифференцировать эти артефакты. Если, например, артефакт не уходит с течением времени, необходимо проверить электрод на полноценность соединения с усилителем, с пациентом и в случае необходимости заменить его/настроить.
5. Эпилептиформная активность
Эпилептиформная активность характеризуется появлением на ЭЭГ острых волн или пиков, которые резко отличаются от основной активности фона и возникают преимущественно у лиц, страдающих эпилепсией. Классификация нарушений ЭЭГ, принятая Американской ассоциацией нейрофизиологов [Daly & Pedley, 1997], придерживается строгой терминологии в обозначении патологических феноменов. В классификации общепринят термин «эпилептиформная активность», в связи с его исключительным применением к электроэнцефалографическим феноменам.
Согласно классификации нарушений ЭЭГ различают 9 межприступных (интериктальных ) и два приступных (иктальных ) эпилептиформных паттерна.
Межприступные эпилептиформные изменения:
Иктальные эпилептиформные изменения:
Рассмотрим все указанные варианты эпилептиформных нарушений на ЭЭГ:
1. Пики (спайки ) — эпилептиформный феномен, отличный от основной активности и имеющий пикообразную форму. Период пика составляет от 40 до 80 мсек. Это специфичный эпилептиформный паттерн, который наблюдается в рамках различных форм эпилепсии (генерализованных и парциальных). Одиночные пики встречаются исключительно редко; обычно они предшествуют появлению волн. Согласно базисным принципам электрофизиологии, появление спайков на ЭЭГ отражает процессы возбуждения корковых нейронов, а медленных волн — процессы торможения.
4. Комплексы пик-медленная волна — представляют паттерн, состоящий из пика и следующей за ним медленной волны. Наиболее часто комплексы пик-медленная волна регистрируются в виде генерализованных разрядов, представленность и амплитуда которых усиливается в ФМС, при ГВ и РФС. Данная ЭЭГ картина высоко специфична для идиопатических генерализованных форм эпилепсии детского и юношеского возраста. Однако по данным Doose & Baier (1987 ), в 10-17% случаев генерализованные комплексы пик-медленная волна могут быть обнаружены у клинически здоровых лиц, в основном, у родственников пробандов с абсансными формами эпилепсии.
В виде единичных паттернов комплексы пик-медленная (или острая-медленная) волна встречаются при криптогенных и симптоматических формах парциальной эпилепсии.
5. Комплексы пик-медленная волна с частотой 3 Гц — представляют регулярный разряд генерализованных паттернов, состоящих из единичных спайков со следующей медленной волной с частотой от 2,5 до 3,5 Гц. Согласно классификации нарушений ЭЭГ, для отнесения паттернов в данную группу, продолжительность этих комплексов должна составлять более 3 секунд. Частота комплексов во время разряда непостоянна. В начале разряда она составляет 3-4 Гц, тогда как к финалу снижается до 2,5-2,25 Гц. Характерно амплитудное преобладание паттернов в лобных отведениях. Медленный сон вызывает активацию пик-волновых комплексов. При этом продолжительность разрядов во время сна укорачивается и одновременно возможно некоторое замедление частоты комплексов. Данный ЭЭГ паттерн характерен для абсансных форм эпилепсии, особенно — детской абсанс эпилепсии. Продолжительность разряда пик-волновых комплексов более 3 сек с высокой вероятностью является иктальным феноменом типичных абсансов.
11. ЭЭГ статуса определяется в случае продолженных эпилептиформных паттернов ЭЭГ приступа или часто повторяющихся паттернов ЭЭГ приступа без восстановления нормального ритма фоновой записи между ними. Следует отметить, что ЭЭГ статуса может не коррелировать с клиническими симптомами эпилептического статуса. Классический тому пример — электрический эпилептический статус медленного сна; тяжелая форма эпилепсии с выраженными когнитивными нарушениями, при которой частота и выраженность эпилептических приступов может быть минимальна или приступы отсутствуют вовсе. Таким образом, даже высоко специфичные паттерны ЭЭГ приступа и ЭЭГ статуса, следует рассматривать только в контексте с клиническими данными. Особенности иктальной ЭЭГ при различных типах эпилептических приступов в рамках отдельных форм эпилепсии будут рассмотрены в следующих главах.
6. Расшифровка и заключение ЭЭГ
Таким образом мы подошли к интерпретации ЭЭГ-нарушений
Эти рекомендации не являются строгими правилами. Они относятся в первую очередь к стандартной ЭЭГ. При описании более специализированных записей (неонатальные записи, электроцеребральное молчание) представление технических деталей должно быть более полным — в соответствии со стандартами ACNS (1 — «Minimum Technical Requirements (MTR ) for Performing Clinical EEG»; 2 — «Minimal Technical Standards for Pediatric Electroencephalography»; 3 — «Minimum Technical Standards for EEG Recording in Suspected Cerebral Death»).
Отчет ВЭЭГ должен состоять из 3 основных частей:
1. Введение.
Введение должно начинаться с описания специальной подготовки, если таковая предпринималась перед записью.
2. Описание.
Описание ЭЭГ должно включать все характеристики записи, включая нормальные и аномальные, представленные объективным способом, максимально избегая утверждений об их значимости.
Целью является полный и объективный отчет, который позволит другим ЭЭГ-специалистам придти к выводу касательно нормальности или степени аномальности записи по описанию — без необходимости просматривать исходную ЭЭГ. Этот вывод может отличаться от исходного вывода, поскольку в определенной мере субъективен.
Если проводились тесты — должны быть описаны реакции на открытие и закрытие глаз, а также произвольных, целенаправленных движений. Включается описание указания на симметрию или асимметрию, полноту или неполноту, устойчивость или неустойчивость.
Если аномалия является эпизодической, необходимо обратить внимание на отсутствие или наличие периодичности между эпизодами, ритмичность или иррегулярность паттерна внутри каждого эпизода. Необходимо представить временной диапазон продолжительности эпизодов.
Нет нужды указывать на отсутствие определенных характеристик, за исключением нормальных, — таких как низкоамплитудная быстрая активность, сонные веретена, и др. Такие фразы как «отсутствие фокальной патологии» или «нет эпилептиформных нарушений» могут использоваться только в разделе интерпретации — при наличии явного или предполагаемого запроса направляющего доктора. Они не должны использоваться в описательной части.
3. Интерпретация.
(I ) Впечатление — это субъективное мнение специалиста о степени нормальности записи. Описание записи предназначено, в первую очередь, для электроэнцефалографиста, который использует его для последующего вывода, или другого эксперта, и должно быть детальным и объективным. Впечатление, с другой стороны, пишется в первую очередь для направляющего врача, и, следовательно, должно быть по возможности сжатым. Большинство клиницистов из предшествующего опыта предполагают, что чтение детального описания не дает им существенно новой информации, и поэтому ограничиваются интерпретаций. Если оно слишком большое и выглядит иррелевантно клинической картине, клиницист может потерять интерес, что в итоге приводит в снижению пользы от всего ЭЭГ отчета. Если запись считается аномальной, желательно указывать ее степень — с целью облегчить сравнение между повторными исследованиями. Поскольку эта часть отчета носит довольно субъективный характер, степень нарушений может варьировать от лаборатории к лаборатории. Однако в каждой лаборатории следует четко определять критерии степени нарушения и строго следовать им.
После определения степени нарушений, необходимо указать причины, на основе которых строится вывод. Если присутствуют несколько видов нарушений, желательно ограничиться списком из двух или трех главных нарушений, которые наиболее характерны для данной записи. Если перечислять все нарушения, наиболее существенные «растворяются » в тексте и теряется значимость выводов. При наличии данных предыдущих ЭЭГ записей, необходимо включать их сравнение с результатами данного исследования.
(II ) Клиническая корреляция — это попытка показать насколько данные ЭЭГ укладываются (или нет) в общую клиническую картину. Оно может варьировать — в зависимости от того, кому оно адресуется. Для адресата, далекого от неврологии или ЭЭГ, оно должно быть более тщательным и выверенным.
Если ЭЭГ аномальная — это указывает на церебральную дисфункцию, поскольку ЭЭГ является отражением церебральной функции. Тем не менее, фраза «церебральная дисфункция» может звучать излишне угрожающе и должна использоваться только когда нарушение квалифицируется как «более чем легкое» и когда имеется достаточно клинической информации, чтобы считать такой вывод реалистичным в данном клиническом контексте. В остальных случаях допустимы предложения типа «Запись указывает на легкую иррегулярность церебральной функции». Определенные паттерны ЭЭГ являются подтверждающими для более или менее специфических клинических ситуаций; дельта фокус может говорить о структурном поражении в соответствующем клиническом контексте; определенные типы спайков или острых волн подтверждают потенциальный эпилептогенез. Если нарушение ЭЭГ соответствует клинической информации, которая содержит диагноз или подозрение на наличие подобного состояния, можно указать, что данные ЭЭГ согласуются или подтверждают диагноз.
Цифровые способы записи, генерации и передачи отчета позволяют, при необходимости, включать в отчет короткие отрезки реальной записи, в том числе с примерами нарушений.
7. ВЭЭГ-мониторинг в оценке эффективности противосудорожной терапии
Одним из основных критериев объективизации действия противоэпилептических препаратов является изменение биоэлектрической активности мозга, регистрируемое с помощью ЭЭГ.
Эти изменения носят различный характер и зависят от формы эпилепсии и применяемой терапии.
Помимо воздействия антиконвульсантов на эпилептическую активность, они также оказывают влияние на характер фоновой ритмической активности. Хорошо описаны изменения фоновой ритмики, появляющиеся при длительном приеме бензодиазепинов и барбитуратов.
При прогрессирующем течении заболевания отмечается нарастание индекса эпилептической активности в очаге.
Другим маркером отрицательной динамики является появление дополнительных очагов эпилептической активности. Они могут быть зависимы от первичного очага или существовать независимо.
К характеристикам проградиентного течения заболевания относится появление феномена вторичной билатеральной синхронизации (ВБС ).
К ЭЭГ-критериям, отражающим положительное влияние ПЭП, относятся: снижение индекса пароксизмальности в очаге, уменьшение количества эпилептических очагов и регресс эффекта ВБС.
Динамические ВЭЭГ-исследования в период отмены терапии с высокой точностью позволяют оценить риск возобновления приступов.
8. Эффективность ЭЭГ-мониторинга
Была проанализирована достоверность направляющего диагноза «Эпилепсия » у первичных пациентов, поступающих в эпилептологический стационар (НПЦ медицинской помощи детям, ДЗ Москвы).
Исследуемая группа составила 1154 пациента в возрасте от 0 до 18 лет. Всем пациентам проводились следующие методы обследования: оценка нервно-психического статуса, видео-ЭЭГ-мониторинг продолжительностью 6 и более часов, и, в большинстве случаев, МРТ головного мозга.
9. Заключение
Успешное лечение эпилепсии напрямую зависит от своевременно и правильно установленного диагноза. Использование неинформативных методов диагностики на стартовом этапе лечения эпилепсии приводит к трудностям в подборе адекватной терапии, прогрессированию заболевания. В ЭЭГ это проявляется в виде появления множественных вторичных очагов эпилептической активности, развитию феномена вторичной билатеральной синхронизации при фокальных формах и значительному нарастанию индекса генерализованных разрядов при генерализованных формах эпилепсии.
Нередко наличие у пациента эпилептических приступов, несмотря на их очевидную курабельность, побуждает врача необоснованно вводить социальные ограничения, применять полипрагмазию в лечении.
С другой стороны, необоснованная констатация ремиссии у пациентов с эпилепсией также имеет неблагоприятные для пациента последствия, поскольку сохраняются клинически «невидимые » виды приступов или эпилептиформная активность на ЭЭГ.
Отсутствие изменений в записанном фрагменте ЭЭГ бодрствования длительностью до 30 мин (рекомендации ILAE) может создать ложное впечатление о положительной динамике на фоне лечения. Опираясь на полученные данные, врач может ошибочно констатировать клинико-энцефалографическую ремиссию. С другой стороны, выявление эпилептической активности на контрольной динамической ЭЭГ на фоне подобранной терапии может содержать фрагмент эпилептической активности, которую врач ошибочно трактует как «отрицательную динамику». В некоторых случаях на коротких фрагментах записи ЭЭГ-характеристики могут выглядеть как «нормальные » при сохраняющихся приступах. При этом объективный анализ продолженной записи свидетельствует, что характер биоэлектрической активности у пациента значимо не менялся. Ошибки при интерпретации связаны с чередованием нормальных и патологических фрагментов ЭЭГ.
Можно утверждать, что объективная трактовка изменений ЭЭГ может проводиться только при проведении ВЭЭГ-мониторинга.
Введение в алгоритм диагностики и динамического обследования ВЭЭГ-мониторинга позволяет, используя объективные клинико-нейрофизиологические критерии, своевременно диагностировать заболевание, оценивать состояние больного на разных этапах лечения, оптимизировать терапевтическую тактику и избегать диагностических ошибок у пациентов с эпилепсиями и эпилептическими синдромами.
Анализ длительного катамнеза больных эпилепсией (взрослых и детей) позволил разработать и внедрить в специализированных отделениях и кабинетах высокодостоверный комплексный клинико-нейрофизиологический подход к дифференциальной диагностике эпилепсий и судорожных синдромов, значительно повысить качество проводимой терапии в этой сложной группе пациентов.
Врач-педиатр, врач высшей категории,
невролог Тамбиев И. Е..
Ковалев И. Г.