что такое рестрикция средне тяжелой степени
Виды дыхательной недостаточности у пациентов. Что нужно знать врачу паллиативной помощи
Время чтения: 4 мин.
Любая одышка, вызванная заболеванием, считается признаком дыхательной недостаточности. Но одышка в состоянии покоя или при минимальной нагрузке вне обострения заболевания — это один из критериев того, что человек нуждается в паллиативной помощи.
Дыхательная недостаточность
Дыхательная недостаточность — не всегда показатель заболеваний легких: она может возникать из-за проблем с сердцем, нейромышечных заболеваний. Любой врач паллиативной помощи может встретить в своей практике такого пациента.
В паллиативе чаще встречается хроническая дыхательная недостаточность. Виды недостаточности различают по:
Локализация поражения
Центральная дыхательная недостаточность возникает из-за повреждений на уровне дыхательного центра в стволе головного мозга. В паллиативной помощи она возникает чаще всего из-за:
Как определить, что у пациента центральная дыхательная недостаточность?
Тогда зачем знать вид дыхательной недостаточности, если паллиативному пациенту в тяжелом состоянии может помочь только симптоматическая терапия? В первую очередь, чтобы более аргументированно и уверенно донести до родственников причину ухудшения состояния их близкого и объяснить объем помощи.
Нейромышечная дыхательная недостаточность возникает, когда пути, связывающие дыхательный центр с межреберными мышцами и диафрагмой (мотонейроны шейного и грудного отделов), прерываются. Нейромышечная дыхательная недостаточность — это осложнение таких заболеваний, как спинальные мышечные атрофии (СМА), миодистрофия Дюшенна, боковой амиотрофический склероз (БАС), миастения и миопатии. Этот вид недостаточности прогрессирует и необратим.
Был случай, когда супруг пациентки с БАС по ее просьбе не надевал маску и не подключал аппарат НИВЛ. Он объяснял это так: «Мы так тренируемся дышать сами, не всю же жизнь на аппарате сидеть».
Конечно, это решение самой пациентки, но у них не было даже понимания того, что аппарат необходим из-за необратимости недостаточности. Важно объяснить это пациенту и его родным.
Торако-диафрагмальная дыхательная недостаточность возникает при колабировании альвеол и ограничении их расправления из-за сдавления легких извне (опухолью, напряженным асцитом, парезом кишечника).
Бронхо-легочная дыхательная недостаточность бывает обструктивной, рестриктивной и перфузионной.
Обструктивная недостаточность возникает из-за:
— сужения просвета из-за утолщения стенок бронхов (воспалительный, аллергический, бактериальный отек);
— наличия на покрове бронхов вязкой слизи при увеличении ее секреции бокаловидными клетками бронхиального эпителия, слизисто-гнойной мокроты, крови;
— сужения вследствие рубцовой деформации бронха;
— развития эндобронхиальной опухоли;
— сдавления бронхов извне, в том числе опухолью, замещающей паренхиму легких, распространения лимфангита на межальвеолярные перегородки;
Однажды мне позвонил врач выездной службы, который был на вызове по причине внезапно возникшей дыхательной недостаточности у пациента с трахеостомой.
Родственники пациента рассказали, что внезапно появилась сильная одышка. Частота дыхательных движений была 24/мин, при этом аускультативно справа дыхание не проводилось.
Врач отметил, что трахеостомическая трубка проходима, однако вдох пациентом осуществляется с трудом. Гемодинамика была стабильной, поэтому версия с тромбоэмболией легочной артерии была неочевидной.
На мой вопрос о сухости языка и кожи врач ответил утвердительно. У меня сразу возникла мысль об обструкции правого бронха густой мокротой. Конечно, в этом случае пациента необходимо было госпитализировать в многопрофильный стационар, ведь обструкция могла привести к ателектазу правого легкого. Но больному повезло: врач попытался улучшить вентиляцию с помощью мешка Амбу, кусок мокроты выскочил прямо в просвет трубки и был извлечен. Признаки дыхательной недостаточности были купированы.
В данном случае врач заподозрил, что причиной недостаточности могла быть обструкция и немедленно приступил к оказанию помощи.
Рестриктивная недостаточность возникает из-за:
Понимание вида дыхательной недостаточности позволяет выбрать наиболее эффективную терапию. Например, при фиброзе кислородный концентратор на 5 литров скорее всего не поможет из-за нарушения альвеолярно-капиллярной мембраны. Таким пациентам нужен 10-литровый кислородный концентратор.
Рестриктивные нарушения дыхания на фоне постторакотомического болевого синдрома как фактор риска развития внутрибольничной пневмонии
В.Э. Хороненко, Д.С. Баскаков, А.С. Маланова, Е.А. Мандрыка, М.М. Шеметова
Для корреспонденции: Маланова Анна Сергеевна, канд. мед. наук, младший научный сотрудник отдела анестезиологии и реанимации МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России, Москва; e-mail: malanova_anna@mail.ru
Для цитирования: Хороненко В.Э., Баскаков Д.С., Маланова А.С., Мандрыка Е.А., Шеметова М.М. Рестриктивные нарушения дыхания на фоне постторакотомического болевого синдрома как фактор риска развития внутрибольничной пневмонии. Вестник интенсивной терапии имени А.И. Салтанова. 2019;1:78–84. DOI: 10.21320/1818-474X-2019-1-78-84
Реферат
Обоснование. Болевой синдром является наиболее частым осложнением торакотомии. Он не только причиняет дискомфорт больным, но и может стать причиной нарушения дыхательной функции.
Цель исследования. Анализ влияния постторакотомического болевого синдрома (ПТБС) на функцию внешнего дыхания онкологических пациентов, перенесших открытые оперативные вмешательства на легких.
Материалы и методы. В исследование включены 300 пациентов, которым выполнены обширные онкологические оперативные вмешательства по поводу злокачественных новообразований легких. В зависимости от варианта анестезиологического пособия все исследуемые были рандомизированы на 3 сопоставимые группы: грудная эпидуральная анальгезия (ГЭА), n = 100; паравертебральная блокада (ПВБ), n = 100; межреберная блокада (МРБ) n = 100. На 3-и сутки после операции осуществлялась оценка интенсивности болевого синдрома по визуально-аналоговой шкале (ВАШ) и выполнялась спирометрия.
Результаты. Анализ интенсивности послеоперационного болевого синдрома показал превосходство эпидуральной анальгезии над другими методиками. У пациентов с болевым синдромом интенсивностью более 30 мм ВАШ показатели объема форсированного выдоха за 1 с (ОФВ1), жизненной емкости легких (ЖЕЛ) и экскурсии грудной клетки были значительно ниже, чем у больных с болевым синдромом до 30 мм ВАШ. Развитие болевого синдрома более 70 мм ВАШ приводило к значимому ухудшению показателей ЖЕЛ и экскурсии грудной клетки относительно больных с ПТБС 31–70 мм ВАШ, что увеличивало риск инфекционных осложнений.
Заключение. Обеспечение оптимальной антиноцицептивной защиты в периоперационный период обеспечивает лучшие показатели функции внешнего дыхания и тем самым способствует снижению частоты бронхопульмональных осложнений. Методом выбора в торакальной хирургии является сочетанная общая анестезия с высокой грудной эпидуральной блокадой.
Ключевые слова: онкохирургия, постторакотомический болевой синдром, эпидуральная анестезия, паравертебральная блокада, межреберная блокада
Поступила: 15.11.2018
Принята к печати: 01.03.2019
Введение
Болевой синдром является наиболее частым осложнением торакотомии, причиняющим дискомфорт больным в период после операции и вызывающим беспокойство не только у пациентов, но и у хирургов и анестезиологов-реаниматологов во всем мире [1]. Несмотря на все большее расширение знаний в области патофизиологии и фармакологии ноцицепции, постторакотомической болевой синдром (ПТБС) продолжает оставаться серьезной проблемой послеоперационного периода. Он способен привести к нарушению нормальной биомеханики дыхания, гормональным и иммунным изменениям [2, 3]. Ограниченная подвижность грудной стенки, в свою очередь, способна привести к нарушению дренажной функции бронхов, формированию участков ателектазирования в легких и, как следствие, присоединению воспалительных осложнений в послеоперационный период [4].
Возможные источники болевой импульсации после торакальной хирургии многочисленны и включают в себя хирургический разрез, повреждение или раздражение межреберных нервов, воспаление в стенке грудной клетки, паренхимы легких и плевры. Присоединение нейропатического компонента боли на ранних этапах послеоперационного периода обусловливает развитие труднокупируемого болевого синдрома [5].
В последние годы для решения проблемы ПТБС использовались разнообразные подходы [6]. Были исследованы различные методики анестезии, проведена сравнительная оценка эффективности высокой грудной анестезии/анальгезии и паравертебральных блокад, межреберных и внутриплевральных блокад [7]. Изучен мультимодальный подход с комбинированным использованием опиоидов, региональных методов обезболивания и других системных противовоспалительных лекарственных средств [8]. Основным направлением для исследования в подобных работах являлась оценка интенсивности болевого синдрома в условиях использования того или иного метода анестезии и анальгезии. Изменения биомеханики дыхания, связанные с болевым синдромом, и развитие на этом фоне респираторных осложнений в большинстве работ не изучались достаточно подробно.
Таким образом, на сегодняшний день представляет определенный интерес оценка влияния ПТБС на показатели функции внешнего дыхания и, как следствие, на частоту развития послеоперационных респираторных инфекций. Особенно актуально данная проблема стоит в хирургии рака легкого [9]. Это обусловлено большим травматизмом онкохирургических вмешательств, значительной коморбидностью пациентов, необходимостью быстрой реабилитации для начала следующего этапа противоопухолевого лечения. Целью нашего исследования являлось определение значимости нарушений функции внешнего дыхания на фоне ПТБС для формирования послеоперационных внутрибольничных респираторных осложнений.
Методы исследования
В исследование включены 300 пациентов (203 мужчин, 97 женщин) в возрасте от 45 до 70 лет (средний возраст 57,87 ± 8,96 года), которым в условиях МНИОИ им. П.А. Герцена в период с 2014 по 2017 г. выполнены обширные онкологические оперативные вмешательства по поводу злокачественных новообразований легких преимущественно II–III стадии или метастазов в легкие опухолей различных локализаций.
Критериями включения в исследование являлись:
В зависимости от варианта анестезиологического пособия все исследуемые были рандомизированы на 3 сопоставимые группы: грудная эпидуральная анальгезия (ГЭА), n = 100; паравертебральная блокада (ПВБ), n = 100; межреберная блокада (МРБ), n = 100.
Пациентам всех групп за сутки до операции назначали антиконвульсант прегабалин 75 мг 2 раза в сутки per os. На ночь перед операцией пациенты получали диазепам 10 мг в/м. За 2 ч до операции больные принимали внутрь утреннюю дозу прегабалина (75 мг). Затем пациентам согласно программе рандомизации осуществлялся определенный вид анестезии. В группе ГЭА (n = 100) катетеризацию эпидурального пространства проводили на уровне Th4–Th6, с последующим проведением катетера в краниальном направлении на 4 см, затем выполнялась инфузия модифицированной смеси Бревика (ропивакаин 3 мкг/мл + фентанил 4 мкг/мл + адреналин 2 мкг/мл) со скоростью 5–15 мл/ч в течение операции. В послеоперационном периоде 1–2 сутки продолжалась дотация смеси Бревика, далее в профильном отделении переходили на 0,2% раствор наропина со скоростью 4–6 мл/ч в течение 5 суток. В группе ПВБ (n = 100) катетеризацию паравертебрального пространства (ПВП) производили с унилатеральной стороны под контролем УЗИ навигации, под местной инфильтрационной анестезией на уровне Th5–Th6 с установкой катетера. До операции в ПВП вводили: лидокаин 2% — 10 мл и смесь 0,3% раствора ропивакаина, фентанила (4 мкг/мл) и адреналина (2 мкг/мл) — 20 мл. В конце операции также болюсно вводили модифицированную смесь Бревика. В послеоперационный период пациенты получали в ПВП модифицированную смесь Бревика в течение 1–2 суток, со скоростью от 8 до 12 мл/ч, с 3-х суток: ропивакаин 0,2% со скоростью 8–12 мл/ч в течение 5 суток. В группе МРБ (n = 100) хирургической бригадой после удаления препарата и выполнения лимфаденэктомии пункционной иглой производилась блокада межреберья, через которое осуществлялся хирургический доступ, а также на одно межреберье выше и ниже. Вводили 30 мл 96% этилового спирта + 30 мл 0,5% раствора новокаина. В послеоперационном периоде при ярко выраженном болевом синдроме проводилось дополнительное введение местного анестетика (новокаина 0,5%) чрескожно.
Интраоперационно осуществлялся стандартный мониторинг показателей гемодинамики (АД, Ps, SaO2, ЭКГ), уровня анестезии (энтропия), нейромышечной проводимости (TOF watch).
Для оценки интенсивности ПТБС использовалась 100-миллиметровая ВАШ. Пациентам предлагалось оценить интенсивность боли на 3-и сутки после операции, выставив специальный бегунок в определенной точке шкалы. Оценивалась только интенсивность болевого синдрома при движении — максимально глубокий вдох, кашель. Расстоянию в миллиметрах от начала шкалы соответствовала интенсивность боли в баллах, крайние точки шкалы были определены как «нет боли» и «настолько сильно болит, насколько это возможно себе представить». Болевой синдром 1–30 мм по ВАШ считался легким, 31–70 мм — умеренным, более 70 мм — тяжелым [10–12].
Оценку функции внешнего дыхания (показатели- ЖЕЛ, ОФВ1) осуществляли с помощью спирометра, а также производили измерения объема грудной клетки на вдохе и на выдохе с помощью сантиметровой ленты до и после операции, накануне операции и на 3-й день после операции.
Оценивали частоту жалоб пациентов на одышку или чувство нехватки воздуха в покое и потребность в выполнении фиброоптических санаций трахеобронхиального дерева в первые 3 суток после операции на основе показателей газообмена капиллярной крови. Особое внимание было уделено регистрации фактов развития внутрибольничных пневмоний за время пребывания пациентов в стационаре по данным рентгенографии легких.
Статистическую обработку данных проводили с помощью программы Statistica 6.0 for Windows (StatSoft Inc., USA), достоверность разницы относительных величин оценивали с помощью χ2 (хи-квадрат), достоверность отличий среди абсолютных величин определяли с помощью U-критерия Манна—Уитни. Разницу величин признавали достоверной при p 70 мм ВАШ) болевого синдрома приводило к значимому ухудшению показателей ЖЕЛ и экскурсии грудной клетки относительно больных с умеренно выраженным ПТБС (31–70 мм ВАШ).
| Таблица 3. Показатели функции внешнего дыхания в зависимости от интенсивности постторакотомического болевого синдрома | |||
| Интенсивность ПТБС (n = 300) | ОФВ1 (ЛЭ/ ПЭ) | ЖЕЛ (ЛЭ/ПЭ) | Экскурсия грудной клетки, см (ЛЭ/ПЭ) |
| 1–30 мм | 1,88 ± 0,6/ | 2,0 ± 0,6/ | 3,6 ± 1,4/ |
| (n = 138) | 1,65 ± 0,4 | 1,51 ± 0,3 | 2,8 ± 1,0 |
| 31–70 мм | 1,59 ± 0,4*/ | 1,72 ± 0,4*/ | 2,9 ± 1,2*/ |
| (n = 141) | 1,41 ± 0,4* | 1,45 ± 0,4 | 2,6 ± 1,0 |
| от 71 мм | 1,52 ± 0,8*/ | 1,48 ± 0,3* / | |
| (n = 21) | 1,16 ± 0,3* | 1,36 ± 0,3 | 1,8 ± 0,9* |
ЖЕЛ — жизненная емкость легких; ЛЭ — лобэктомия; ОФВ1 — объем форсированного выдоха за 1 с; ПТБС — постторакотомический болевой синдром; ПЭ — пневмонэктомия.
Случай эффективного лечения хронической дыхательной недостаточности у пациентки с кифосколиозом
Патология грудной стенки – одна из хорошо известных причин, ведущих к формированию хронической дыхательной недостаточности. Типичным примером такого варианта нарушений легочной вентиляции является кифосколиоз. Это заболевание позвоночника, характеризующееся увеличением его кривизны в сагиттальном и фронтальном направлении в сочетании с частичным поворотом вокруг собственной оси [1]. Частота тяжелых, клинически значимых форм кифосколиоза составляет 1 на 10000 человек [2]. Выделяют врожденную, вторичную – ассоциированную с нейромышечной патологией и идиопатическую формы заболевания. Последняя встречается наиболее часто, развивается преимущественно у женщин и обычно дебютирует в детском или подростковом возрасте [3].
Тяжесть течения заболевания зависит от его этиологии и степени искривления позвоночника. Наиболее благоприятный прогноз имеют пациенты с идиопатическим кифосколиозом и умеренным искривлением позвоночника [3]. Для врожденной формы кифосколиоза характерно быстрое прогрессирование, резкая деформация грудной клетки и раннее возникновение дыхательной недостаточности [4]. При вторичном кифосколиозе проявление симптоматики зависит от тяжести нейромышечной патологии и возраста больных [5].
Выраженная деформация грудной клетки часто приводит к тяжелым рестриктивным нарушениям легочной вентиляции и хроническим нарушениям газообмена [1]. До недавнего времени такое осложнение кифосколиоза как дыхательная недостаточность свидетельствовало о неблагоприятном прогнозе заболевания. Однако в настоящее время существует возможность эффективно лечить таких больных, что подтверждается нашим практическим опытом.
Приводим клиническое наблюдение:
Из анамнеза заболевания известно, что у пациентки врожденный сколиоз 3 степени в связи с чем она является инвалидом 2 группы. Из-за своего недуга с детства была ограничена в физической активности. Тем не менее, получила высшее образование и работает преподавателем. Кроме того, с юных лет страдает поллинозом, что проявляется аллергическим ринитом в весенний и летний период. Никогда не курила. В последние годы периодически отмечала одышку и сердцебиение при умеренных физических нагрузках, но к врачам по этому поводу не обращалась.
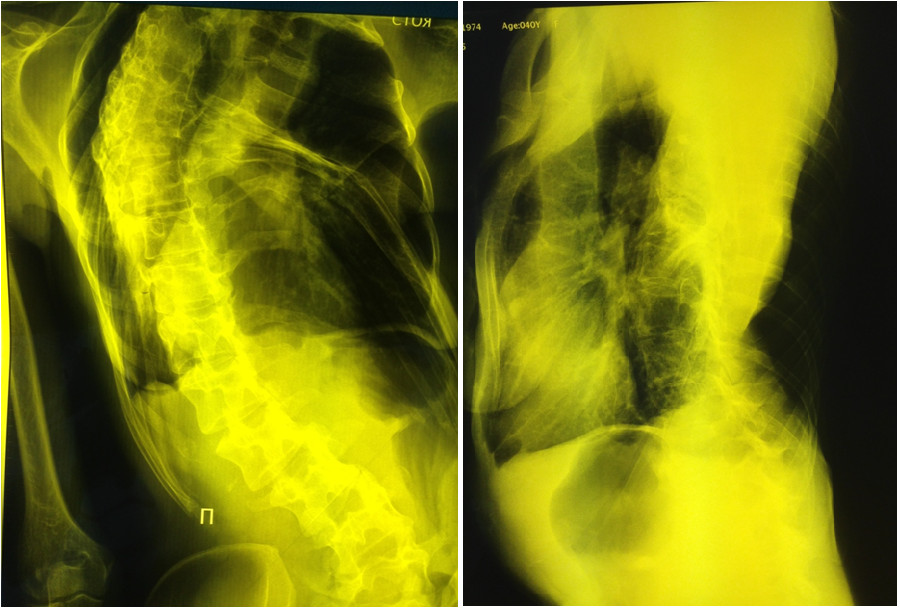
Настоящее ухудшение состояния началось с середины декабря 2014 г., когда пациентка отметила субфебрильное повышение температуры, малопродуктивный кашель и усиление одышки, которая быстро прогрессировала и стала значительно ограничивать ее в повседневной жизни. В связи с этим обратилась к пульмонологу в одну из больниц г. Москвы, где была выполнена рентгенография органов грудной клетки. Выявленное затемнение правой половины грудной клетки (Рис. 1.) в сочетании с клинической картиной навело врача на мысль о возможной тотальной пневмонии правого легкого.
Рисунок 1. Рентгенография органов грудной клетки пациентки Ш., декабрь 2014 г. (комментарии в тексте).
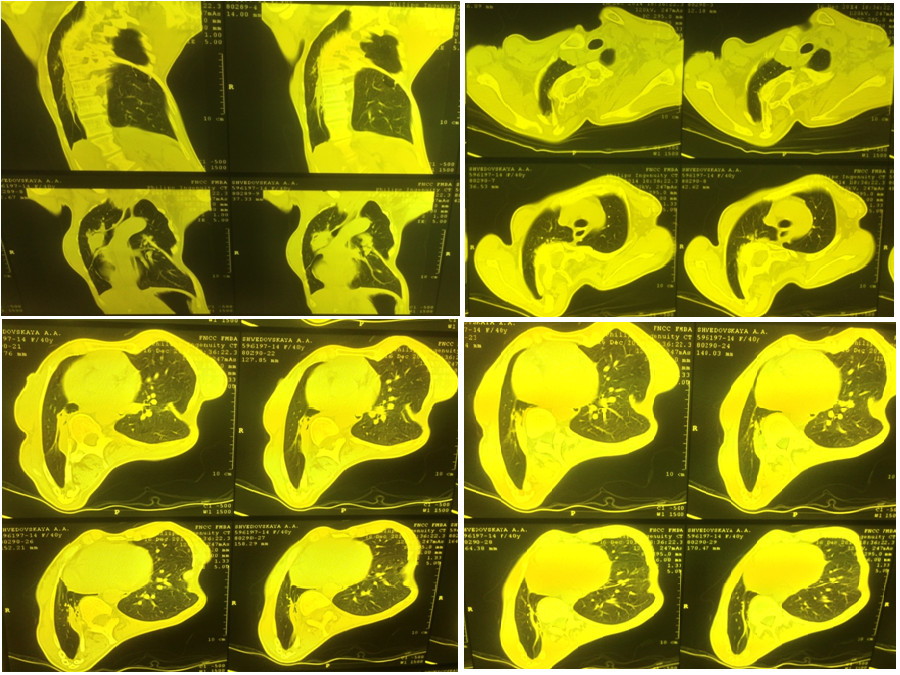
Для уточнения диагноза была проведена компьютерная томография органов грудной клетки (Рис. 2.) при которой установлено, что на фоне выраженной деформации грудной клетки за счет кифосколиоза нижняя и частично средняя доля правого легкого компримированы, легочная ткань в этих отделах уплотнена, безвоздушна. На фоне уплотненной ткани прослеживаются деформированные, сближенные и суженные бронхи. Очаговых, инфильтративных и полостных изменений в легочной ткани не выявлено. Органы средостения смещены вправо. Корни легких не расширены, структурны. Просвет трахеи свободен, не деформирован. Внутригрудные лимфоузлы не увеличены. Сердце не увеличено. Крупные сосуды не расширены. Свободного воздуха, жидкости в плевральных полостях нет.
Рисунок 2. Компьютерная томография органов грудной клетки пациентки Ш., декабрь 2014 г. (описание в тексте).
Одновременно проводилось рутинное обследование – клинический и биохимический анализы крови, наличие антител к атипичным возбудителям, С-реактивный белок. Несмотря на то, что инфильтративных изменений и патологических воспалительных сдвигов выявлено не было, пациентке последовательно проведено 3 курса антибактериальной терапии (ципрофлоксацином, амоксиклавом и линкомицином), также назначались различные муколитики. При этом состояние больной продолжало ухудшаться, прогрессировали одышка и сердцебиение, которые теперь возникали уже в покое, возросли слабость и утомляемость, снизился аппетит и пациентка в течение нескольких недель потеряла в весе 3 кг, нарушился сон.
В связи с отсутствием эффекта от антибактериальной терапии, прогрессирующей одышкой и наличием поллиноза было высказано предположение о дебюте бронхиальной астмы и начата комбинированная терапия ингаляционным кортикостероидом и бета-2-агонистом длительного действия (беклометазоном и формотеролом). Однако положительного эффекта вновь не было отмечено. В результате в середине января 2015 г. пациентка обратилась в УКБ №1 и была госпитализирована.
При осмотре на момент поступления состояние средней тяжести. Умеренный цианоз губ. Одышка при разговоре. Частота дыхания 22-24 в минуту. Измеренная с помощью пульсоксиметра сатурация кислорода в покое – 87-89%, при ходьбе по палате быстро снижается до 78%. Пациентка пониженного питания, индекс массы тела – 17 кг/м2. Обращает на себя внимание выраженная деформация грудной клетки за счет кифосколиоза. Перкуторный звук над левыми отделами легочный с коробочным оттенком, справа – притупление перкуторного звука. Аускультативно над легкими справа дыхание практически не выслушивается, слева – с жестким оттенком, хрипов нет. Границы относительной сердечной тупости смещены вправо. Тоны сердца звучные, ритм правильный с частотой 90 в минуту, патологические сердечные шумы не выслушиваются. Артериальное давление 130/80 мм рт. ст. Живот при пальпации мягкий, безболезненный во всех отделах. Печень не увеличена. Селезенка не пальпируется Симптом поколачивания по поясничной области отрицательный. Дизурических явлений нет. Щитовидная железа не увеличена. Патологической неврологической симптоматики нет.
При обследовании в общем анализе крови гемоглобин 126 г/л, эритроциты 4,4 млн, цветовой показатель 0.84, тромбоциты 282 тыс., лейкоциты 6,29 тыс., лейкоцитарная формула без особенностей, СОЭ 4 мм/ч. В биохимическом анализе крови также без патологических отклонений.
При исследовании КЩС и газового состава артериальной крови выявлены выраженная гипоксемия и компенсированный дыхательный ацидоз: рН-7,39, рО2 – 46,6 мм рт. ст.,
рСО2 – 53 мм рт. ст., SрO2 – 77,9%.
Мокрота слизистая, лейкоциты 7-12 в поле зрения, эритроциты 1-2 в поле зрения, эозинофилы единичные в поле зрения, эпителий плоский значительное количество, циллиндрический – умеренное количество, макрофагов немного, спирали Куршмана и кристаллы Шарко-Лейдена не найдены. Атипичных клеток и микобактерий туберкулеза нет.
ЭКГ: ритм синусовый, правильный с ЧСС 90 в минуту. Отклонение ЭОС вправо. Признаки перегрузки правого предсердия. Неполная блокада правой ножки пучка Гисса.
При исследовании функции внешнего дыхания выявлены выраженные вентиляционные нарушения по смешанному типу с преобладанием рестрикции. При анализе кривой поток-объем отмечается значительное снижение скоростных показателей на всех уровнях бронхов. ЖЕЛ 0,63 л (18%), ОФВ1 0,58 л (20%), ФЖЕЛ/ОФВ1 91 %. Проба на обратимость бронхиальной обструкции (беродуал) отрицательная.
Эхо-Кардиография: Полость левого желудочка и толщина его стенок в пределах нормы. Диастолическая функция не нарушена. Глобальная сократительная функция левого желудочка в норме. Нарушений его локальной сократимости также нет. Фракция выброса 76%. Полость правого желудочка, толщина стенок в норме, характер движения стенок не изменен. Межжелудочковая перегородка без особенностей. Клапанный аппарат интактен за исключением гемодинамически незначимого пролапса одной из створок митрального клапана. Клапан легочной артерии не лоцируется.
Таким образом, проведенное обследование выявило выраженные вентиляционные нарушения преимущественно по рестриктивному типу и признаки дыхательной недостаточности по смешанному типу (гипоксемия и гиперкапния), что обусловлено значительными скелетными нарушениями грудной клетки и гиповентиляцией. Кашель с отхождением небольшого количества мокроты, по всей видимости, является следствием перенесенного пациенткой в декабре 2014 г. острого вирусного трахеобронхита, который из-за выраженных нарушений легочной вентиляции принял затяжное течение. Изменения на ЭКГ позволяют говорить о наличии у пациентки как минимум начальной легочной гипертензии. Отсутствие признаков гипертрофии правого желудочка при эхокардиографии может объясняться как отсутствием у больной до недавнего времени значимой дыхательной недостаточности, так и возможными погрешностями при локации правого желудочка у пациентки со столь выраженной деформацией грудной клетки.
Пациентке был поставлен следующий клинический диагноз: Врожденный кифосколиоз грудного и поясничного отделов позвоночника IV степени. Фиброателектаз нижней и частично средней доли правого легкого. Выраженные вентиляционные нарушения преимущественно по рестриктивному типу. Хроническая дыхательная недостаточность III степени по смешанному типу. Вторичная легочная гипертензия. Остаточные явления острого трахеобронхита.
В отделении больной была начата неинвазивная вентиляция легких в режиме БиПАП (два уровня положительного давления воздуха), первоначально – круглосуточно с короткими перерывами на еду и гигиенические мероприятия, а затем только во время ночного сна. Вспомогательная масочная вентиляция сочеталась с малопоточной оксигенотерапией – в начале 3-4 л О2 в минуту, а после стабилизации состояния пациентки потребность в кислороде снизилась до 2 л в минуту. Кроме этого проводилась симптоматическая терапия растворами беродуала и флуимуцила через небулайзер, фраксипарином в профилактических дозах и кораксаном 10 мг в сутки. На фоне лечения состояние пациентки улучшилось, ощутимо уменьшилась одышка, нормализовался ночной сон, частота сердечных сокращений снизилась до 75 в минуту и к моменту выписки (спустя 2 недели) потребность в приёме кораксана отпала, сатурация О2 при дыхании атмосферным воздухом в покое составляла 90-92%. При контрольном исследовании газов артериальной крови гиперкапния купирована, но все еще сохраняется гипоксемия: рН – 7,40,
рСО2 – 44,1 мм рт.ст, рО2 – 53,5 мм рт.ст, SрО2 – 89%. У пациентки повысилась толерантность к физической нагрузке. После выписки из клиники больная продолжила использовать БиПАП в сочетании с малопоточной оксигенотерапией во время ночного сна. При контрольном визите спустя еще две недели пациентка отмечает дальнейшее улучшение самочувствия и повышение толерантности к физическим нагрузкам, SpO2 при пульсоксиметрии в пределах 93-95%. Пациентка смогла вернуться к трудовой деятельности.
Хроническая дыхательная недостаточность у пациентов с кифосколиотической деформацией грудной клетки – типичный пример гиповентиляционного синдрома, что и определяет дальнейший терапевтический подход.
Основа лечения пациентов с альвеолярной гиповентиляцией – неинвазивная вспомогательная вентиляция легких с положительным давлением. При этом тип используемого дыхательного аппарата не принципиален для последующего эффективного лечения [8]. Показанием к назначению респираторной поддержки являются гиперкапния в бодрствовании или ночная сатурация кислорода ≤ 88% в течение 5 последовательных минут и более, как маркер развивающейся во время сна гиповентиляции [9]. Сочетание неинвазивной вентиляции с малопоточной оксигенотерапией необходимо в тех случаях, когда при достижении нормального уровня РСО2 сохраняется гипоксемия.
У многих пациентов явления нарушения вентиляции существенно усугубляются во время сна. Это может быть связано как с утратой волевого контроля, так и за счет снижения вентиляционного ответа на гипоксемию и гиперкапнию во время сна [10]. Ночные нарушения газообмена типичны для пациентов с тяжелым кифосколиозом и обычно предшествуют появлению признаков хронической дыхательной недостаточности в бодрствовании [11]. Поэтому основное внимание следует уделять терапии, проводимой во время ночного сна. Использование респираторной поддержки приводит не только к нормализации легочной вентиляции во сне, но и улучшает параметры газообмена в бодрствовании. Это объясняется повышением чувствительности дыхательного центра к СО2, снижением нагрузки на дыхательную мускулатуру и обусловленным этим последующим улучшением механики дыхания [12].
К сожалению, респираторная поддержка у пациентов со стабильной дыхательной недостаточностью используется редко, так как все еще рассматриваются многими клиницистами исключительно в качестве составляющей терапии критических или терминальных состояний. Наш опыт показывает, что у пациентов с кифосколиозом и хронической дыхательной недостаточностью вовремя и по показаниям начатая неинвазивная вспомогательная вентиляция, при необходимости – в сочетании с малопоточной кислородотерапией, позволяет реабилитировать таких больных и вернуть их к активной жизни.