что такое реальный газ в химии
Газ. Идеальный газ. Реальный газ. Сжижение газов
В идеальном газе междумолекулярные силы равны нулю, и объем самих молекул бесконечно мал сравнительно с объемом междумолекулярного пространства. Состояние идеального газа является тем предельным разведенным состоянием вещества, к которому стремятся все тела природы при достаточно высоких температурах и достаточно низких давлениях; в этом и заключается особое значение состояния идеального газа, к тому же наиболее просто поддающегося исследованию и потому полнее всего изученного. Вещество, в крайнем разрежении заполняющее межпланетное пространство, может считаться находящимся в состоянии идеального газа.
Это уравнение ( уравнение Клапейрона ) заключает в себе в явной форме три основных закона состояния идеального газа:
находим вместо уравнений (2) и (3):
в этом и состоит физическое значение R.
находим числовое значение
В других единицах значения R (на 1 моль) таковы:
Кроме разобранных трех законов, из уравнения (1) состояния идеального газа в соединении с двумя началами термодинамики следуют еще такие основные законы:
дает вместе с уравнением (1) следующие условия для внутренней энергии U идеального газа:
5) Теплоемкости идеального газа при постоянном объеме cv и при постоянном давлении ср являются функциями одной лишь Т. Термодинамика дает общие уравнения
но для идеального газа (р) и (v) линейно зависят от (Т), по закону Гей-Люссака (4) и (5); следовательно, правые части уравнений (9) обращаются в 0 и
Теплоемкости ср и cv не независимы друг от друга, но связаны для идеального газа простым условием:
В кинетической теории принимается, по принципу равномерного распределения энергии, что на каждую степень свободы газовой молекулы приходится энергия k0∙Т/2, а на 1 моль приходится
(приближенно, считая R = 2, cv = i, ср = i+2).
В учении о газе важную роль играет отношение cp/cv = γ; из уравнений (11) и (12):
В простейшем случае одноатомного газа (молекула которого состоит из 1 атома, каковы благородные газы и пары многих металлов) i наименьшее и равняется 3: вся энергия молекулы сводится к кинетической энергии ее поступательных движений, которые могут совершаться по трем независимым взаимно перпендикулярным направлениям; тогда
а γ имеет наибольшую возможную величину: γ = 5/3 = 1,667. Для двухатомных газов (Н2, O2, N2, СО и другие) можно считать I = 3+2 (два вращения вокруг двух взаимно перпендикулярных осей, перпендикулярных к линии, соединяющей оба атома); тогда cv = 4,96 ≈ 5, cр = 6,95 ≈ 7 и γ = 7/5 = 1,40. Для трехатомного газа (Н2O, СO2, H2S, N2O)i = 3+3 (вращение вокруг трех взаимно перпендикулярных осей) и cv = 5,96 ≈ 6, cр = 7,95 ≈ 7 и γ = 4/3 = 1,33.
При дальнейшем усложнении строения молекулы, т. е. с увеличением i, возрастают cv и ср, а γ = 1 + 2/i и стремится к 1. Табл. 1 показывает, что все сказанное хорошо согласуется с данными опыта, что γ всегда >1 и ≤1,667 и не может быть = 1,50 (для i = 4).
Для одноатомных газов cv и ср, в соответствии с теорией, практически не изменяются с температурой (так, для Ar значения cv и ср лежат в пределах от 2,98 до 3,00 между температурами = 0° и 1000° С). Изменения cv и ср с температурой находят объяснение в теории квант. Впрочем, теплоемкости газов, близких к идеальным, практически почти не изменяются в широких интервалах температуры. Экспериментально определяются обычно ср и у, a cv вычисляется из этих данных.
В этом общем уравнении К и b могут зависеть от Т и v.
а и b, константы Ван-дер-Ваальса, как показывает опыт, все же зависят от T и v, и потому уравнение (15) является лишь первым приближением; оно хорошо передает качественную форму изотерм реальных газов.
Сжижение газа. Всякий газ можно обратить в жидкость надлежащим давлением, предварительно охладив его ниже критической температуры. Необходимые для сжижения СО2 давления (в Atm) при разных температурах приведены в табл. 2.
Понятно, что эти давления являются давлениями насыщенного пара жидкой углекислоты и тем ниже, чем ниже температура.
Чтобы предварительно сильно охладить газ для сжижения, в технических установках пользуются эффектом Джоуля-Томсона, заключающимся в том, что при адиабатическом расширении (например, при резком падении давления, когда газ вытекает из отверстия) внутренняя энергия газа возрастает на ΔU, а Т изменяется на ΔТ, причем термодинамически
В случае идеальных газов ΔU = 0 и ΔТ = 0 [так как, по уравнению (1), T∙dv/dT – v = 0].
Для реальных газов ΔТ ≠ 0, т. е. происходит охлаждение или нагревание, смотря по тому, будет ли T∙dv/dT – v ≠ 0 (Δp 0, т. к. a/R∙T инверсионная точка Тi, определяемая условием
Если за единицы измерения Т, р и v принять соответственно критические величины, то вместо Т, р и v состояние будет характеризоваться приведенными величинами :
вовсе не содержащее величин, зависящих от природы вещества. Уравнение (19) предполагает, однако, правильность уравнения Ван-дер-Ваальса, и потому уклонения от него часто весьма значительны, особенно в случае ассоциированных веществ. Учение о соответственных состояниях (так называются состояния, отвечающие одинаковым θ, π и ϕ) дает возможность находить большое число универсальных зависимостей, подобных уравнению (19).
Реальный газ
Изотермы реального газа (схематично)
Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния.
Участок левее точки F — нормальная жидкость.
Точка F — точка кипения.
Прямая FG — равновесие жидкой и газообразной фазы.
Участок FA — перегретая жидкость.
Участок F′A — растянутая жидкость (p
Физика реального газа
Чтобы подробнее установить условия, когда газ может превратиться в жидкость и наоборот, простых наблюдений за испарением или кипением жидкости недостаточно. Надо внимательно проследить за изменением давления и объёма реального газа при разных температурах.
Медленно будем сжимать газ в сосуде с поршнем, например сернистый ангидрид (SO2). Сжимая его, мы выполняем над ним работу, вследствие чего внутренняя энергия газа увеличится. Когда мы хотим, чтобы процесс происходил при постоянной температуре, то сжимать газ надо очень медленно, чтобы теплота успевала переходить от газа в окружающую среду.
Выполняя этот опыт, можно заметить, что сначала при большом объёме давление с уменьшением объёма увеличивается согласно закону Бойля — Мариотта. В конце концов, начиная с какого-то значения, давление не будет изменяться, несмотря на уменьшение объёма. На стенках цилиндра и поршня образуются прозрачные капли. Это означает, что газ начал конденсироваться, то есть переходить в жидкое состояние.
Продолжая сжимать содержимое цилиндра, мы будем увеличивать массу жидкости под поршнем и соответственно, будем уменьшать массу газа. Давление, которое показывает манометр, будет оставаться постоянным до тех пор, пока всё пространство под поршнем не заполнит жидкость. Жидкости мало сжимаемы. Поэтому дальше, даже при незначительном уменьшении объёма, давление быстро будет возрастать.
Поскольку весь процесс происходит при постоянной температуре T, кривую, что изображает зависимость давления р от объёма V, называют изотермой. При объёме V1 начинается конденсация газа, а при объёме V2 она заканчивается. Если V > V1 то вещество будет в газообразном состоянии, а при V Уравнения состояния реального газа
Наиболее часто используются следующие уравнения состояния реального газа:
Реальный газ
Реальный газ – это такой газ, который не является идеальным газом.
Описание идеального и реального газа
Идеальный газ – математическая модель газа, которая описывается уравнением состояния идеального газа Клапейрона — Менделеева. Данное уравнение имеет вид:
Уравнение состояния идеального газа Клапейрона — Менделеева
Иначе данную формулу можно записать в следующем виде:
Уравнение состояния идеального газа Клапейрона — Менделеева
Где m – масса, M – молярная масса, а V — объем
В отличие от идеального газа, молекулы реального газа взаимодействуют между собой, а также занимают определенный объем. По этой причине реальный газ описывается так называемым обобщенным уравнением Менделеева — Клапейрона:
Обобщенное уравнение Менделеева — Клапейрона
Как видно – здесь возникает Zr – коэффициент сжимаемости газа, который зависит от температуры и давления. Именно данный коэффициент определяет отклонение термодинамических свойств реальных газов от свойств идеальных.
Z – коэффициент сжимаемости газа
Здесь V – молярный объем. Для идеального газа коэффициент сжимаемости газа равен единице.
Свойства реального газа заметно различны со свойствами идеального в случае, когда температура газа достигает критической точки, либо имеют место высокое давление или низкие температуры. Данные различия имеют большое значение в точных расчетах, например, в гиперзвуковой аэродинамике.
Похожие статьи
Понравилась запись? Расскажи о ней друзьям!
Реальные газы
Курсовая работа выполнил: студент 462 группы Махорт Александр
ГОУ ВПО Тюменский государственный университет
Понятие реального газа. Его свойства.
Газы (французское gaz; название предложено голланским учёным Я. Б. Гельмонтом), агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек. Солнце, звёзды, облака межзвёздного вещества состоят из газов — нейтральных или ионизованных (плазмы). Встречающиеся в природных условиях газы представляют собой, как правило, смеси химически индивидуальных газов.
Газы обладают рядом характерных свойств. Они полностью заполняют сосуд, в котором находятся, и принимают его форму. В отличие от твёрдых тел и жидкостей, объём газа существенно зависит от давления и температуры. Коэффициент объёмного расширения газа в обычных условиях (0-100°С) на два порядка выше, чем у жидкостей, и составляет в среднем 0,003663 град-1.
Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяющая описывать поведение разрежённых реальных газов при достаточно высоких температурах и низких давлениях. При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объём молекул и взаимодействие между ними. При высоких давлениях и низких температурах указанная модель идеального газа непригодна.
Неидеальность газов в молекулярно-кинетической теории рассматривается как результат взаимодействия молекул. В первом приближении ограничиваются рассмотрением парных взаимодействий, во втором-тройных и т.д. Такой подход приводит к вириалъному уравнению состояния, коэффициенты которого могут быть теоретически рассчитаны, если известен потенциал межмолекулярных взаимодействий. Наиболее полезно вириальное уравнение при рассмотрении свойств газов малой и умеренной плотности. Этот вопрос будет раскрыт немного позже.
Наличие межмолекулярных взаимодействий оказывает влияние на все свойства реальных газов, в т.ч. приводит и к тому, что их внутренняя энергия зависит от плотности. С этим свойством связан эффект Джоуля-Томпсона: изменение температуры газа при его адиабатическом расширении, напр. при протекании с малой постоянной скоростью через пористую перегородку (этот процесс называется дросселированием). Учет межмолекулярных взаимодействий и внутреннего строения молекул необходим при решении многих теоретических задач физики и физической химии. Молекул, которые можно было бы принимать как упругие шары, практически не бывает, и при расчете свойств реальных газов применяют другие молекулярные модели. Из них наиболее употребительны простые модели гармонического осциллятора и жесткого ротатора.
Реальные газы при незначительных плотностях имеют свойства, отличающиеся от свойств идеальных газов. Это различие свойств тем значительнее, чем выше плотность газа. Так, например, из уравнения Менделеева-Клайперона следует, что так называемый коэффициент сжимаемости для любого газа Zсж = pV/RT = 1. В действительности же коэффициент сжимаемости является переменной величиной, принимающей в зависимости от давления и температуры значения и большие, и меньшие единицы, и только при малых давлениях он равен единице. (см. рис 6.1)
. При отсутствии заряженных частиц газы являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность увеличивается.</p><p>При температурах, начиная с нескольких тысяч градусов всякий газ частично ионизуется и превращается в плазму. Если концентрация зарядов в плазме невелика, то свойства её мало отличаются от свойств обычного газа.</p><p>По магнитным свойствам газы делятся на диамагнитные (к ним относятся, например, инертные газы, H2, N2, CO2, H2O) и парамагнитные (например, O2). Диамагнитны те газы, молекулы которых не имеют постоянного магнитного момента и приобретают его лишь под влиянием внешнего поля. Те же, у которых молекулы обладают постоянным магнитным моментом, во внешнем магнитном поле ведут себя как парамагнетики. Учёт межмолекулярного взаимодействия и внутреннего строения молекул необходим при решении многих проблем физики Г., например при исследовании влияния верхних разреженных слоев атмосферы на движение ракет и спутников.</p><p>Применение законов классичесской статистики с учетом квантовых закономерностей позволяет рассчитать по молекулярным данным термодинамические функции газа (энтропию, внутреннюю энергию, энергии Гельмгольца и Гиббса), константы химического равновесия газофазных реакций, теплоемкость и кинетические характеристики, знание которых требуется при проектировании многих технологических процессов. Так, теплоемкость идеального газа может быть рассчитана в классической теории, если известно число i степеней свободы молекулы. Вклад каждой из вра-щат. и постулат, степеней свободы молекулы в молярную теплоемкость Суд равен R/2, а каждой из колебательных степеней свободы-JR (т. наз. закон равнораспределения). Частица одноатомного газа обладает тремя степенями свободы, соотв. его теплоемкость составляет ЗЯ/2, что хорошо совпадает с экспериментальными данными. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы, и, согласно закону равнораспределения, Суд = 1R/2, однако это значение не совпадает с опытными данными даже при обычных температурах. Наблюдаемое расхождение, а также температурная зависимость теплоемкости газа объясняются квантовой теорией.</p><p>Внутренняя энергия реальных газов.</p><p>Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и из потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ.</p><p style=)
 при давлениях до 50 атм отклонения не превышают 5%, а при давлениях до 10 атм – 2%. Легко конденсирующиеся газы (CO2, SO2, Cl2, CH3Cl) уже при 1 атм обнаруживают отклонения до 2 – 3%.</p><p>Одной из наглядных характеристик отклонений реальных газов от идеального поведения оказывается мольный <a href=)

В точке Е весь образец представляет собой жидкость, и дальнейшее уменьшение объема образца требует значительного давления, поскольку жидкости по сравнению с газами очень трудно сжимаются, что проявляется в резком подъеме кривой слева от точки Е.
Изотерма при температуре Tк играет особую роль в теории состояния вещества. Изотерма, соответствующая температуре ниже Tc, ведет себя так, как уже описано: при определенном давлении газ конденсируется в жидкость, которую можно различать по наличию поверхности раздела. Если же сжатие осуществлять при Tc, то поверхность, разделяющая две фазы, не появляется, а точка конденсации и точка полного перехода в жидкость сливаются в одну критическую точку газа. При температуре выше Tc газ невозможно обратить в жидкость никаким сжатием. Температура, давление и мольный объем в критической точке называются критической температурой Tc, критическим давлением pc и критическим мольным объемом Vc вещества. Собирательно параметры pк, Vк, и Tк называются критическими константами данного газа.
При T > Tк образец представляет собой фазу, полностью занимающую объем содержащего ее сосуда, т. е. по определению является газом. Однако плотность этой фазы может быть значительно большей, чем это типично для газов, поэтому обычно предпочитают название «сверхкритический флюид» (supercritical fluid).
В критической точке изотермический коэффициент сжимаемости 
 и, соответственно, изотерм p – V вблизи критической точки. В то же время критическую температуру можно определить весьма точно как такую температуру, при которой поверхность, разделяющая газообразную и жидкую фазы, исчезает при нагревании и вновь появляется при охлаждении. Зная критическую температуру, можно определить критическую плотность (и, соответственно, критический мольный объем), пользуясь эмпирическим правилом прямолинейного диаметра (правило Кальете-Матиаса), согласно которому средняя плотность жидкости и насыщенного пара является линейной функцией температуры:</p><p style=)
: p(V – νb) = νRT, где постоянная b учитывает собственный мольный <a href=)
При понижении температуры межмолекулярное взаимодействие в реальных газах приводит к конденсации (образование жидкости). Межмолекулярное притяжение эквивалентно существованию в газе некоторого внутреннего давления (иногда его называют статическим давлением). Изначально величина была учтена в общей форме в уравнении Гирна (1865): (p + π ) (V – νb) = νRT.
Ван-дер-Ваальс в 1873 г. дал функциональную интерпретацию внутреннего давления. Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса) обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Считается также, что силы притяжения суммируются с внешним давлением. С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса:


 вместо горизонтальных прямых, соответствующих равновесию жидкости и пара, получаются волнообразные кривые 12345 с тремя действительными корнями, из которых только два, 1 и 5, физически осуществимы. Третий <a href=)
Согласно правилу Максвелла (the Maxwell construction), которое имеет теоретическое обоснование, для того, чтобы расчетная кривая соответствовала экспериментальной равновесной изотерме, нужно вместо кривой 12345 провести горизонтальную прямую 15 так, чтобы площади 1231 и 3453 были равны. Тогда ордината прямой 15 будет равна давлению насыщенного пара, а абсциссы точек 1 и 5 – мольным объемам пара и жидкости при данной температуре.
По мере повышения температуры все три корня сближаются, и при критической температуре Tc все три корня становятся равными. В критической точке изотерма Ван-дер-Ваальса имеет точку перегиба 


, приведенный <a href=)





, так и притягивающую часть.</p><p>Данная курсовая работа посвящена рассмотрению реальных газов с точки зрения физики и физической химии. В ней рассмотрены принципы описания свойств реальных при высоких давлениях и низких температурах, когда классическое уравнение состояния Клайперона-Менделеева уже не имеет смысла.</p><p>Это происходит при увеличение давления, когда расстояние между молекулами начинает сокращаться и они взаимодействуют между собой, что приводит нас к выводу вириальных коэффициэнтов, которые характеризуют потенциалы парных, тройных и т.д. межмолекулярных взаимодействий.</p><p>Учет этих взаимодействий позволяет не только точно рассчитывать рассличные характерные свойства газов, но также и их калорические характеристики, например теплоемкость, при учете которой, также необходимо знать размеры молекул атомов и потенциалы межмолекулярных взаимодействий.</p><p>1. Савельев «Курс общей физики». Учебное пособие для ВТузов. Молекулярная физика. Первый том.</p><p>2. И. И. Новиков «Термодинамика.» 1984.</p><p>3. Т.И.Трофимова «Курс общей физики». Молекулярная физика. Лекции.</p><p>4. К.В.Глаголев «Физическая термодинамика». Том второй.</p><p>5. А.Н.Морозов. МГТУ им. Н.Б.Баумана. 2002г.</p><p>6. В.В. Еремин, С.И. Каргов, Н.Е. Кузьменко «Реальные газы.» 1998</p><p><a href=)


































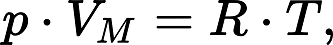
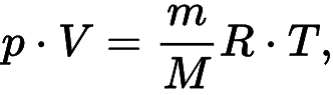
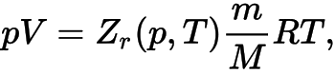
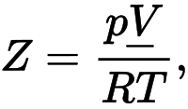

. При высоких давлениях для всех газов Z > 1, т.е. их труднее сжать, чем идеальный газ, поскольку в этой области преобладают силы межмолекулярного отталкивания. Из рисунка видно, что при более низких давлениях для некоторых газов Z 1). Очевидно, что основными причинами отклонений свойств реальных газов от свойств идеального газа оказываются взаимное притяжение молекул и наличие у них собственного объема. Наиболее ярко межмолекулярное притяжение в реальных газах проявляется в их способности к конденсации – переходу в жидкое состояние.</p><p>При понижении температуры или повышении давления наблюдаются отклонения от законов идеального газа. Когда T и P достигают некоторых определенных значений, то происходит конденсация газа, т.е. газ переходит в жидкость. Это явление уже никак не следует из уравнения состояния идеального газа. Рассмотрим его более подробно.</p><p>Рассмотрим, что происходит, когда образец газа в состоянии, отмеченном точкой А на рис. 1.3, сжимается при постоянной температуре.</p><p style=)

 уравнение было получено из модельных представлений о свойствах реальных газов и жидкостей, а не явилось результатом эмпирического подбора функции f(p,V,T), описывающей свойства реальных газов;</p><p>2) уравнение долго рассматривалось как некоторый общий вид уравнения состояния реальных газов, на основе которого было построено много других уравнений состояния (см. ниже);</p><p>3) с помощью уравнения Ван-дер-Ваальса впервые удалось описать явление перехода газа в жидкость и проанализировать критические явления. В этом отношении уравнение Ван-дер-Ваальса имеет преимущество даже перед более точными уравнениями в вириальной форме (см. 1.1, 1.2).</p><p>Причиной недостаточной точности уравнения Ван-дер-Ваальс считал ассоциацию молекул в газовой фазе, которую не удается описать, учитывая зависимость параметров a и b от объема и температуры, без использования дополнительных постоянных. После 1873 г. сам Ван-дер-Ваальс предложил еще шесть вариантов своего уравнения, последнее из которых относится к 1911 г. и содержит пять эмпирических постоянных. Две модификации уравнения предложил Клаузиус, и обе они связаны с усложнением вида постоянной b. Больцман получил три уравнения этого типа, изменяя выражения для постоянной a. Всего известно более сотни подобных уравнений, отличающихся числом эмпирических постоянных, степенью точности и областью применимости. Выяснилось, что ни одно из уравнений состояния, содержащих менее 5 индивидуальных постоянных, не оказалось достаточно точным для описания реальных газов в широком диапазоне p, V, T, и все эти уравнения оказались непригодными в области конденсации газов. Из простых уравнений с двумя индивидуальными параметрами неплохие результаты дают уравнения Дитеричи и Бертло.</p><p>Вириальное уравнение состояния.</p><p style=)
 представляет собой только первый член ряда разложения по степеням переменной (в данном случае p или Vm).</p><p style=)
 = 0</p><p>Поскольку это приведенное уравнение не содержит в явном виде индивидуальных постоянных, оно должно быть применимо к любому веществу. Закон соответственных состояний является общим утверждением, не связанным с конкретным видом уравнения состояния. На практике закон соответственных состояний приближенно выполняется для однотипных веществ, что позволяет, например, использовать для реальных газов обобщенные диаграммы сжимаемости.</p><p style=)
 = 0 говорит не о неверности закона о соответственных состояниях, а о недостаточности двух индивидуальных постоянных и R в уравнении состояния.</p><p>В настоящее время понятно, почему в уравнениях состояния реальных газов двух индивидуальных параметров в общем случае не хватает, но в первом приближении этого достаточно. Причиной всех отклонений от уравнения состояния идеального газа являются межмолекулярные взаимодействия в газах.</p><p>Статистический расчет показывает, что наличие индивидуальных постоянных в уравнении межмолекулярного взаимодействия всегда приводит к появлению индивидуальных постоянных и в уравнении состояния газов. Поэтому в области значений p, V и T, для которых в реальных газах вклад межмолекулярных взаимодействий достаточно велик, в уравнениях состояния появляются индивидуальные постоянные, зависящие от параметров уравнении межмолекулярного взаимодействия. Поэтому в приближенных уравнениях состояния часто оказывается достаточно использовать две индивидуальные постоянные. Если же требуется описать поведение газа с более высокой точностью, необходимо использовать уравнения с бу льшим числом постоянных. Так, например, уравнение Битти – Бриджмена содержит пять постоянных кроме R и считается одним из лучших эмпирических уравнений состояния. В течение некоторого времени оно применялось при составлении справочных таблиц реальных газов. В настоящее время для возможно более точного описания свойств газов используют эмпирическое уравнение Бенедикта – Вебба – Рубина:</p><p style=)

