что такое раас в кардиологии
Что такое раас в кардиологии
Ренин образуется в виде г роренина и секретируется в юкстагломерулярном аппарате (ЮГА) (от латинских слов juxta — около, glomerulus — клубочек) почек миоэпителиоидными клетками приносящей артериолы клубочка, получившими название юкстагломерулярных (ЮГК). Структура ЮГА приведена на рис. 6.27. В ЮГА кроме ЮГК также входит прилегающая к приносящим артериолам часть дистального канальца нефрона, многослойный эпителий которого образует здесь плотное пятно — macula densa. Секреция ренина в ЮГК регулируется четырьмя основными влияниями. Во-первых, величиной давления крови в приносящей артериоле, т. е. степенью ее растяжения. Снижение растяжения активирует, а увеличение — подавляет секрецию ренина. Во-вторых, регуляция секреции ренина зависит от концентрации натрия в мочедистального канальца, которая воспринимается macula densa — своеобразным Na-рецептором. Чем больше натрия оказывается в моче дистального канальца, тем выше уровень секреции ренина. В-третьих, секреция ренина регулируется симпатическими нервами, ветви которых заканчиваются на ЮГК, медиатор норадреналин через бета-адре-норецепторы стимулирует секрецию ренина. В-четвертых, регуляция секреции ренина осуществляется по механизму отрицательной обратной связи, включаемой уровнем в крови других компонентов системы — ангиотен-зина и альдостерона, а также их эффектами — содержанием в крови натрия, калия, артериальным давлением, концентрацией простагландинов в почке, образующихся под влиянием ангиотензина.
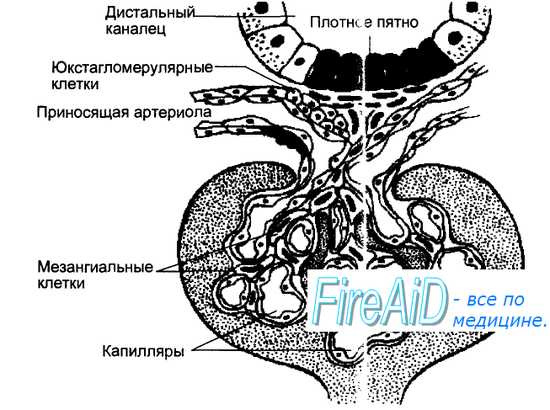
Кроме почек образование ренина происходит в эндотелии кровеносных сосудов многих тканей, миокарде, головном мозге, слюнных железах, клубочковой зоне коры надпочечников.
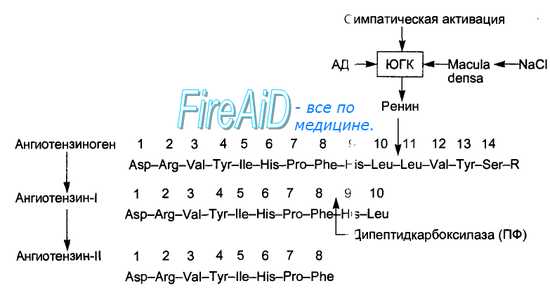
Секретированный в кровь ренин вызывает расщепление альфа-глобулина плазмы крови — ангиотензиногена, образующегося в печени. При этом в крови образуется (рис. 6.1-8) малоактивный декапептид ангиотензин-I, который в сосудах почек, легких и других тканей подвергается действию превращающего фермента (карбоксикатепсин, кининаза-2), отщепляющего от ангиотензина-1 две аминокислоты. Образующийся октапептид ангиотензин-II обладает большим числом различных физиологических эффектов, в том числе стимуляцией клубочковой зоны коры надпочечников, секретирующей альдостерон, что и дало основание называть эту систему ренин-ангиотензин-альдостероновой.
Ангиотензин-II, кроме стимуляции продукции альдостерона, обладает следующими эффектами:
• вызывает сужение артериальных сосудов,
• активирует симпатическую нервную систему как на уровне центров, так и способствуя синтезу и освобождению норадреналина в синапсах,
• повышает сократимость миокарда,
• увеличивает реабсорбцию натрия и ослабляет клубочковую фильтрацию в почках,
• способствует формированию чувства жажды и питьевого поведения.
Таким образом, ренин-ангиотензин-альдостероновая система участвует в регуляции системного и почечного кровообращения, объема циркулирующей крови, водно-солевого обмена и поведения.
Ренин-ангиотензиновая система
Ренин-ангиотензиновая система (РАС) или ренин-ангиотензин-альдостероновая система (РААС) — это гормональная система человека и млекопитающих, которая регулирует кровяное давление и объём крови в организме.
Содержание
Компоненты системы
Компоненты Ренин-ангиотензиновой (Ренин-ангиотензин альдостероновой) системы
Контроль секреции ренина
Активная секреция ренина регулируется четырьмя независимыми факторами:
Контроль секреции ренина — определяющий фактор активности РААС.
Механизм действия Ренин-ангиотензиновой системы
Ренин регулирует начальный, ограничивающий скорость, этап РААС путем отщепления N-концевого сегмента ангиотензиногена для формирования биологически инертного декапептида ангиотензина 1 или Ang-(1-10). Первичный источник ангиотензиногена — печень. Долговременный подъем уровня ангиотензиногена в крови, который происходит во время беременности, при синдроме Кушинга или при лечении глюкокортикоидами, может вызвать гипертензию, хотя и существуют данные о том, что хроническое повышение концентрации ангиотензина в плазме частично компенсируется снижением секреции ренина. Неактивный декапептид Ang 1 гидролизуется ангиотензин-конвериртирующим ферментом (ACE), который отщепляет С-концевой дипептид и, таким образом, формируется октапептид Ang 2 [Ang-(1-8)], биологически активный, мощный вазоконстриктор. АСЕ представляет собой экзопептидазу и секретируется главным образом легочным и почечным эндотелием, нейроэпителиальными клетками. Ферментативная активность АСЕ заключается в повышении вазоконстрикции и снижении вазодилятации.
Новые данные о компонентах Ренин-ангиотензиновой системы
Хотя Ang2 наиболее биологически активный продукт РААС, существуют данные, что другие метаболиты агиотензинов 1 и 2 могу также могут иметь значительную активность. Ангиотензин 3 и 4 (Ang 3 & Ang 4) формируются путем отщепления аминокислот с N-конца от Ангиотензина 2 вследствие действия аминопептидаз А и N. Ang 3 и 4 наиболее часто вырабатываются в тканях с высоким содержанием этих ферментов, например, в мозге и почках. Ang 3 [Ang-(2-8)], гептапептид образующий в результате отщепления аминокислоты с N-конца, наиболее часто он встречается в центральной нервной системе, где Ang III играет важную роль в поддержании кров давления. Ang IV [Ang-(3-8)] гексапептид является результатом дальнейшего ферментативного расщепления AngIII. Предполагается, что Ang 2 и 4 работают кооперативно. В качестве примера можно привести повышение кровяного давления в мозгу, вызываемое действием этих ангиотензинов на AT1-рецептор. Причем этот гемодинамический эффект Ang 4 требует наличия как Ang2 так и самого AT1- рецептора. Пептиды, получаемые отщеплением аминокислот с С-конца, могут также иметь биологическую активность. Например, Ang-(1-7), гептапептидный фрагмент ангиотензина 2, может образовываться как из Ang2 так и из Ang1 действием ряда эндопептидаз или действием карбоксипептидаз (например, гомологом ACE, названным ACE2) конкретно на Ang2. В отличие от ACE, ACE2 не может участвовать в реакции превращения Ang1 в Ang2 и его активность не подавляется ингибиторами ACE (ACEIs). Ang-(1-7) реализующий свои функции через определенные рецепторы, впервые был описан как вазодилататор и как натуральный ингибитор ACEI. Ему также приписываются и кардиопротекторные свойства. ACE2 может также отщеплять одну аминокислоту с С-конца, результатом такого действия является Ang-(1-9), пептид с неизвестными функциями.
Рецепторы к Ангиотензину II
Описаны как минимум 4 подтипа рецепторов к ангиотензину.
Влияние на прочие секреции
Что такое раас в кардиологии
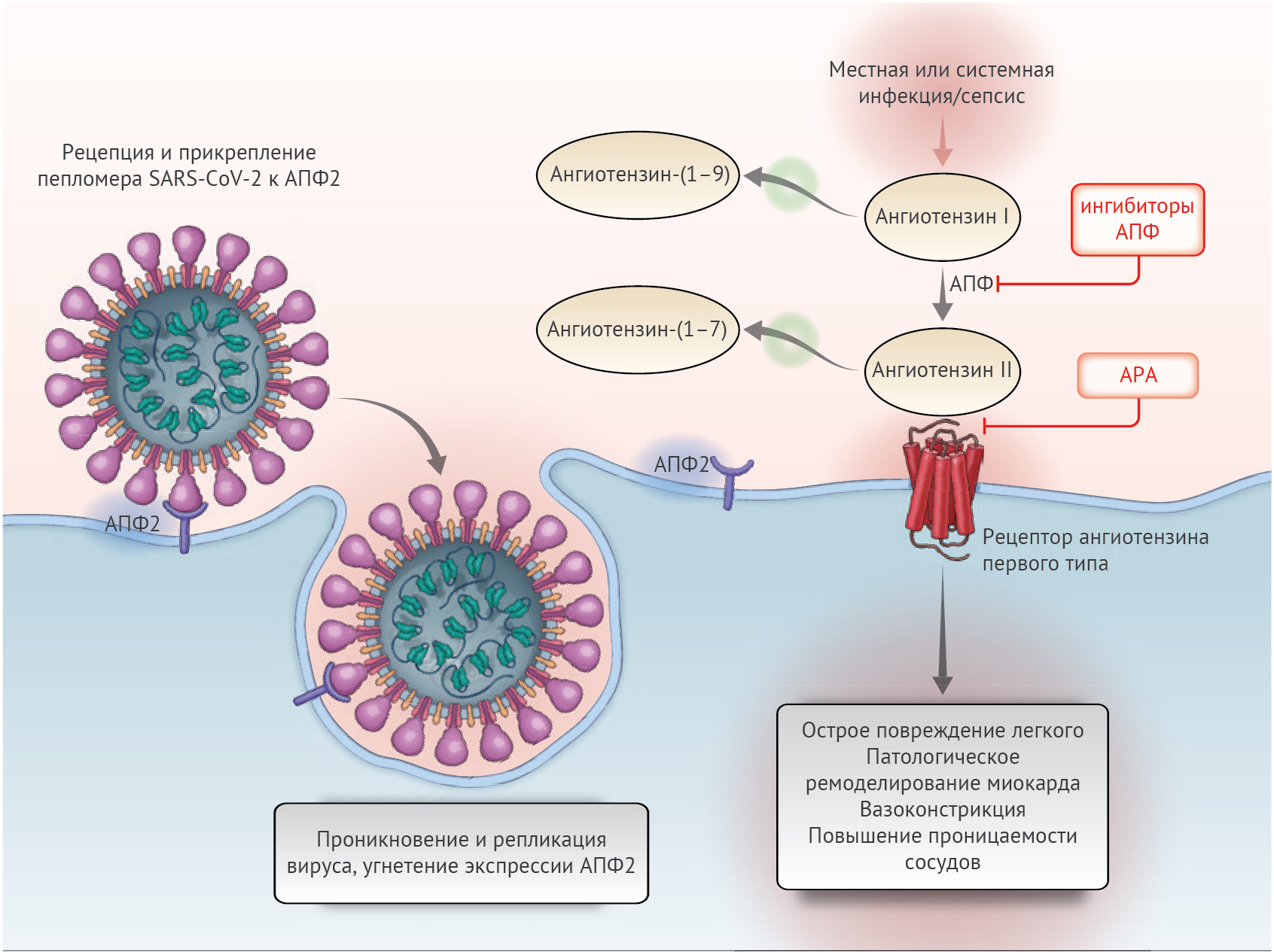
Ренин-ангиотензин-альдостероновая система (РААС) — это элегантный каскад вазоактивных пептидов, организующий ключевые физиологические процессы в теле человека. Коронавирусы тяжелого острого респираторного синдрома SARS-CoV-1 и SARS-CoV-2 стали причиной эпидемии тяжелого острого респираторного синдрома в 2002–2004 годах и текущей пандемии коронавирусной инфекции (COVID-19). Эти вирусы взаимодействуют с РААС через ангиотензин-превращающий фермент 2 (ACE2, АПФ2) — белок, физиологической функцией которого является угнетение активации РААС, но который также служит рецептором для обоих типов вирусов SARS. Эта связь между вирусами SARS и АПФ2 рассматривается как потенциальный фактор инфективности, соответственно, высказываются опасения относительно применения ингибиторов РААС, которые изменяют активность АПФ2, и влияния различий в экспрессии АПФ2 на степень вирулентности вируса в текущей пандемии COVID-19. Действительно, недавно некоторые СМИ и системы здравоохранения призвали к отказу от ингибиторов АПФ и антагонистов рецепторов ангиотензина (АРА) как с профилактической целью, так и в контексте подозрения на COVID-19.
Принимая во внимание обширное применение ингибиторов АПФ и АРА во всем мире, существует срочная потребность в рекомендациях по использованию этих лекарств в терапии пациентов с COVID-19. Здесь мы подчеркиваем, что собранные данные на человеческих выборках весьма скудны и не могут быть применены для подтверждения или опровержения высказываемых гипотез и опасений. В особенности мы обсуждаем неопределенные эффекты блокаторов РААС на уровень и активность АПФ2 у людей и выдвигаем альтернативную гипотезу о том, что изменения АПФ2 могут быть полезны, а не вредны для пациентов с поражениями легких. Также мы недвусмысленно хотим выразить озабоченность касаемо отказа от применения ингибиторов РААС, так как считаем, что это может быть опасным для некоторых пациентов из групп высокого риска с выявленным или подозреваемым COVID-19.
COVID-19 и пожилые пациенты с сопутствующей патологией
Первые доклады обращали внимание на потенциально высокую встречаемость гипертензии среди пациентов с COVID-19 по сравнению с общей популяцией. В самой большой серии случаев из Китая, собранных во время пандемии, гипертензия была самой часто встречаемой сопутствующей патологией у 1099 пациентов, что составляло примерно 15 % от выборки, однако эти значения оказываются ниже, чем встречаемость гипертензии у пациентов с другими вирусными инфекциям, и ниже, чем частота гипертензии в популяции Китая.
По данным докладов, сопутствующие патологии, включая гипертензию, встречались гораздо чаще у пациентов с тяжелым течением COVID-19, требующих перемещения в отделения интенсивной терапии и назначения ИВЛ, или у погибших пациентов в сравнении с пациентами с более мягким течением. Высказываются опасения, что терапия сопутствующих патологий, в том числе применение ингибиторов РААС, могла внести вклад в исход основного заболевания. Однако эти исходы наблюдались также в тесной связи с пожилым возрастом, который в настоящее время считается самым значимым предиктором COVID-19-ассоциированной смерти. К сожалению, на сегодняшний день в докладах недостаточное внимание уделяется возрасту или иным важным факторам, которые могут выступать в качестве потенциальных предикторов риска. Для других инфекционных заболеваний сопутствующие патологии, такие как гипертензия, являются ключевыми прогностическими факторами, что, скорее всего, верно и в отношении COVID-19.
Важно отметить, что, несмотря на заключения о применении ингибиторов РААС, в этих работах отсутствуют конкретные данные. Согласно популяционным исследованиям, доля получающих антигипертензивную терапию от общего числа больных гипертензией в Китае составляет всего от 30 до 40 %. Ингибиторы РААС как базовую терапию или в составе комбинированной терапии получают только 25–30 %пациентов, проходящих лечение. Представленные данные позволяют оценить, что лишь незначительная часть пациентов с COVID-19 получала терапию ингибиторами РААС, по крайней мере в Китае. Необходимо получить информацию о связи терапии ингибиторами РААС и соответствующими исходами основного заболевания со строгим учетом показаний к терапии и тяжести сопутствующего заболевания у пациентов с COVID-19.
Неопределенные эффекты ингибиторов РААС на АПФ2 у людей
Тканеспецифичные и системные компоненты РААС составляют сложную переплетающуюся сеть активирующих и ингибирующих пептидов (рис. 1). АПФ2 — важнейший ингибирующий белок, ответственный за распад ангиотензина II до ангиотензина-(1–7), который таким образом ослабляет его эффекты на вазоконстрикцию, задержку натрия и процессы фиброзирования. Хотя ангиотензин II и является главным субстратом АПФ2, этот фермент также может превращать ангиотензин I в ангиотензин-(1–9) и участвовать в гидролизе иных пептидов. В исследованиях на людях была показана обширная экспрессия АПФ2 в образцах ткани, полученных из 15 органов, в числе которых были сердце и почки, а также в основных клетках-мишенях SARS-CoV-2 (c манифестными признаками поражения) — альвеолярном эпителии легких. Определенный интерес вызывает низкий уровень растворимых форм АПФ2 в системном кровотоке вместе с относительно низкой функциональной ролью АПФ2 в легочной ткани в нормальных условиях. Однако существуют клинические состояния, способствующие активации этого звена.
Можно ожидать, что ингибиторы АПФ и АРА оказывают разное влияние на уровень АПФ2, так как их эффекты на ангиотензин II (основной субстрат АПФ2) различаются. Несмотря на существенную структурную гомологию между АПФ и АПФ2, их активные центры различны. В результате этого ингибиторы АПФ не влияют на активность АПФ2 напрямую. Экспериментальные животные модели позволили обнаружить смешанное воздействие ингибиторов АПФ на уровни АПФ2 и его активность в тканях. Подобные противоречивые результаты в исследованиях на животных моделях наблюдались и в отношении влияния АРА на АПФ2. В одних исследованиях была обнаружена усиленная экспрессия матричной РНК АПФ2 или же увеличенные концентрации самого АПФ2, другие же работы не нашли никаких эффектов.
В отличие от работ на животных моделях, существует мало исследований эффектов ингибиторов РААС на экспрессию АПФ2 на людях. В одной работе описано, что внутривенное введение ингибиторов АПФ пациентам с коронарной недостаточностью никак не повлияло на продукцию ангиотензина-(1–7), что ставит под вопрос влияние ингибиторов АПФ на АПФ2-опосредованный метаболизм ангиотензина II вообще. Аналогично, в другом исследовании среди пациентов с гипертензией уровни ангиотензина-(1–7) остались неизменными после назначения ингибитора АПФ каптоприла. Однако если монотерапия каптоприлом продолжалась 6 месяцев, уровень ангиотензина-(1–7) увеличился. Кроме того, в нескольких исследованиях изучалась активность АПФ2 в плазме или концентрация АПФ2 в моче у пациентов на длительной терапии ингибиторами РААС. В кросс-секционных исследованиях пациентов с сердечной недостаточностью, фибрилляцией предсердий, аортальным стенозом и коронарной недостаточностью, принимающих ингибиторы АПФ или АРА, активность АПФ2 в плазме не отличалась от пациентов с такими же заболеваниями, не получавших терапии. В лонгитюдном когортном исследовании японских пациентов с гипертензией уровень АПФ2 в моче пациентов, получавших длительное лечение АРА олмесартаном, был выше, чем в контрольной группе, не получавшей терапии, но такого эффекта не наблюдалось в отношении ингибитора АПФ эналаприла или других АРА (лозартан, кандесартан, валсартан, и телмисартан). Предшествующая терапия ингибиторами АПФ связывалась с ростом уровня матричной РНК АПФ2 в тканях кишки, но никакой связи между терапией АРА и количеством РНК АПФ2 выявлено не было; влияние ингибиторов РААС на экспрессию АПФ2 в легочной ткани неизвестно.
Эти противоречивые данные указывают на всю сложность устройства ответов РААС на модуляторы и подтверждают предположение о том, что выводы доклинических исследований на модельных организмах нельзя однозначно переносить на человеческую физиологию. Это наводит на мысль, что воздействие ингибиторов РААС на АПФ2 может принимать различные формы в зависимости от конкретного препарата данного класса. Важно отметить, что уровни АПФ2 в плазме могут быть не показательны в отношении полноразмерной мембраносвязанной формы, частично из-за того, что процесс отделения АПФ2 от мембраны отдельно регулируется эндогенным ингибитором. Помимо степени экспрессии, значимость роли АПФ2 может различаться в зависимости от конкретной ткани или клинического состояния. К сожалению, отсутствуют данные о влиянии ингибиторов АПФ, АРА и других ингибиторов РААС на экспрессию АПФ2 в легочной ткани. Более того, даже если ингибиторы РААС и влияют на уровень и/или активность АПФ2 в тканях-мишенях, нет клинических данных о том, что это влияет на процесс связывания и проникновения пепломеров SARS-CoV-2 в клетку. Необходимо дальнейшее изучение взаимного влияния SARS-CoV-2 и РААС на людях.
Потенциальная польза ингибиторов РААС при COVID-19
SARS-CoV-2 не только использует АПФ2 для проникновения в клетку, он также угнетает его дальнейшую экспрессию, что приводит к прекращению его органопротективного действия. В настоящее время предполагается, хоть и без каких-либо доказательств, что непрерывное действие ангиотензина II может частично влиять на степень повреждения органа при COVID-19. Сразу после рецепции и прикрепления пепломера вируса начинается процесс последовательного снижения концентрации АПФ2 на поверхности мембраны. Продолжительно персистирующая вирусная инфекция и репликация вирионов также вносят вклад в снижение экспрессии АПФ2, во всяком случае на клеточных культурах in vitro. Угнетение активности АПФ2 в легких обусловливает первичную инфильтрацию нейтрофилов в ответ на бактериальные эндотоксины и может вести к чрезмерному накоплению освободившегося от ингибирования ангиотензина II и местной активации РААС. Действительно, в экспериментальных моделях на мышах воздействие пепломеров SARS-CoV-1 вызывало острое поражение легких, которое ограничивалось блокадой РААС. В экспериментах с другими мышиными моделями авторы пришли к выводу, что дисрегуляция АПФ2 может способствовать вторичному острому поражению легких при первичном поражении вирулентными штаммами вируса гриппа и респираторно-синцитиального вируса человека. В небольшом исследовании проследили корреляцию между повышенным уровнем плазменного ангиотензина II с общей вирусной нагрузкой и степенью тяжести поражения легких у пациентов с COVID-19. Восстановление уровня АПФ2 посредством введения рекомбинантного препарата АПФ2 позволило обратить разрушительные процессы в легочной ткани на доклинических моделях иных острых вирусных инфекций, а в испытаниях второй фазы у людей с острым респираторным дистресс синдромом безопасно снизить уровень ангиотензина II.
Дисрегуляция АПФ2 при COVID-19 в теории может привести к снижению его кардиопротективного эффекта при вовлечении миокарда и аномальной легочной гемодинамики. Уровни маркеров повреждения миокарда повышались во время развития COVID-19 и продолжали нарастать при ухудшении течения заболевания и перед смертью. Многие вирусы кардиотропны, и многие вирусемии сопровождаются субклиническим вирусным миокардитом. Роль АПФ2 в ответе миокарда на повреждения и его восстановлении хорошо известна. Так, в одном исследовании на животных с нокаутированным геном АПФ2 у них развивались крайне неблагоприятные процессы ремоделирования левого желудочка в ответ на острое повреждение в связи с накоплением ангиотензина II. При аутопсии пациентов, погибших от SARS, в 35 % образов сердец было обнаружено присутствие вирусной РНК, которое, в свою очередь, было ассоциировано со сниженной экспрессией АПФ2. Введение рекомбинантного АПФ2 нормализовало уровень ангиотензина II в изолированных сердцах человека, пораженных дилатационной кардиомиопатией. Данные гипотезы легли в основу испытаний рекомбинантного препарата АПФ2 для восстановления баланса РААС и потенциального предотвращения органного повреждения. В дополнении к этому, на текущий момент проводятся парные исследования лозартана для лечения COVID-19 на пациентах, не получавших ранее терапию блокаторами РААС, которые были госпитализированы, и на пациентах, не имевших госпитализаций в анамнезе.
Продолжение применения блокаторов РААС у пациентов с выявленным или подозреваемым COVID-19
Несмотря на приведенные теоретические противоречия относительно влияния фармакологический регуляции АПФ2 на инфективность SARS-CoV-2, существует явный риск здоровью при отмене терапии блокаторами РААС у пациентов, которые в остальном находятся в стабильном состоянии. COVID-19 протекает особенно тяжело у пациентов с сопутствующими кардиоваскулярными патологиями, что ведет к активному поражению миокарда, миокардиальному стрессу, и кардиомиопатии. Блокаторы РААС показали клиническую эффективность в отношении протективного действия на сердце и почки, их отмена может привести к клинической декомпенсации у пациентов в группах высокого риска.
Несмотря на то, что данные по сердечной недостаточности нечасто встречаются в эпидемиологических докладах из Китая, встречаемость сердечной недостаточности среди пациентов в критическом состоянии в США может быть велика (> 40 %). В клинических испытаниях квинаприла для лечения сердечной недостаточности было продемонстрировано серьезное прогрессирующее ухудшение состояния пациентов с хронической симптоматической сердечной недостаточностью. В исследовании TRED-HF среди пациентов с асимптоматической сердечной недостаточностью и восстановленной фракции выброса левого желудочка был продемонстрирован стремительный рецидив дилатационной кардиомиопатии сразу после прекращения терапии (в том числе терапии блокаторами РААС). Более того, блокаторы РААС являются базисной терапией после инфаркта миокарда: продолжительная терапия на протяжении нескольких дней или недель после указанного события показала снижение ранней смертности. Инфаркт миокарда, ассоциированный с COVID-19, может быть более опасным среди клинически нестабильных пациентов в случае отмены блокаторов РААС.
Отмена блокаторов РААС, назначенных для контроля гипертензии, может нести меньшие риски, нежели их отмена при состояниях, для которых они показаны множеством клинических рекомендаций как базисный метод терапии, однако в этом случае она может быть сопряжена с иными трудностями. Отмена блокаторов РААС для перехода на другую антигипертензивную терапию у стабильных амбулаторных пациентов должна проводиться осторожно во избежание эффекта рикошета. Более того, подбор эквивалентной дозы иной антигипертензивной терапии может быть проблематичным на практике и зависеть от индивидуальных особенностей каждого пациента. Даже малые и непродолжительные скачки АД после смены терапевтической тактики связаны с избыточным кардиоваскулярным риском. Это может быть особенно важно у пациентов с COVID-19 — инфекцией, влекущей за собой активацию РААС, в странах, где не достигнут адекватный контроль артериального давления в популяции (например, в Китае).
Эффекты при отмене блокаторов РААС или при переходе на другие схемы терапии у пациентов с хронической болезнью почек (ХБП) остаются неопределенными. Хотя в Китае частота встречаемости ХБП, госпитализированных по поводу COVID-19, достаточно низка (1–3 %), в других странах и у пациентов в критическом состоянии встречаемость ХБП может быть выше. Многие пациенты испытывают острую почечную недостаточность разной степени в течении болезни. Для этих групп высокого риска рекомендуется принимать индивидуальные решения по терапевтической тактике в отношении блокаторов РААС, руководствуясь гемодинамическим статусом, функцией почек и клинической стабильностью.
На основе доступных данных мы считаем, что несмотря на теоретические опасения и неопределенность в отношении эффектов блокаторов РААС на АПФ2 и потенциального влияния этих препаратов на течение COVID-19, терапия блокаторами РААС должна быть продолжена у пациентов в стабильном состоянии, имеющих риск заражения или уже болеющих COVID-19 (см. сноску). Данную позицию сейчас поддерживает множество профессиональных ассоциаций (Таблица S2). Несмотря на то, что дополнительные данные могут влиять на принятие решений о терапии пациентов с COVID-19 из групп высокого риска, врачи должны осознавать нежелательные последствия преждевременного прекращения доказанной терапии из-за гипотетических опасений, основанных на неполных экспериментальных данных.
Ключевые положения взаимодействия между COVID-19 и ренин-ангиотензин-альдостероновой системой
Сложные взаимодействия в ренин-ангиотензин-альдостероновой системе
Ренин-ангиотензин-альдостероновая система (РААС) – это сигнальный путь, отвечающий в организме за регуляцию артериального давления.
При понижении артериального давления или в стрессовых ситуациях почки выделяют фермент, который называется ренином. Ренин расщепляет белок ангиотензиноген, в результате чего образуется ангиотензин I. Он преобразуется еще одним ферментом, который называется ангиотензин-превращающий фермент (АПФ), в ангиотензин II.
Ангиотензин II не только вызывает сужение кровеносных сосудов (вазоконстрикцию), он одновременно стимулирует выделение гормона вазопрессина (также называемого АДГ) в гипофизе, а также адреналина, норадреналина и альдостерона в надпочечниках.
В то время как адреналин и норадреналин усиливают вазоконстрикцию, альдостерон воздействует на фильтрационную функцию почек. Почки задерживают в организме натрий и воду, при этом увеличивая выделение калия. Вазопрессин препятствует выведению воды из организма не оказывая влияния на электролиты калия и натрия.
Ангиотензин, альдостерон и вазопрессин также могут оказывать и прямое воздействие на сердце. При определенных процессах ремоделирования, например, после сердечного приступа, эти гормоны участвуют в патологическом увеличении сердца или развитии рубцовой ткани, что, в конце концов, может приводить к развитию сердечной недостаточности.
Ряд препаратов, применяемых в кардиологии, воздействует на ренин-ангиотензин-альдостероновую систему. Например, диуретики повышают выделение воды из организма и, таким образом, уменьшают объем крови; ингибиторы АПФ блокируют фермент, который необходим для образования ангиотензина II – прерывая, таким образом, сигнальный путь. Bayer также участвует в исследованиях ренин-ангиотензин-альдостероновой системы (РААС) и рецепторов вазопрессина.