что такое р2о5 в химии
Содержание питательного вещества р2о5 в простом суперфосфате
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Оксид фосфора (III) – это кислотный оксид. Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6.
Получитьоксид фосфора (III) можно окислением фосфора при недостатке кислорода:
4P + 3O2 → 2P2O3
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
Например, оксид фосфора (III) диспропорционирует в горячей воде:
2Р2О3 + 6Н2О (гор.) → РН3 + 3Н3РО4
2. При взаимодействии с окислителямиP2O3 проявляет свойства восстановителя.
Например, N2O окисляется кислородом:
Р2О3 + О2 → Р2О5
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
Р2О3 + 3Н2О → 2Н3РО3
а со щелочами – с образованием солей (фосфитов):
Р2О3 + 4KOH → 2K2HРО3 + H2O
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
4P + 5O2 → 2P2O5
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2HNO3 → 2HPO3 + N2O5
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
P2O5 + 3H2O → 2H3PO4
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
P2O5 + 2H2O → 2H4P2O7
P2O5 + H2O → HPO3
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3.Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями.
Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении):
P2O5 + 3BaO → Ba3(PO4)2
Химические и физические свойства
Оксид фосфора – бесцветное аморфное или стекловидное вещество, существующеев трех кристаллических, двух аморфных и двух жидких формах. Токсичное вещество. Вызывает ожоги кожи и раздражение слизистой оболочки.
Пентаоксид фосфора очень гигроскопичен. Реагирует со спиртами эфирами, фенолами, кислотами и прочими веществами. В процессе реакции с органическими веществами происходит разрыв связей фосфора с кислородом, и образуются фосфорорганические соединения. Вступает в химические реакции с аммиаком (NH3) и галогеноводородами с образованием фосфатов аммония и оксигалогенидов фосфора. С основными оксидами образует фосфаты.
Графическая (структурная) формула оксида фосфора 5
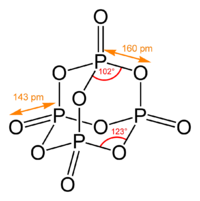
Структурная (графическая) формула оксида фосфора (V) является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 2). Оксид фосфора (V) может димеризоваться (соответствует химической формуле P4O10) и существование его в такой форме наиболее предпочтительно.
Рис. 2. Графическая формула оксида фосфора (V).
Состав
Простой суперфосфат в своем составе имеет фосфор, который присутствует в виде свободной фосфорной кислоты и фосфата кальция. В небольших количествах содержится гипс, а также иные примеси (фосфаты алюминия и железа, соединения фтора, кремнезём).
Получение оксида фосфора (V):
P4 + 5O2 → P4O10 (t = 34-60 °C).
Готовый продукт состоит из смеси разных форм P4O10.
Реакции, в которых участвует Оксид фосфора
Форма выпуска
Гранулированный продукт или сыпучий порошок, светло-серого цвета (возможны оттенки от белого до темно-серого окраса). Полностью растворяется в воде.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной киcлоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Поглощение пентаоксида фосфора растениями
Как указывалось выше, в природе основной источник фосфора – это соли ортофосфорнонй кислоты H3PO4. Однако после гидролиза пиро-, поли- и метафосфаты так же используются практически всеми культурами.
Гидролиз пирофосфата натрия:
Na4P2O7 + H2O + 2H+ → 2NaH2PO4 +2Na+
Гидролиз триполифосфата натрия:
Na5P3O10 + 2H2O + 2H+ → 3NaH2PO4 +2Na+
Гидролиз метафосфат иона (в кислой среде):
(PO3)66- + 3H2O → H2P3O103- + H2P2O72- + H2PO4-
Опытным путем установлено, что поглощаемый корнями фосфор прежде всего идет на синтез нуклеотидов, а для дальнейшего продвижения в наземную часть фосфаты вновь поступают в проводящие сосуды корня в виде минеральных соединений.
Модификации оксида фосфора:
Твердый оксид фосфора (V) склонен к полиморфизму. Существуют три формы-модификации оксида фосфора (V): H, O`, O и G формы-модификации.
| гексагональная H-форма | орторомбическая O`-форма | орторомбическая O-форма | G-форма | |
| Состояние вещества | Кристаллический вид | Кристаллический | Кристаллический вид | Стекловидный вид |
| Характер стабильности формы | Метастабильная форма | Стабильная форма | Метастабильная форма | |
| Другие характеристики | a=0,744 нм, угол = 87°, пространственная группа R3C | a=1,63 нм, b=0,814 нм, c=0,526 нм, пространственная группа Fdd2 | a=0,923 нм, b = 0,718 нм, c = 0,494 нм, пространственная группа Pnam |
H-форма переходит в O-форму при 300-360 °C (процесс заканчивается при 378 °C).
Рерасчет содержения фосфора в удобрениях
В некоторых случаях требуется рассчитать процентное содержание фосфора в удобрении, если дано содержание по P2O5. Расчет производится по формуле:
y = x,% × 30,974 (молярная масса P) × 2 / 30,974 (молярная масса P) × 2 + 15,999 (молярная масса O) × 5
х – содержание P2O5 в удобрении, %;
y – содержание P в удобрении, %
y = x, % × 0,43643
в удобрении содержится 40% оксида фосфора
для пересчета процентного содержания элемента фосфор в удобрении нужно умножить массовую долю оксида в удобрении на массовую долю элемента в оксиде (для P2O5 – 0,43643): 40 * 0,43643 = 17,4572 %
Оксид фосфора (V)
Оксид фосфора (V) [P2O5] – соединение фосфора с кислородом, существует в виде димера P4O10 (декаоксид тетрафосфора). Наиболее употребима формула состава P2O5 (пентаоксид фосфора).
Устаревшее название – фосфорный ангидрид. Является действующим веществом всех фосфорсодержащих удобрений
Традиционно содержание Фосфора в удбрениях выражают содержанием Оксида фосфора.
Все свойства Фосфора, как питательного элемента описаны в статье Фосфор.
Химические и физические свойства
Оксид фосфора – бесцветное аморфное или стекловидное вещество, существующеев трех кристаллических, двух аморфных и двух жидких формах. [1]
Токсичное вещество. Вызывает ожоги кожи и раздражение слизистой оболочки.
Пентаоксид фосфора очень гигроскопичен. Реагирует со спиртами эфирами, фенолами, кислотами и прочими веществами. В процессе реакции с органическими веществами происходит разрыв связей фосфора с кислородом, и образуются фосфорорганические соединения. Вступает в химические реакции с аммиаком (NH3) и галогеноводородами с образованием фосфатов аммония и оксигалогенидов фосфора. С основными оксидами образует фосфаты. [3]
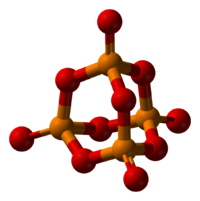
Трехмерная модель молекулы
Содержание пентаоксида фосфора в почве и удобрениях
Фактически в почве имеются только соли ортофосфорной кислоты H3PO4, но в сложных удобрениях могут быть и соли мета-, пиро- и полифосфорных кислот. [4]
Основой для образования ортофосфорной кислоты является пентаоксида фосфора. Именно поэтому, а так же в связи с тем, что растения не поглощают элементарный фосфор, условлено обозначать концентрацию фосфора через содержание пентаоксида фосфора. [2]
P2O5 + 3H2O → 2H3PO4
Двузамещенные соли двухвалентных катионов в воде не растворимы, но легко растворяются в слабокислых кислотах корневых выделений и органических кислотах жизнедеятельности микроорганизмов. В этой связи они так же являются хорошим источником P2O5 для растений. [4]
Поглощение пентаоксида фосфора растениями
Как указывалось выше, в природе основной источник фосфора – это соли ортофосфорнонй кислоты H3PO4. Однако после гидролиза пиро-, поли- и метафосфаты так же используются практически всеми культурами.
Гидролиз пирофосфата натрия:
Гидролиз триполифосфата натрия:
Гидролиз метафосфат иона (в кислой среде):
Некоторые растения приспособились усваивать фосфат-ион из фосфорорганических соединений (фитин, глицефосфаты и прочее). Корни данных растений выделяют особый фермент (фотофтазу), который и отщипляет анион фосфорной кислоты от органических соединений, а затем растения поглощают этот анион. К подобного рода растениям относятся горох, бобы, кукуруза. Причем фосфатазная активность возрастает в условиях фосфорного голода.
Опытным путем установлено, что поглощаемый корнями фосфор прежде всего идет на синтез нуклеотидов, а для дальнейшего продвижения в наземную часть фосфаты вновь поступают в проводящие сосуды корня в виде минеральных соединений. [4]
Рерасчет содержения фосфора в удобрениях
В некоторых случаях требуется рассчитать процентное содержание фосфора в удобрении, если дано содержание по P2O5. Расчет производится по формуле:
y = x,% × 30,974 (молярная масса P) × 2 / 30,974 (молярная масса P) × 2 + 15,999 (молярная масса O) × 5
х – содержание P2O5 в удобрении, %;
y – содержание P в удобрении, %
y = x, % × 0,43643
в удобрении содержится 40% оксида фосфора
для пересчета процентного содержания элемента фосфор в удобрении нужно умножить массовую долю оксида в удобрении на массовую долю элемента в оксиде (для P2O5 – 0,43643): 40 * 0,43643 = 17,4572 %
Химические свойства оксида фосфора 5 и его применение
Оксид фосфора (V) — что это такое
Оксид фосфора (V) является кислотным оксидом. Представляет собой кристаллическое вещество белого цвета молекулярного строения.
Химическая формула оксида фосфора (V):
P 4 O 10 и P 2 O 5
Структурные модификации оксида фосфора (V):
Характеристика модификаций оксида фосфора (V) с разным строением:
Химические и физические свойства
Список физических свойств оксида фосфора (V):
Оксид фосфора (V) относят к группе кислотных оксидов неметаллов. К примеру, оксид кремния (IV) и оксид серы (VI) также являются кислотными оксидами.
Взаимодействие оксида фосфора (V) с белым фосфором можно описать с помощью уравнения:
3 P 4 O 10 + 2 P 4 → 5 P 4 O 6 ( t = 50 ° C )
Результатом реакции является образование оксида фосфора (III).
При соединении оксида фосфора (V) с натрием образуются соли метафосфат натрия N a P O 3 и фосфид натрия N a 3 P :
Химическая реакция оксида фосфора (V) и лития приводит к образованию солей в виде метафосфата лития L i P O 3 и фосфида лития L i 3 P :
При контакте оксида фосфора (V) со фтором образуются оксид-трифторид фосфора(V) и кислород:
P 4 O 10 + 6 F 2 → 4 P O F 3 + 3 O 2 ( t = 100 ° C )
Химическая реакция оксида фосфора (V) и воды протекает таким образом:
P 4 O 10 + 6 H 2 O → 4 H 3 P O 4 или P 2 O 5 + 3 H 2 O → 2 H 3 P O 4
P 4 O 10 + 2 H 2 O → 4 H P O 3 или P 2 O 5 + H 2 O → 2 H P O 3
Взаимодействие оксида фосфора (V) с оксидом кальция приводит к образованию солей:
C a O + P 2 O 5 → C a ( P O 3 ) 2
2 C a O + P 2 O 5 → C a 2 P 2 O 7
3 C a O + P 2 O 5 → C a 3 ( P O 4 ) 2 ( t ° )
Взаимодействие оксида фосфора (V) с оксидом натрия приводит к образованию соли в виде ортофосфата натрия:
3 N a 2 O + P 2 O 5 → 2 N a 3 P O 4
Реакция оксида фосфора (V) и оксида бора является процессом образования фосфата бора:
2 B 2 O 3 + P 4 O 10 → 4 B P O 4 ( t ° )
В процессе реакции оксида фосфора (V) и гидроксида натрия образуются соль ортофосфат натрия и вода:
P 4 O 10 + 12 N a O H → 4 N a 3 P O 4 + 6 H 2 O или P 2 O 5 + 6 N a O H → 2 N a 3 P O 4 + 3 H 2 O
Оксид фосфора (V) вступает в реакцию с плавиковой кислотой, что приводит к образованию оксида-трифторида фосфора и метафосфорной кислоты:
Оксид фосфора (V) реагирует с бромоводородом, что в результате позволяет получить оксид-трибромид фосфора и метафосфорную кислоту:
P 4 O 10 + 3 H B r → P O B r 3 + 3 H P O 3 ( t = 200 ° C )
Взаимодействие оксида фосфора (V) с азотной кислотой с образованием оксида азота и метафосфорной кислоты:
4 H N O 3 + P 4 O 10 → 2 N 2 O 5 + 4 H P O 3 или 2 H N O 3 + P 2 O 5 → N 2 O 5 + 2 H P O 3 ( t = – 10 ° C )
Оксид фосфора (V) взаимодействует с ортофосфорной кислотой, что сопровождается образованием дифосфорной (пирофосфорной) кислоты:
Взаимодействие оксида фосфора (V) и пероксида водорода с образованием дипероксодиоксофосфата водорода и воды:
P 4 O 10 + 8 H 2 O 2 → 4 H 3 P O 2 ( O 2 ) 2 + 2 H 2 O ( t = – 20 ° C )
В процессе реакции оксида фосфора (V) с амидами они превращаются в нитрилы. При взаимодействии вещества со спиртами, эфирами, фенолами, другими органическими соединениями образуются фосфорорганические соединения.
Получение и использование оксида фосфора (V)
Практическое применение полученного в результате данной химической реакции оксида фосфора (V) заключается в его использовании для осушения газообразных и жидких веществ, в органическом синтезе (как водоотнимающее средство). Соединение активно используют в производстве такой продукции, как:
Другим соединением фосфора является фосфин. Вещество представляет собой ядовитый газ c неприятным запахом, самовоспламеняющийся на воздухе. Фосфин является продуктом разложения органических веществ.
Оксид фосфора (V), свойства, получение, химические реакции
Оксид фосфора (V), свойства, получение, химические реакции.
Оксид фосфора (V) – неорганическое вещество, имеет химическую формулу P4O10 и P2O5.
Краткая характеристика оксида фосфора (V). Формула оксида фосфора (V) :
Оксид фосфора (V) – неорганическое вещество белого цвета.
Оксид фосфора (V) содержит четыре атома фосфора и десять атомов кислорода.
Химическая формула оксида фосфора (V) P4O10 и P2O5. Для простоты записи используют последнюю формулу.
В воде не растворяется, а взаимодействует с ней, образуя кислоты.
Модификации оксида фосфора (V):
Твердый оксид фосфора (V) склонен к полиморфизму. Существуют три формы-модификации оксида фосфора (V): H, O`, O и G формы-модификации.
| гексагональная H-форма | орторомбическая O`-форма | орторомбическая O-форма | G-форма | |
| Состояние вещества | Кристаллический вид | Кристаллический | Кристаллический вид | Стекловидный вид |
| Характер стабильности формы | Метастабильная форма | Стабильная форма | Метастабильная форма | |
| Другие характеристики | a=0,744 нм, угол = 87°, пространственная группа R3C | a=1,63 нм, b=0,814 нм, c=0,526 нм, пространственная группа Fdd2 | a=0,923 нм, b = 0,718 нм, c = 0,494 нм, пространственная группа Pnam |
H-форма переходит в O-форму при 300-360 °C (процесс заканчивается при 378 °C).
Оксид фосфора(V)
| Оксид фосфора(V) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид фосфора(V) |
| Химическая формула | P4O10 |
| Физические свойства | |
| Состояние (ст. усл.) | белый порошок |
| Отн. молек. масса | 283.889 а. е. м. |
| Молярная масса | 283.889 г/моль |
| Плотность | 2.39 г/см³ |
| Термические свойства | |
| Температура плавления | 420 о С(Н-форма),569 (О-форма) °C |
| Температура кипения | возгоняется при 359 (Н-форма) °C |
| Энтальпия образования (ст. усл.) | -3010,1 кДж/моль |
| Химические свойства | |
| Растворимость в воде | реагирует г/100 мл |
| Классификация | |
| Рег. номер CAS | [1314-56-3] (P2O5) [16752-60-6] (P4O10) |
Пентаокс́ид фосфора (фо́сфорный ангидрид, пятиокись фосфора, оксид фосфора(V)) — P2O5, кислотный оксид.
Содержание
Строение
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b — 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P2O5 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360 о С) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (
580 о С) и менее химически активны. H-форма переходит в О-форму при 300—360 о C.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:

Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твердые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Литература
Полезное
Смотреть что такое «Оксид фосфора(V)» в других словарях:
Оксид фосфора — Оксид фосфора: Оксид фосфора(III) Оксид фосфора(V) … Википедия
Оксид фосфора(III) — Оксид фосфора(III) … Википедия
Фосфора оксиды — Известны следующие оксиды фосфора: Название Формула Температура плавления Температура кипения Оксид фосфора(III) P2O3 (P4O6) 23.8 °C 173.5 °C Оксид фосфора(V) P2O5 (P4O10) 569 °C 591 °C … Википедия
Оксид углерода(II) — Оксид углерода(II) … Википедия
фосфора(V) оксид — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
фосфора(III) оксид — fosforo(III) oksidas statusas T sritis chemija formulė P₂O₃ atitikmenys: angl. phosphorus trioxide; phosphorus(III) oxide rus. фосфора трехокись; фосфора(III) оксид; фосфористый ангидрид ryšiai: sinonimas – difosforo trioksidas … Chemijos terminų aiškinamasis žodynas
фосфора пентоксид — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
фосфора пятиокись — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
Оксид углерода (II) — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
фосфора трехокись — fosforo(III) oksidas statusas T sritis chemija formulė P₂O₃ atitikmenys: angl. phosphorus trioxide; phosphorus(III) oxide rus. фосфора трехокись; фосфора(III) оксид; фосфористый ангидрид ryšiai: sinonimas – difosforo trioksidas … Chemijos terminų aiškinamasis žodynas



















