что такое протонирование в химии
Что такое протонирование в химии
ПРОТОНИРОВАНИЕ, процесс переноса протона с кислоты на прогофильную частицу (основание):
Доноры протонов в ПРОТОНИРОВАНИЕ-кислоты Брёнстеда (см. Кислоты и основания), в частности ОН-, NH-, СН- и вообще ЭН-кис-лоты (см. СН-кислоты), акцепторы-различные основания. Возможность протекания ПРОТОНИРОВАНИЕ обусловлена относит. силой кислоты и основания. Например, для таких сильных оснований, как карбанионы или амидные анионы, донорами протонов могут служить весьма слабые СН-кислоты; сильные протонные кислоты и особенно сверхкислоты (см. Кислоты неорганические) позволяют осуществить протонирование таких молекул, как карбоновые кислоты и даже насыщ. углеводороды, например:
ПРОТОНИРОВАНИЕ может происходить как межмолекулярно, так и внутемпературимолекулярно и сопровождаться перемещением кратной связи, образованием циклический структуры, изменением валентности атома, к которому мигрирует протон, и др. превращениями.
от 1 до 10 10 дм 3 /(моль•с)] из-за необходимости перестройки электронной или геометрическая структуры протофиль-ной частицы при переносе протона. На скорость ПРОТОНИРОВАНИЕ в неводных средах сильное влияние оказывают сольватация и ионная ассоциация.
Количеств. данные о кинетике и механизме ПРОТОНИРОВАНИЕ получают с помощью спец. методов изучения быстрых реакций (см. Струевые кинетические методы, Релаксационные методы, Электрохимическая кинетика). Информацию о тонких дета лях механизма ПРОТОНИРОВАНИЕ дают зависимости (соотношения Брён-стеда) k от кислотности (рК а ) или основности (рК b ) участвующих в ПРОТОНИРОВАНИЕ реагентов и величины кинетическая (первичного и вторичного) изотопных эффектов и изотопного эффекта растворителя. Предполагается, что в некоторых химический процессах ПРОТОНИРОВАНИЕ может происходить без преодоления энергетич. барьера (туннельный эффект).
Енолизация, изотопный водородный обмен, ионный обмен, гидролиз, гидратация, этерификация-явления, в которых ПРОТОНИРОВАНИЕ-обязательная или возможная стадия.
Литература: Шатенштейн А. И., Теории кислот и оснований, М.-Л., 1949; Меландер Л., Изотопные эффекты в скоростях реакций, пер. с англ., М., 1964; Белл Р., Протон в химии, пер. с англ., М., 1977; Гордон Дж., Органическая химия растворов электролитов, пер. с англ., М., 1979; Химия гиперкоординиро-ванного углерода, пер. с англ., М., 1990, с. 169-229, 253-327.
Химическая энциклопедия. Том 4 >> К списку статей
Протонирование
17.1.1. Протонирование
Индолы, так же как и пирролы, очень слабые основания: величина pKa для индола составляет −3,5, для 3-метилиндола −4,6 и для 2-метилиндола −0,3 [4]. Это означает, что в 6 М серной кислоте на каждые две протонированные молекулы индола приходится одна непротонированная, тогда как 2-метилиндол оказывается почти полностью протонированным в этих условиях. С помощью УФ- и ПМР-спектроскопии было установлено образование только 3-протони-рованного катиона (3Н-индолий-катиона) [5]; это наиболее термодинамически устойчивый катион (в противоположность 2-протонированному катиону), и заряд делокализуется между атомом азота и α-углеродным атомом.
Не обнаруженный спектральными методами N-протонированный катион может образовываться, причём довольно быстро; в кинетически контролируемых условиях дейтерообмен по атому азота происходит в 400 раз быстрее, чем по атому углерода C(3) [6]. Действительно, атом водорода при азоте обменивается быстро даже при pH 7, тогда как обмен по атому C(3) в этих условиях не происходит вовсе: селективное превращение индола в 3-дейтероиндол успешно идёт при обработке дейтерокислотой, а затем водой [7]. Катализируемый основаниями обмен, включающий образование индолил-аниона (разд. 17.4.), также идёт по атому C(3) [8].
Гораздо более высокая основанность 2-метилиндола по сравнению с индолом обусловлена стабилизацией 2-метил-3Н-индолий-катиона электроно-донорным влиянием метальной группы в положении 2; 3-метилиндол имеет основность более низкую, чем индол.
Реакции протонированных индолов
Смотрите также разд. 17.1.6. и 17.1.9. 3Н-Ивдолий-катионы, будучи без сомнения электрофильными частицами в противоположность нейтральным индолам, в благоприятных условиях реагируют в качестве таковых. Например, незамещённый 3Н-индолий-катион присоединяет бисульфит при pH 4 в условиях кристаллизации натриевой соли ивдолин-2-сульфокислоты (индолин — широко используемое тривиальное название 2,3-дигидроиндола).
Эта соль при растворении в воде превращается в индол, однако её можно проацетилировать по атому азота, а полученный ацетамид можно использовать для дальнейшего галогенирования по положению 5. Последующий гидролиз с потерей бисульфита приводит к образованию 5-замещённых индолов [9].
В сильной кислоте из N-ацилтриптофана образуется 3Н-протонированный индолий-катион, который внутримолекулярно диклизуется с участием атома азота боковой цепи [10]
протонирование
Смотреть что такое «протонирование» в других словарях:
АМИНОПИРИДИНЫ — Моноаминопиридины (см. табл.) бесцв. кристаллы; легко раств. в воде и мн. орг. р рителях, трудно в лигроине. Протонирование А. происходит в первую очередь по атому N в цикле. В образующемся пиридиниевом катионе основность аминогруппы ( рК а… … Химическая энциклопедия
Гуанидин — Для улучшения этой статьи желательно?: Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное. Гуанидин … Википедия
Десорбционные методы ионизации в масс-спектрометрии — Десорбционные методы ионизации в масс спектрометрии группа методов ионизации в масс спектрометрии, для которых процессы десорбции твердого анализируемого вещества и его ионизации практически неотделимы во времени. Наиболее полное развитие… … Википедия
Ориентации правила — в органической химии определяют порядок замещения в ароматическом кольце при наличии в нём заместителя (ориентанта). При электрофильном ароматическом замещении (см. Замещения реакции, Нуклеофильные и электрофильные реагенты) ориентанты I… … Большая советская энциклопедия
БЁРЧА РЕАКЦИЯ — (р ция Бёрча Хюккеля), восстановление ароматич. соед. в производные 1,4 циклогексадиена при действии щелочного металла и спирта в жидком NH3. Механизм р ции предполагает участие в восстановлении сольватированного электрона и послед,… … Химическая энциклопедия
ГИДРОКСОКОМПЛЕКСЫ — координац. соед., содержащие в кач ве лигандов одну или неск. монодентатных групп ОН. Эти группы связаны с центральным атомом металла через атом кислорода. Соединения, в к рых группы ОН связаны одновременно с двумя атомами металла, наз. о левыми … Химическая энциклопедия
ГРАНИЧНЫХ ОРБИТАЛЕЙ ТЕОРИЯ — простейший вариант возмущений теории в методе молекулярных орбиталей. Предназначена для предсказания реакц. способности соединений. С этой целью в реагирующих молекулах рассматривают т. наз. граничные молекулярные орбитали (МО) высшую занятую и… … Химическая энциклопедия
ЕНАМИНЫ — орг. соединения общей ф лы Первичные (R = R = Н) и вторичные (R = Н) Е. могут находиться в таутомерном равновесии с соответствующими иминами, напр.: Е. поглощают в УФ области при l макс 220 235 нм (диенамины ок. 280 нм); в ИК при n макс 1630 1650 … Химическая энциклопедия
ИМИДАЗОЛ — (1,3 диазол, глиоксалин), мол. м. 68,08; бесцв. кристаллы с моноклинной решеткой (а= 0,754 нм, b =0,544 нм, с =0,975 нм, b = 117°30 ); т. пл. 90 °С, т. кип. 257°С; m 13,28.10 30 Кл. м (диоксан); DH0 обр Ч 60 кДж/молъ (для газа Ч 130… … Химическая энциклопедия
ИМИНОЭФИРЫ — (имидаты), соед. общей ф лы RC(=NR )OR:, где R и R H, Alk, Ar; R: Alk, Аr; эфиры имидовых к т (имидокислот) RC(=NR )OH неустойчивых изомеров первичных или вторичных амидов карбоновых к т. Известны также И., в к рых фрагмент ЧОЧC=NЧ входит в цикл… … Химическая энциклопедия
Разница между протонированием и депротонированием
Главное отличие
Основное различие между протонированием и депротонированием состоит в том, что протонирование — это добавление протона в химическое соединение, тогда как депротонирование — это отщепление протона из химического соединения.
Протонирование против депротонирования
Протонирование — это химический процесс, который происходит во время химических реакций, в которых протон присоединяется к химическому соединению; с другой стороны, депротонирование — это процесс, который происходит во время химической реакции, в которой протон удаляется из химического соединения. Протонирование — это увеличение заряда +1 в атоме, молекуле, ионе или соединении; с другой стороны, депротонирование — это уменьшение заряда +1 атома, иона, молекулы или соединения.
Атом, молекула или соединение, участвующие в протонировании, называются основанием; С другой стороны, атом, молекула или соединение, участвующие в депротонировании, называются кислотой. Протонирование — это процесс увеличения pH химического соединения; Напротив, депротонирование — это процесс, при котором снижается pH раствора химического соединения.
Протонирование — это процесс добавления, тогда как депротонирование — это удаление или устранение процесса. Протонирование — это химический процесс, в котором энергия добавляется в химических реакциях; с другой стороны; депротонирование — это химический процесс, при котором выделяется энергия во время реакций. Другими словами, протонирование — это добавление H + в химическое соединение; с другой стороны, депротонирование — это удаление H + из химического соединения.
Протонирование увеличивает заряд атома, иона или молекулы; С другой стороны, депротонирование снижает заряд иона, атома или молекулы. Основания всегда подвергаются химическим процессам протонирования во время кислотно-основных реакций; с другой стороны, кислоты всегда подвергаются химическим процессам депротонирования во время кислотно-основных реакций.
Протонирование — это химический процесс образования сопряженных кислот в ходе химических процессов; с другой стороны; депротонирование — это химический процесс образования сопряженного основания во время химического процесса. Протонирование всегда вызывает образование молекул воды из гидроксильных групп соединения в химических процессах; С другой стороны, депротонирование всегда вызывает образование гидроксильных молекул из молекул воды в химических процессах.
Протонирование — это очень быстрый химический процесс в ходе органических реакций; с другой стороны, депротонирование — очень медленный процесс в ходе органических реакций. Протонирование — это химический процесс, который стимулирует процесс изомеризации, тогда как химический процесс, который стимулирует процесс изомеризации. Протонирование — это нарастающая скорость кислотного характера; С другой стороны, депротонирование — это нарастающая скорость основного характера.
Сравнительная таблица
| Протонирование | Депротонирование |
| Протонирование — это добавление протона в химическое соединение. | Депротонирование — это отщепление протона от химического соединения. |
| Протоны | |
| Протоны добавляют в соединение | Протоны удаляют из соединения |
| Плата | |
| Увеличивает +1 заряд молекулы | Уменьшает заряд +1 молекулы |
| Уровень кислотности или основности | |
| Уровень основности | Показатель кислотности |
| PH соединения | |
| Повышает pH соединения. | Снижает pH соединения. |
| Скорость процесса | |
| Это быстрый процесс | Это медленный процесс |
| Процесс изомеризации | |
| Стимулирует процесс изомеризации | Подавить процесс изомеризации |
| Энергия процесса | |
| Добавляет энергии реакции | Высвобождает энергию из реакций |
| Тип процесса | |
| Процесс добавления | Устранение процесса |
| H + Ион | |
| Ионы водорода добавляют в соединение | Ионы водорода удаляют из соединения |
| Обратимость | |
| Это обратимый процесс | Это необратимый процесс |
| Каталитическая способность | |
| Обладает каталитической силой | Не обладает каталитической силой |
Что такое протонирование?
Протонирование — это химический процесс присоединения протона к химическим соединениям во время химических реакций. Это очень быстрый процесс. Он может образовывать молекулы воды из молекул гидроксила. Протонирование — это обратимый процесс, который увеличивает заряд химического соединения со скоростью +1 заряд в атоме, ионе, молекулах или частицах.
PH растворов или растворителей, участвующих в протонировании, очень низкий. Протонирование — это степень основности или кислотности химических или органических соединений. Протонирование — это процесс присоединения или эндотермический процесс, который участвует в процессе изомеризации. Также он стимулирует процесс полимеризации.
Он обладает каталитической способностью увеличивать кислотность реакций, которые используются в нескольких процессах, таких как реакции присоединения, нуклеофильные, электрофильные реакции, реакции замещения и т. Д. Процесс протонирования пропорционален степени кислотности вещества. Обычно это связано с образованием молекул воды во время процесса.
Ионы водорода всегда добавляются в химическое соединение в процессе протонирования. Он также обладает способностью изменять оптические характеристики молекулы. Процесс протонирования соединений зависит от кислотности кислот, доступных для растворов или растворителей. Процесс протонирования используется для уменьшения реакционной способности органических молекул. Протонирование обычно известно как эндотермический процесс, который включает в себя высвобождение энергии путем очень легкой передачи протона химическим веществам.
Такие процессы, как добавление водорода в молекулу аммиака, которое приводит к образованию ионов аммония, добавление ионов водорода в молекулы воды для образования ионов гидроксония, протонирование иона гидроксила с образованием молекул воды, добавление ионов водорода к спиртам с образованием ионов гидроксония в растворе, добавление ионов водорода к алкенам и алкинам и т. д. лучше всего объясняет термин протонирование.
Что такое депротонирование?
Депротонирование — это химический процесс удаления протонов из химических соединений во время химических реакций. Это медленный процесс. Этот процесс также имеет свою способность образовывать гидроксильные ионы из молекул воды. Депротонирование — это необратимый процесс, который имеет свою способность уменьшать заряд химического соединения со скоростью +1 заряд в атоме, молекуле или разновидности иона.
PH растворов или растворителей, участвующих в процессе депротонирования, очень высок. Этот процесс не может выполнять химические реакции, действуя как катализатор. Процесс протонирования пропорционален основному характеру вещества. Ионы водорода всегда удаляются из химического соединения в процессе депротонирования. Его оптическая активность также различна.
Процесс депротонирования также зависит от pH растворов или растворителей. Этот процесс увеличивает реакционную способность органических молекул. Такие процессы, как удаление ионов водорода из воды с образованием гидроксильных ионов, удаление протона из алканов с образованием алкенов и алкинов, удаление ионов водорода из спиртов и т. Д. Лучше всего объясняют термин депротонирование.
Ключевые отличия
Заключение
Из приведенного выше обсуждения делается вывод, что протонирование — это увеличение заряда +1 химического соединения; с другой стороны, депротонирование — это уменьшение заряда +1 химического соединения.
Протон
Из Википедии — свободной энциклопедии
>)>
1,672 621 923 69(51)⋅10 −27 кг [2]
1,007 276 466 621(53) а. е. м. [3]
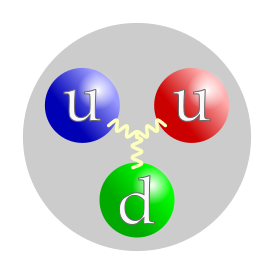
Прото́н (от др.-греч. πρῶτος — первый [7] ) — одна из трёх (вместе с нейтроном и электроном) элементарных частиц, из которых построено обычное вещество. Протоны входят в состав атомных ядер; порядковый номер химического элемента в таблице Менделеева равен количеству протонов в его ядре.
Масса протона составляет 1,6726⋅10 −27 кг или 938,27 МэВ, что примерно в 1836 раз больше массы электрона. Спин равен 1/2, поэтому протон является фермионом. Внутренняя чётность положительна.
В классификации элементарных частиц протон относится к адронам. Он обладает способностью ко всем четырём фундаментальным взаимодействиям — сильному, электромагнитному, слабому и гравитационному. Электрический заряд его положителен и равен по модулю заряду электрона: e = +1,6022⋅10 −19 Кл.
В отличие от, например, электрона, протон не является точечной частицей, а имеет внутреннюю структуру и конечные размеры. Фундаментальные частицы, из которых построен протон — кварки и глюоны. Какую именно величину считать размером протона, зависит от договорённости, но в любом случае это будет величина порядка 1 фм. Наиболее точно измерен так называемый электрический радиус — 0,841 фм.
Протон стабилен, многочисленные эксперименты не выявили никаких свидетельств его распада. Для объяснения этого факта было введено сохраняющееся барионное число (протону приписывается барионное число +1).
Название «протон» предложено Э. Резерфордом в 1920 году.