что такое проточная цитометрия
Принцип метода проточной цитометрии
1 Описание метода
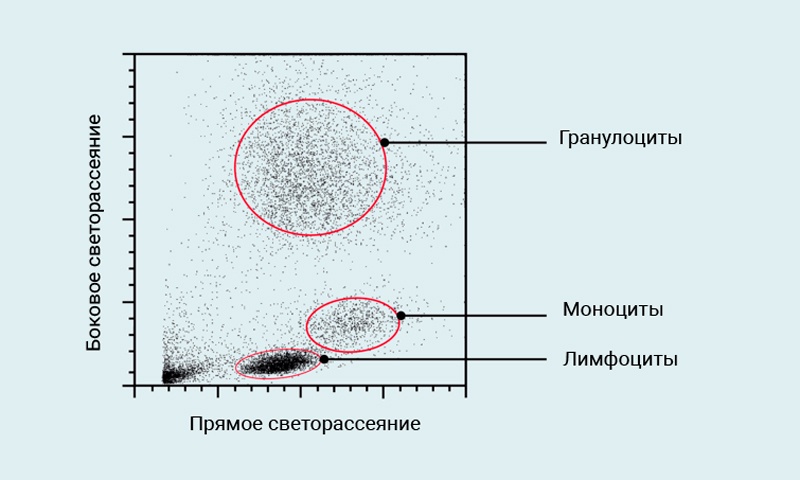
Проточная цитометрия (другое название проточная цитофлюориметрия, Flow cytometry) – это измерение химических и физических свойств клеток по мере того, как клетки “протекают” одна за одной через точку интеграции, которой наиболее часто является лазер. Поскольку клетки рассеивают лазерный свет в различных направлениях, то свойства клеток, такие как их относительный размер и сложность структуры цитоплазмы, могут быть измерены. В цельной крови человека лимфоциты, моноциты, и гранулоциты могут быть различимы друг от друга просто потому, что рассеивают лазерный свет различным образом.
Рис. 1 Типичный профиль светорассеяния лизированной цельной крови
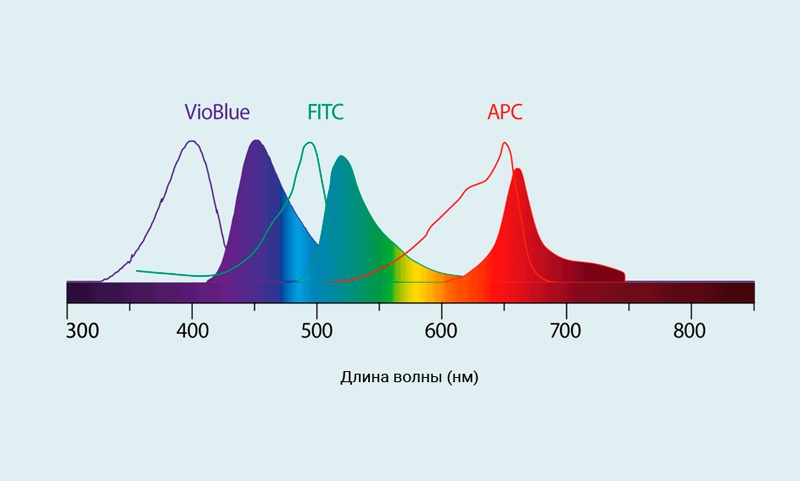
Большинство современных проточных цитометров могут измерять внешние клеточные свойства (экспрессию маркеров клеточной поверхности) или экспрессию внутриклеточных маркеров, содержание нуклеиновых кислот, активность ферментов и многое другое. Чтобы исследовать эти клеточные особенности, используются флуоресцентные реагенты, такие как антитела, конъюгированные с флуорохромом. Эти реагенты имеют характерные свойства светоизлучения, так что они могут быть обнаружены отдельно в различных параметрах флуоресценции.
Уникальным атрибутом проточной цитометрии является то, что флуоресценция на клеточном уровне или уровне частиц может быть измерена очень быстро. Когда флуоресцентно меченные клетки или частицы проходят через луч света, флуоресцентные зонды возбуждаются. Обнаружение испускаемого света и, в конечном счете, определенных клеточных свойств происходит со скоростью 10000 событий / секунду.
Рис.2 Спектры возбуждения и испускания для флуорохромов VioBlue®, FITC, and APC.
Проточная цитометрия используется как в клинических, так и в фундаментальных исследованиях: иммунология, трансплантация, гематология, неврология, исследования стволовых клеток, онкология, клеточная биология, молекулярная биология, разработка лекарственных препаратов, системная биология, морская биология, микробиология, вирусология и многие другие. Клинические исследования включают, в частности, диагностику in vitro, исследования в контексте испытаний или мониторинг пациентов после лечения. Некоторые клиники также используют проточную цитометрию для характеристики клеток донора и реципиента перед трансплантацией, чтобы снизить риск побочных эффектов после трансплантации.
2 Примеры применения проточной цитометрии
3 Принцип работы проточного цитометра
Проточный цитометр, например MACSQuant от Miltenyi Biotec, основан на системе, объединяющей флюидику, оптику и электронику.
3.1 Система флюидики
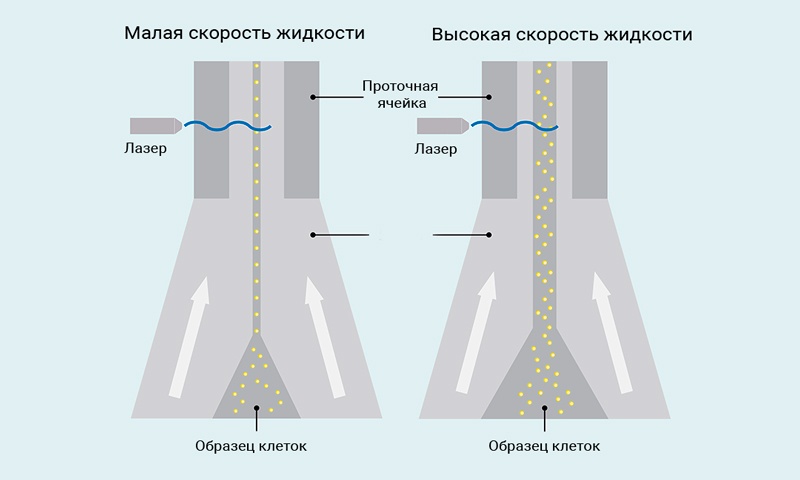
Гидродинамическая фокусировка используется для выравнивания и перемещения клеток или частиц через луч лазера. Жидкость протекает с постоянным давлением через проточную кювету. Клетки вводятся в середину потока обтекающей жидкости. По принципу ламинарного потока образцы клеток и обтекающая жидкость движутся в одном направлении, но остаются разделенными. Перепад давления между обтекающей жидкостью и образцами клеток определяет, насколько широк поток пробы по мере ее прохождения через проточную ячейку. Лазеры возбуждают флуоресцентно меченные клетки или частицы по отдельности, затем измеряются флуоресценция и светорассеяние.
Рис.3 Иллюстрация гидродинамической фокусировки прибора MACSQuant®
В исследованиях с применением проточной цитофлюориметрии, которые требуют очень высокого разрешения определенных популяций клеток, например, для анализа клеточного цикла, низкая скорость жидкости рекомендуется для генерирования узкого потока образца. Для применений в обычном иммунофенотипировании, любая скорость жидкости является подходящей. Однако важно, чтобы настройка скорости событий прибора не превышала 10000 событий в секунду для любой из скоростей потока.
3.2 Оптическая система
3.2.1 Фильтры и зеркала
После возбуждения лазером флуоресцентные реагенты, связанные с клетками или частицами, излучают свет, который обнаруживается в соответствии с их конкретным диапазоном длин волн. При использовании комбинации флуоресцентных красителей эти реагенты должны иметь отличающиеся спектры излучения. В системах MACSQuant используются различные оптические фильтры и дихроичные зеркала для направления света с определенной длиной волны на соответствующие флуоресцентные детекторы. Такое расположение создает так называемые каналы флуоресценции.
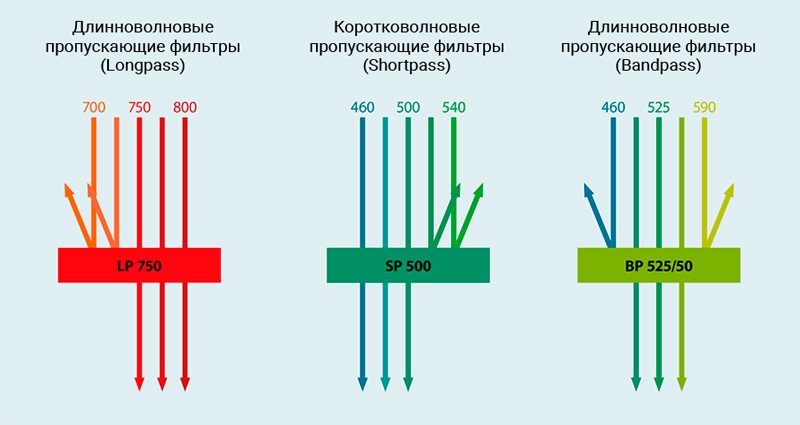
Различные типы фильтров определяют, какие длины волн могут входить в каналы флуоресценции. По своим оптическим свойствам они относятся к коротковолновым пропускающим, длинноволновым пропускающим, и полосовым светофильтрам. Проточные цитометры MACSQuant используют длинноволновые пропускающие и полосовые светофильтры.
Рис.4 Оптические фильтры
Иллюстрация функции длинноволновых пропускающих (Longpass; LP), коротковолновых пропускающих (Shortpass; SP) и полосовых (Bandpass; BP) фильтров. Длинноволновые пропускающие фильтры блокируют свет до определенной длины волны, тогда как коротковолновые пропускающие фильтры пропускают свет до определенной длины волны. Полосовые фильтры пропускают свет в определенном диапазоне длин волн.
Длинноволновые пропускающие фильтры обозначаются буквами LP и конкретным числом, например, LP 750. Это означает, что свет с длинами волн 750 нм и более может проходить через фильтр. Свет всех других длин волн будет заблокирован. Коротковолновые пропускающие светофильтры имеют аналогичное обозначение, например, SP 500. В этом случае свет с длинами волн 500 нм и меньше может проходить, тогда как оставшийся свет будет блокирован. Полосовые фильтры пропускают свет с определенным диапазоном длин волн. Полосовые фильтры обозначаются через буквы BP, за которыми следуют два числа. Первое число представляет собой среднюю точку диапазона длин волн. Второе число указывает диапазон длин волн в нм, который может пройти. Таким образом, свет, который может проходить через фильтр BP 525/50, находится в диапазоне от 500 до 550 нм.
Дихроичные зеркала, по существу, выполняют ту же функцию, что и фильтры, но ориентированы под углом 45 ° к пути света, тогда как фильтры ориентированы перпендикулярно пути света. Свет, который не может пройти через дихроичное зеркало, отклоняется под углом 90 ° к другому детектору света.
Оптические системы проточных цитометров MACSQuant сочетают в себе три лазера, различные фильтры и зеркала, что дает до 14 отдельных каналов флуоресценции и два канала рассеяния.
3.2.2 Фотонные детекторы – фотоэлектронные умножители (PMTs)
Путь света определенных длин волн, то есть флуоресцентных каналов, контролируется фотоэлектронными умножителями (ФЭУ). ФЭУ усиливают флуоресцентный сигнал, испускаемый флуорохромом, связанным с клеткой или частицей, и генерируют электрический ток.
Величина усиления зависит от напряжения, приложенного к каждому ФЭУ. Когда напряжение увеличивается, усиление обнаруживаемой флуоресценции также увеличивается, что приводит к более высокой средней интенсивности флуоресценции (MFI). И наоборот, когда напряжение уменьшается, усиление также уменьшается, что приводит к снижению MFI. Электрический ток, генерируемый ФЭУ, преобразуется в импульс напряжения внутри электронной системы.
3.3 Электроника
Электронная система проточного цитометра преобразует световые сигналы в пропорциональные электронные сигналы (импульсы напряжения), оцифровывает сигнал в соответствии с разрядностью аналого-цифрового преобразователя (АЦП) и взаимодействует с компьютером для передачи данных.
Преимущества цифровых проточных цитометров включают в себя:
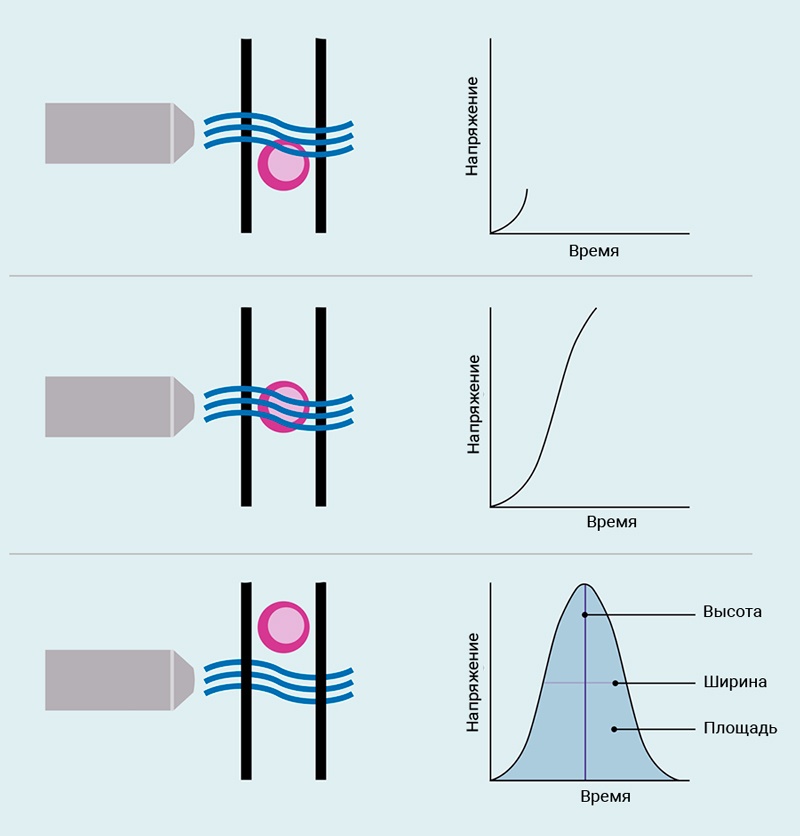
Рис.5. Импульс напряжения
Когда клетка проходит сквозь луч лазера, прикрепленный флуорохром начнет флуоресцировать. Этот свет обнаруживается ФЭУ и запускает генерацию импульса напряжения. Когда клетка полностью входит в луч лазера, флуоресценция достигает пика излучения, что приводит к наибольшему пику импульса напряжения. Наконец, когда клетка покидает лазерный луч, обнаруживаемая флуоресценция уменьшается, импульс напряжения пропадает.
Импульс напряжения характеризуется его высотой (интенсивностью сигнала), шириной (интервалом времени) и площадью (излучаемая флуоресценция при прохождении клетки через лазерный луч).
Далее аналоговые сигналы преобразуются в цифровые сигналы для отображения данных в соответствии с разрядностью АЦП. Системы MACSQuant имеют 16-битный АЦП для всех параметров. Для площади импульса применяются дополнительные вычисления с 18-битной обработкой. Это означает, что для измерений площади импульса сигнал разлагается на более чем 253 000 частотных полос. Это позволяет использовать для отображения данных логарифмическую шкалу вплоть до пяти порядков.
4 Визуализация данных проточной цитометрии
Для визуализации данных значения каждого измеренного оптического параметра могут быть нанесены на график различными способами. Эти графики могут быть одномерными (гистограммы) или двумерными (точечные диаграммы).
4.1 Одномерные графики — гистограммы
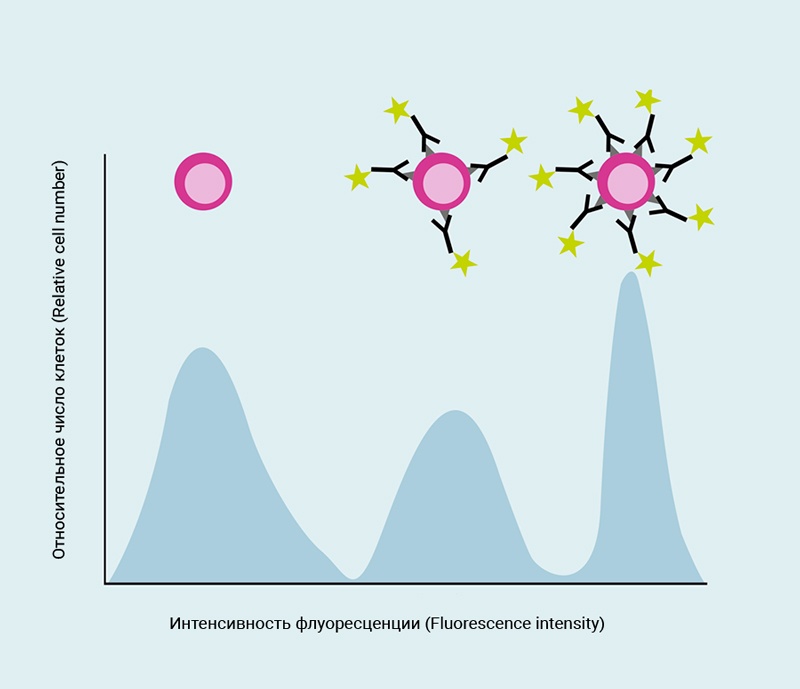
Одномерные графики позволяют визуализировать один оптический параметр события (флуоресценции или рассеяния света). Для каждого события значения интенсивности сигнала каждого измеренного параметра сохраняются в файле данных. Когда события начинают накапливаться, генерируется «кривая», которая описывает распределение измеренных событий в соответствии с интенсивностью их сигнала.
Рис.6 Гистограмма, показывающая интенсивность флуоресценции в зависимости от количества событий
Интенсивность нанесенных на график сигналов увеличивается слева направо, т.е. клеточные популяции слева показывают меньшую интенсивность сигнала, чем популяции справа.
Одномерная гистограмма показывает распределение интенсивности флуоресценции.
4.2 Двумерные диаграммы — точечные диаграммы
Точечные диаграммы позволяют визуализировать два оптических параметра на одном графике. Положение события определяется двумя значениями, то есть интенсивностями сигнала для оптических параметров, отображаемых на осях x и y. Когда все события нанесены на график, события с аналогичными значениями интенсивности накапливаются в кластерах, которые могут представлять определенные клеточные популяции.
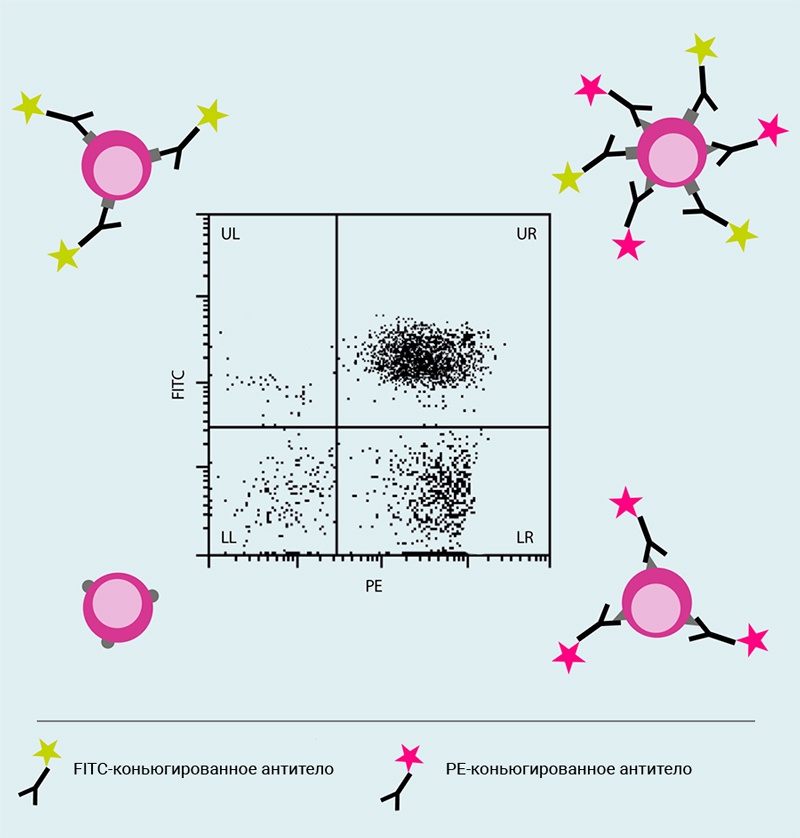
Рис.7 Точечная диаграмма, отображающая интенсивность двух параметров флуоресцентных сигналов
Двумерные точечные диаграммы позволяют одновременно визуализировать два оптических параметра.
На этом точечном графике клетки анализировали с использованием антител, конъюгированных с флуорохромами FITC и PE. График показывает клеточные популяции, которые являются либо отрицательными по обоим параметрам (нижний левый квадрант, LL), либо положительными по одному параметру (верхний левый (UL) и нижний правый (LR) квадранты), либо положительные по обоим параметрам (верхний правый квадрант, UR).
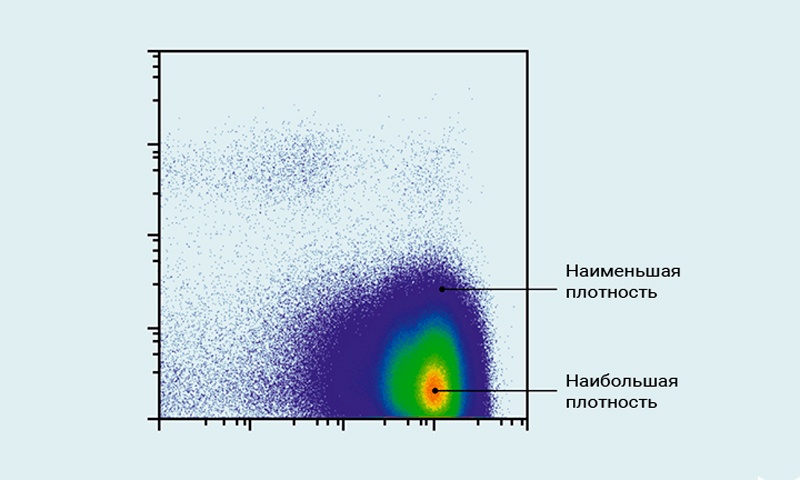
4.3 Двумерные диаграммы — диаграммы плотности
Диаграммы плотности отображают два параметра в виде распределения по частоте событий подобно точечной диаграмме, где каждой клетке соответствует точка. Кроме того, этот тип диаграмм изображает распределение клеток внутри популяции, характеризующейся очень высокой плотностью событий.
Рис.8 Диаграмма плотности
Диаграмма плотности показывает распределение клеток внутри популяции.
На этом графике плотности красный цвет представляет наибольшую плотность событий в клеточной популяции. С уменьшением плотности цвет переходит от желтого через зеленый к синему.
5 Источники
4 «Guide to Flow Cytometry» — Dako, Sonja Wulff, Colorado, USA
Что такое проточная цитометрия
 |  |
|  | ТОМ 4, СТ. 131 (стр. 465-470) // ПРОТОЧНАЯ ЦИТОМЕТРИЯ Е.Е.Зуева * Резюме Ключевые слова: иммунофенотипирование, проточная цитометрия, анализ изображения Учет результатов Представление данных Анализ данных При одновременном использовании трех антител возможно получение восьми комбинаций положительных и отрицательных популяций (табл1),
расположение которых в пространстве трех четырехдекадных гистограмм (FL1/Fl2, Fl2/Fl3, Fl3/Fl1) строго определено (рис.2). Такое изображение может быть получено при гомогенном характере экспрессии, т.е. в том случае, если все клетки популяции однородно экспрессируют каждый анализируемый маркер. Анализ коэкспрессии маркеров Фактически на двумерной гистограмме может быть представлено всего несколько вариантов коэкспрессии маркеров. * Адрес для переписки: Зуева Екатерина Евгеньевна, с.н.с. лаборатории молекулярной диагностики Научно-методического центра по молекулярной медицине СПбГМУ им. акад.И.П.Павлова, ул. Л.Толстого, 6/8, Санкт-Петербург, Российская Федерация, 197089. Тел/факс: +7 812-2387194, e-mail: dinzu@mail.ru 1 Молекулярная клиническая диагностика. Методы. Под ред. С.Херрингтона и Дж. Магки, М.,Мир, 1999, 506 стр. 2 Horsburg T., S. Martin, A.J.Robson The application of flow cytometry to histocompatibility testing. Transplant Immunology 2000, 8 (1):3-15. 3 Gelman R., Wilkening C. Analyses of quality assessment studies using CD45 for gating lymphocytes for CD3+CD4+%. Cytometry (Comm in Clin Cytometry) 2000; 42:1-4. 4 Gratama JW, Sutherland DR, Keeney M, Papa S. Flow cytometric enumeration and immunophenotyping of hematopoietic stem and progenitor cells. J Biol Regul Homeost Agents 2001;15:14-22. 5 Hrusak O., Porwit-MacDonald A. Antigen expression patterns reflecting enotype of acute leukemias. Leukemia 2002; 16:1233-1258. 6 Cualing HD. Automated analysis in flow cytometry. Cytometry. 2000 Apr 15;42(2):110-3 Что такое проточная цитометрияПодводные камни проточной цитометрии в диагностической гематопатологииАннотацияПроточная цитометрия (ФК) оказалась чрезвычайно универсальным и полезным инструментом для диагностики и мониторинга гематологических заболеваний в дополнение ко многим другим применениям. Значительные достижения в области электроники, программного обеспечения и реагентов за последние годы упростили некоторые аспекты ФК, в то же время способность комбинировать 8–10 антител в одной пробирке может создать как технические, так и интерпретационные проблемы, которые труднее обнаружить при использовании только 3–4 цветовых комбинаций. Использование многопараметрических панелей может облегчить идентификацию аномальных популяций; Однако характеристики опухолевого населения могут создавать потенциальные диагностические ошибки. Понимание нормальных иммунофенотипических паттернов в состоянии покоя, восстановления, и активация является критическим первым шагом для того, чтобы надлежащим образом идентифицировать аномальные популяции, которые характеризуют гематопоэтические новообразования. Кроме того, внедрение новых терапевтических стратегий, в частности таргетной терапии, может смешивать стандартные методы анализа данных проточной цитометрии, и знание влияния терапии на данные проточной цитометрии имеет решающее значение для точной интерпретации данных. В этой рукописи будут рассмотрены вопросы доаналитического анализа, инструментов и интерпретации, которые могут привести к неправильной интерпретации результатов. 2 ПРЕАНАЛИТИЧЕСКИЕ ВОПРОСЫОбразцы, полученные для ПЦ, должны быть проверены на наличие признаков плохого обращения после сбора. Например, свернутые или гемолизированные образцы могут не отражать исследуемого состояния заболевания. Образцы, загрязненные периферической кровью, показывают увеличенное количество зрелых гранулоцитов, и это должно быть отмечено в окончательном отчете. Жизнеспособность часто вызывает беспокойство, когда образцы ткани собирают, и по этой причине их следует помещать в консервирующую среду [например, среду 199 или среду Roswell Park Memorial Institute (RPMI) 1640] сразу после сбора. Все образцы должны быть оценены на жизнеспособность. В большинстве лабораторий график прямого рассеяния в зависимости от бокового рассеяния (SSC) используется для исключения мусора и получения грубой оценки жизнеспособности. Один метод, используемый в некоторых лабораторных условиях, в частности, при оценке образцов тканей следует включать в анализ образцов жизнеспособный краситель (например, 7AAD или амино-реактивные флуоресцентные красители). Такие красители могут быть добавлены к образцу и проанализированы с помощью FC, чтобы обеспечить точную оценку качества исследуемого материала. Образцы тканей, отправляемые в реферальные лаборатории, часто могут извлечь выгоду из использования флуоресцентных красителей жизнеспособности, поскольку дегенеративные клетки могут быть трудно исключить только с помощью рассеяния света. Преимущества такого удаления достигаются за счет уменьшения максимального количества антигенов, доступных для данной пробирки. Лаборатория, обрабатывающая только периферическую кровь из собственного учреждения, может посчитать использование красителя жизнеспособности менее важным, чем региональная или национальная референс-лаборатория, которая получила большое количество образцов ткани. Как правило, образцы либо промывают, окрашивают, и затем добавляют буфер для лизиса, или образцы можно окрашивать, лизировать и затем промывать. Для обнаружения поверхностного иммуноглобулина важно, чтобы образцы были промыты минимум два раза в физиологическом растворе с фосфатным буфером перед окрашиванием для удаления цитофильных антител. фигураНа фиг.1 показано влияние увеличения степени промывки на отделение поверхностного окрашивания каппа и лямбда в образце крови. В случаях, когда встречаются необычные или неожиданные схемы окрашивания, промывка для удаления компонентов плазмы может улучшить качество данных. Кроме того, некоторые клоны антител могут быть более восприимчивыми к таким взаимодействиям (Wood & Levin, 2006 ). Некоторые образцы могут демонстрировать устойчивость к лизису эритроцитов (RBC) в зависимости от болезненного состояния пациентов или лекарственной терапии (Kasinrerk, 2003 ). Рисунок 2 иллюстрирует образец, который можно увидеть, когда образцы несоответствующим образом лизируются. Нагревание образца во время инкубации в лизирующем агенте может увеличить лизис эритроцитов. Кроме того, встряхивание образца может усилить лизис эритроцитов. Когда антитела поставляются в предварительно смешанном коктейле, который был проверен, мало беспокоит то, что неправильное антитело могло быть добавлено в окрашивающую пробирку. Однако, если антитела добавляются по отдельности, всегда существует вероятность того, что будет добавлено неправильное антитело или флуорохром. Это может быть трудно обнаружить, особенно в многоцветных многослойных ситуациях. Всякий раз, когда отмечается неожиданное окрашивание популяции, следует рассмотреть эту возможность. Проверка окрашивания всех популяций в выборке часто позволяет обнаружить эту проблему. Рисунок 5показывает пример, где правильное антитело (CD5), но неправильный флуорохром (PE-Cy5) было добавлено к образцу, что привело к ложной CD34-позитивной экспрессии на лимфоцитах. Ложная экспрессия CD34, наблюдаемое в этом примере, связано с тем, что между PE-Cy5 и APC требуется существенная коррекция перелива, которая не требовалась при использовании предполагаемого флуорохрома. 3 АНАЛИТИЧЕСКИЕ ВОПРОСЫВажно, чтобы перед тестированием образцов пациентов проточный цитометр был оптимально выровнен, трубки фотоумножителя были настроены для оптимального обнаружения сигнала, и выполнялась компенсация прибора, чтобы исключить появление нежелательного сигнала в канале, отличном от конкретного интересующего канала. Это достаточно простая проблема в 2 или 3 цветных окрасках; однако в 8–10 цветных окрасках это становится слишком сложным, чтобы делать это вручную, и требует, чтобы компьютерные алгоритмы отслеживали множественные области перекрытия сигналов. Рисунок 6a иллюстрирует значительный потенциал для неправильного сообщения о ненормальной популяции B-клеток с ограниченной легкой цепью, основанной на яркой экспрессии лямбда-PE, вызывающей ложно-положительное окрашивание (CD10 PE Texas Red) целевой популяции. Компенсация между двумя каналами установлена на уровне 72%. На рис. 6, б показан тот же образец с корректной компенсацией (увеличение компенсации на 1%). Обратите внимание, что «положительная» популяция теперь показана отрицательной, и у пациента есть поликлональные В-клетки. Все современные проточные цитометры позволяют собирать «время» в качестве параметра. Это очень полезно в ситуациях, когда поток пробы может быть прерван (например, пузырьками в трубке) или когда образец высохнет. Если ввести «время», то область, в которой виден разрыв потока или конец цикла, можно легко исключить или «закрыть», чтобы оставить только те части анализа, которые не были затронуты нарушением потока. Рисунок 7a, b показывает влияние стробирования по временному параметру на образец костного мозга, который высыхает примерно через 400 с. Левый ряд графиков показывает значительные «осколки» как рассеяния света, так и флуоресценции. Когда временной интервал (верхний правый график) перемещается, чтобы исключить всплеск событий, а затем падение, данные из начальной части цикла сохраняются. Параметр номера события также может быть использован таким образом. Многие образцы содержат клеточные дублеты. Они могут быть увеличены в недостаточно дезагрегированных образцах ткани и в некоторых В-клеточных злокачественных опухолях и могут быть увеличены, когда используются более высокие скорости потока. Проточный цитометр может обнаруживать дублеты на основе различий в рассеивании света, где дублеты могут иметь ту же общую флуоресценцию, что и большая ячейка, амплитуда сигнала будет отличаться между ними, как и время полета (TOF). Посредством построения графика прямой рассеяния в зависимости от прямой амплитуды (высоты) или TOF довольно легко обнаружить и исключить дублеты из анализа. На рисунке 8a показан пример, в котором дублеты могут создавать аномальную популяцию, экспрессирующую CD19 и CD5 (Keeney, Hedley, & Chin-Yee, 2017 ). После удаления дублета популяция, экспрессирующая CD19 и CD5, больше не присутствует (рис. 8, б). При работе с образцами с очень небольшим количеством ячеек, например, CSF, или при выполнении минимального остаточного обнаружения (MRD), важно, чтобы прибор был чистым (например, чистящая панель или пустая пробирка должна быть запущена до образца) и чтобы не является переносом из предыдущего образца, который может выглядеть как ложноположительная популяция (Craig, Ohori, Gorrill, & Swerdlow, 2011 ). Наконец, когда пробы запускаются на проточном цитометре, обычной практикой является использование заранее определенных протоколов с предварительно выбранными комбинациями антител, чтобы упростить анализ как во время, так и в автономном режиме после сбора данных. Если выбранный протокол не соответствует применяемым комбинациям антител и флуорохрома, существует вероятность неправильной характеристики популяции клеток. Всегда проверка образцов окрашивания остаточных нормальных популяций является одним из способов обнаружить это. 4 ВОПРОСА ИНТЕРПРЕТАЦИИ ДАННЫХПосле проверки потенциальных преаналитических и аналитических переменных для обеспечения высококачественных проточных цитометрических данных необходимо учитывать несколько факторов для достижения точной и последовательной интерпретации данных. Основа ПЦ для распознавания гематопоэтической неоплазии основана на том принципе, что аномальные клетки, включающие гематопоэтическое новообразование, отличаются по иммунофенотипу от нормальных аналогов, что позволяет распознавать неопластические гематопоэтические клетки методом проточной цитометрии (Craig & Foon, 2008 ). Следует отметить, что иммунофенотип, связанный с нормальным кроветворением, не является статичным и характеризуется сдвигами в экспрессии антигена, которые происходят во время созревания и с различными состояниями активации (Li, Juco, Mann & Holden, 2004 ; McKenna, Washington, Aquino, Picker, & Kroft, 2001 ; van Lochem et al., 2004 ; Wood, 2016 ). Характер экспрессии антигена, связанный с нормальными гемопоэтическими клетками, также может варьироваться в зависимости от типа образца. Неопластические популяции могут напоминать состояние созревания или активации, но будут демонстрировать аберрантные иммунофенотипические паттерны, отсутствующие при нормальных обстоятельствах. Экспрессия антигена может быть увеличена, уменьшена или отсутствует по сравнению с нормальным аналогом. Кроме того, аномальные популяции могут экспрессировать антиген, обычно не экспрессируемый на какой-либо стадии нормального развития (например, экспрессия нелинейного антигена или сверхэкспрессия онкогена). Таким образом, основа для интерпретации данных проточной цитометрии для идентификации кроветворных новообразований в значительной степени опирается на глубокое понимание нормальных иммунофенотипических паттернов. Рисунок 10 характеризует несколько примеров экспрессии антигена в лимфоидных новообразованиях с акцентом на то, как эти паттерны отличаются от нормальных аналогов. Поскольку популяции опухолей характеризуются аберрантными физическими и иммунофенотипическими свойствами, эти популяции могут уклоняться от типичных стратегий гейтирования. Лимфоидные гейты, основанные на прямом и SSC или CD45 против SSC свойствах, могут быть общей отправной точкой для идентификации лимфоидных популяций. Хотя эта стратегия будет эффективна при выявлении большинства лимфоидных новообразований от маленького до среднего размера, крупноклеточная лимфома (и волосатоклеточный лейкоз) может иметь улучшенные рассеивающие свойства, удаляя часть или всю опухолевую популяцию из стандартных лимфоидных гейтов (рис. 11).). Точно так же бластные гейты, определяемые CD45 и SSC, часто являются отправной точкой для выявления аномальных предшественников при оценке образца для острого лейкоза; однако, острый промиелоцитарный лейкоз, как правило, демонстрирует повышенную SSC, часто удаляя большую часть опухолевой популяции из стандартного CD45 по сравнению с SSC-определенными бластными гейтами. В таких случаях опухолевая популяция может чрезмерно гранулоцитарной популяции в проекции CD45 против SSC. Подобно тому, как физические свойства могут изменяться в опухолевых популяциях, экспрессия антигена может изменяться и мешать стандартным стратегиям стробирования. Двумя часто встречающимися примерами этого явления являются лимфобластный лейкоз / лимфома, которые могут быть отрицательными для CD45 и избегать стандартного CD45 в сравнении с SSC-определенными бластными гейтами и новообразованиями Т-клеток, который может показывать отсутствие или снижение интенсивности одного или нескольких Т-клеточных антигенов, включая в некоторых случаях CD3. Поскольку свойства разброса, CD45 и маркеры происхождения могут использоваться для стробирования, очень важно не ограничивать поиск неопластической популяции одной популяцией, а скорее оценивать данные дополнительными способами, используя более одного параметра и прогноз для идентификации населения. Например, при оценке на острый лейкоз не ограничивайте поиск предшественников или бластов CD45 в сравнении с SSC-определенными бластными гейтами, а скорее рассматривайте все клетки в образце, используя несколько маркеров, которые могут быть экспрессированы популяцией предшественников. Точно так же, хотя оценка Т-клеток может начинаться с оценки лимфоидных клеток, экспрессирующих маркеры, включая CD3, Дополнительным предостережением, которое следует учитывать при интерпретации данных проточной цитометрии, является наблюдение, что негематопоэтические новообразования могут иногда экспрессировать гематопоэтические маркеры. Например, CD56 обычно экспрессируется в солидных опухолях, происходящих из эпителия (Chu, Arber, & Weiss, 2003 ). Поскольку в некоторых случаях при негематопоэтических новообразованиях можно наблюдать экспрессию одного или нескольких гематопоэтических антигенов, следует проявлять осторожность при интерпретации данных, а данные проточной цитометрии следует рассматривать в соответствующем клиническом и морфологическом контексте. Важно признать, что нормальные паттерны не являются статичными и могут изменить настройку терапии. Способ изменения экспрессии антигена зависит от типа проводимой терапии и временного интервала с момента самой последней терапии. По этой причине крайне важно интерпретировать данные проточной цитометрии в соответствующем терапевтическом контексте. Например, традиционные химиотерапевтические схемы лечения острого лейкоза могут привести к неспецифическому уничтожению быстро делящихся клеток, что приводит к панцитопении и общему снижению клеточности образцов, таких как костный мозг или кровь, в дни и недели после терапии. В зависимости от интенсивности проводимой терапии можно увидеть различия в количестве и качестве нормальных регенерирующих популяций предшественников в разные моменты времени (Рисунок 12). Таргетная терапия обычно используется отдельно или в комбинации при различных гематопоэтических новообразованиях. Нормальные паттерны, встречающиеся у пациентов, получающих целевую терапию, могут сильно отличаться от паттернов регенерации костного мозга в условиях обычной терапии. Рисунок 12 иллюстрирует паттерны, наблюдаемые у пациентов с B-LL, которые получали различные целевые терапии. Такая целевая терапия не только изменяет паттерны нормальных фоновых клеток, но также может изменять иммунофенотип опухолевой популяции (рис. 13).). Часто встречающееся явление — потеря целевого антигена в опухолевой популяции. Это может иметь значение для выявления остаточных заболеваний. Например, CD19 экспрессируется на большинстве нормальных В-клеток на всех стадиях созревания, а также на большинстве незрелых и зрелых новообразований В-клеток. Эта особенность обычно делает CD19 и отличным стробирующим реагентом для идентификации как нормальных популяций B-клеток, так и новообразований B-клеток. Однако полезность этого реагента снижается при назначении методов лечения, нацеленных на этот антиген, так как рецидивы после терапии могут быть CD19-отрицательными. Наконец, в условиях высокочувствительных анализов со сбором большого количества событий, а также в ситуациях, когда стратегии гейтирования изменяются, можно найти «новые группы населения», которые являются нормальными, но не видны при использовании знакомых стратегий гейтирования и когда меньшее количество события собраны. Один пример этого встречается при использовании CD45 против SSC-определенных доменных гейтов для идентификации предшественников. В то время как многие популяции бластов попадают в этот регион, другие популяции занимают «бластные гейты», которые не являются прародителями. Например, плазмоцитоидные дендритные клетки и базофилы занимают типичные CD45-определяемые SSC «бластные гейты». Эти популяции могут не быть легко идентифицированы, когда существует пропорционально большая популяция предшественников и / или относительно меньшее количество событий собрано. В настройках MRD, когда собирается большое количество событий, такие популяции становятся более очевидными и их не следует принимать за аномальные взрывы. Такие группы населения должны быть специально определены, чтобы избежать ошибочной идентификации как взрывов. В случае плазмоцитоидных дендритных клеток и базофилов обе популяции являются строго положительными в отношении CD123, что позволяет уверенно отделяться от нормальных и аномальных предшественников в большинстве случаев (рис.14 а). Включение реагентов для конкретной идентификации таких популяций желательно при рассмотрении конструкции панели. При сборе большого количества событий, как в случае MRD, можно встретить необычные паттерны экспрессии антигена, которые могут запутать анализ. Например, было описано, что небольшая часть естественных клеток-киллеров (NK) экспрессирует CD19 или CD117 низкого уровня (Montaldo et al., 2013 ; Soma et al., 2015) ). Хотя это открытие не представляет проблемы в стандартном анализе, NK-клетки, экспрессирующие CD19 или CD117, могут мешать анализу MRD в условиях B-LL или острого миелоидного лейкоза соответственно. Наконец, изменения в стратегии гейтирования могут иногда выявлять новые, ранее непризнанные, нормальные группы населения. Один из примеров этого явления показан на рисунке 14 d – f. В этом примере переход от использования CD19 для идентификации B-клеток к использованию стратегии, использующей комбинацию экспрессии CD22 или CD24 (Cherian et al., 2018 ), привел к идентификации дополнительных CD34-позитивных предшественников, у которых отсутствовал CD19 и которые следует различать из CD19- отрицательных аберрантных групп населения. 5. ВЫВОДЫПЦ является мощным инструментом для характеристики кроветворных клеток и играет важную роль в диагностике и классификации многих гематопоэтических новообразований, а также некоторых неопухолевых состояний. Полное понимание потенциальных ловушек, которые могут возникнуть на доаналитической и аналитической стадиях, включая подготовку образцов, сбор данных и интерпретацию данных, является критическим элементом, необходимым для получения высококачественных данных проточной цитометрии. | ||||||||||||||||||||||||||||||||||||||||||||


 Фундаментальные исследования
Фундаментальные исследования