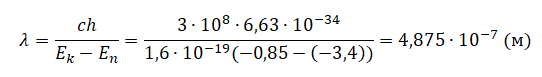что такое постулаты бора
Постулаты Бора
теория по физике 🧲 квантовая физика
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Квантовые постулаты Бора – предположения (утверждения), сделанные Н. Бором для того, чтобы модель строения атома Резерфорда соответствовала реальному поведению атомов водорода.
Первый постулат Бора
Первый постулат Бора также носит название постулата стационарных состояний:
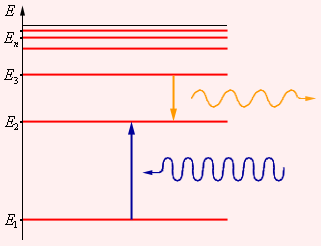
Атомная система может находиться только в стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия En. В стационарном состоянии атом не излучает электромагнитные волны.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн.
Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (см. рисунок ниже). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного
Внимание! В квантовой физике энергию принято измерять не в Джоулях, а в электрон-вольтах, обозначаемых «эВ». 1 эВ равен энергии, приобретаемой электроном при прохождении разницы потенциалов 1 В. 1 эВ = 1,6∙10 –19 Дж.
Отсюда можно выразить частоту излучения:
Частоту найдем по формуле:
Следовательно, длина волны равна:
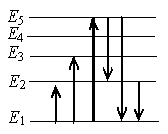
а) с уровня 1 на уровень 5
б) с уровня 5 на уровень 2
в) с уровня 5 на уровень 1
г) с уровня 2 на уровень 1
Алгоритм решения
Решение
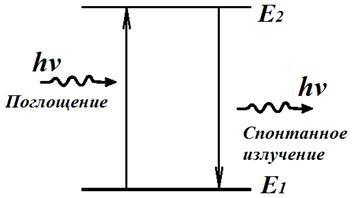
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний.
Причем чем на более высоком уровне находится электрон, тем с более высокой энергией фотон он испускает при переходе на 1 уровень. Поэтому на рисунке нам подходит переход с уровня 5 на уровень 1.
pазбирался: Алиса Никитина | обсудить разбор | оценить
В сосуде находится разреженный атомарный водород. Атом водорода в основном состоянии (Е1 = – 13,6 эВ) поглощает фотон частотой 3,7⋅10 15 Гц. С какой скоростью υ движется вдали от ядра электрон, вылетевший из атома в результате ионизации? Энергией теплового движения атомов водорода пренебречь.
Квантовые постулаты Бора
В свое время планетарная модель атома была предложена Резерфордом. Фактически, это была неудачная попытка перенести классические представления о движении тел в область явлений атомных масштабов. Планетарная модель оказалась несостоятельной, так как атом неустойчив по причине ускорения, с которым электроны якобы движутся по орбите. В таких условиях электроны должны достаточно быстро растрачивать свою энергию на электромагнитное излучение и падать на ядро.
На смену планетарной теории пришли постулаты Бора. В 1913 году выдающийся датский физик Нильс Бор на основе своих наблюдений и фактов, полученных опытным путем, установил, что большая часть представлений о строении атома не соответствовала действительности. Он же стал основоположником новой теории о строении атома.
Рассмотрим два постулата Бора подробнее.
Первый постулат Бора
В соответствии с классической механикой энергия электрона, движущегося по орбите вокруг ядра, может быть любой. В этом плане первый постулат Бора находится в явном противоречии и с планетарной моделью атома, и с классической механикой.
Второй постулат Бора
Энергия кванта при этом определяется как разность энергий двух квантовых состояний:
где h – постоянная Планка.
Квантовые постулаты Бора
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн (рис. 6.2.1).
Неустойчивость классического атома
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. 6.2.2). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En Опубликовано в разделах: Физика атомов и ядра
Постулаты Бора
Вы будете перенаправлены на Автор24
Планетарная модель Резерфорда, которая не истолковывалась в рамках классической физики.
Квантовый характер испускания и поглощения света атомами.
С тем, чтобы решить поставленную задачу Бор, используя классический подход к описанию того как ведет себя электрон в атоме, предложил постулаты. Которые в настоящее время носят его имя (постулаты Бора). Смысл этих постулатов классическая физика объяснить не может, кроме того они существуют в противоречии с классическим описанием движения электрона в атоме. Истинный смысл и значение постулатов были открыты в рамках квантовой механики.
Первый постулат Бора
Постулат стационарных состояний. Его смысл в следующем: Атом может находиться в стационарных состояниях, которые являются постоянными во времени, в том случае, если нет внешних воздействий. В таких состояниях атом не излучает электромагнитные волны. Таким состояниям соответствуют стационарные орбиты движения электронов. При этом электроны движутся ускоренно, но электромагнитных волн не излучают. В данном случае появляется противоречие с положениями классической физики, которая утверждает, что ускоренно движущийся заряд является источником излучения энергии.
Второй постулат Бора
Готовые работы на аналогичную тему
Правило частот. Это правило говорит о том, что в случае перехода атома из одного стационарного состояния в другое, атом поглощает или испускает один квант энергии. Атом излучает, если переходит из состояния с большей энергией в состояние с меньшей энергией. Данному процессу соответствует переход электрона с более удаленной от ядра орбиты на орбиту, которая расположена ближе к ядру. Поглощение атомом энергии происходит при переходе атома из состояния с меньшей энергией, в состояние с большей энергией. Изменение энергии у атома проходит при излучении (поглощении) им электромагнитных волн, причем данное изменение пропорционально частоте волн:
Третий постулат Бора
Правило квантования. Он утверждает, что электрон, если атом находится в стационарном состоянии, движется по круговым орбитам, имеет дискретные квантовые значения момента импульса:
Постулаты, которые предложил Бор, дали ему возможность, исходя из теории, рассчитать спектр водорода и ионов, которые имеют один электрон и вычислить постоянную Ридберга ($R$). Считая движение электрона, перемещением по круговой орбите, он получил для постоянной Ридберга следующую расчётную формулу для водорода:
Экспериментальное подтверждение постулатов Бора
Первые два постулата Бора получили эмпирическое подтверждение в опытах Дж. Франка и Г. Герца. Ученые исследовали прохождение пучка ускоренных электрическим полем электронов сквозь газы. Первоначально электроны пропускали сквозь пары ртути. При этом происходят соударения электронов с атомами ртути, которые делятся на два типа: упругие и неупругие соударения. В результате первых, величины скорости и энергии не изменяются, изменяется только направление движения электронов. При неупругих соударениях электроны теряют энергию, передавая ее атома ртути. Электрон может иметь любую кинетическую энергию. В случае непрерывного изменения энергии атома, при столкновении электрона с атомами передается любая порция энергии, которая находится в согласии с законом сохранения. Так как разница масс электрона и атома велика, то изменение кинетической энергии атома в столкновении мало, и его можно учитывать, используя классические формулы. В случае дискретности состояний атомных систем, то внутренняя энергия атомов при столкновениях меняется дискретно, при этом изменения энергии равны разности энергий атома в стационарных состояниях. Значит, электрон в неупругом соударении, передает атому только определенную порцию энергии. При измерении энергии, которую передает электрон атому в столкновении, делается вывод о разности энергий состояний атома. Все результаты опытов Франка и Герца привели ученых к заключению, что состояния атомных систем изменяются дискретно.
Решение:
Энергия электрона на первом Боровском уровне равна:
\[E_1=-Rh=-3,29\cdot <10>^<15>\cdot 6,63\cdot <10>^<-34>=-21,81\cdot <10>^<-19>\ \left(Дж\right)=-13,6\ \left(эВ\right).\]
При переходе электрона с первого уровня в возбужденное состояние, в соответствии со вторым постулатом Бора, имеем:
Задание: В чем достижения и недостатки теории Бора?
Решение:
Теория Бора истолковала существования линейчатых спектров водородоподобных систем. Она дала объяснение физической природы характеристических рентгеновских лучей. Теория Бора сыграла существенную роль в развитии атомной спектроскопии. При использовании теории Бора был собран экспериментальный материал о спектрах атомов и молекул.
К недостаткам теории Бора относят ее внутреннюю противоречивость. Она соединяет классическую физику с квантовыми постулатами. Эта теория неприменима к атомам, которые имеют более одного электрона. Развитие физики показало, что теория, созданная Бором, верно истолковывает одни факты и не способна объяснить другие. Эта теория является переходной при создании последовательной квантовой теории. Недостатки теории Бора проявились уже в применении к атому водорода. Так, правильно определяя частоты линий спектра, эта теория не дает возможности найти их интенсивность. Теория не рассматривает вопросы поляризации и когерентности. С помощью разработок Бора не было возможности пояснить дублетный характер спектров щелочных металлов. В данной теории не выяснялся вопрос о квантовании непериодических движений. Дифракция частиц, также осталась вне рамок теории.
Квантовые постулаты Бора: формулы
Постулаты Бора: описание теории строения атомов
Изначально предположение о строении атома носило планетарный характер лишь по той причине, что это было классическое представление о закономерностях движения тел. Предложенная Эрнестом Резерфордом планетарная модель оказалась нежизнеспособной, и на смену ей пришли постулаты Бора.
1913 год был ознаменован работой датского физика Нильса Бора. Основываясь на наблюдениях и фактах, Бор заключил, что предыдущая модель строения атома была далека от действительности. Ученый стал основоположником новой теории строения атома, состоящей из трех постулатов.
Постулаты Бор применил для того, чтобы сформулировать теорию о строении атома водорода. Бор смог выделить несколько тезисов касательно атомов водорода, в том числе вычислил возможные радиусы орбит электрона и размеры атома, энергии стационарных состояний атома и частоты излучаемых и поглощаемых электромагнитных волн.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Однако постулаты Бора не были непогрешимыми: они с абсолютной точностью объясняли процессы водородных элементов, но были несостоятельны применительно к другим.
Постулат стационарных состояний (1 Постулат)
Первый постулат Бора, носящий название постулата стационарных состояний, гласит: атомная система может находиться только в особых стационарных либо квантовых состояниях, каждому из которых соответствует некоторая энергия En. Когда атом находится в стационарном состоянии, электромагнитные волны атома отсутствуют.
Стоит отметить, что этот постулат противоречит не только планетарной модели атома, но и классической механике, согласно которой энергия движущегося по орбите электрона может быть любой. Постулат также идет вразрез с теорией Максвелла об электродинамике в том ключе, что предполагает возможность ускоренного движения электронов при отсутствии излучения электромагнитных волн.
Правило квантования (3 Постулат)
Формулировка третьего постулата Бора следующая: момент импульса электрона, если атом находится в стационарном состоянии и вращается по круговым орбитам, имеет исключительно дискретные квантовые значения, кратные постоянной Планка.
Правило квантования Бора записывается следующим образом:
В данной формуле me — это масса электрона, v — его скорость, r — радиус орбиты, h — постоянная Планка, n — главное квантовое число.
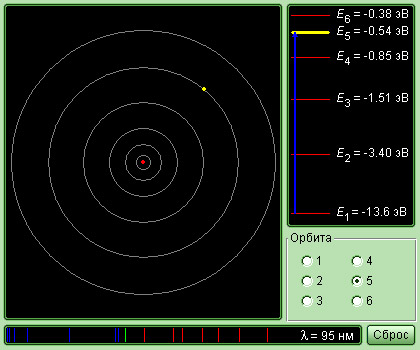
Бор смог определить возможные радиусы орбит и значения энергии стационарных состояний, используя законы механики Ньютона и правило квантования. Величина атома обуславливается минимальным радиусом орбиты, она равна 0,53 ⋅ 10 -10 м. Значения энергий стационарных состояний в электронвольтах размещены на вертикальной оси. 1 эВ — энергия, которая приобретается электроном при расхождении разности потенциалов 1 В.
Эксперименты и подтверждение постулатов
В 1914 году немецкие ученые Густав Герц и Джеймс Франк стали авторами экспериментального исследования, подтверждающего существование дискретных энергетических уровней атома. Впоследствии в 1925 году за эту работу они получили Нобелевскую премию. Опыт Франкаи Герца считается классическим случаем подтверждения квантовой теории.
Перед началом исследования учеными был выдвинут тезис, что электроны, которые проходят через пары ртути, передают энергию дискретно и что это сопровождается эмиссией ультрафиолетовой спектральной линии ртути (λ = 254 нм). В последующем эксперименте немецкие ученые использовали лампу, поместив туда каплю ртути, и измеряли критический потенциал ее атомов.
Ход эксперимента
Чтобы определить критические потенциалы возбуждения атомов, Франком и Герцем был использован метод задерживающего потенциала. Чтобы давление насыщенных паров ртути в лампе достигло нужного уровня, прибор поместили внутрь электрической печи и нагрели до необходимой температуры.
Трубка из стекла, откуда откачали воздух, имела катод накал, сетку и электрод. Электроны, вылетая из катода, ускорялись напряжением U в направлении сетки. Они проходили через нее и достигали электрода, внося вклад в ток мишени I, в том случае, когда их кинетическая энергия была достаточной преодоления замедляющего напряжения UСA между сеткой и мишенью.
Имея малую величину, ток в анодной цепи мог быть зарегистрирован только с помощью системы, состоящий из усилителя постоянного тока и вольтметра. Усилитель поднимал величину падения напряжения, а вольтромер эту величину фиксировал. Падение напряжение измерялось в момент прохождения анодного тока по входному сопротивлению усилителя.
Выводы
В соответствии с теорией Бора любой атом ртути может получить лишь вполне определенную энергию при переходе в одно из возбужденных состояний. В связи с этим при наличии в атомах стационарных состояний электроны при столкновении с атомами ртути должны терять энергию дискретно, определенными порциями, равными разности энергии соответствующих стационарных состояний атома.
Из эксперимента можно заключить, что в случае увеличения ускоряющего потенциала до 4,86 В, анодный ток возрастает монотонным образом, его значение достигает максимума (4,86 В), затем следует резкое уменьшение и вновь рост. Впоследствии максимумы можно наблюдать при 2 ⋅ 4, 86 В и 3 ⋅ 4, 86 В.
Электроны, лишившиеся своей кинетической энергии, более не смогут преодолеть тормозящий потенциал и достигнуть анода. Этим и объясняется резкое падение анодного тока при
\(e\phi\) = 4,86 эВ. Если значения энергии кратны 4,86, электроны могут испытывать с атомами ртути 2, 3 и более неупругих соударения.
Таким образом, опыт показал, что электроны передают свою энергию атомам ртути порциями. Наименьшей порцией будет 4,86 эВ. Это минимум, который может быть поглощен атомом ртути в основном энергетическом состоянии. Из этого следует, что тезис Бора о существовании в атомах стационарных состояний выдержала проверку экспериментом.
Произвести вычисление длины волны светового кванта при известном значении \(\triangle E = 4,86\) можно с помощью формулы:
\(\lambda = hc/ \triangle E \approx 255 нм.\)
Так, в опытах обнаружилась правильность теории о том, что атомы ртути, подвергающиеся бомбардировке электронами с энергией 4,86 эВ, являются источником ультрафиолетового излучения с \(\lambda = 255\ нм.\)
Примеры задач
Вам нужно определить скорость и ускорение электрона на первой боровской орбите, радиус которой можно рассчитать с помощью формулы
Где me и \(e\) — масса и заряд электрона, а \(k_ <э>= 9 ⋅ 10 \frac
\(r_ <1>= \frac<ħ^<2>>
\(r_ <1>= \frac<ħ^<2>>
\(m_ = 9,1 ⋅ 10^<-31>кг \) — масса электрона;
\(e = 1,6 ⋅ 10^ <-19>Кл \) — заряд электрона.
В формуле радиуса первой боровской орбиты: \(ħ = 1,0546 ⋅ 10^<-34>\) Дж ⋅ с — квантовая постоянная Планка. Радиус окружности, по которому происходит движение, равен:
Эта сила в том числе является центростремительной, чему соответствует формула
В таком случае ускорение можно определить по формуле
В задаче дано: \( e = 1,6 ⋅ 10^ <-19>Кл\) – заряд электрона;
\(r_ <1>= 0,53 ⋅ 10^ <-10>м\) — радиус орбиты;
\(v \approx 2,2 ⋅ 10^ <6>\frac<м><с>\) — скорость электрона (мы нашли ее в первой задаче).
Если сила тока равна
То в данной задаче \( <\triangle q>= e, <\triangle t>= T\) (период обращения электрона). Период обращения электрона равен:
Таким образом, сила тока, возникающего при движении электрона по орбите радиусом r1 со скоростью v, равна:
Если подставить в эту формулу известные данные, то получим решение: