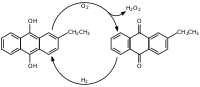
что такое пероксид углерода
Пероксиды
Перекисные соединения — сложные вещества, в которых атомы кислорода соединены друг с другом. Пероксиды легко выделяют кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для органических веществ и сегодня в русском языке часто используют термин перекись. Пероксиды многих органических веществ взрывоопасны (пероксид ацетона), в частности, они легко образуются фотохимически при длительном освещении эфиров в присутствии кислорода. Поэтому перед перегонкой многие эфиры (диэтиловый эфир, тетрагидрофуран) требуют проверки на отсутствие пероксидов.
Пероксиды замедляют синтез белка в клетке.
В зависимости от структуры различают собственно пероксиды, надпероксиды, озониды.
Содержание
Пероксиды (перекиси)
Неорганические пероксиды в виде бинарных или комплексных соединений известны почти для всех элементов. Пероксиды щелочных и щелочноземельных металлов реагируют с водой, образуя соответствующий гидроксид и пероксид водорода.
Органические пероксиды подразделяются на диалкилпероксиды, алкилгидропероксиды, диацилпероксиды, ацилгидропероксиды (пероксокарбоновые кислоты), циклические пероксиды. Органические пероксиды термически неустойчивы и часто взрывоопасны. Используются как источники свободных радикалов в органическом синтезе и промышленности (ди-трет-бутилпероксид, перекись ацетила), окисляющие антисептики (пероксид бензоила).
Надпероксиды
Озониды
Литература
Полезное
Смотреть что такое «Пероксиды» в других словарях:
ПЕРОКСИДЫ — (перекиси), химическое СОЕДИНЕНИЕ, содержащее два атома кислорода, связанных друг с другом и с третьим химическим элементом. Примером является перекись бария (ВаО2), из которой при обработке кислотой получают раствор ПЕРОКСИД ВОДОРОДА (H2О2),… … Научно-технический энциклопедический словарь
ПЕРОКСИДЫ — перекиси соединения, в которых атомы кислорода связаны друг с другом и с атомами более электроположительного элемента. Пример: пероксид водорода Н О О Н. Пероксиды применяют в SO2 процессе и при литье в керамические формы … Металлургический словарь
пероксиды — peroksidai statusas T sritis chemija apibrėžtis ↑ *dioksidas (2–). formulė ROOR, [RC(=O)O]₂ atitikmenys: angl. peroxides rus. перекиси; пероксиды … Chemijos terminų aiškinamasis žodynas
пероксиды — 3.3. пероксиды: Первичные продукты окисления липидов в виде труднореагируемых перекисных соединений, образующихся при глубоком окислении. Источник … Словарь-справочник терминов нормативно-технической документации
ГОСТ Р 54509-2011: Классификация химической продукции, опасность которой обусловлена физико-химическими свойствами. Методы испытаний химической продукции, в состав которой входят органические вещества (саморазлагающаяся химическая продукция и органические пероксиды) — Терминология ГОСТ Р 54509 2011: Классификация химической продукции, опасность которой обусловлена физико химическими свойствами. Методы испытаний химической продукции, в состав которой входят органические вещества (саморазлагающаяся химическая… … Словарь-справочник терминов нормативно-технической документации
органические пероксиды — 3.1 органические пероксиды: Химическая продукция, в состав которой входят органические вещества, содержащие двухвалентную структуру О О и считающиеся производными продукта пероксида водорода, в котором один или оба атома водорода замещены… … Словарь-справочник терминов нормативно-технической документации
ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ ОРГАНИЧЕСКИЕ — содержат группировку из связанных между собой двух атомов О. Различают собственно пероксиды ROOR (R и R орг. радикалы), гидропероксиды ROOH и озониды, напр. соед. ф лы I. В пероксидных соед. (II.) один или оба радикала м. б. присоединены к группе … Химическая энциклопедия
Перекиси
Часто пероксиды нестабильны, поэтому они не могут храниться и иногда являются опасными веществами. Вот почему они часто производятся на месте ( на месте ) и сразу же внедряются.
оглавление
история
Вхождение
В окружающей среде
В биохимических процессах
Образующийся перекись водорода затем превращается в свою очередь каталазой.
привязка
Неорганические пероксиды
описание
Синтез ионных пероксидов
С другой стороны, пероксид лития можно синтезировать путем реакции гидроксида лития с пероксидом водорода.
Пероксид бария, исторически используемый для производства пероксида водорода, может быть получен путем окисления оксида бария при повышенных температуре и давлении.
Синтез ковалентных пероксидов
Прямой синтез перекиси водорода из элементов в настоящее время невозможен в промышленных масштабах, так как она образуется лишь в незначительной степени. Многие пероксидные минеральные кислоты могут быть синтезированы путем анодного окисления лежащих в основе кислот. Например, таким образом доступны пероксодисульфаты и перкарбонаты.
характеристики
Обычно можно сформулировать несколько реакций для реакций солей пероксидов. В случае всех солей перекиси при смешивании с избытком разбавленных кислот выделяется перекись водорода.
Реакция с водой, а также термолиз соли приводит к образованию выделяющегося кислорода.
использовать
Пероксиды являются сильными окислителями и могут использоваться для окисления других соединений.
Перекись бария исторически использовалась для получения чистого кислорода из воздуха. Для этого использовалось температурно-зависимое равновесие между оксидом бария и пероксидом бария. При взаимодействии оксида бария с воздухом пероксид бария первоначально образовывался при 500 ° C. При температурах выше 700 ° C выделяется кислород с регрессией оксида бария.
Перекись кальция CaO 2 используется в качестве аэратора, выделяющего кислород, в почве и иле прудов, в США также в качестве пищевой добавки для разрыхления теста.
Органические пероксиды
описание
Синтез пероксидов и гидропероксидов
Синтез пероксикарбоновых кислот
Большинство пероксикарбоновых кислот доступны в результате реакции пероксида водорода с соответствующей карбоновой кислотой :
Ароматические альдегиды также подвергаются самоокислению до пероксикарбоновых кислот:
Однако они реагируют с дополнительным альдегидом с образованием карбоновой кислоты:
характеристики
В присутствии окисляемых соединений они могут действовать как окислители.
использовать
Промышленные синтетические смолы на основе эфиров акриловой и / или метакриловой кислоты без исключения производятся радикальной полимеризацией с органическими пероксидами при повышенных температурах. Скорость полимеризации можно регулировать подходящим выбором температуры и типа пероксида.
Из-за взрывного действия многих пероксидов были также разработаны и использованы исходные взрывчатые вещества на основе пероксидов. Наиболее известными из них являются пероксид ацетона (APEX) и гексаметилентрипероксид диамин (HMTD).
доказательство
Меры предосторожности
Пероксиды являются нестабильными соединениями и могут проявлять взрывоопасные свойства, особенно в более высоких концентрациях и при повышенных температурах. Кроме того, они способствуют возгоранию и могут вступать в реакцию с окисляющимися веществами (включая вату и целлюлозу), вызывая возгорание. По этой причине при работе с пероксидами необходимо соблюдать ряд мер безопасности:
Подробные правила техники безопасности закреплены в Положении 13 профессиональной ассоциации DGUV.
Углерод
Углерод
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Природные соединения
Получение
Химические свойства
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
Может восстановить и собственный оксид:
В реакциях с кислотами углерод проявляет себя как восстановитель:
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
СОДЕРЖАНИЕ
Типы органических пероксидов
Основные классы органических пероксидов включают:
Эти соединения встречаются в природе или используются в коммерческих целях. Известны и другие более специализированные пероксисоединения.
Характеристики
Биология
Промышленное использование
В химии полимеров
Перекись дибензоила используется в качестве радикального инициатора и способствует полимеризации акрилатов. Промышленные смолы на основе эфиров акриловой и / или метакриловой кислоты неизменно получают радикальной полимеризацией с органическими пероксидами при повышенных температурах. Скорость полимеризации регулируется подходящим выбором температуры и типа пероксида.
Отбеливающие и дезинфицирующие средства
Подготовка
Реакция взаимодействия диалкилсульфатов и щелочной перекиси водорода. В этом методе алкилсульфат отдает алкильную группу, а сульфат-ион образует уходящую группу :
Реакции
Реакция Хоха
Гидропероксиды являются промежуточными продуктами или реагентами в основных промышленных процессах. Ацетон и фенол образуются при разложении гидропероксида кумола по реакции Хоха (Me = метил):
Другие реакции
4 ROOH + LiAlH 4 → LiAlO 2 + 2 H 2 O + 4 ROH
В сложных эфиров фосфористой кислоты и третичные фосфины также снижения эффекта:
Расщепление до кетонов и спиртов в перегруппировке Корнблюма – ДеЛамара, катализируемой основанием
Активный кислород в пероксидах
Считается, что каждая пероксигруппа содержит один активный атом кислорода. Концепция содержания активного кислорода полезна для сравнения относительной концентрации пероксигрупп в составах, которая связана с содержанием энергии. Как правило, содержание энергии увеличивается с увеличением содержания активного кислорода, и, таким образом, чем выше молекулярная масса органических групп, тем ниже содержание энергии и, как правило, меньше опасность.
Термин « активный кислород» используется для обозначения количества пероксида, присутствующего в любом составе органического пероксида. Один из атомов кислорода в каждой пероксидной группе считается «активным». Теоретическое количество активного кислорода можно описать следующим уравнением:
Термическое разложение органических пероксидов
Самоускоряющееся разложение происходит, когда скорость разложения пероксида достаточна для генерации тепла с большей скоростью, чем оно может рассеиваться в окружающую среду. Температура является основным фактором скорости разложения. Самая низкая температура, при которой упакованный органический пероксид будет подвергаться самоускоряющемуся разложению в течение недели, определяется как температура самоускоряющегося разложения (ТСУР).
Безопасность
1) Оборудование размещается внутри железобетонных конструкций с окнами из фольги, которые сбрасывают давление и не разрушаются в случае взрыва.
2) Продукция разливается в небольшие емкости и сразу после синтеза перемещается в холодное место.
3) Емкости изготовлены из нереактивных материалов, таких как нержавеющая сталь, некоторые алюминиевые сплавы или темное стекло.
Для безопасного обращения с концентрированными органическими пероксидами важным параметром является температура образца, которая должна поддерживаться ниже температуры самоускоряющегося разложения соединения.
Доставка органических пероксидов ограничена. Департамент транспорта США списки органического пероксида перевозки ограничения и запрещенные материалы в 49 CFR 172,101 опасных материалы таблицы на основе концентрации и физическое состоянии материала:
СОДЕРЖАНИЕ
Типы органических пероксидов
Основные классы органических пероксидов включают:
Эти соединения встречаются в природе или используются в коммерческих целях. Известны и другие более специализированные пероксисоединения.
Характеристики
Биология
Промышленное использование
В химии полимеров
Перекись дибензоила используется в качестве радикального инициатора и способствует полимеризации акрилатов. Промышленные смолы на основе эфиров акриловой и / или метакриловой кислоты неизменно получают радикальной полимеризацией с органическими пероксидами при повышенных температурах. Скорость полимеризации регулируется подходящим выбором температуры и типа пероксида.
Отбеливающие и дезинфицирующие средства
Подготовка
Реакция взаимодействия диалкилсульфатов и щелочной перекиси водорода. В этом методе алкилсульфат отдает алкильную группу, а сульфат-ион образует уходящую группу :
Реакции
Реакция Хоха
Гидропероксиды являются промежуточными продуктами или реагентами в основных промышленных процессах. Ацетон и фенол образуются при разложении гидропероксида кумола по реакции Хоха (Me = метил):
Другие реакции
4 ROOH + LiAlH 4 → LiAlO 2 + 2 H 2 O + 4 ROH
В сложных эфиров фосфористой кислоты и третичные фосфины также снижения эффекта:
Расщепление до кетонов и спиртов в перегруппировке Корнблюма – ДеЛамара, катализируемой основанием
Активный кислород в пероксидах
Считается, что каждая пероксигруппа содержит один активный атом кислорода. Концепция содержания активного кислорода полезна для сравнения относительной концентрации пероксигрупп в составах, которая связана с содержанием энергии. Как правило, содержание энергии увеличивается с увеличением содержания активного кислорода, и, таким образом, чем выше молекулярная масса органических групп, тем ниже содержание энергии и, как правило, меньше опасность.
Термин « активный кислород» используется для обозначения количества пероксида, присутствующего в любом составе органического пероксида. Один из атомов кислорода в каждой пероксидной группе считается «активным». Теоретическое количество активного кислорода можно описать следующим уравнением:
Термическое разложение органических пероксидов
Самоускоряющееся разложение происходит, когда скорость разложения пероксида достаточна для генерации тепла с большей скоростью, чем оно может рассеиваться в окружающую среду. Температура является основным фактором скорости разложения. Самая низкая температура, при которой упакованный органический пероксид будет подвергаться самоускоряющемуся разложению в течение недели, определяется как температура самоускоряющегося разложения (ТСУР).
Безопасность
1) Оборудование размещается внутри железобетонных конструкций с окнами из фольги, которые сбрасывают давление и не разрушаются в случае взрыва.
2) Продукция разливается в небольшие емкости и сразу после синтеза перемещается в холодное место.
3) Емкости изготовлены из нереактивных материалов, таких как нержавеющая сталь, некоторые алюминиевые сплавы или темное стекло.
Для безопасного обращения с концентрированными органическими пероксидами важным параметром является температура образца, которая должна поддерживаться ниже температуры самоускоряющегося разложения соединения.
Доставка органических пероксидов ограничена. Департамент транспорта США списки органического пероксида перевозки ограничения и запрещенные материалы в 49 CFR 172,101 опасных материалы таблицы на основе концентрации и физическое состоянии материала: