что такое период полувыведения лекарственного препарата
Что такое период полувыведения лекарственного препарата
В распределении анестетика важную роль играет также связывание с белками плазмы, наибольшее значение из которых имеют альбумины. Связанная с белками часть препарата образует депо и находится в равновесии с растворенной в плазме частью, но лишь растворенная часть препарата (не связанная с белками плазмы) распределяется в тканях и оказывает фармакологическое действие. Различные прераты при одновременном введении вместе конкурируют за места связывания с белками плазмы.
В результате концентрация свободной фракции отдельных препаратов в плазме может возрасти, что проявляется признаками передозировки. Аналогичный эффект может вызвать уменьшение белково-связывающей емкости плазмы при заболеваниях печени и почек, а также алиментарной белковой недостаточности. В этих случаях дозу анестетика можно уменьшить. Еше большее практическое значение имеет зависимость связывания препарата с белками плазмы от скорости его введения.
При быстром введение препарата свободная его фракция (т.е. экологически активная часть) увеличиваются. Во избежание острой передозировки внутривенные анестетики вводят можно и с учетом достигаемого эффекта.|
Элиминация. Внутривенные анестетики подвергаются биотрансформации. Отчасти метаболизируются или инактивируются в печени и выводятся с желчью, почками (гепаторенальный клиренс). Лишь небольшая часть препаратов выдится из организма в неизмененном виде. Метаболизация с участием фермнтов более длительный процесс, чем вывод через легкие. Поэтому время элиминации даже современных внутривенных аанестетиков короткого действия больше ингаляционных анестетиков.
Период полувыведення. При системном применении фармакологических препаратов различают три объема (пространства, камеры) распределения: 1. Плазма крови, составляющая 4 объема тела (центральный объем).
2. Интерстициальное пространство (15%).
3. Внутриклеточный объем (40%). Поскольку эндотелий большинства органов содержит межклеточные поры или фенестрирован, то проникновение веществ через него происходит относительно беспрепятственно и зависит только от размера молекул. В связи с этим представляется привлекательной концепция, согласной которой интерстициальное пространство и плазма с точки зрения фармакокинетики рассматриваются как единое (внеклеточное) пространство.
Для активного проникновения внутривенного анестетика решающее значение имеет скорость, с которой анестетик диффундирует из центрального объема (плазма крови) в более глубокие пространства головного мозга. Математически этот процесс можно описать уравнением, рассчитав равновесный период полувыведения 11/2 keO. Он позволяет судить о начале действия препарата. Время, в течение которого происходит начальное распределение препарата по всему организму, обозначают как период полураспределения (tl/2a).
После завершения распределения между концентрациями препарата в отдельных пространствах устанавливается устойчивое равновесие (steady state). Дальнейшая динамика концентрации определяется в первую очередь процессом элиминации анестетика (клиренс плазмы). Время, необходимое для уменьшения концентрации вещества в плазме до половины исходного уровня, называют периодом полувыведения (tl/2p). Снижение концентрации, как правило, описывается логарифмической зависимостью.
Период полувыведения вещества не следует отождествлять с длительностью его действия (см. выше)! Чтобы рассчитать элиминацию при непрерывном поступлении препарата (ТВА, ИУЦК), основываются на контекстно-чувствительном периоде полувыведения. Под контекстно-чувствительным периодом полувыведения понимают время, за которое концентрация анестетика в плазме крови после прекращения внутривенной его инфузии уменьшается на 50%. Элиминационный период полувыведения анестетика определяют исходя из его плазменного клиренса и объема распределения. Этот период тем короче, чем больше клиренс и чем меньше объем распределения.
Период полувыведения (полужизни)
Период полувыведения [ править | править код ]
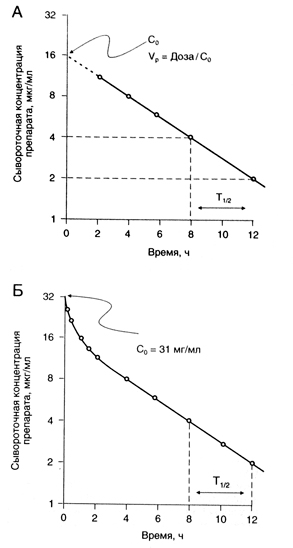
Период полувыведения (Т1/2) — это время, за которое сывороточная концентрация вещества (или его общее содержание в организме) снижается вдвое. В рамках однокамерной модели (рис. 1.4, А) определить Т1/2 очень просто. Полученное значение используют затем для расчета дозы. Однако для многих лекарственных средств приходится использовать многокамерную модель, так как динамика их сывороточной концентрации описывается несколькими экспоненциальными функциями (рис. 1.4, Б). В таких случаях рассчитывают несколько значений Т1/2.
Раньше Т1/2 рассчитывали по участку фармакокинетической кривой, отражающему стадию равновесия (стадию элиминации). С появлением более чувствительных методов измерения концентрации веществ в крови оказалось, что конечный Т1/2 гораздо больше начального. Например, для гентамицина конечный Т1/2 равен 53 ч, тогда как в Приложении II приведен T1/2 2—3 ч. Чрезвычайно длительный конечный Т1/2 индометацина (120 ч) обусловлен, вероятно, активным кишечно-печеночным кругооборотом препарата (в Приложении II приведен Т 1/2 2,4 ч). Клиническая значимость Т1/2 для того или иного периода зависит от того, какая доля вещества выводится из организма и каков объем распределения в этот период, а также от того, какой из показателей — сывороточная концентрация препарата или его общее содержание в организме — лучше коррелирует с фармакологическими эффектами. В Приложении II приведены величины Т1/2, имеющие наибольшее практическое значение.
В прошлом изменение фармакокинетики лекарственных средств при разных патологических состояниях оценивали только на основании Т1/2. В настоящее время общепризнано, что Т1/2 зависит от клиренса и объема рас- пределения вещества. В стационарном состоянии зависимость между Т1/2, клиренсом и объемом распределения приблизительно описывается следующим уравнением:
T1/2 = 0.693 x Vc / Cl(1.12)
Клиренс характеризует способность организма элиминировать вещество, поэтому при снижении этого показателя вследствие какого-либо заболевания Т1/2 должен увеличиваться. Но это справедливо лишь в том случае, если не меняется объем распределения вещества. Например, с возрастом Т1/2 диазепама увеличивается, но не за счет уменьшения клиренса, а вследствие увеличения объема распределения (Klotzetal., 1975). На клиренс и объем распределения влияет степень связывания вещества с белками плазмы и тканей, так что предсказать изменение Т1/2 при том или ином патологическом состоянии не всегда возможно. При остром вирусном гепатите Т1/2 толбутамида уменьшается, а не увеличивается, как это можно было бы ожидать, из-за снижения степени связывания препарата с белками плазмы и тканей. Объем распределения толбутамида не меняется, а клиренс увеличивается вследствие увеличения сывороточной концентрации свободного препарата (Williams et al., 1977).
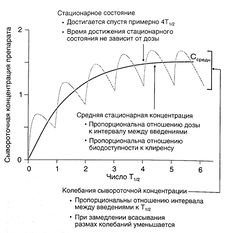
По Т1/2 не всегда можно судить об изменении элиминации препарата, зато этот показатель позволяет рассчитать время достижения стационарного состояния (в начале лечения, а также при изменении дозы или частоты введения). Сывороточная концентрация, составляющая примерно 94% средней стационарной, достигается за время, равное 4Т1/2. Кроме того, с помощью Т1/2 можно оценить время, необходимое для полного удаления вещества из организма, и рассчитать интервал между введениями (см. ниже).
Стационарное состояние [ править | править код ]
Согласно уравнению 1.1, если вещество вводится путем инфузии с постоянной скоростью, в стационарном состоянии скорость поступления вещества (скорость инфузии) равна скорости его элиминации (произведение клиренса на сывороточную концентрацию препарата — уравнение 1.3). Уравнение 1.1 можно применять и при дробном введении (например, 250 мг каждые 8 ч): в этом случае также устанавливается стационарная сывороточная концентрация препарата, но в промежутках между введениями она колеблется от минимальной до максимальной (рис. 1.5).
Описание к рис. 1.5. Динамика сывороточной концентрации лекарственного средства при дробном введении. Серая кривая описывает накопление препарата при введении с интервалами, равными Т1/2, при условии, что скорость всасывания в 10 раз больше скорости элиминации. При увеличении скорости всасывания максимальная концентрация в стационарном состоянии стремится к 2, а минимальная — к 1. Черная кривая отражает динамику сывороточной концентрации препарата, который вводят в эквивалентной дозе путем инфузии. Обе кривые соответствуют однокамерной фармакокинетической модели. Средняя концентрация в стационарном состоянии вычисляется по уравнению:
Cсредн=F x Доза / (Cl x T)
Это уравнение можно получить путем замены в уравнении 1.1 скорости поступления вещества на выражение F х Доза / Т. Ссредн соответствует концентрации препарата в стационарном состоянии при введении путем инфузии.
Что такое период полувыведения лекарственного препарата
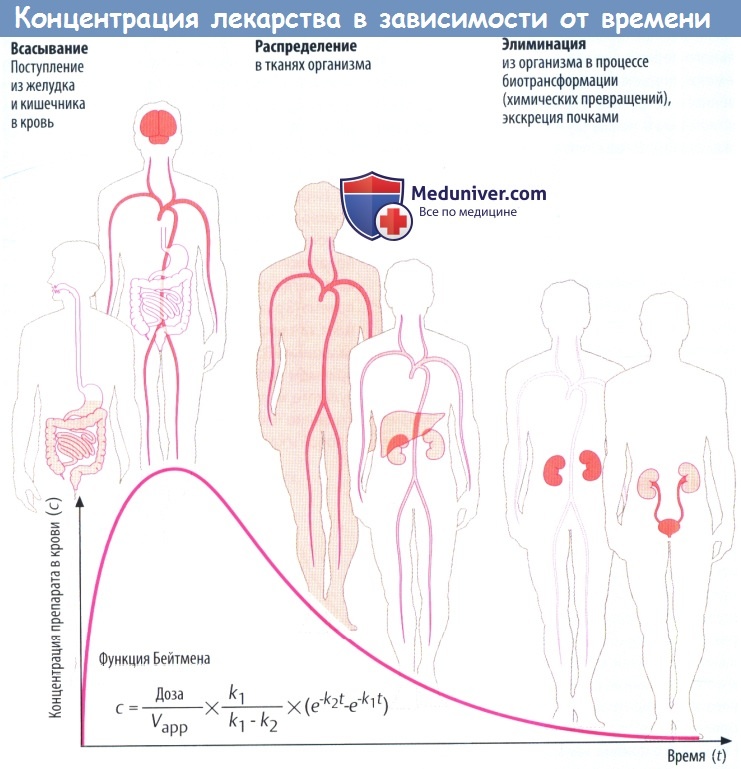
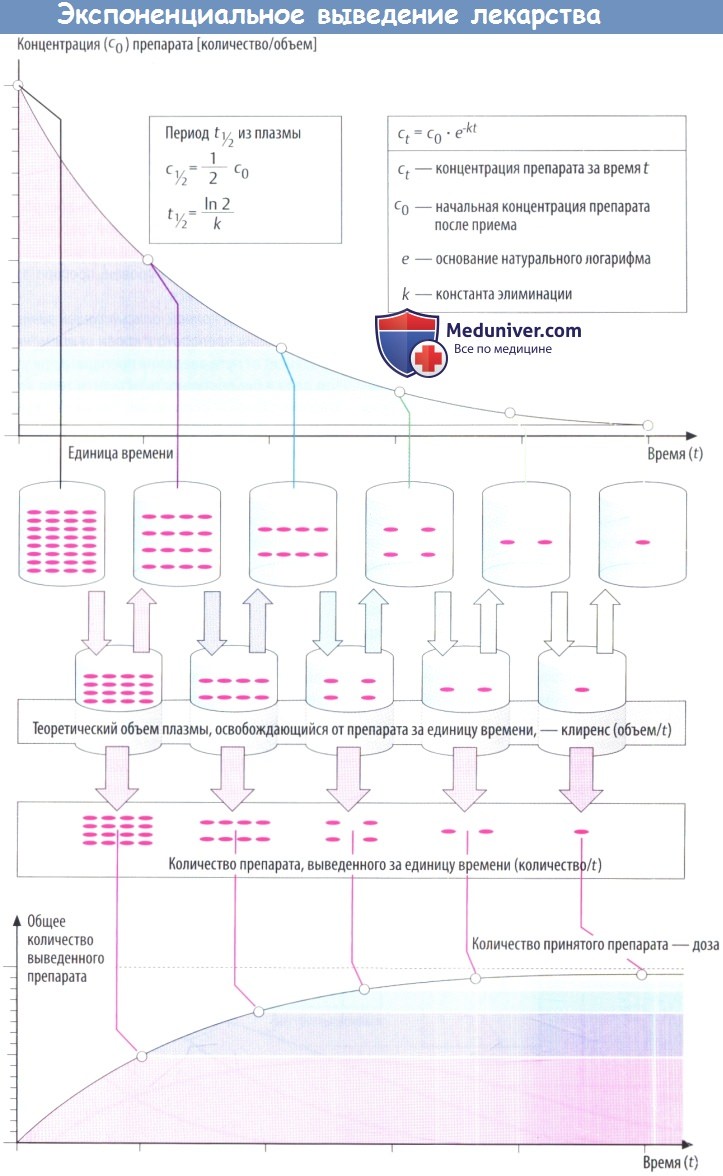
Такие процессы, как всасывание и выведение, обладают экспоненциальными характеристиками. В отношении всасывания это следует из простого факта: количество препарата, перемещающегося за единицу времени, зависит от разности концентраций (градиента) на границе двух тканей (закон Фика).
В процессе всасывания из пищеварительного тракта содержимое кишечника и кровь представляют собой ткани с изначально высокой и низкой концентрациями соответственно. При выведении лекарственного вещества через почки экскреция часто зависит от скорости клубочковой фильтрации, т. е. от количества препарата, попавшего в первичную мочу.
По мере снижения концентрации в крови количество лекарственного вещества, экскретируемого через почки за единицу времени, уменьшается. В результате происходит экспоненциальное снижение, показанное на рисунке ниже. Время экспоненциальногоснижения — постоянный интервал, в течение которого концентрация снижается в 2 раза.
Этот интервал представляет собой период полувыведения (t1/2) и связан с константой скорости элиминации (k) уравнением: t1/2 = (ln2)/k. Эти два параметра вместе с исходной концентрацией (с0) описывают скорость реакции первого порядка (экспоненциальную).
Поскольку эта скорость постоянная, она дает возможность вычислить объем плазмы, освобожденной от лекарственного вещества, учитывая, что оставшееся количество не распределено равномерно в общем объеме плазмы (условие, невозможное в реальности). Теоретический объем плазмы, освобождающейся от лекарственного вещества за единицу времени, называется клиренсом.
В зависимости от того, снижается концентрация в плазме в результате экскреции с мочой либо в результате разрушения в процессе метаболизма, клиренс называют почечным или печеночным. Почечный и печеночный клиренсы суммируются, образуя общий клиренс (Cltot) в случае, если препараты выводятся в неизмененном виде через почки и подвергаются биотрансформации в печени.
Cltot представляет собой сумму всех процессов, участвующих в выведении; он связан с периодом полувыведения (t1/2) и объемом распределения препарата (Vapp) формулой:
Чем меньше объем распределения и чем больше общий клиренс, тем короче период полувыведения.
Для препаратов, выводимых почками в неизмененном виде, t1/2 можно вычислить на основании кумулятивной экскреции с мочой; итоговое общее количество выведенного препарата соответствует количеству всосавшегося препарата.
Печеночная элиминация происходит по экспоненте, т. к. ферменты, катализирующие реакции метаболизма, действуют в квазилинейной области своей кривой активности концентрации; следовательно, количество вещества, подвергшегося метаболизму за единицу времени, уменьшается параллельно снижению концентрации в крови.
Самое известное исключение из экспоненциального закона — выведение алкоголя (этанола), которое происходит по линейному закону (кинетика нулевого порядка), во всяком случае, при концентрации в крови менее 0,02%. Это происходит потому, что лимитирующий скорость фермент алкогольдегидрогеназа достигает полунасыщения при очень низких концентрациях вещества — примерно 80 мг/л (0,008%).
Таким образом, при концентрации этанола в крови на уровне примерно 0,02% скорость реакции выходит на плато, при концентрациях выше этого уровня количество лекарственного вещества, выведенного за единицу времени, остается постоянным.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
| Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях стационарной медицинской помощи. |
Регистрационный номер:
Торговое наименование:
Международное непатентованное или группировочное наименование:
Лекарственная форма:
лиофилизат для приготовления концентрата для приготовления раствора для инфузий
Состав на 1 флакон:
| Действующее вещество: | ||
| Фавипиравир | 400 мг | 800 мг |
| Вспомогательные вещества: | ||
| L-лизина моногидрат | 192 мг | 384 мг |
| Натрия гидроксид | до pH 6,8-8,0 | |
Описание
Лиофилизированный порошок с фрагментами пористой массы или пористая масса от желтого до желтого с зеленоватым оттенком цвета.
Прозрачный или опалесцирующий желтого или желтого с зеленоватым оттенком цвета раствор.
Фармакотерапевтическая группа:
Код АТХ:
Фармакологические свойства
Фармакодинамика
Противовирусная активность in vitro
Фавипиравир обладает противовирусной активностью против лабораторных штаммов вирусов гриппа А и В (половинная максимальная эффективная концентрация (ЕС50) 0,014-0,55 мкг/мл).
Для штаммов вирусов гриппа А и В, резистентных к адамантану (амантадину римантадину), осельтамивиру или занамивиру, ЕС50 составляет 0,03-0,94 мкг/мл и 0,09-0,83 мкг/мл, соответственно. Для штаммов вируса гриппа А (включая штаммы, резистентные к адамантану, осельтамивиру и занамивиру), таких как свиной грипп типа А и птичий грипп типа А, включая высокопатогенные штаммы (в том числе, H5N1 и H7N9), ЕС50 составляет 0,06-3,53 мкг/мл.
Для штаммов вирусов гриппа А и В, резистентных к адамантану, осельтамивиру и занамивиру, ЕС50 составляет 0,09-0,47 мкг/мл; перекрестная резистентность не наблюдается.
Фавипиравир ингибирует вирус SARS-CoV-2, вызывающий новую коронавирусную инфекцию (COVID-19). ЕС50 в клетках Vero Е6 составляет 61,88 мкмоль, что соответствует 9,72 мкг/мл.
Фавипиравир метаболизируется в клетках до рибозилтрифосфата фавипиравира (РТФ фавипиравира) и избирательно ингибирует РНК-зависимую РНК полимеразу, участвующую в репликации вируса гриппа. РТФ фавипиравира (1000 мкмоль/л) не показал ингибирующего действия на α ДНК человека, но показал ингибирующее действие в диапазоне от 9,1 до 13,5% на β и в диапазоне от 11,7 до 41,2% на γ ДНК человека. Ингибирующая концентрация (IC50) РТФ фавипиравира для полимеразы II РНК человека составила 905 мкмоль/л.
После 30 пересевов в присутствии фавипиравира не наблюдалось изменений в восприимчивости вирусов гриппа типа А к фавипиравиру, резистентных штаммов также не наблюдалось. В проведенных клинических исследованиях не обнаружено появление вирусов гриппа, резистентных к фавипиравиру.
Фармакокинетика
При пероральном приеме фавипиравир легко всасывается в желудочно-кишечном тракте. Время достижения максимальной концентрации (Тmax) 1,5 ч. При внутривенном введении фавипиравира однократно в диапазоне доз 400-1800 мг время достижения максимальной концентрации (Тmax) составляет от 1,85 до 2,05 ч. При однократном введении зависимость вводимой дозы от максимального значения концентрации фавипиравира в плазме (Cmax) носит линейный характер в диапазоне доз 400-1600 мг (гМ),98). Зависимость вводимой дозы от площади под кривой «концентрация-время» с момента введения до последнего определяемого значения концентрации фавипиравира во временной точке (AUC0-t) носит линейный характер на всем изучаемом диапазоне доз (400-1800 мг) (r²=0,97).
В проведенном клиническом исследовании I фазы лекарственного препарата АРЕПЛИВИР ® при парентеральном введении лекарственного препарата время достижения максимальной концентрации (Сmax) составило 52,70±14,86 мкг/мл при двукратном введении дозы 1600 мг, а время достижения максимальной концентрации (Тmax) составило 14 часов (через 2 часа после второго введения). Значения AUC0-∞ и AUC0-t составили 554,63±319,12 мкг*ч/мл и 443,82±200,33 мкг*ч/мл соответственно.
Связывание с белками плазмы составляет около 54%.
Фавипиравир в основном метаболизируется альдегидоксидазой и частично метаболизируется до гидроксилированной формы ксантиноксидазой. В клетках метаболизируется РТФ фавипиравира. Из других метаболитов, кроме гидроксилата, в плазме крови и моче человека регистрировали также конъюгат глюкуроната.
В основном фавипиравир выводится почками в виде активного метаболита гидроксилата, небольшое количество в неизменном виде. Период полувыведения фавипиравира после перорального применения (Т1/2) около 5 ч.
Пациенты с нарушением функции печени
При приеме пероральной формы фавипиравира пациентами с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью) увеличения Сmax и AUC составили 1,5 раза и 1,8 раз, соответственно, по сравнению со здоровыми добровольцами. Данные увеличения Сmax и AUC для пациентов с печеночной недостаточностью тяжелой степени тяжести (класс С по классификации Чайлд-Пью) составляли 2,1 раз и 6,3 раза, соответственно.
Пациенты с нарушением функции почек
Необходимо использовать эффективные методы контрацепции (презерватив со спермицидом) во время приема препарата и по ле его окончания в течение 1 месяца женщинам и в течение 3 месяцев мужчинам.
При назначении лекарственного препарата АРЕПЛИВИР ® кормящим женщинам необходимо прекратить грудное вскармливание на время приема препарата и в течение 7 дней после его окончания, так как основной метаболит фавипиравира попадает в грудное молоко.
Способ применения и дозы
Применение лекарственного препарата АРЕПЛИВИР ® должно осуществляться в условиях стационара.
Для лечения новой коронавирусной инфекции (COVID-19), вызванной вирусом SARS-CoV-2, рекомендуется следующий режим дозирования:
Введение препарата осуществляется внутривенно капельно в течение 2 ч.
Применение препарата должно осуществляться на основании клинической картины и/или после лабораторного подтверждения диагноза и при наличии характерной клинической симптоматики.
Общая продолжительность курса лечения составляет 10 дней или до подтверждения элиминации вируса (отрицательный результат ПЦР-исследования), если наступит ранее.
Инструкция по приготовлению раствора для инфузий
В 1 флакон препарата с содержанием фавипиравира 400 мг медленно по внутренней стенке добавляют 20 мл 0,9% раствора натрия хлорида.
В 1 флакон препарата с содержанием фавипиравира 800 мг медленно по внутренней стенке добавляют 40 мл 0,9% раствора натрия хлорида.
Флакон энергично встряхивают до полного растворения препарата. Ориентировочное время растворения 30 секунд. Необходимо убедиться в том, что весь препарат полностью растворился. В случае неполного растворения препарата перемешивание повторяют. Должен получиться прозрачный или опалесцирующий желтого или желтого с зеленоватым оттенком цвета раствор. В таблице 1 представлены необходимое количество флаконов и объем требуемого концентрата на 1 пациента на 1 инфузию в зависимости от дозы.
Таблица 1. Количество лиофилизата и объем требуемого концентрата
| Разовая доза, мг | Необходимое количество флаконов препарата на 1 пациента на 1 инфузию | Необходимое количество концентрата на 1 пациента на 1 инфузию |
| 800 | 2 флакона по 400 мг | 40 мл |
| 1 флакон по 800 мг | ||
| 1600 | 4 флакона по 400 мг | 80 мл |
| 2 флакона по 800 мг |
Приготовление раствора для инфузий:
Из флакона с 200 мл физиологического раствора (0,9% натрия хлорида) удаляют соответственно по 40 или 80 мл раствора и замещают эти количества требуемым объемом восстановленного концентрата.
Т.е. для каждого введения подготавливается препарат в дозе 800 или 1600 мг в 200 мл физиологического раствора (0,9% натрия хлорида).
Хранение восстановленного раствора
Проведенные исследования стабильности восстановленного раствора показали, что приготовленный раствор для инфузий препарата АРЕПЛИВИР ® может храниться при температуре не выше 25 °С не более 4 часов.
Побочное действие
1) При назначении лекарственного препарата АРЕПЛИВИР ® женщинам, способным к деторождению (в том числе в постменопаузе менее 2-х лет), необходимо подтвердить отрицательный результат теста на беременность до начала лечения. Женщинам, способным к деторождению, необходимо в полной мере объяснить риски и тщательно проинструктировать использовать наиболее эффективные методы контрацепции с их партнерами во время приема препарата и в течение 1 месяца после его окончания (презерватив со спермицидом). При предположении о возможном наступлении беременности необходимо незамедлительно отменить прием препарата и проконсультироваться с врачом.
2) При распределении в организме человека фавипиравир попадает в сперму. При назначении препарата пациентам мужчинам необходимо в полной мере объяснить риски и тщательно проинструктировать использовать наиболее эффективные методы контрацепции при сексуальных контактах во время приема препарата и в течение 3 месяцев после его окончания (презерватив со спермицидом). Дополнительно необходимо проинструктировать пациентов мужчин не вступать в сексуальные контакты с беременными женщинами.
3) При распределении в организме человека фавипиравир попадает в грудное молоко. При назначении препарата кормящим женщинам необходимо в полной мере объяснить риски и тщательно проинструктировать прекратить грудное вскармливание на время приема препарата и в течение 7 дней после его окончания.
Влияние на способность управлять транспортными средствами, механизмами
Следует соблюдать осторожность при управлении транспортными средствами и работе с механизмами.
Форма выпуска
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий, 400 мг, 800 мг.
По 400 мг действующего вещества во флаконы объемом 20 мл или 30 мл бесцветного стекла 1-го гидролитического класса, герметично укупоренные бромо-бутиловыми резиновыми пробками и обжатые колпачками комбинированными.
По 800 мг действующего вещества во флаконы объемом 50 мл или 100 мл бесцветного стекла 1-го гидролитического класса, герметично укупоренные бромо-бутиловыми резиновыми пробками и обжатые колпачками комбинированными.
По 1, 5, 6, 10, 12, 15, 20 флаконов с препаратом вместе с инструкцией по медицинскому применению помещают в пачку из картона.
По 48, 50 флаконов с приложением равного количества инструкций по медицинскому применению помещают в коробку из картона (для стационаров).
Условия хранения
При температуре не выше 25 °С в оригинальной упаковке (пачке).
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
ООО «ПРОМОМЕД РУС», Россия
129090, г. Москва, проспект Мира, дом 13, строение 1, офис 13
Производитель
АО «Биохимик», Россия
Юридический адрес: 430030, Республика Мордовия, г. Саранск, ул. Васенко, д. 15А
Адрес места производства: 430030, Республика Мордовия, г. Саранск, ул. Васенко, д. 15А
Организация, принимающая претензии потребителей
ООО «ПРОМОМЕД РУС», Россия
129090, г. Москва, проспект Мира, дом 13, строение 1, офис 13