что такое панкреатический шок
Неотложные состояния. Острый панкреатит
Как поставить диагноз? Какие осложнения несут угрозу для жизни пациента? Можно ли остановить рост заболеваемости? Острый панкреатит — одно из самых сложно диагностируемых и вместе с тем широко распространенных заболеваний пищеварительной системы.
Как поставить диагноз?
Какие осложнения несут угрозу для жизни пациента?
Можно ли остановить рост заболеваемости?
Острый панкреатит — одно из самых сложно диагностируемых и вместе с тем широко распространенных заболеваний пищеварительной системы. Специфическая терапия практически отсутствует; проявления чрезвычайно разнообразны и поставить диагноз трудно даже с помощью лабораторных тестов. Ему сопутствует целый ряд осложнений, угрожающих жизни, а клиническое течение и исход непредсказуемы.
В основу данной статьи легли новые рекомендации Британского гастроэнтерологического общества, касающиеся ведения больных острым панкреатитом. Больным, незнакомым с симптомами и возможными серьезными последствиями этого заболевания, полезно обратиться к буклету, выпущенному группой поддержки больных панкреатитом [1].
На Международном симпозиуме, проходившем в Атланте в 1972 году [2], предложено такое определение острого панкреатита: «острое воспаление поджелудочной железы, обыкновенно с острым началом, выраженным болевым синдромом, напряжением мышц живота, рвотой, и последующим вовлечением в процесс различных органов и систем». Объективно заболевание подтверждается «повышенным содержанием панкреатических ферментов в крови или моче». Более точной является классификация осложнений, на которой строится сравнительный анализ и научные исследования (табл. 1).
Таблица 1. Клиническая классификация, предложенная Международным симпозиумом в Атланте [1]
Различные диагностические критерии делают недостоверными показатели заболеваемости. Однако установлено, что частота его в молодом возрасте среди городского населения существенно коррелирует со злоупотреблением алкоголя, а у пожилых сельских жителей — с желчнокаменной болезнью.
По статистике в Великобритании ежегодно острым панкреатитом заболевают 200 из миллиона человек, около 1500 умирают. В среднем врач общей практики сталкивается с вновь заболевшим один раз в три-четыре года. За последние полвека заболеваемость росла синхронно с увеличением потребления алкоголя. В это время госпитальная смертность оставалась в пределах 10%, общая достигала 20%, учитывая случаи посмертной диагностики.
Большинство приступов ограничивается поражением только поджелудочной железы, тогда как в остальных развиваются осложнения, угрожающие жизни или приводящие к смертельному исходу. Обычно это рано развивающаяся органная недостаточность, сопровождающаяся поражением поджелудочной железы в виде некроза, абсцесса или формирования псевдокисты (табл. 1). По последним сообщениям из Йоркшира и западной Шотландии, из 730 случаев острого панкреатита 73% пациентов полностью поправились после легкого приступа, 18% выжили, несмотря на осложнения, и 9% погибли.
Внезапная острейшая боль, иррадиирующая в спину, тошнота или рвота — вот типичное начало приступа. Нередко ему предшествует прием пищи или алкоголя
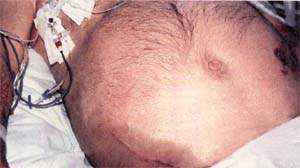 |
| Рисунок 1. Распространение воспалительного экссудата по заднебрюшинной клетчатке вызывает кровоподтеки на боках и в околопупочной области Нарушение пигментации обусловлены разрушением гемоглобина; эти пятна изчезают за несколько дней |
или недавний подобный приступ. При обследовании выявляется бледность, похолодание конечностей, тахикардия, гипотензия, указывающие на гиповолемию.
Иногда присутствует умеренная лихорадка, желтушность кожи и слизистых; абдоминальные симптомы варьируют от легкого напряжения мышц в эпигастрии до генерализованных симптомов раздражения брюшины, развивающегося также и при перфорации внутренних органов. В некоторых случаях обнаруживаются признаки шока и метаболических нарушений при отсутствии объективных абдоминальных симптомов.
Кровоподтеки (рис. 1) патогномоничны только в том случае, если захватывают и пупочную область (как при прерывании эктопической беременности) и боковые стенки живота (как при разрыве аневризмы аорты). Подобный признак указывает на тяжесть приступа, и вероятность смертельного исхода увеличивается в четыре раза.
Диагностически значимым является и четырех-шестикратное увеличение содержания в крови амилазы. Определение амилазы в моче с помощью тест-полоски используется как метод быстрого скрининга. Возможные ошибочные диагнозы, при которых требуется скорее срочная лапаратомия, чем консервативное лечение, приведены в табл. 2.
Таблица 2. Возможные ошибки при определении гиперамилаземии
По данным йоркширской/шотландской статистики, большинство приступов в мире провоцируется желчнокаменной болезнью и алкоголем — 41% и 25% соответственно. Но причина многих из них так и остается неизвестной, хотя и предложено множество этиологических сочетаний (табл. 3) [3].
Начиная с тиазидов в 1959 году предложено более тысячи лекарственных препаратов, способных провоцировать приступ, но в каждом конкретном случае для доказательства лекарственной этиологии необходимо исключить множество других причин, что практически весьма трудно.
Повышенный риск нарушения функции почек и желудочно-кишечных кровотечений исключает применение нестероидных противовоспалительных препаратов.
Стандартный набор больничных исследований включает общий клинический и биохимический анализ крови, определение газов крови и общий анализ мочи. В первые сутки течение заболевания непредсказуемо, и пациент требует постоянного наблюдения и ухода, предпочтительно в специализированном отделении.
К системным осложнениям относятся: дыхательная недостаточность (развивается в 20% приступов), почечная недостаточность (5%), сердечно-сосудистый коллапс, такой же, как при септическом шоке (5% пациентов).
Срочную ретроградную холангиопанкреатографию и эндоскопическую папиллотомию рекомендуется проводить при тяжелых приступах. Хотя данные о результатах таких процедур различны, их эффективность подтверждают британские исследования [5]. При тяжелых приступах повышается интенсивность катаболических процессов, и при продолжительном голодании (более трех-четырех дней) возникает необходимость в парентеральном питании наряду с дополнительным энтеральным введением пищи для сохранения барьерной функции слизистой оболочки кишечника. Диеты придерживаются до тех пор, пока у пациента не восстанавливается переносимость жидкостей и не ослабевают боль и мышечная защита.
Абсцесс поджелудочной железы проявляется симптомами общей интоксикации у 2 — 3% пациентов, обычно через несколько недель после приступа. Инкапсулированный жидкий гной либо аспирируется, либо удаляется через чрезкожный дренаж. Острая псевдокиста осложняет 2 — 3% приступов, содержит панкреатический сок, отграниченный зрелой фиброзной или грануляционной тканью в отличие от эпителия истинных кист.
Псевдокисты развиваются вследствие повреждения панкреатического протока. Диагноз ставится при обычном рентгенологическом исследовании, но иногда кисты определяются даже пальпаторно. Лучшие методы для их исследования — компьютерная томография и магнитно-резонансная томография. Ультразвуковой метод применяется для контроля за их развитием.
При разрывах может возникать панкреатический асцит, эрозии в сосуды приводят к развитию воспалительных псевдоаневризм или серьезных кровотечений. Увеличение абсцесса вызывает боль, билиарную или пилорическую обструкцию.
Таблица 3. Этиологические факторы, точно установленные и возможные
В йоркширском/глазговском исследовании 90% смертей были связаны с системной органной недостаточностью, что частично перекрывается 50% смертей, вызванных накоплением жидкости в поджелудочной железе. Интенсивное лечение ранних осложнений, казалось, должно было бы увеличить выживаемость, но из-за поздних, с трудом поддающихся лечению осложнений общая смертность остается на прежнем уровне. Ей также способствуют истощенные биологические резервы организма и отягощенный преморбидный фон.
За жизнь тысяч пациентов приходится бороться, и выжившие, как правило, выздоравливают полностью. Молодым пациентам, возвращающимся к трудовой деятельности, рекомендуется проводить более интенсивное лечение.
Потеря веса длится около месяца после окончания приступа. В это время у многих пациентов подавленное состояние, и их важно убеждать в том, что оно нормализуется. Стимуляция поджелудочной железы сводится к минимуму посредством диеты, бедной жирами и с высоким содержанием крахмалистых веществ. Короткий курс панкреатина способствует восстанавлению веса, эндо- и экзокринной функций. Вне зависимости от этиологии заболевания необходимо воздерживаться от алкоголя в течение трех месяцев. При подозрении на наличие алкоголизма необходимо тщательно собрать не только анамнез жизни пациента, но и семейный анамнез.
Профилактика предполагает установление и устранение причины развития приступа. Национальная программа борьбы с алкоголизмом в Скандинавии позволила остановить рост заболеваемости, но в остальном профилактика является, по существу, вторичной. Уровень трансаминаз, превышающий 60 МЕ/л, дает возможность подозревать наличие желчных камней; если они не обнаруживаются при ультразвуковом исследовании, то РХПГ способна выявить их или установить иную, поддающуюся коррекции причину.
 |
| Рисунок 2. Во всем мире большая часть панкреатитов вызывается камнями желчного пузыря или алкоголем |
Несмотря на диету с низким содержанием жира, распространенным остается рецидивирующий панкреатит, обусловленный камнями в желчном пузыре. Наилучшие результаты в данном случае дает холецистэктомия, но при условии хорошей подготовленности пациента и нормализации функции печени.
К холецистэктомии прибегают и в случае повторных идиопатических приступов, если, по данным РХПГ, желчь содержит кристаллы холестерола. Определять содержание алкоголя в крови бессмысленно, поскольку приступ может развиться через несколько дней после приема алкоголя. Совет воздерживаться от приема спиртных напитков, как правило, игнорируется.
Гиперкальциемия и гиперлипопротеидемия, обнаруженные после выздоровления, требуют специальной коррекции. Несмотря на все прилагаемые усилия по установлению этиологии, около четверти приступов остаются идиопатическими.
Многочисленные, в основном британские исследования так и не выявили какого-либо роста выживаемости. Причина тому — отсутствие возможности четкой демонстрации «отрицательных» результатов в контрольных группах (ошибка II типа).
Пациенты, находящиеся в тяжелом состоянии, нуждаются в постоянном уходе со стороны опытного персонала, состоящего из различных специалистов. При отсутствии такой возможности пациента с тяжелым приступом необходимо перевести в специализированный центр. Опыт показывает, что увеличение процента выживаемости происходит в том случае, если туда поступают еще не умирающие пациенты.
1. Neoptolemos J. P. What’s wrong with my pancreas? Produced by the Pancreatitis Supporters Network. (Information leaflet available from Duphar Laboratories, Southampton).
2. Braganza J. M, ed. The Pathogenesis of Pancreatitis. Manchester: Manchester University Press, 1991.
3. Bradley E. L. A clinically based classification for acute pancreatitis. Arch. Surg, 1993; 128:586-90.
4. Kingsnorth A. N. Role of cytokines and their inhibitors in acute pancreatitis. Gut 1997; 40:1-4.
5. Neoptolemus J. P., Carr-Locke D. L, London N. J., Bailey I. A., James D. F., Ossard D. P. Controlled trial of urgent endoscopic cholangio-pancreatography and endoscopic sphincterotomy versus conservative treatment for acute pancreatitis due to gallstones. Lancet ii:979-983.
6. Larvin M., Chalmers A. G., McMahon M. J. Dynamic contrast enchanced computed tomography: a precise technique for identifying and localising pancreatic necrosis. Br. Med. J., 1990; 300:1425-1428.
7. Saiffudin A., Ward J., Rigway L., Chalmers A. G. Comparison of MR and CT scanning un severe acute pancreatitis: initial experiences. Clin. Radiol, 1993;48:111-16.
8. Larvin M., Chalmers A. G., Robinson P. J., Mc Mahon M. J. Debridement and closed cavity irrigation for the treatment of pancreatic necrosis. Br. J. Surg, 1989; 76:465-471.
ОСТРЫЙ ПАНКРЕАТИТ
Острый панкреатит относится к тяжелым заболеваниям желудочно-кишечного тракта и по частоте возникновения занимает третье место среди острых хирургических заболеваний органов брюшной полости после острого аппендицита и острого холецистита. В последнее десятилетие отмечается неуклонный рост числа пациентов с острым панкреатитом, особенно деструктивных форм. Общая летальность при данном заболевании колеблется от 4,5% до 15%, при деструктивных формах летальность составляет 24-60 %, а послеоперационная достигает 70% и выше и не имеет тенденции к снижению (А.Ермолов, Э.Луцевич, В.Савельев, В.Федоров, Ю.Шевченко, И.Ярема).
Причина возникновения этого заболевания остается до конца невыясненной. Проводимые в последние десятилетия сложные биохимические, функциональные и морфологические исследования диктовались необходимостью найти подходы к раскрытию патогенеза острого панкреатита. Сложность современных представлений о причинах развития и патогенетических механизмах острого панкреатита подчеркивает факт существования более чем 140 причин развития острого деструктивного панкреатита. Вместе с тем у 20,3% больных не удается выявить этиологические факторы, приведшие к развитию этого заболевания.
В основе любого острого панкреатита, независимо от преобладающей протеазной или липазной аутоагрессии, определяющей геморрагический или жировой характер поражения поджелудочной железы, лежит ферментный некроз ацинарной паренхимы (фокальный внутриклеточный, ацинарный, лобарный или крупномасштабный) с вторичными локальными сосудистыми, интерстициальными местными и системными изменениями, определяющими функциональную недостаточность внутренних органов и многообразие клинических проявлений заболевания. Важнейшим признается тезис о том, что развившийся воспалительный процесс в поджелудочной железе первично асептичен (В.Савельев, В.Буянов, В.Огнев, 1983).
В настоящее время используется несколько классификаций острого панкреатита. Хирургическая служба России сегодня пользуется классификацией острого панкреатита В. Савельева (1978), в которой выделяются отечный и деструктивный панкреатит. Последний, в свою очередь, делится на геморрагический, жировой и гнойный.
Среди всех форм острого панкреатита отечный панкреатит занимает первое место и встречается у 70-90% больных.
В последнее время получает распространение международная классификация острого панкреатита, предложенная в 1992 г. в Атланте (M.Thumshirn et al., 1994, G.G.Tsitos et al., 1999):
отечная форма (интерстициальный панкреатит);
Проанализировав отечественную и зарубежную литературу, а также обобщив результаты исследований, проводимых на кафедре хирургических болезней № 1 лечебного факультета с курсами маммологии и нейрохирургии ФПДО Московского государственного медико-стоматологического университета более чем за 10 лет, было выделено 8 этиопатогенетических форм острого деструктивного панкреатита, которые имеют свой механизм развития.
Контактный (гастродуоденоульцерозного генеза).
Холангиогенный панкреатит встречается у 29,5% больных. В основе развития холангиогенного панкреатита были выявлены изменения направления лимфотока в гепатобилиопанкреатодуоденальной зоне вследствие поражения воспалительным процессом интегральных лимфатических узлов этой области.
Патогенез иммунозависимого панкреатита подобен патогенезу синдрома Дресслера (W.Dressler) при инфаркте миокарда. Сенсибилизированные антигенами поджелудочной железы лимфоциты мигрируют в панкреас и вызывают у больных отечно-геморрагический панкреатит без стаза секрета в поджелудочной железе, что и отличает эту форму панкреатита от других. Иммунопатоморфологические исследования свидетельствуют о значительном повреждении ацинарных клеток лимфоцитами-киллерами при иммунозависимой форме острого панкреатита.
У умерших от панкреанекроза больных выявлено отложение циркулирующих иммунных комплексов в почках, печени, сердце, плевре, легких, сальнике, брюшине, суставных сумках. Из вышеизложенного следует, что вторичный аутоиммунный процесс при панкреонекрозе обусловлен тем, что в результате некроза окружающих клеток остаются свободными отдельные панкреациты у которых теряется феномен иммунологической толерантности и отменяется толерантность к собственным антигенам.
Ангиогенный панкреатит выявляется у больных, имевших длительный спазм или окклюзии панкреатических артерий или вен, портальную гипертензию различной этиологии. Наступающие при этом ишемия, эмболия или тромбоз сосудов приводят к нарушению кровоснабжения в поджелудочной железе, что сопровождается массивным некрозом ее ткани и развитием деструктивного панкреатита.
Контактный (гастродуоденоульцерогенный) панкреатит встречается у больных с пенетрирующими в поджелудочную железу гастродуоденальными язвами, диагностированными методом эндоскопической гастродуоденолимфографии. В результате действия на нее ферментов железы, активирующихся под влиянием желчи, кишечного сока, энтерокиназы, микробов, поступающих в железу через язвенный дефект, происходит аутолиз ткани поджелудочной железы.
Наличие алкогольного панкреатита доказано на основании экспериментального создания модели алкогольного панкреатита путем приема алкоголя на фоне специальной диеты у белых крыс, а также на основании резкого снижения числа больных острым панкреатитом в период действия «сухого закона» 1986-1988 гг. После его отмены заболеваемость острым панкреатитом возросла в 6 раз.
Послеоперационный панкреатит выявляется у больных, перенесших различные оперативные вмешательства на органах брюшной полости, полости малого таза, грудной клетке и т.д., которые анатомически не соприкасались с поджелудочной железой. Причинами развития такого панкреатита могут быть нейрогуморальные механизмы, операционная травма, медиаторы повреждения тканей, микроциркуляторные нарушения, наркоз и т.д.
В итоге при всех патогенетических формах острого панкреатита происходит повреждение панкреацитов и возникают условия для внутритканевой активации и самоактивации ферментных систем поджелудочной железы.
Кроме этиопатогенетических форм острого деструктивного панкреатита следует отметить, что патологический процесс в поджелудочной железе протекает во времени с характерными для каждого периода изменениями, которые определяются как фазы течения процесса.
Острый панкреатит имеет свои особенности клинического течения, которые заключаются в том, что у части пациентов отмечаются признаки поражения как билиарной системы, так и поджелудочной железы. Болевой симптомокомплекс у больных панкреатитом нередко бывает настолько сложным, что могут быть значительные затруднения в определении локализации отраженных болей. Последние в одинаковой мере иррадиируют в надключичную область, плечевой сустав и лопатку как справа, так и слева. Чаще всего боли локализуются в эпигастрии и носят опоясывающий характер. Боли в животе сопровождаются тошнотой и многократной рвотой, не приносящей облегчения. У 25,01% пациентов могут быть перитонеальные явления. Может отмечаться вздутие живота за счет пареза кишечника. Желтушность кожных покровов и склер наблюдается у 72,37% больных и обусловлена сдавлением терминального отдела общего желчного протока увеличенной головкой поджелудочной железы, острыми воспалительными явлениями в желчном пузыре и протоках или ущемлением конкремента в большом дуоденальном соске. В крови при этом повышается уровень общего билирубина, в основном за счет прямой фракции, амилазы и липазы крови. Отмечается также увеличение активности щелочной фосфатазы, АлТ и АсТ. О нарастании интоксикации свидетельствуют ретикулоцитарный тест, число сердечных сокращений лягушки и семенной индекс токсичности, они изменяются.
В.Савельев (1983) прогнозирует тяжесть течения и исход острого панкреатита, основываясь на следующих клинических синдромах: респираторный, перитонеальный и гемодинамический, синдром динамической кишечной непроходимости и лабораторных показателях (уровень глюкозы крови более 9,9 ммоль/л, дефицит оснований, превышающий 4 ммоль/л, дефицит объема циркулирующей крови более 1500 мл, артериальная гипоксемия ниже 65 мм рт. ст., повышение уровня мочевины более 16,6 ммоль/л, активность лактатдегидрогеназы крови выше 400 ЕД).
Сегодня, проводя диагностику, хирург должен фиксировать не только диагноз «острый панкреатит», но и его форму и фазу.
Диагностика острого деструктивного панкреатита в настоящее время, как правило, не представляет особых трудностей. Комплексное применение современных методов диагностики, включающее оценку клинических симптомов, биохимических анализов, ферментных тестов, использование ультразвукового исследования, компьютерной томографии, лапароскопии, ангиографии сосудов поджелудочной железы и т.д., позволяет не только правильно и своевременно установить диагноз, но и выбрать лечебную тактику.
В связи с этим считается наиболее целесообразным следующий диагностический алгоритм для обследования больных с острым деструктивным панкреатитом.
клинико-лабораторные методы (клинический анализ крови, биохимические анализы крови, энзимологические методы исследования, общий анализ мочи, иммунологические и лимфологические методы обследования и т.д.);
инструментальные методы (обзорная рентгенография органов брюшной полости и грудной клетки, ультрасонография органов гепатопанкреатодуоденальной зоны и забрюшинного пространства, компьютерная томография брюшной полости и забрюшинного пространства и т.д.).
Инвазивные методы: лапароскопия, эзофагогастродуоденоскопия, эндоскопическая ретроградная холангиопанкреатография, чрескожная чреспеченочная холангиография, пункционная биопсия ткани поджелудочной железы и т.д.
При верификации панкреонекроза, особенно жирового, наиболее достоверны энзимологические методы исследования. Повышение уровня лактатдегидрогеназы, увеличение концентрации свободных кининов, выраженная гиперкоагуляция, угнетение фибринолитической функции крови являются достаточно чувствительными диагностическими тестами при деструктивных формах острого панкреатита. Отмечается накопление перекисей липидов, уменьшение антиокислительной активности липидов. Уровень панкреатической липазы в сыворотке крови повышается у 91,5%, заболевших жировым панкреонекрозом, особенно на фоне стимуляции панкреозимином.
Для определения степени иммунных нарушений при остром панкреатите стали внедряться тесты, позволяющие диагностировать глубокие механизмы нарушений иммунной системы. Чаще всего при этом используются моноклональные антитела. Определяются уровень интерлейкина-1 и 2, функции нейтрофилов и рецепторная функция моноцитов, уровень медиаторов и ингибиторов патологического процесса, а вместе с тем и иммунопатологии; исследуется уровень цитофильных комплементсвязывающих антител к тканям различных органов; проводится ретикулярный тест: хемилюминисценция и иммунофлюоресценция, кинетический метод количественного определения комплемента и другие тесты.
Исследование центральной лимфы проводилось для дифференциальной диагностики различных форм острого панкреатита. Выявление хлопьев эритроцитов на границе разделения градиентов плотности свидетельствует о деструктивной форме острого панкреатита (В.Буянов, 1979).
Г.Акжигитов (1974) встречал осложнения при деструктивных формах панкреатита в 12 раз чаще, чем при отечной. В основе их лежат значительные изменения метаболизма, эндогенная интоксикация и нарушения иммунной защиты (J.H.Siegel, 1981).
Ю.Лопухин (1983) предложил следующую классификацию иммунодефицитных состояний для больных хирургического профиля.
Острые иммунодефицитные состояния, связанные с оперативным вмешательством, наркозом, крово- и лимфопотерей.
Иммунодефицитные состояния, обусловленные воспалительными процессами, инфицированными ранами, абсцессами и т.д.
Иммунодефициты вследствие основного заболевания, повлекшего необходимость операции.
Л.Ковальчук и А.Чередеев (1984) различают иммунодефициты по степени тяжести: легкие, средней степени и тяжелые.
Наиболее быстрым, безопасным и информативным инструментальным методом диагностики остается ультразвуковое исследование, которое проводится у всех пациентов с острым деструктивным панкреатитом. Данный метод позволяет установить диагноз в 87% случаев. При этом особое внимание следует уделять следующим ультрасонографическим данным: наличие конкрементов в желчном пузыре, холестероз желчного пузыря, увеличение желчного пузыря в размерах, утолщение стенки желчного пузыря, двойной контур стенки желчного пузыря, акустически неоднородное содержимое желчного пузыря, расширение диаметра холедоха более 9 мм, наличие конкрементов в холедохе, увеличение поджелудочной железы, отек парапанкреатической клетчатки, исчезновение контура поджелудочной железы и снижение ее эхогенности, наличие свободной жидкости в брюшной полости.
Таким образом, ультразвуковое исследование позволяет выявить воспалительные изменения в желчном пузыре, магистральных желчных протоках и поджелудочной железе, установить наличие конкрементов в них, определить выпот в сальниковой сумке и брюшной полости, обнаружить парапузырные и парапанкреатические флегмоны и абсцессы, а также другие патологические изменения. Вместе с тем у 13% больных визуализировать поджелудочную железу из-за пареза желудочно-кишечного тракта, особенно поперечно-ободочной кишки, не удается, что снижает диагностическую ценность этого метода при остром панкреатите. Ограничение возможностей ультразвукового исследования для диагностики острого панкреатита обусловливает необходимость проведения других методов.
К компьютерной томографии прибегают, как правило, в тех трудно диагностируемых наблюдениях, когда сложно осуществить дифференциальную диагностику панкреатита с опухолями поджелудочной железы, а также для определения степени распространенности процесса на забрюшинное пространство и окружающие ткани, своевременного выявления гнойных осложнений и в случаях, когда парез кишечника не позволяет полноценно провести ультрасонографическое исследование. Сегодня компьютерная томография является самым достоверным единственно неинвазивным методом исследования поджелудочной железы, позволяющим получить стабильную анатомическую картину поджелудочной железы, ее форму, размеры и определить распространенность патологического процесса в поджелудочной железе и окружающих ее тканях и органах. Однако из-за дороговизны этот метод пока остается малодоступным.
Кроме этого диагностическая ценность манипуляции определяется еще возможностью исключить перфоративную язву желудка или 12-перстной кишки.
Чрескожная чреспеченочная холангиография (ЧЧХГ) под ультрасонографическим контролем. Показаниями к проведению ЧЧХГ являются случаи опасности или невозможности проведения эндоскопической ретроградной холангиопанкреатографии или необходимость декомпрессии билиарной системы у больных с тяжелыми формами (билиарная и холангиогенная) деструктивного панкреатита путем наложения чрескожной чреспеченочной холангиостомии (ЧЧХС). Существует несколько способов выполнения ЧЧХС. По одному из них желчные протоки катетеризируют по металлическому проводнику, введенному в проток через иглу, используемую для чрескожной чреспеченочной холангиографии (ЧЧХГ). При другом способе проток пунктируют иглой с тефлоновой «оболочкой» или стилетом-катетером. Если пункция успешна, иглу извлекают, а катетер продвигают в проток по металлическому проводнику. Возможен третий способ. Вначале производят ЧЧХГ тонкой иглой, а потом иглой с «оболочкой» пунктируют выбранный для дренирования желчный проток. В большинстве случаев, чтобы добиться успеха, пункцию требуется повторить 2-10 раз.
ЧЧХС может быть использована как для наружного, так и для внутреннего отведения желчи при обтурационной желтухе. Внутреннее дренирование желчных протоков осуществляют в два этапа. Вначале накладывают наружную гепатохолангиостому, а спустя 5-7 дней, когда вокруг внутрибрюшной внепеченочной части катетера сформируются сращения, выполняют второй этап. При этом по гибкому проводнику, проведенному через препятствие, в общий желчный проток или в 12-перстную кишку вводят перфорированный во многих местах катетер. Через 24-48 часов наружное отверстие дренажной трубки закрывают. При длительном дренировании катетер меняют через каждые 3-4 месяца. Применение до операции ЧЧХС у пациентов с обтурационной желтухой позволяет в 2-3 раза уменьшить число послеоперационных осложнений и летальность по сравнению с аналогичными больными, у которых подобная процедура не производилась. Появились сообщения об успешном применении ЧЧХС для дилатации и электрорассечения стриктур желчных протоков, удаления из них камней, папиллотомии, дилатации сфинктера Одди баллонными катетерами и проталкивания камней из желчного протока в 12-перстную кишку. Чрескожным чреспеченочным путем производится холангиоскопия. В то же время ЧЧХС может сопровождаться рядом осложнений. Сепсис, лихорадка, истечение желчи или крови из места пункции печени, гемобилия, гематома печени, смещение, закупорка дренажной трубки, холангит встречаются у 11-20% больных. Однако лишь у 3-5% из них эти осложнения бывают тяжелыми. Летальность составляет 0,8-1,5%. Таким образом, ЧЧХГ тонкой иглой и ЧЧХС являются ценными диагностическими и лечебными мероприятиями.
Для получения биопсийного материала из поджелудочной железы используются чрескожная пункция, интраоперационная пункционная биопсия, пункционная биопсия со стороны спины, аспирационная биопсия под рентгенологическим контролем на фоне искусственного ретроперитонеума (В.Цой и соавт., 1977; В.Горбачев, 1990). Тонкоигольная пункционная биопсия поджелудочной железы является наиболее безопасным и высокоинформативным методом исследования (В.Горбачев, 1990; М.Кузин, М.Данилов, Д.Благовидов, 1985).
Основой эффективности лечения острого деструктивного панкреатита является ранняя диагностика и своевременное начало комплексной терапии. Лечебный процесс у всех пациентов с острым панкреатитом начинают с консервативной терапии. При проведении лечения всех патогенетических форм панкреатита следует исходить из фазового характера развития деструктивного панкреатита, а именно ферментативной реактивно-инфильтративной, гнойно-некротической фазы.
Лечебный процесс, как правило, направлен на следующее.
Блокирование пусковых механизмов, приводящих к переходу воспалительного процесса с поджелудочной железы на парапанкреатичекую клетчатку и забрюшинное клетчаточное пространство.
Остановка перехода отечной формы панкреатита в деструктивную и предупреждение прогрессирования панкреонекроза.
Проведение деэскалационной антимикробной терапии и профилактики гнойных осложнений у пациентов с деструктивным панкреатитом в фазу ферментативной токсемии или фазу инфильтративных изменений.
Ферментативная (I) фаза (1-я неделя заболевания) требует максимально интенсивной терапии. Всем больным проводятся базисная терапия, включающая антисекреторную (сандостатин или октреатид, цитостатики и т.д.), реологическую (реополиглюкин, фраксипарин), детоксикационную (форсированный диурез, плазмаферез, лапароскопическое дренирование брюшной полости и сальниковой сумки), цитокиновую (ингибиторы протеаз) и возмещение потерь белков, жиров, углеводов, электролитов и жидкости, форсированный диурез. При наличии сопутствующей патологии лечение согласовывается с соответствующими специалистами и осуществляется на основе индивидуальной оценки клинико-лабораторных показателей. Исходы ферментативной фазы панкреатита на фоне проводимого лечения могут быть следующими.
Выздоровление благодаря рано начатой адекватной интенсивной терапии в первые 6-12 часов от начала заболевания.
Реактивно-инфильтративная (II) фаза развивается на 2-й неделе после кратковременного 1-2-суточного светлого промежутка и характеризуется резорбтивной лихорадкой и образованием перипанкреатического инфильтрата. Лечение реактивной фазы строго консервативное и включает следующее:
базовая терапия ферментативной фазы;
экстракорпоральные методы детоксикации (гемофильтрация, гемодиафильтрация, плазмаферез, лимфо- и холесорбция);
панкреатотропная антибиотикотерапия препаратами широкого спектра действия (доксициклин, перфлоксацин, цефалоспорины 3-4-го поколения);
иммунорегулирующая терапия (местное введение тактивина в парапанкреатическую клетчатку под контролем УЗИ, УФО лимфы и крови);
лимфологические методы (эндолимфатическое, лимфотропное введение лекарственных препаратов, регионарная лимфостимуляция, местная иммунотерапия).
Исходом течения патологического процесса в зоне поджелудочной железы и парапанкреатической клетчатке могут быть рассасывание инфильтрата, асептическая секвестрация очагов некроза или их нагноение и переход в третью фазу.
Оперативное вмешательство при остром панкреатите независимо от фазы течения заболевания проводится при холангиогенной, билиарной, контактной и посттравматической форме заболевания.
Оперативные вмешательства при билиарном панкреатите выполняют на внепеченочных желчных протоках с целью их санации и восстановления внутреннего пассажа желчи (холецистэктомия, холецистостомия, холедохотомия, наружное дренирование общего желчного протока, эндоскопическая папилосфинктеротомия, чрескожная чреспеченочная холангиостомия, билиодигестивные анастомозы). При этом сальниковая сумка всегда вскрывается для ревизии поджелудочной железы и подведения дренажа.
Холангиогенный панкреатит требует выполнения срочной холецистэктомии, которая сочетается с вмешательствами на магистральных желчных протоках или выполнением холецистостомии. Последняя осуществляется, реже, хирургически и, как правило, лапароскопически или с помощью малоинвазивных вмешательств под ультрасонографическим контролем у пациентов с высоким риском оперативного вмешательства. Проводятся санация внепеченочных желчных протоков и восстановление внутреннего пассажа желчи. Корригирующие операции на поджелудочной железе зависят от изменений в железе и вокруг нее, что определяется фазой течения процесса, и направлены на санирование деструктивного очага в этом органе. Явления ферментативного перитонита требуют проведения хирургической или лапароскопической санации и дренирования брюшной полости.
У больных острым деструктивным контактным (гастродуоденоульцерогенным) панкреатитом наиболее эффективными методами лечения являются резецирующие операции на желудке вместе с пенетрирующей язвой и интермедиальной зоной (см. «Язвенная болезнь желудка», «Медицинская газета» № 88 от 13.11.2002), направленные на ликвидацию пенетрации язвы в ткань поджелудочной железы с учетом изучения вариантов скорости регионарного кровотока, состояния секреторной и моторной функции желудка и локализации гастродуоденальных язв. Со стороны поджелудочной железы вмешательства выполняются с учетом фаз течения заболевания.
При посттравматическом панкреатите оперативное вмешательство заключается в проведении этапных эндоскопических санаций, которые позволяют контролировать и регулировать регенеративный процесс в поврежденной поджелудочной железе и предотвращают наступление тяжелых гнойных осложнений за счет дренирования гематом, выполнения гемостаза, удаления свободных фрагментов ткани поджелудочной железы по междольковым промежуткам с атравматической, прецизионной перевязкой поврежденных мелких протоков и сосудов. При распространенном травматическом панкреонекрозе может быть сформирована широкая оментобурсопанкреатостома с дренированием образовавшихся гнойных очагов. Лечение осложнений посттравматического панкреатита в виде псевдокисты, ограниченного скопления жидкости или абсцесса проводится с помощью чрескожных манипуляций под контролем ультразвуковых методов. При полных поперечных разрывах поджелудочной железы или при ее размозжении дистальную часть железы отсекают от неповрежденной ткани с прошиванием и перевязкой проксимального конца панкреатического протока синтетической нерассасывающейся нитью, затем проводят первичную хирургическую обработку раны поджелудочной железы.
Ферментативный перитонит требует проведения видеолапароскопической санации, аквапурации и дренирования брюшной полости.
При обнаружении забрюшинной флегмоны выполняют бурсооментопанкреатостомию и дренирование забрюшинной клетчатки широкими, иногда двухпросветными трехканальными дренажными трубками или чрескожное дренирование при ультразвуковой визуализации.
В первые дни после операции состояние больных остается тяжелым из-за эндогенной интоксикации, что находит подтверждение при определении семенного индекса токсичности (СИТ). Эндогенная интоксикация клинически проявляется неустойчивой гемодинамикой, почечно-печеночной и дыхательной недостаточностью.
Через 7-10 дней у большинства пациентов с некротической формой деструктивного панкреатита присоединяются признаки гнойного расплавления некротических участков поджелудочной железы, что сопровождается нарастанием интоксикации по семенному индексу токсичности, РТ, СТОЭМ и другим показателям.
Стадия гнойного расплавления и секвестрации длится в течение 30-42 дней. Такое состояние требует на 9-10-й день после операции удаления салфеток из бурсаоментостомы и введения в раневой канал по ходу ложа поджелудочной железы двухпросветных и трехканальных дренажных трубок под контролем фистулоскопии (с помощью лапароскопа или эндоскопов (PF, CHF-P3R или BF фирмы «Olympus») для активного промывания сальниковой сумки физиологическим раствором.
Бурсаоментостому поддерживают открытой широкими резиновыми перчаточными полосами (4-5) и дренажной трубкой в течение всего периода гнойного расплавления, сменяя трубки по мере сокращения размеров бурсостомы с постепенным уменьшением диаметра с 20 мм до 5 мм.
Санация сальниковой сумки с помощью промываний через бурсаоментостому и боковые дренажи позволяет эффективно и достаточно быстро убрать эндогенную интоксикацию.
Учитывая, что некротические ткани при отторжении вызывают эрозивное кровотечение, иногда интенсивное, целесообразно применять фотодинамическую терапию участков панкреонекроза. Фотосенс через хирургический лапароскоп или через фиброэндоскоп вводят в сальниковую сумку, и затем полость облучают лазерным светом (длина волны 670 нм). Образующийся при этом синглетный кислород при фотореакции коагулирует мелкие сосуды, имеющиеся в местах некроза. Для обеспечения адекватного оттока и эффективной санации гнойно-некротического очага операцию необходимо завершить формированием бурсостомы, а также дополнительно дренировать сальниковую сумку и область головки поджелудочной железы трубчатыми дренажами и широкими резиновыми перчаточными полосами. Сформированная бурсостома более эффективно, чем трубчатые дренажи, обеспечивает отток токсического экссудата, что позволяет снизить уровень эндогенной интоксикации.
Причинами летальности в III фазе были распространенный перитонит с полиорганной недостаточностью, прогрессирующая некротическая забрюшинная флегмона, прогрессивное эрозивное кровотечение, острая печеночно-почечная недостаточность, острая сердечно-сосудистая недостаточность, острый инфаркт миокарда, острая пневмония, тромбоэмболия легочной артерии.
заведующий кафедрой хирургических болезней № 1
лечебного факультета с курсами маммологии