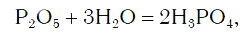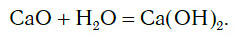что такое оксиды примеры
Урок 31. Оксиды
В уроке 31 «Оксиды» из курса «Химия для чайников» познакомимся с оксидами их классификацией, а также узнаем где они встречаются в природе.
Все неорганические вещества делятся на несколько классов, важнейшими из которых являются оксиды, кислоты, основания и соли. Первоначальные сведения об этих веществах вы уже получили. Теперь вам предстоит познакомиться с ними более подробно и систематизировать свои знания.
Вы уже знаете, что самым распространенным элементом на Земле является кислород. Его атомы, соединяясь с атомами других элементов, образуют огромное количество сложных неорганических веществ, среди которых важное место занимают оксиды.
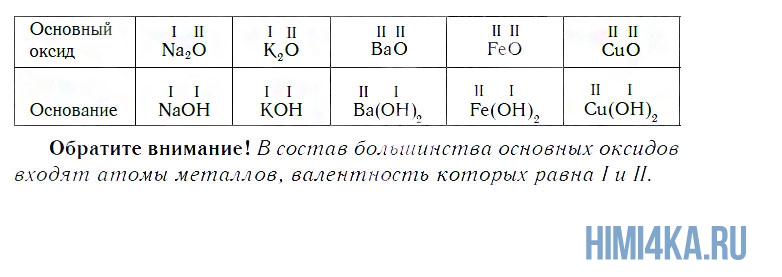
Состав оксидов
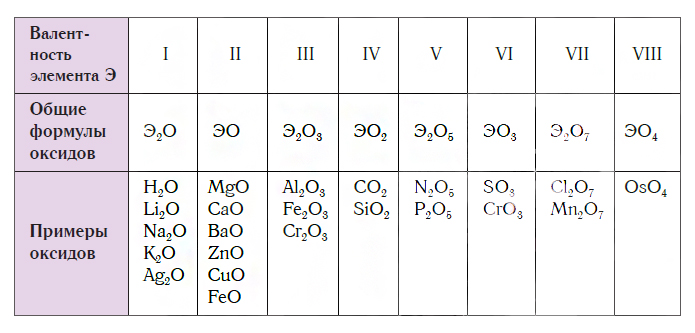
В состав любого оксида входят атомы двух химических элементов, один из которых — кислород, например: Н2О, Al2O3, Р2О5, CuO, Cl2O7. Всего известно около трехсот разных оксидов. Их общая химическая формула — ЭxOy, где буква Э обозначает символ химического элемента, образующего оксид, О — символ кислорода, а буквы x и y — индексы, обозначающие число атомов в молекулах или в формульных единицах оксидов.
Поскольку валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов принимает значения от I до VIII, состав оксидов выражается формулами, приведенными в следующей таблице.
Классификация оксидов
Поскольку оксидов известно очень много, возникает необходимость классификации этих веществ по их химическим свойствам, т. е. по способности превращаться в другие вещества.
Вы уже знаете, что оксиды могут реагировать с водой, превращаясь при этом в соединения двух типов — кислоты и основания. Так, например, оксид фосфора(V) P2O5, присоединяя воду, превращается в кислоту H3PO4:
а оксид кальция CaO, взаимодействуя с водой, превращается в основание Ca(OH)2:
Иначе говоря, оксиду фосфора соответствует кислота, а оксиду кальция соответствует основание. Исходя из этого, оксиды можно разделить на две большие группы — кислотные и основные оксиды.
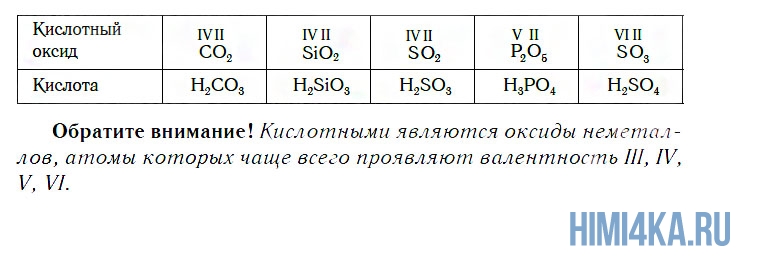
К кислотным относятся оксиды, которым соответствуют кислоты. Наряду с Р2О5, кислотными являются также оксиды: CO2, SiO2, SO2, N2O5, SO3 и некоторые другие. Всем им соответствуют кислоты.
К основным относятся оксиды, которым соответствуют основания. Кроме СaO, основными являются оксиды: Na2O, K2O, BaO, FeO, CuO и ряд других. Всем этим оксидам соответствуют основания.
Оксиды в природе
Оксиды содержатся в каждой из трех оболочек нашей планеты — в атмосфере, гидросфере, литосфере.
Самым распространенным оксидом в атмосфере и гидросфере является вода H2O, а в литосфере — оксид кремния(IV) SiO2, встречающийся в виде красивых кристаллов кварца (рис. 116) и кварцевого песка.
Краткие выводы урока:
Надеюсь урок 31 «Оксиды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Оксиды – Химия 8 класс
Химические формулы оксидов и их названия Вам уже известно, что оксиды – это бинарные соединения, в состав которых обязательно входит химический элемент кислород.
На сегодняшний день получены оксиды всех существующих в природе химических элементов кроме трех: гелия, неона и аргона.
Рассмотрим химические формулы оксидов, с которыми мы уже встречались:
CO2, SO2, Fe3O4 и т.д.
Как видно, в формулах оксидов на первом месте принято записывать химический символ элемента, который образует оксид, а на втором – химический символ кислорода. Попробуем вывести общую формулу для оксидов, то есть формулу, при помощи которой можно составить формулу оксида любого элемента. Элемент, образующих оксид, будем обозначать буквой R, а его валентность в оксиде, как х.
С учетом того, что валентность кислорода равна II, получим:
Итак, общая формула оксидов:
Рассмотрим пример. Необходимо составить формулы оксидов серы, в которых сера проявляет валентность IV и VI. Получаем: В тех случаях, когда оксид образован химическим элементом с переменной валентностью, после названия оксида, в скобках, римской цифрой указывается валентность элемента в данном оксиде.
Например:
SO2 – оксид серы (IV), SO3 – оксид серы (VI). Если валентность химического элемента постоянна, естественно, он может образовать с кислородом только один оксид. В таких случаях валентность в скобках после названия не указывается. Например: ZnO – оксид цинка
Классификация оксидов
Оксиды – весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд природных пигментов. Оксидами также является класс минералов, представляющих собой соединения металлов с кислородом. Самым распространенным оксидом в земной коре является минерал кварц, его систематическое название – оксид кремния (IV) – SiO2. Этот оксид образует множество различных минералов, которые геологи объединяют в минералы группы кварца.
По своему агрегатному состоянию оксиды могут быть газообразными: углекислый газ CO2, сернистый газ SO2 – эти газы бесцветны. А оксид азота (IV) NO2 – газ коричневого цвета.
Оксидов – жидкостей в обычных условиях сравнительно немного. Примеры таких оксидов: вода – оксид водорода, оксид марганца (VII) Mn2O7, оксид хлора (VII) Cl2O7, оксид хлора (VI) ClO3.
Большинство оксидов – твердые вещества, имеющие молекулярное или ионное строение.
Оксиды металлов имеют ионное строение. В кристаллических решетках оксидов металлов находятся ионы кислорода O2− и ионы соответствующего металла. Оксиды неметаллов, как правило, имеют молекулярное строение. На рисунке 139 приведена модель молекулы оксида фосфора (V).
Химическая формула оксида фосфора (V), которую мы уже записывали не раз – P2O5.
На самом деле это эмпирическая, простейшая формула. Истинная химическая формула, которая реально отвечает строению оксида фосфора (V) – P4O10 Существуют оксиды и атомного строения. К таким оксидам относятся оксид бора B2O3, оксид кремния (IV) SiO2. Кристаллические решетки этих оксидов состоят из атомов.
Применение оксидов
Многие оксиды нашли разнообразное применение в различных сферах деятельности человека. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически нерастворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды. TiO2 добавляют в качестве наполнителя в мыло, лекарственные препараты, которые выпускаются в виде таблеток.
Оксид хрома (III) – Cr2O3 – кристаллы темно-зеленого цвета (см. рисунок 138, а), нерастворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это далеко не единственное их применение Оксиды неметаллов так же имеют широкое применение. Углекислый газ, или оксид углерода (IV) – CO2 применяется как наполнитель углекислотных огнетушителей, так как данный оксид негорюч. Сернистый газ, или оксид серы (IV) – SO2 применяется в качестве дезинфицирующего вещества для зернохранилищ. Как вы уже заметили, множество химических веществ имеют тривиальные названия. Ниже приведены тривиальные названия некоторых оксидов:
| Химическая формула | Химическое название | Тривиальное название |
| СО | Оксид углерода (II) | Угарный газ |
| СО2 | Оксид углерода (IV) | Углекислый газ |
| SO2 | Оксид серы (IV) | Сернистый газ |
| Al2O3 | Оксид алюминия | Глинозём |
| СаО | Оксид кальция | Негашеная известь |
Основные оксиды, перечень, список, физические и химические свойства
Основные оксиды, перечень, список, физические и химические свойства.
Основные оксиды – солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2.
Основные оксиды:
Основные оксиды – солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2.
К солеобразующим оксидам помимо основных оксидов также относят кислотные и амфмотерные оксиды. Соответственно кислотным оксидам соответствуют кислоты, амфотерным оксидам – амфотерные основания.
К основным оксидам относятся оксиды щелочных и щёлочноземельных металлов, а также оксиды переходных металлов в низших степенях окисления.
Какие оксиды основные? Список, примеры и перечень основных оксидов:
| Название оксида: | Химическая формула: |
| Оксид бария | BaO |
| Оксид калия | K2O |
| Оксид кальция | CaO |
| Оксид лития | Li2 O |
| Оксид магния | MgO |
| Оксид меди II | CuO |
| Оксид натрия | Na2O |
| Оксид ртути II | HgO |
Физические свойства основных оксидов:
Общим физическим свойством для всех основных оксидов является то, что они представляют собой твердые вещества. В то время как другие: внешний вид, цвет, плотность, температуры плавления и кипения, молярная масса, твердость и пр. различаются.
| Название оксида: | Химическая формула: | Внешний вид: |
| Оксид бария | BaO | бесцветные кристаллы |
| Оксид калия | K2O | твердое бесцветное или бледно-желтое вещество |
| Оксид кальция | CaO | белое кристаллическое вещество |
| Оксид лития | Li2 O | бесцветные кристаллы |
| Оксид магния | MgO | твердое белое вещество |
| Оксид меди II | CuO | твердое черное вещество |
| Оксид натрия | Na2O | бесцветные кристаллы |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
Получение основных оксидов:
Основные оксиды получаются в результате:
2Сa + О2 → 2CaО (t = 300 o C);
Ba(OH)2 → BaO + H2О (t = 780-800 o C);
Сa(OH)2 → СaO + H2О (t = 520-580 o C);
BaCO3 → BaO + CO2 (t = 1000-1450 o C);
MgCO3 → MgО + СО2 (t > 650 o C);
Химические свойства основных оксидов. Химические реакции основных оксидов:
Для основных оксидов характерны следующие общие химические реакции:
1. взаимодействие с водой.
В реакцию с водой вступают не все основные оксиды, а только оксиды наиболее активных металлов, которые расположены в главных подгруппах первой и второй групп периодической таблицы химических элементов Д.И. Менделеева (натрий, калий, кальций, барий и др.).
В результате взаимодействия основных оксидов с водой образуются основания.
MgО + Н2О → Mg(ОН)2 (t = 100-125 o C);
2. взаимодействие с кислотными оксидами.
В результате химической реакции основных оксидов с кислотными оксидам образуется соль.
CaО + SiО2 → CaSiО3 (t = 1100-1200 o C);
MgО + SiО2 → MgSiО3 (t = 1100-1200 o C);
3. взаимодействие с кислотами.
В результате химической реакции основных оксидов с кислотами образуется соль и вода.
Аналогично проходят реакции основных оксидов и с другими кислотами.
4. взаимодействие с амфотерными оксидами.
В результате химической реакции основных оксидов с амфотерными оксидам образуется соль.
BaO + ZnO → BaZnO2 (t = 1100 o C);
BaO + SnO → BaSnO2 (t = 1000 o C);
5. восстановление до простых веществ:
BaO + Be → Ba + BeO (t = 270 o C);
3BaO + 2Al → 3Ba + Al2O3 (t = 1200 o C);
2Al + 4BaO → Ba(AlO2)2 + 3Ba (t = 1100-1200 o C);
2Al + 4BaO → BaAl2O4 + 3Ba (t = 1100-1200 o C);
3BaO + Si → 2Ba + BaSiO3 (t = 1200 o C);
4CaО + 2Al → 2Ca + Ca(AlO2)2 (t = 1200 o C);
Li2O + Mg → 2Li + MgO (t > 800 o C);
2Li2O + Si → 4Li + SiO2 (t = 1000 o C);
2MgО + Si → 2Mg + SiО2;
MgО + Са → Mg + СаО (t = 1300 o C);
CuО + H2 → Cu + H2О (t = 300 o C);
CuО + С → Cu + СО (t = 1200 o C);
3CuО + 2Al → 3Cu + Al2О3 (t = 1000-1100 o C).
6. взаимодействие с галогеноводородами (бромоводородом, йодоводородом и пр.).
В результате химической реакции основных оксидов с галогеноводородами образуется соль и вода.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидер ом в мировом сообществе и останется недосягаемой для других стран на века.
Оксид
Окси́д (о́кисел, о́кись) — соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Оксиды — весьма распространенный тип соединений, содержащихся в земной коре и во вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Окислами называется класс минералов, представляющих собой соединения металла с кислородом (см. Категория:Окислы).
Соединения, содержащие атомы кислорода, соединённые между собой, называются пероксидами (перекисями) и супероксидами. Они не относятся к категории оксидов.
Содержание
Классификация
В зависимости от химических свойств различают:
Номенклатура
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент образует несколько оксидов, то в их названиях указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, моноокисью или закисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распостранены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
Химические свойства: Основные оксиды.
Примечание:кислота ортофосфорная или сильная.
2. Сильноосновный оксид + вода = щелочь
3. Сильноосновный оксид + кислотный оксид = соль
4. Основный оксид + водород = металл + вода
Примечание: металл менее активный, чем алюминий.
Химические свойства: Кислотные оксиды.
Некоторые оксиды, например SiO2, с водой не реагируют, поэтому их кислоты получают косвенным.
2. Кислотный оксид + основной оксид = соль
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
4. Нелетучий оксид + соль1 = соль2 + летучий оксид
Химические свойства: Амфотерные оксиды.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
ZnO + 2KOH + H2O = K2[Zn(OH)4)] (в водном растворе)
ZnO + CaO = CaZnO2 (при сплавлении)
Получение оксидов
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
2. Обжиг или горение бинарных соединений в кислороде:
3. Термическое разложение солей:
4. Термическое разложение оснований или кислот:
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
6. Взаимодействие некоторых металлов с водой при высокой температуре:
7. Взаимодействие солей с кислотными оксидами при нагревании с выделением летучего оксида:
9. При действии водоотнимающих веществ на кислоты и соли:
10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
Ссылки
Полезное
Смотреть что такое «Оксид» в других словарях:
оксид — окисел, глинозем Словарь русских синонимов. оксид сущ., кол во синонимов: 3 • глинозем (8) • окисел … Словарь синонимов
ОКСИД — ОКСИД, а, муж. (спец.). То же, что окисел. | прил. оксидный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Оксид — – соединение химического элемента с кислородом. Оксиды – весьма распространенный тип соединений, содержащихся в земной коре и во вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд… … Нефтегазовая микроэнциклопедия
оксид — В полупроводниковой технологии так обычно обозначается двуокись кремния (SiO2). [http://www.cscleansystems.com/glossary.html] Тематики полупроводниковые приборы EN oxide … Справочник технического переводчика
оксид — ОКСИД, а, м Соединение химического элемента с кислородом; окислы. Оксид цинка применяют как белый пигмент, активатор … Толковый словарь русских существительных
оксид — oksidas statusas T sritis chemija apibrėžtis Elemento junginys su deguonimi. atitikmenys: angl. oxide rus. окисел; окись; оксид … Chemijos terminų aiškinamasis žodynas
оксид — (2 м); мн. окси/ды, Р. окси/дов … Орфографический словарь русского языка
оксид — Химик элементның кислород белән кушылмасы … Татар теленең аңлатмалы сүзлеге
оксид — у, ч. Те саме, що окисень … Український тлумачний словник
оксид — [окси/д] ду, м. (на) д і, мн. дие, д іў … Орфоепічний словник української мови