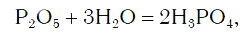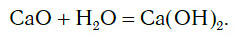что такое оксиды и как они образуются
Урок №43. Оксиды: классификация, номенклатура, свойства, получение, применение
Сегодня мы начинаем подробное знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые (металлы и неметаллы) и сложные:
А – кислотный остаток
ОН – гидроксильная группа
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИДЫ
оксид углерода ( II )
оксид марганца (VII )
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
Классификация по растворимости в воде
Кислотные оксиды
(не растворим в воде)
Основные оксиды
В воде растворяются только оксиды щелочных и щелочноземельных металлов
Амфотерные оксиды
С водой не взаимодействуют.
В воде не растворимы
Выполните задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
Выпишите оксиды и классифицируйте их.
Физические свойства оксидов
Химические свойства оксидов
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Na 2 O + H 2 O = 2NaOH
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена)
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
4. Менее летучие вытесняют более летучие из их солей
CaCO 3 + SiO 2 = CaSiO 3 +CO 2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 HCl = ZnCl 2 + H 2 O
ZnO + 2 NaOH + H 2 O = Na 2 [Zn(OH) 4 ] ( в растворе)
ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении)
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
В результате часто получаются очень нужные и полезные соединения. Например, H 2 SO 4 – серная кислота, Са(ОН) 2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO 2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
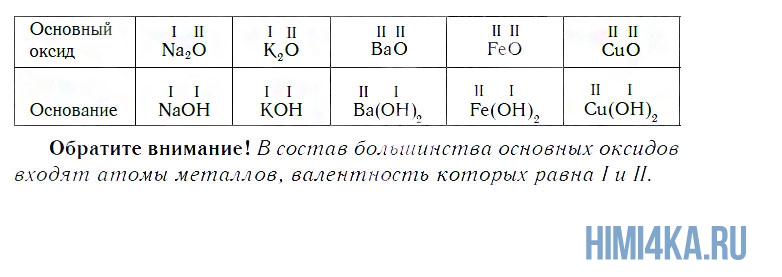
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
Урок 31. Оксиды
В уроке 31 «Оксиды» из курса «Химия для чайников» познакомимся с оксидами их классификацией, а также узнаем где они встречаются в природе.
Все неорганические вещества делятся на несколько классов, важнейшими из которых являются оксиды, кислоты, основания и соли. Первоначальные сведения об этих веществах вы уже получили. Теперь вам предстоит познакомиться с ними более подробно и систематизировать свои знания.
Вы уже знаете, что самым распространенным элементом на Земле является кислород. Его атомы, соединяясь с атомами других элементов, образуют огромное количество сложных неорганических веществ, среди которых важное место занимают оксиды.
Состав оксидов
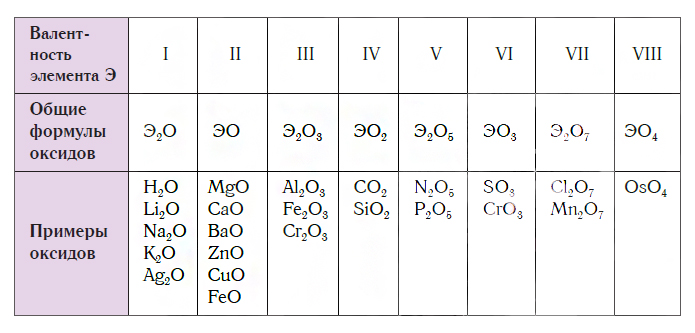
В состав любого оксида входят атомы двух химических элементов, один из которых — кислород, например: Н2О, Al2O3, Р2О5, CuO, Cl2O7. Всего известно около трехсот разных оксидов. Их общая химическая формула — ЭxOy, где буква Э обозначает символ химического элемента, образующего оксид, О — символ кислорода, а буквы x и y — индексы, обозначающие число атомов в молекулах или в формульных единицах оксидов.
Поскольку валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов принимает значения от I до VIII, состав оксидов выражается формулами, приведенными в следующей таблице.
Классификация оксидов
Поскольку оксидов известно очень много, возникает необходимость классификации этих веществ по их химическим свойствам, т. е. по способности превращаться в другие вещества.
Вы уже знаете, что оксиды могут реагировать с водой, превращаясь при этом в соединения двух типов — кислоты и основания. Так, например, оксид фосфора(V) P2O5, присоединяя воду, превращается в кислоту H3PO4:
а оксид кальция CaO, взаимодействуя с водой, превращается в основание Ca(OH)2:
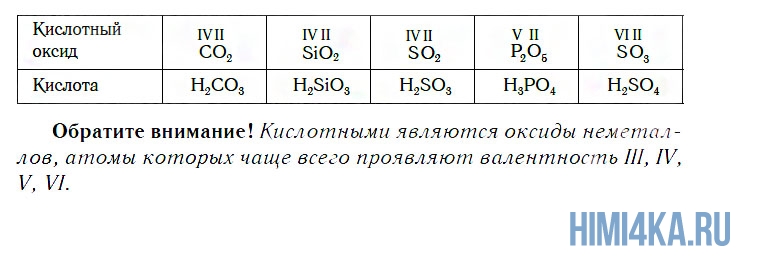
Иначе говоря, оксиду фосфора соответствует кислота, а оксиду кальция соответствует основание. Исходя из этого, оксиды можно разделить на две большие группы — кислотные и основные оксиды.
К кислотным относятся оксиды, которым соответствуют кислоты. Наряду с Р2О5, кислотными являются также оксиды: CO2, SiO2, SO2, N2O5, SO3 и некоторые другие. Всем им соответствуют кислоты.
К основным относятся оксиды, которым соответствуют основания. Кроме СaO, основными являются оксиды: Na2O, K2O, BaO, FeO, CuO и ряд других. Всем этим оксидам соответствуют основания.
Оксиды в природе
Оксиды содержатся в каждой из трех оболочек нашей планеты — в атмосфере, гидросфере, литосфере.
Самым распространенным оксидом в атмосфере и гидросфере является вода H2O, а в литосфере — оксид кремния(IV) SiO2, встречающийся в виде красивых кристаллов кварца (рис. 116) и кварцевого песка.
Краткие выводы урока:
Надеюсь урок 31 «Оксиды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Лабораторная работа № 1
Получение и химические свойства оксидов
Цель работы: ознакомиться с химическими свойствами оксидов и способами их получения. Освоить технику выполнения нагревания в открытом пламени.
Посуда и реактивы: пробирки, пробиркодержатель, спиртовка, фарфоровый тигель, коническая колба, микрошпатель. Набор индикаторов, магниевая лента, кусочки малахита, серы, дистиллированная вода.
Опыт № 1. Получение и свойства оксида магния
Небольшой кусочек магниевой ленты закрепить в пробиркодержатель и нагреть в пламени спиртовки до начала реакции. Работу надо проводить в темных защитных очках. Отметить, что магний горит ярким пламенем с выделением большого количества тепла. Продукт горения магния собрать в небольшой фарфоровый тигель или пробирку. Отметить цвет порошка. Написать уравнение реакции. Какими свойствами обладает этот порошок?
Полученный порошок растворить в небольшом количестве воды при нагревании. В этот раствор добавить 1–2 капли фенолфталеина. Отметить окраску фенолфталеина и сделать вывод. Напишите уравнения реакций.
Опыт № 2. Получение и свойства оксида меди ( II )
Как изменился цвет малахита? Почему на стенках пробирки появились капельки воды? Если закрыть отверстие пробирки пробкой с газоотводной трубкой и опустить в известковую воду, то образуется белый осадок. Написать уравнения реакций. Охладить пробирку до комнатной температуры, прилить небольшое количество воды и осторожно взболтать. Осадку дать отстояться и сделать вывод о его растворимости.
Опыт № 3. Получение и свойства оксида серы ( IV )
В термостойкий стакан или коническую колбу налить небольшое количество воды. Нагреть в железной ложке небольшой кусочек серы до воспламенения, опустить ложку в стакан (не касаясь воды) и прикрыть сверху крышкой. Записать уравнения реакции горения серы, учитывая, что образуется оксид серы (1 V ). Затем убрать ложку, взболтать содержимое стакана и внести в раствор 3–4 капли лакмуса. Как изменится цвет индикатора? Напишите уравнения реакции. Сделайте соответствующие выводы.
Статья. «Оксиды. Классификация оксидов и их свойства»
ОКСИДЫ – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Оксиды бывают солеобразующие, которые делятся на:
Основными называются оксиды, которым соответствуют основания
Это оксиды, из которых прямо (при взаимодействии с водой) или косвенно могут быть получены основания. Например:
Кислотными называются оксиды, которым соответствуют кислоты
Те кислотные оксиды, которые не реагируют с водой, соответствующая кислота можно получить косвенным путём:
основание амфотер. оксид кислота
А. При горении простых и сложных веществ:
Примечание: при горении азотсодержащих веществ, в обычных условиях оксиды азота не образуются. SO 3 образуется только при каталитическом окислении.
Б. Если сжигаемое вещество содержит металл, то при горении обычно образуются высшие оксиды этих металлов, а щёлочные металлы (кроме лития) образуют пероксиды.
В . Прокаливанием нерастворимых оснований, солей (некоторых)
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Из основных только оксиды щёлочных и щёлочноземельных металлов
Амфотерные оксиды с водой не реагируют.
Кислотные оксиды (большинство) реагируют с водой:
Б. Отношение к кислотам:
С кислотами реагируют основные и амфотерные оксиды с образованием соли и воды, а при избытке кислоты –
Двойные оксиды образуют две соли:
В. Отношение к основаниям:
Кислотные оксиды реагируют с растворимыми основаниями при обычных условиях, с нерастворимыми – при плавлении, с образованием соли и воды:
Основные оксиды с основаниями не реагируют
Амфотерные оксиды реагируют только со щёлочами:
Г. Отношение друг к другу:
Основные оксиды реагируют с кислотными оксидами, образуя соль:
Амфотерные оксиды реагируют и кислотными, и основными оксидами:
Д. Отношение к металлам:
Активные металлы вытесняют менее активные из их оксидов – металлотермия :
Е. Отношение к солям:
Оксиды с солями реагируют редко и только при сплавлении
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Статья. ОКСИДЫ – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
КЛАССИФИКАЦИЯ: оксиды бывают несолеобразующие (N2O,No,CO)
Оксиды бывают солеобразующие, которые делятся на:
Основными называются оксиды, которым соответствуют основания
Это оксиды, из которых прямо (при взаимодействии с водой) или косвенно могут быть получены основания.
Кислотными называются оксиды, которым соответствуют кислоты
Те кислотные оксиды, которые не реагируют с водой, соответствующая кислота можно получить косвенным путём:
Номер материала: ДБ-394415
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Минпросвещения предлагает закрыть пляжи детских лагерей для посторонних лиц
Время чтения: 1 минута
В России утвердили квоты приема на целевое обучение в вузах на 2022 год
Время чтения: 3 минуты
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
В России отцы охотнее дают деньги детям на карманные расходы, чем матери
Время чтения: 2 минуты
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Педагогов и учеников предлагают тренировать на случай нападения
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.