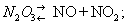что такое окислы азота
Азота окислы
Полезное
Смотреть что такое «Азота окислы» в других словарях:
Окислы азота — Смесь различных окислов азота, кроме закиси NO2, образовавшихся в цилиндре дизеля в процессе сгорания Источник: ГОСТ 24585 81: Дизел … Словарь-справочник терминов нормативно-технической документации
ОКИСЛЫ — ОКИСЛЫ, соединения элементов с кислородом. Кислород соединяется со всеми элементами кроме благородных газов. Недавно открытая юкись фтора заполняет существовавший в отношении фтора пробел. В зависимости от степени окисления и валентности элемента … Большая медицинская энциклопедия
Окислы азота (NOх) — 5. Окислы азота (NOх) Смесь окиси и двуокиси азота, содержащихся в пробе газа Примечание. В расчетах условно предполагается, что окись азота находится в виде двуокиси азота Источник … Словарь-справочник терминов нормативно-технической документации
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окислы азота — Оксиды азота соединения азота с кислородом. Содержание 1 Список оксидов 2 N2O 3 NO 4 N2O3(III) 5 NО2, N2O4 … Википедия
Окислы — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окислы азота и азотная кислота — 4.6. Окислы азота и азотная кислота оказывают в основном вредное влияние на активную массу отрицательных электродов, окисляя свинец в окись. Окись свинца, в свою очередь, вступая в реакцию с оставшейся неиспользованной кислотой, образует… … Словарь-справочник терминов нормативно-технической документации
Окислы — О. называются соединения простых тел с кислородом. Если придерживаться деления простых тел на две группы, на металлы и металлоиды (см.), то вообще в характере их О. можно заметить довольно ясную разницу. Тогда как типические представители первой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — веселящий газ, один из окислов азота (см. Азота окислы); в медицине применяют в смеси с кислородом как средство для ингаляционного Наркоза при хирургических операциях, родах, иногда при инфаркте миокарда. Назван веселящим газом английским … Большая советская энциклопедия
Закись азота — химический состав см. Окислы азота. В медицине З. азота получила название веселящего газа: вдыхаемая в смеси с атмосферным воздухом или кислородом при обыкновенной температуре и давлении она вызывает особое состояние опьянения, уничтожающего… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окислы азота
ОКИСЛЫ АЗОТА ЧТО ЭТО

Закись азота N2O. Закись азота получается при нагревании нитрата аммония:
При этой реакции один из атомов азота, входящих в состав NH4NO3, теряет электроны, а другой — приобретает их, причем оба атома азота становятся положительно одновалентными.
Закись азота что такое
Закись азота представляет собой бесцветный, не имеющий запаха газ, сгущающийся в жидкость при 0° под давлением 30 ат. Она довольно хорошо растворима в воде: при 0° один объем воды растворяет 1,3, а при 25° — 0,6 объема N2O. При растворении закись азота никакого соединения с водой не образует.
Закись азота — эндотермическое соединение, легко разлагающееся при нагревании на азот и кислород:
поэтому она хорошо поддерживает горение. Тлеющая лучинка, опущенная в закись азота, вспыхивает в ней, как в чистом кислороде; фосфор, сера и другие вещества также энергично сгорают в закиси азота, освобождая азот.
Закись азота для чего
Вдыхание небольших количеств закиси азота приводит к притуплению болевой чувствительности, вследствие чего этот газ иногда применяют в смеси с кислородом для наркоза при легких операциях. Большие количества закиси азота возбуждающе действуют на нервную систему; поэтому раньше ее называли «веселящим газом».
Азот оксид

Образование окиси азота при электрическом разряде может быть иллюстрировано следующим опытом. В большую колбу (рис.) через боковые горла вставляют на пробках две толстые медные проволоки и соединяют их с полюсами большой индукционной катушки. При пропускании через катушку тока между концами проволок образуется непрерывная искра, а над ней появляется желтоватое пламя «горящего» в кислороде азота.
Реакция образования окиси азота из азота и кислорода обратима и сопровождается поглощением большого количества тепла:
При низкой температуре равновесие этой реакции практически полностью сдвинуто влево, т. е, количество образующейся окиси азота ничтожно мало. С повышением температуры равновесие начинает смещаться вправо, и о так медленно, что даже при 1000° в смеси газов содержится всего лишь около 1% окиси азота. При понижении температуры окись азота снова разлагается на азот и кислород.
Но если очень быстро охладить газовую смесь, то равновесие не успевает сразу сместиться, а потом уже не смещается вследствие крайне малой скорости реакции при низкой температуре, и таким образом, в смеси остается почти то же количество NO, которое образовалось при высокой температуре. В лаборатории окись азота получают обычно взаимодействием разбавленной азотной кислоты с медью:
или в ионной форме
3Cu + 2NO3‘ + 8H • = 3Cu •• + 2NO + 4H2O
Газ no или окись азота представляет собой бесцветный газ, очень трудно сжижаемый. Жидкая окись азота кипит при —151,8° и затвердевает при —163,7°
В воде она растворима лишь незначительно один объем воды растворяет при 0 ° всего 0,07 объема NO газа.
По химическим свойствам окись азота относится к числу безразличных окислов, так как не образует никакой кислоты.
Окись азота труднее других окислов азота отдает свой кислород. Поэтому в ней могут гореть лишь такие вещества, которые особенно энергично соединяются с кислородом, как, например, фосфор. Но зажженная свеча, лучинка, сера гаснут при внесении их в окись азота.
Наиболее характерным свойством окиси азота является ее способность легко, без всякого нагревания, соединяться с кислородом с образованием бурой двуокиси азота:
Если, например, открыть цилиндр, наполненный окисью азота, то у отверстия его тотчас же появляется бурое облако двуокиси азота.
Двуокись азота
Изменение окраски двуокиси азота при повышении температуры сопровождается и изменением плотности ее пара. При низкой температуре плотность пара приблизительно отвечает удвоенной формуле N2O4. С повышением температуры плотность пара уменьшается и при 140 ° в точности соответствует формуле NО2— Отсюда следует, что бесцветные кристаллы, существующие при —10 ° и ниже, состоят, вероятно, целиком из молекул N2О4 и могут быть названы четырехокисью азота.
По мере нагревания бесцветная четырехокись азота постепенно диссоциирует с образованием молекул темно-бурой двуокиси азота N02; полная диссоциация происходит при 140°. Поэтому при температурах от —10° до + 140° всегда имеется смесь молекул NO2 и N2О4, находящихся в равновесии друг с другом:
Выше 140° начинается диссоциация NО2 на NO и кислород.
Двуокись азота очень энергичный окислитель. Многие вещества могут гореть в двуокиси азота, отнимая от нее кислород. Сернистый газ окисляется ею в серный ангидрид, на чем основан нитрозный метод получения серной кислоты.
Пары двуокиси азота довольно ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
При растворении в воде двуокись или, вернее, четырехокись азота вступает в реакцию с водой, образуя азотную и азотистую кислоты:
Но азотистая кислота очень неустойчива и быстро разлагается на азотную кислоту, окись азота и воду:
Поэтому практически взаимодействие двуокиси (четырех окиси) азота с водой, особенно с теплой, идет по уравнению
которое легко может быть получено сложением двух предыдущих уравнений, если предварительно первое из них умножить на 3.
В присутствии воздуха образующаяся окись азота немедленно окисляется в двуокись азота, так что в этом случае NO2 полностью переходит в азотную кислоту. Эта реакция имеет важное техническое значение и используется в современных способах получения азотной кислоты.
Если растворять двуокись (четырехокись) азота в щелочах, то образуется смесь солей азотной и азотистой кислот:
Приведенные выше реакции взаимодействия четырехокиси азота с водой и щелочами показывают, что в молекуле этого вещества один атом азота имеет валентность +5, а другой — валентность +3. Поэтому четырехокись азота часто называют смешанным ангидридом азотистой и азотной кислот и изображают ее структурную формулу следующим образом:
Если мы подсчитаем общее число валентных электронов у всех атомов в молекулах N O и NO2, то найдем, что оно равно соответственно 11 (5 + 6) и 17 (5 + 2•6), т. е. выражается нечетными числами. Окись и двуокись азота относятся к ограниченному числу молекул с нечетным числом электронов. Такие молекулы ведут себя в химическом отношении, как свободные атомы, тоже имеющие неспаренные электроны. Молекулы с неспаренными электронами называются свободными радикалами.
Азотистый ангидрид N2 O 3
Представляет собой темно-синюю жидкость, кипящую при +4° и разлагающуюся при этом на окись и двуокись азота. Смесь равных объемов окиси и двуокиси азота при охлаждении вновь образует азотистый ангидрид:
Азотистому ангидриду соответствует азотистая кислота.
Азотный ангидрид N2O5 — твердое кристаллическое вещество, плавящееся при 30°. Он может быть получен действием фосфорного ангидрида на азотную кислоту:
Азотный ангидрид является очень сильным окислителем. Многие органические вещества при соприкосновении с ним воспламеняются. В воде азотный ангидрид легко растворяется с образованием азотной кислоты.
Вы читаете, статья на тему Окислы азота
Похожие страницы:
Понравилась статья поделись ей
Оксиды азота. Азотная кислота
Оксиды азота
Известны несколько оксидов азота.
Несолеобразующие оксиды: N2O, NO
Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):

Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO3. Поэтому взаимодействие с водой происходит по уравнению:
При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
В избытке кислорода образуется только нитрат натрия:
Ниже 22 0 С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0 С превращается в бесцветные кристаллы.
В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:

Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0 С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства
Кислотно – основные свойства
Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
Как и все кислоты, она реагирует:
в) с солями более слабых кислот:
Окислительно – восстановительные свойства

Концентрированная HNO3 при взаимодействии с наиболее активными металлами (до Al в ряду напряжений) восстанавливается до N2O. Например:
Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH4NO3:
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:

Получение
В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
В промышленности получение азотной кислоты идет в три стадии:
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
Все соли азотной кислоты хорошо растворимы в воде.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:
*на изображении записи кристаллы нитрата меди (II)
Оксиды азота
Содержание
Список оксидов
Известны девять соединений азота с кислородом. Кроме пяти классических оксидов азота:
обнаружены ещё димер диоксида азота (NO2)2 и три малостабильных соединения: нитрозилазид N4O, тринитрамид N(NO2)3 и нитратный радикал NO3.
Несолеобразующий оксид. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.
Оксид азота NO (монооксид азота) — бесцветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
N2O3(III)
Оксид N2O3 (триоксид диазота, азотистый ангидрид) — темно-синяя жидкость, неустойчивая при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NO2, N2O4(IV)
Оксид азота NO2 (диоксид азота) — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NO2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
и растворами щелочей:
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NO2. Этот оксид окисляет SO2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
N2O5(V)
Оксид азота N2O5 (пентаоксид диазота, азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NO2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
N(NO2)3
Тринитрамид открыт в 2010 году. Является перспективным кандидатом на роль высокоэффективного ракетного топлива, однако на данный момент неизвестно, является ли устойчивой твёрдая фаза вещества.
Существует при температуре ниже −50 °C как бледно-жёлтое твёрдое вещество, выше этой температуры разлагается на N2O и N2.
Воздействие на организм
Все оксиды азота физиологически активны, относятся к третьему классу опасности.
Применение
Закись азота используется в медицине для наркоза, в пищевой промышленности в качестве пропеллента и упаковочного газа (зарегистрирована в качестве пищевой добавки E942).
См. также
Полезное
Смотреть что такое «Оксиды азота» в других словарях:
оксиды азота — оксиды азота: Смесь различных оксидов азота, образовавшихся в процессе горения топлива в цилиндре дизеля, обозначаемая символом NOx. Источник … Словарь-справочник терминов нормативно-технической документации
оксиды азота — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN nitrogen oxides Oxides formed and released in all common types of combustion; they are formed by the oxidation of atmospheric nitrogen at high temperatures. Introduced into the … Справочник технического переводчика
оксиды азота NOx — 3.6 оксиды азота NOx %: Смесь различных оксидов азота, образующихся в процессе горения топлива в цилиндре дизеля. Источник … Словарь-справочник терминов нормативно-технической документации
быстрые оксиды азота — Образуются в небольшом количестве в процессе окисления молекулярного азота во фронте горения. [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN promt nitrogen oxidations … Справочник технического переводчика
термические оксиды азота — Образуются при высокой температуре горения в результате окисления молекулярного азота, содержащегося в воздухе, по механизму Я.Б. Зельдовича, в зависимости от времени пребывания в зоне горения и концентрации кислорода. [А.С.Гольдберг. Англо… … Справочник технического переводчика
топливные оксиды азота — Образуются в процессе горения в результате окисления содержащегося в топливе азота. [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN fuel nitrogen oxidations … Справочник технического переводчика
АЗОТА ОКСИДЫ — АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы) сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO несолеобразующие оксиды, N2O3 с … Большой Энциклопедический словарь
АЗОТА ОКСИДЫ — АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO несолеобразующие оксиды, N2O3… … Энциклопедический словарь
Азота оксиды — N0, Оксиды азота NO, N02 в сумме в пересчете на NOj, относящиеся к классу опасности III Источник: ГОСТ Р 51206 98: Автотранспортные средства. Содержание вредных веществ в воздух … Словарь-справочник терминов нормативно-технической документации
АЗОТА ФОСФОРА СЕМЕЙСТВО — ПОДГРУППА VA. СЕМЕЙСТВО АЗОТА ФОСФОРА Тенденция изменения свойств от неметаллических до металлических, которая выявлена в подгруппах IIIA и IVA, характерна и для этой подгруппы. Переход к металличности (хотя и нерезкий) начинается с мышьяка, у… … Энциклопедия Кольера