что такое обычные условия в химии
Нормальные и стандартные условия
При нормальных условиях объём одного моля идеального газа составляет 22,413 996(39) дм³ [2] (следствие из закона Авогадро), а количество молекул в 1 см³ составляет 2,6867774(47)×10 19 [3] (постоянная Лошмидта).
Содержание
Другие области
Авиация
Она используется при расчётах движения летательных аппаратов.
Газовое хозяйство
Газовая отрасль Российской Федерации при расчётах с потребителями использует атмосферные условия по ГОСТ 2939—63:
Таким образом, масса кубометра газа по ГОСТ 2939—63 несколько меньше, чем при «химических» нормальных условиях.
Иногда путают нормальные условия со стандартными, полагая, что ГОСТ определяет нормальные условия, и делается вывод о неоднозначности термина «нормальные условия». На самом деле ГОСТ 2939—63 никак не определяет и не упоминает нормальные условия, поэтому «н.у.» определяются однозначно.
См. также
Примечания
Полезное
Смотреть что такое «Нормальные и стандартные условия» в других словарях:
Стандартные условия — Необходимо перенести в эту статью содержимое статьи Нормальные и стандартные условия и поставить оттуда перенаправление. Вы можете помочь проекту, объединив статьи (cм. инструкцию по объединению). В случае необходимости обсуждения… … Википедия
Стандартные условия (СУ), нормальные условия (НУ), легочные условия (ЛУ) — физические условия состояния объемов газов. Источник … Словарь-справочник терминов нормативно-технической документации
стандартные условия — 1.3.2.22 стандартные условия: Температура окружающей среды 15 °С, атмосферное давление 101,3 кПа. Источник: ГОСТ Р 51983 2002: Устройства многофункцио … Словарь-справочник терминов нормативно-технической документации
Стандартные состояния — Стандартные состояния в химической термодинамике условно принятые состояния индивидуальных веществ и компонентов растворов при оценке термодинамических величин. Необходимость введения «стандартных состояний» связана с тем, что… … Википедия
условия — (см. раздел 1) d) Может ли машина представлять опасности при создании или потреблении определенных материалов? Нет Источник: ГОСТ Р МЭК 60204 1 2007: Безопасность машин. Электрооборудование машин и механизмов. Часть 1. Общие требования … Словарь-справочник терминов нормативно-технической документации
Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом чистой и прикладной химии)… … Википедия
НОРМАЛЬНЫЕ УСЛОВИЯ — стандартные физ. условия, определяемые давлением р = 101 325 Па (760 мм рт. ст.) и термодинамич. темп рой Т = 273,15 К (t = О °С) … Большой энциклопедический политехнический словарь
НОРМАЛЬНЫЕ УСЛОВИЯ — стандартные физические условия, определяемые давлением 101 325 Па (760 мм рт. ст.) и абсолютной температурой 273,15 К (0°С) … Металлургический словарь
ГОСТ Р 51847-2001: Аппараты водонагревательные проточные газовые бытовые типа А и С. Общие технические условия — Терминология ГОСТ Р 51847 2001: Аппараты водонагревательные проточные газовые бытовые типа А и С. Общие технические условия оригинал документа: 3.2 аппарат с пропорциональной подачей газа: Аппарат, в котором расход газа изменяется пропорционально … Словарь-справочник терминов нормативно-технической документации
Агрегатное состояние — Агрегатное состояние состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение… … Википедия
Что такое обычные условия в химии
Нормальными условиями принято считать давление газа P0 =101.325 кПа и его температуру T0 =0 ºС или T0 =273.2 К.
ГОСТы на топливные газы принято утверждать при температуре T20 =+20 ºС и P0 101.325 кПа (760 мм рт.ст.), в связи с этим эти условия называют стандартными.
Нормальные и стандартные условия введены для сравнения объёмных количеств различных газов.
Приведение газа к нормальным условиям осуществляется по следующему уравнению:
Рисунок 235. (1)
Аналогично для приведения газа к стандартным условиям:
Рисунок 236. (2)
Иногда приходится газ, находящийся при нормальных и стандартных условиях, приводить к заданным условиям температуры и давления. Приведенные выше соотношения примут следующий вид:
Рисунок 237. (3)
Рисунок 238. (4)
P0 – нормальное давление газа, P0 =101.325 кПа = 0.101325 МПа, (760 мм рт.ст.);
Стандартные условия
В случае необходимости обсуждения целесообразности объединения, замените этот шаблон на шаблон <<к объединению>> и добавьте соответствующую запись на странице ВП:КОБ.
Стандартные условия — значения температуры и давления, при которых определяются (или к которым приводятся) значения различных количественных характеристик веществ, зависящих от давления и температуры (например, электродные потенциалы, скорости звука и т. д.).
Для обеспечения единообразия представления характеристик в научной и справочной литературе ИЮПАК в 1982 установила следующие стандартные условия: [1]
До 1982 года значение стандартного давления было установлено 101325 Па = 1 атм. Очень часто в качестве стандартных условий для любых состояний указывается (подразумевается) температура 298 K, либо 25°С (298,15 К). Однако такая температура не установлена ИЮПАК в качестве стандартной. Это следует учитывать при использовании справочных данных.
См. также
Примечания
 | Это заготовка статьи о науке. Вы можете помочь проекту, исправив и дополнив её. Это примечание по возможности следует заменить более точным. |
Полезное
Смотреть что такое «Стандартные условия» в других словарях:
стандартные условия — 1.3.2.22 стандартные условия: Температура окружающей среды 15 °С, атмосферное давление 101,3 кПа. Источник: ГОСТ Р 51983 2002: Устройства многофункцио … Словарь-справочник терминов нормативно-технической документации
стандартные условия — pamatinės naudojimo sąlygos statusas T sritis Standartizacija ir metrologija apibrėžtis Naudojimo sąlygos, nurodytos matavimo priemonės parametrams tikrinti arba matavimo rezultatams tarpusavyje palyginti. atitikmenys: angl. reference conditions… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
стандартные условия — pamatinės sąlygos statusas T sritis fizika atitikmenys: angl. reference conditions vok. Referenzbedingungen, f; Standardbedingungen, f rus. стандартные условия, n pranc. conditions de référence, f … Fizikos terminų žodynas
стандартные условия — техн условия, оговоренные каким либо стандартом. Например, по ГОСТ 18509 “Дизели тракторные и комбайновые. Методы стендовых испытаний”: атмосферное давление равно 101,3 кПа, температура воздуха – 20оС, относительная влажность воздуха 50% … Универсальный дополнительный практический толковый словарь И. Мостицкого
стандартные условия — температура окружающей среды 15°С, атмосферное давление 101,3 кПа. (Смотри: ГОСТ Р 51733 2001. Котлы газовые центрального отопления, оснащенные атмосферными горелками, номинальной тепловой мощностью до 70 квт. Требования безопасности и методы… … Строительный словарь
Стандартные условия страхования грузов — условия страхования, выработанные в международной практике страхования грузов. В некоторых странах в стандартные условия могут вноситься существенные изменения и дополнения. См. также: Стандартные условия страхования грузов Оговорки морского… … Финансовый словарь
Стандартные условия (СУ), нормальные условия (НУ), легочные условия (ЛУ) — физические условия состояния объемов газов. Источник … Словарь-справочник терминов нормативно-технической документации
Стандартные условия наблюдения — условия, предусматривающие просмотр полиграфических оттисков, проб и изобразительных оригиналов с регламентированными интенсивностью и цветовой температурой освещения, цветом фона, расстоянием рассматривания и т. п … Реклама и полиграфия
Стандартные условия газового состояния — Состояние газа при температуре 20° С и давлении 101,325 кПа Источник … Словарь-справочник терминов нормативно-технической документации
стандартные условия измерений — 2.10 стандартные условия измерений (metering reference conditions): Определенные температура t2 и давление р2. Они являются условиями, при которых количество сжигаемого топлива определяется условно, и не существует причины a priori считать… … Словарь-справочник терминов нормативно-технической документации
Формулировка и определение закона Авогадро
Закон Авогадро в химии — история открытия
Известно, что вещества бывают в твердом, жидком и газообразном состоянии. Частицы жидкости и твердого вещества расположены близко по отношению друг к другу. Это объясняется взаимным притяжением молекул. Можно сделать вывод о существовании сил, удерживающих молекулы жидкости или твердого вещества вместе. Такие силы носят название сил межмолекулярного взаимодействия.
Молекулы газов существенно удалены друг от друга, что отличает подобные вещества от жидкостей и твердых. На таком расстоянии взаимодействие между молекулами почти отсутствует. В связи с этим, для трансформации вещества из жидкого или твердого агрегатного состояния в газообразное требуется преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние реализуется в результате повышения температуры веществ, которые находятся в виде жидкости или твердого:
Исходя из того, что расстояние между молекулами газов существенно превышает размеры самих молекул, объем, занимаемый газообразным веществом, — это, по существу, объем свободного пространства между хаотично перемещающимися молекулами газа. Величина данного пространства определяется условиями, при которых находится газ:
Такая величина приблизительно одинакова для всех газообразных веществ при одинаковых температуре и давлении. При этом объемом, который занимают сами молекулы, допустимо пренебречь. Отсюда вытекает закон Авогадро.
Согласно закону Авогадро, если объемы различных газов равны и взяты при одинаковых температурах и давлении, то они содержат одинаковое число молекул. Гипотезу выдвинул в 1811 году в Турине профессор физики Амедео Авогадро. Данная закономерность нашла подтверждение в многочисленных экспериментальных исследованиях и в дальнейшем получила название закона Авогадро.
Спустя полвека после открытия, на съезде химиков в Карлсруэ признали значение этого закона и приняли его за количественную основу современной химии (стехиометрии). Закон Авогадро в точности выполняется в случае идеального газа. Точность расчетов повышается с увеличением степени разреженности газообразного вещества.
Впервые количественные исследования взаимодействия газов между собой провел французский ученый Гей-Люссак. Ученому принадлежит авторство законов о тепловом расширении газов и закона объемных отношений. Теоретическое объяснение данных постулатов было представлено в 1811 году итальянским физиком Амедео Авогадро.
Интересным является тот факт, что при жизни открытие Авогадро осталось незамеченным по причине критических отзывов со стороны авторитетных химиков той эпохи — Йенса Якоба Берцелиуса и Джона Дальтона, которые утверждали, что возможность существования двухатомных молекул простых веществ отсутствует. Лишь в 1858 году труды Авогадро были по случайному стечению обстоятельств обнаружены итальянским химиком Станислао Канниццаро и обнародованы в 1860 году на Первом международном химическом конгрессе в Карлсруэ (Германия).
Формулировка закона, основная формула
Закон Авогадро: в равных объемах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул.
В химии можно встретить другую формулировку, которая следует из закона: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,4 л.
Нормальные условия предполагают температурный режим в 273,15 К (0 °C). Давление при этом составляет 1 атм.
В формулировке закона речь идет о равных объемах. При наличии, к примеру, 1 м³ кислорода и 2 м³ азота соотношение Авогадро выполняться не будет. Закон выполняется точно в случае сравнения идеальных газов. Чем сильнее газ отличается от идеального, тем больше отклонение от закона Авогадро.
Идеальными называют газы, частицы которых не взаимодействуют, а их размеры пренебрежимо малы.
Для выполнения закона давление и температура должны быть одинаковы. В противном случае — при разных температурах и давлениях — плотности газов будет отличаться и равенство выполняться не будет.
Пусть температура и давление газа постоянны T=const, p=const, объем не меняется V=const, тогда N — число частиц (молекул) любого идеального газа, является величиной неизменной. Данное утверждение является формулировкой закона Авогадро.
В равных объемах газов V при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул. Предпосылкой к открытию закона стало правило кратных отношений: при одинаковых условиях объемы газов, которые взаимодействуют между собой, находятся в простых соотношениях, к примеру, 1:1, 1:2, 1:3.
Закон объемных отношений: объемы газов, которые участвуют в химической реакции, при одинаковых условиях (температуре и давлении) относятся друг к другу, как простые целые числа.
В качестве примера можно привести следующие реакции:
Реальные газообразные системы в распространенных случаях представляют собой смесь чистых газов, в том числе, кислорода, водорода, азота, гелия и других. К примеру, в состав воздуха входят (в % по объему):
Каждый из перечисленных газов оказывает давление на стенки сосуда, в котором он заключен. Исходя из этого, можно ввести еще одно важное определение.
Парциальное давление — такое, которое в смеси газов создает каждый газ в отдельности, как будто он один занимает весь объем.
Закон Авогадро, с другой стороны, является следствием основного уравнения молекулярно-кинетической теории:
С учетом концентрации:
Последняя запись позволяет сделать вывод о количестве молекул газа:
Таким образом, можно заключить, что при одинаковых условиях (одинаковых давлении и температуре) в равных объемах различных газов число молекул будет одинаковым.
Первое и второе следствия из закона Авогадро
Парциальное давление — такое, которое в смеси газов создает каждый газ в отдельности, как будто он один занимает весь объем.
где V μ — является молярным объемом газообразного вещества (размерность л/моль);
V — объем вещества системы;
n — определяет количество вещества системы.
Можно записать следующее справедливое равенство:
V μ газа (н.у.) = 22,4 л/моль.
Второе следствие из закона Авогадро: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов.
Величина, описанная во втором следствии закона Авогадро, то есть отношение масс одинаковых объемов двух газов, является относительной плотностью D.
D = m 1 m 2 = μ 1 μ 2
где μ 1 и μ 2 — молярные массы двух газов.
Параметр D рассчитывается по результатам экспериментальных опытов как отношение масс одинаковых объемов рассматриваемого газообразного вещества m 1 и эталонного газа, молекулярная масса которого известна ( m 2 ). В зависимости от величины D и μ 2 определяют молярную массу исследуемого газа:
Относительную плотность в распространенных случаях определяют по отношению к воздуху или водороду, зная, что молярные массы водорода и воздуха известны и равны, соответственно:
Концентрация молекул идеального газа при нормальных условиях:
Данная величина носит название числа Лошмидта.
Особенности применения, примеры решения задач
При этом учитывается плотность его пара, которая в 5,85 раз превышает плотность воздуха. Таким образом, молекулярная масса рассматриваемого вещества равна:
ρ′C = 5,85 · 28,9 а.е.м. = 169,06 а.е.м.
Газообразные вещества, молярная масса которых меньше 29, легче, чем воздух. В том случае, когда молекулярная масса газа больше 29, вещество тяжелее воздуха.
В задачах по химии можно встретить заданные относительные плотности неизвестного газа по азоту, кислороду и другим газам. Тогда, чтобы найти молярную массу неизвестного газообразного вещества, следует умножить относительную плотность на молярную массу соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро нашел широкое применение в расчетах в химии. В связи с тем, что для газов объемы пропорциональны количествам (моль) веществ, коэффициенты в уравнении реакции между газообразными веществами, которые отражают количественное соотношение реагирующих веществ, пропорциональны объемам взаимодействующих газов. Измерения объемов проводят при одинаковых условиях.
Имеется газообразное вещество с относительной плотностью по водороду, равной 8. Нужно найти молярную массу этого газа.
М ( Х ) = М ( Н 2 ) ∙ D = 2 ∙ 8 = 16 г/моль
Газ с соответствующей молярной массой является метаном C H 4
Некий газообразный углеводород обладает относительной плотностью по воздуху, равной 2. Требуется рассчитать молярную массу этого углеводорода.
Средняя молярная масса воздуха составляет 29 г/моль
М(Х) = М(возд.) ∙ D = 29 ∙ 2 = 58 г/моль
Необходимо вычислить объем кислорода, который нужен, чтобы сжечь 2 дм³ пропана. Измерения объемов проводились при нормальных условиях.
Следует записать уравнение химической реакции:
С 3 Н 8 + 5 О 2 → 3 С О 2 + 4 Н 2 О
1 дм 3 С 3 Н 8 — 5 дм 3 O 2
2 дм 3 С 3 Н 8 — 10 дм 3 O 2
Ответ: V ( О 2 ) = 10 дм 3
Требуется вычислить объем, занимаемый 0,5 моль C l 2 при нормальных условиях, и объем, который займут 142 гр хлора при нормальных условиях.
По условиям задачи величины представлены в СИ, поэтому можно выполнить расчеты:
Вторая часть задания решается с помощью уравнения для количества вещества:
Определить молярную массу хлора можно по таблице Менделеева:
Путем подстановки первого выражения во второе, получим:
Ответ: Объем 0,5 молей хлора займут объем 11,2 л. Объем 142 гр хлора — 44,8 л.
D = m 1 m 2 = μ x μ H 2 → μ x = 23 · 2 = 46 г м о л ь
Далее необходимо вычислить массу углерода путем составления пропорции:
Аналогичным способом можно определить массу водорода:
Согласно закону сохранения массы, масса кислорода составит:
Далее нужно определить количество молей атомов элементов:
Согласно закону отношений:
После деления чисел из последнего выражения на 0,3, получим:
Таким образом, получается простейшая формула:
μ C 2 H 6 O = 24 + 6 + 16 = 46 г м о л ь
Необходимо вычислить, какой объем занимает 0,2 моль N 2 при нормальных условиях.
ν ( N 2 ) = V ( N 2 ) / V m
V ( N 2 ) = ν ( N 2 ) · V m = 0,2 моль · 22,4 л / моль = 4,48 л
Нужно определить объем, занимаемый 56 г газа СО при н.у.
ν ( C O ) = V ( C O ) / V m
V ( C O ) = ν ( C O ) · V m
Неизвестное количество вещества можно рассчитать по формуле:
M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль
ν (СО) = m/M = 56 г / 28 г/моль = 2 моль
V (CO ) = ν (CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л
Требуется рассчитать объем, занимаемый 8 г газа O 2 при нормальных условиях.
В первую очередь следует определить количество молей в заданной массе кислорода:
Объем газа составит:
Молярная масса кислорода O 2 :
Таким образом, можно определить:
Газообразное вещество массой 1 г при нормальных условиях занимает объем 1,32 л. Необходимо вычислить, какова относительная плотность этого газа по хлору.
Количество вещества данного газа составляет:
Можно записать другую формулу для расчета количества вещества:
В результате, правые части уравнений допустимо приравнять и определить молярную массу газа:
Относительная плотность газа по хлору:
D = μ μ C l = m V μ μ C l V
Молярная масса хлора:
После перевода единиц в систему СИ получим:
Далее можно рассчитать относительную плотность:
Один моль вещества содержит число Авогадро молекул:
Количество молей углекислого газа:
Объем, который занимает газообразное вещество, составит:
V = ν V μ = N N A V μ
Количество молекул, содержащееся в массе m вещества, можно найти с помощью следующего отношения:
Молярная масса фтористого водорода:
После перевода в СИ, получим, что масса фтористого водорода:
Объем, который занимает газообразный фтор с аналогичным количеством молекул, равен:
V = ν V μ = N N A V μ
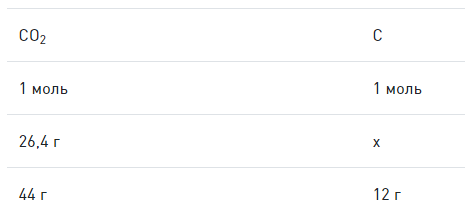
Что такое обычные условия в химии
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

Интересное по рубрике
Найдите необходимую статью по тегам
Подпишитесь на нашу рассылку
Мы в инстаграм
Домашняя онлайн-школа
Помогаем ученикам 5–11 классов получать качественные знания в любой точке мира, совмещать учёбу со спортом и творчеством

Рекомендуем прочитать
Реальный опыт семейного обучения
Звонок по России бесплатный
Посмотреть на карте
Если вы не нашли ответ на свой вопрос на нашем сайте, включая раздел «Вопросы и ответы», закажите обратный звонок. Мы скоро свяжемся с вами.

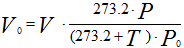
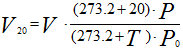
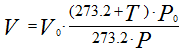
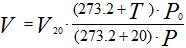


.jpg)
.jpg)
.jpg)
.jpg)


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)










